NeoRecormon® 500 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 2 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 3 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 4 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 5 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 6 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 10 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 20 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon® 30 000 I.E. Injektionslösung in Fertigspritze
NeoRecormon 500 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 500 Internationale Einheiten (I.E.) entsprechend 4,15 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 1 667 I.E. Epoetin beta.
NeoRecormon 2 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 2 000 Internationale Einheiten (I.E.) entsprechend 16,6 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 6 667 I.E. Epoetin beta.
NeoRecormon 3 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 3 000 Internationale Einheiten (I.E.) entsprechend 24,9 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 10 000 I.E. Epoetin beta.
NeoRecormon 4 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 4 000 Internationale Einheiten (I.E.) entsprechend 33,2 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 13 333 I.E. Epoetin beta.
NeoRecormon 5 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 5 000 Internationale Einheiten (I.E.) entsprechend 41,5 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 16 667 I.E. Epoetin beta.
NeoRecormon 6 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,3 ml Injektionslösung enthält 6 000 Internationale Einheiten (I.E.) entsprechend 49,8 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 20 000 I.E. Epoetin beta.
NeoRecormon 10 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,6 ml Injektionslösung enthält 10 000 Internationale Einheiten (I.E.) entsprechend 83 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 16 667 I.E. Epoetin beta.
NeoRecormon 20 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,6 ml Injektionslösung enthält 20 000 Internationale Einheiten (I.E.) entsprechend 166 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 33 333 I.E. Epoetin beta.
NeoRecormon 30 000 I.E. Injektionslösung in Fertigspritze
Eine Fertigspritze mit 0,6 ml Injektionslösung enthält 30 000 Internationale Einheiten (I.E.) entsprechend 250 Mikrogramm Epoetin beta* (rekombinantes humanes Erythropoietin).
Ein ml Injektionslösung enthält 50 000 I.E. Epoetin beta.
* hergestellt aus Ovarialzellen des Chinesischen Hamsters (CHO) durch rekombinante DNA-Technologie.
Sonstige(r) Bestandteil(e) mit bekannter Wirkung:
Phenylalanin (bis zu 0,3 mg pro Fertigspritze)
Natrium (weniger als 1 mmol pro Fertigspritze)
Polysorbat 20 (0,034 mg pro Fertigspritze mit einem Nominalvolumen von 0,3 ml und 0,063 mg pro Fertigspritze mit einem Nominalvolumen von 0,6 ml).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Injektionslösung.
Farblose, klare bis schwach opaleszente Lösung.
NeoRecormon wird angewendet zur:
Behandlung der symptomatischen Anämie infolge von chronischer Niereninsuffizienz bei erwachsenen Patienten und Kindern.
Vorbeugung einer Frühgeborenenanämie bei Kindern mit einem Geburtsgewicht zwischen 750 und 1 500 g, die vor der 34. Schwangerschaftswoche geboren wurden.
Behandlung der symptomatischen Anämie bei erwachsenen Patienten mit nicht-myeloischen malignen Erkrankungen, die eine Chemotherapie erhalten.
Steigerung der Menge an Eigenblut bei Patienten in einem Eigenblutspendeprogramm.
Die Anwendung in dieser Indikation muss gegenüber dem berichteten erhöhten Risiko für thromboembolische Ereignisse abgewogen werden. Es sollten nur Patienten mit mäßiggradiger Anämie (Hb 10 - 13 g/dl [6,21 - 8,07 mmol/l], kein Eisenmangel) behandelt werden, falls blutsparende Verfahren nicht verfügbar oder unzureichend sind, sofern der geplante größere chirurgische Eingriff große Mengen an Blut erfordert (4 oder mehr Blutkonserven bei Frauen bzw. 5 oder mehr Blutkonserven bei Männern). Siehe Abschnitt 5.1.
Eine Behandlung mit NeoRecormon sollte von Ärzten eingeleitet werden, die Erfahrung in den oben genannten Anwendungsgebieten haben. Da in Einzelfällen anaphylaktoide Reaktionen beobachtet wurden, wird empfohlen, die erste Dosis unter ärztlicher Kontrolle zu verabreichen.
Dosierung
Behandlung der symptomatischen Anämie bei erwachsenen Patienten und Kindern mit chronischer Niereninsuffizienz
Die Symptome einer Anämie und deren Folgen können sich aufgrund von Alter, Geschlecht und der Gesamtbelastung durch Krankheiten unterscheiden. Eine ärztliche Bewertung des klinischen Verlaufs und des Zustandes eines jeden Patienten ist daher erforderlich. NeoRecormon sollte entweder subkutan oder intravenös verabreicht werden, um das Hämoglobin auf nicht mehr als 12 g/dl (7,45 mmol/l) zu erhöhen. Eine subkutane Anwendung ist bei Patienten zu bevorzugen, die keine Hämodialyse erhalten, um die Punktion peripherer Venen zu vermeiden. Bei intravenöser Anwendung sollte die Lösung über ca. 2 Minuten injiziert werden, z. B. bei Hämodialyse-Patienten über die arteriovenöse Fistel im Anschluss an die Dialyse.
Aufgrund intraindividueller Variabilität können gelegentlich bei einem Patienten einzelne Hämoglobinwerte über und unter dem gewünschten Hämoglobinspiegel beobachtet werden. Hämoglobinschwankungen sollten mittels Dosisanpassung unter Berücksichtigung eines Zielbereichs für Hämoglobin von 10 g/dl (6,21 mmol/l) bis 12 g/dl (7,45 mmol/l) behandelt werden. Ein anhaltender Hämoglobinspiegel von mehr als 12 g/dl (7,45 mmol/l) sollte vermieden werden. Eine Anleitung für eine entsprechende Dosisanpassung bei Überschreiten der Hämoglobinwerte von 12 g/dl (7,45 mmol/l) ist nachstehend beschrieben.
Ein Anstieg des Hämoglobins um mehr als 2 g/dl (1,25 mmol/l) innerhalb von vier Wochen sollte vermieden werden. In einem solchen Fall muss die Dosis den Vorgaben entsprechend angepasst werden. Wenn der Hämoglobinwert innerhalb eines Monats um mehr als 2 g/dl (1,25 mmol/l) ansteigt oder wenn der Hämoglobinwert ansteigt und sich einem Wert von 12 g/dl (7,45 mmol/l) annähert, muss die Dosis um etwa 25 % reduziert werden. Wenn der Hämoglobinspiegel weiter ansteigt, sollte die Therapie unterbrochen werden, bis der Hämoglobinspiegel abzufallen beginnt. Zu diesem Zeitpunkt sollte die Therapie mit einer Dosis, die etwa 25 % unter der zuletzt angewendeten Dosis liegt, fortgesetzt werden.
Die Patienten sollten engmaschig überwacht werden, um sicherzustellen, dass die niedrigste zugelassene wirksame Dosis von NeoRecormon angewandt wird, die eine adäquate Kontrolle der Anämiesymptome unter Beibehaltung einer Hämoglobinkonzentration unter oder bis zu 12 g/dl (7,45 mmol/l) ermöglicht.
Vorsicht ist geboten bei der Steigerung der Dosis von NeoRecormon bei Patienten mit chronischer Niereninsuffizienz. Bei Patienten mit schlechtem Hämoglobin-Ansprechen auf NeoRecormon sollten alternative Ursachen für das schlechte Ansprechen in Betracht gezogen werden (siehe Abschnitte 4.4 und 5.1).
Bei Vorliegen einer Hypertonie sowie bei bestehenden kardiovaskulären, zerebrovaskulären oder peripheren vaskulären Erkrankungen sollten der wöchentliche Anstieg und der Zielbereich des Hämoglobins unter Berücksichtigung des klinischen Bildes individuell gewählt werden.
Die Therapie mit NeoRecormon unterteilt sich in zwei Behandlungsphasen.
1. Korrekturphase
Subkutane Anwendung:
Die Anfangsdosis beträgt 3 x 20 I.E./kg Körpergewicht und Woche. Bei nicht ausreichendem Anstieg des Hämoglobins (< 0,25 g/dl pro Woche) kann die Dosis in monatlichen Abständen um 3 x 20 I.E./kg und Woche erhöht werden.
Die Wochendosis kann auch auf tägliche Einzelgaben aufgeteilt werden.
Intravenöse Anwendung:
Die Anfangsdosis beträgt 3 x 40 I.E./kg Körpergewicht und Woche. Die Dosis kann nach einem Monat auf 80 I.E./kg 3 x pro Woche und, falls erforderlich, in monatlichen Abständen um weitere 20 I.E./kg 3 x pro Woche erhöht werden.
Für beide Anwendungsarten sollte die maximale Dosis von 720 I.E./kg und Woche nicht überschritten werden.
2. Erhaltungsphase
Zur Aufrechterhaltung eines Hämoglobinwertes zwischen 10 und 12 g/dl wird die Dosis zunächst auf die Hälfte der zuletzt eingesetzten Dosis reduziert. Anschließend wird die Dosierung in 1‑ bis 2‑wöchigen Abständen individuell auf den Patienten eingestellt (Erhaltungsdosis).
Bei subkutaner Anwendung kann die Wochendosis als einmalige Injektion gegeben werden oder auf drei oder sieben Einzeldosen pro Woche verteilt werden. Patienten, die in der einmal wöchentlichen Anwendung stabil sind, können auf eine Anwendung alle zwei Wochen umgestellt werden. In diesem Fall können Dosiserhöhungen nötig werden.
Ergebnisse klinischer Studien bei Kindern haben gezeigt, dass im Mittel die NeoRecormon Dosen umso höher lagen, je jünger die Patienten waren. Trotzdem sollte vom empfohlenen Dosierungsschema nicht abgewichen werden, da das individuelle Ansprechen nicht vorhersagbar ist.
Die Behandlung mit NeoRecormon ist normalerweise eine Langzeittherapie. Eine Unterbrechung ist möglich und kann jederzeit erfolgen. Die Angaben zum einmal wöchentlichen Dosierungsschema basieren auf klinischen Studien mit einer Behandlungsdauer von 24 Wochen.
Vorbeugung einer Frühgeborenenanämie
Die Lösung wird in einer Dosis von 3 x 250 I.E./kg Körpergewicht und Woche subkutan verabreicht. Der Nutzen der Behandlung mit NeoRecormon bei Frühgeborenen, die zuvor bereits transfundiert wurden, ist möglicherweise geringer ausgeprägt als bei nicht transfundierten Kindern. Die empfohlene Behandlungsdauer beträgt 6 Wochen.
Behandlung der symptomatischen, chemotherapie-induzierten Anämie bei Krebspatienten
NeoRecormon sollte bei Patienten mit Anämie subkutan verabreicht werden (Hämoglobinkonzentration ≤ 10 g/dl [6,21 mmol/l]). Die Symptome einer Anämie und deren Folgen können sich aufgrund von Alter, Geschlecht und der Gesamtbelastung durch Krankheiten unterscheiden. Eine ärztliche Bewertung des klinischen Verlaufs und des Zustandes eines jeden Patienten ist daher erforderlich.
Die Wochendosis kann als einmalige Injektion gegeben werden oder in Teildosen drei- bis siebenmal pro Woche.
Die empfohlene Initialdosis beträgt 30 000 I.E. pro Woche (entsprechend ca. 450 I.E./kg Körpergewicht pro Woche, berechnet auf einen Patienten mit durchschnittlichem Gewicht).
Aufgrund intraindividueller Variabilität können gelegentlich bei einem Patienten einzelne Hämoglobinwerte über und unter dem gewünschten Hämoglobinspiegel beobachtet werden. Hämoglobinschwankungen sollten mittels Dosisanpassung unter Berücksichtigung eines Zielbereichs für Hämoglobin von 10 g/dl (6,21 mmol/l) bis 12 g/dl (7,45 mmol/l) behandelt werden. Ein anhaltender Hämoglobinspiegel von mehr als 12 g/dl (7,45 mmol/l) sollte vermieden werden. Eine Anleitung für eine entsprechende Dosisanpassung bei Überschreiten der Hämoglobinwerte von 12 g/dl (7,45 mmol/l) ist nachstehend beschrieben.
Wenn nach vierwöchiger Therapie der Hämoglobinwert um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist, sollte die derzeitige Dosis beibehalten werden. Wenn der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist, sollte eine Verdoppelung der Dosis erwogen werden. Falls nach achtwöchiger Therapie der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) angestiegen ist, ist ein Ansprechen unwahrscheinlich und die Behandlung sollte abgebrochen werden.
Die Therapie sollte bis zu 4 Wochen nach Beendigung der Chemotherapie fortgesetzt werden.
Die maximale Dosis von 60 000 I.E. pro Woche sollte nicht überschritten werden.
Ist das individuelle Therapieziel eines Patienten erreicht, sollte die Dosis um 25 bis 50 % reduziert werden, um diese Hämoglobinkonzentration zu erhalten. Eine entsprechende Dosistitration sollte in Betracht gezogen werden.
Wenn das Hämoglobin 12 g/dl (7,45 mmol/l) überschreitet, sollte die Dosis um etwa 25 bis 50 % reduziert werden. Wenn der Hämoglobinwert 13 g/dl (8,1 mmol/l) überschreitet, sollte die Behandlung mit NeoRecormon zeitweise unterbrochen werden. Nachdem der Hämoglobinspiegel auf 12 g/dl (7,45 mmol/l) oder darunter gefallen ist, sollte die Therapie mit einer Dosis, die um etwa 25 % unter der zuletzt angewendeten Dosis liegt, wieder begonnen werden.
Beträgt der Anstieg des Hämoglobinwertes mehr als 2 g/dl (1,3 mmol/l) in 4 Wochen, sollte die Dosis um 25 bis 50 % reduziert werden.
Die Patienten sollten engmaschig überwacht werden, damit gewährleistet ist, dass NeoRecormon in der niedrigst möglichen Dosis angewendet wird, die für eine adäquate Kontrolle der Symptome einer Anämie erforderlich ist.
Behandlung zur Steigerung der Eigenblutmenge
Die Lösung wird intravenös über ca. zwei Minuten oder subkutan verabreicht.
NeoRecormon wird zweimal wöchentlich über 4 Wochen verabreicht. Besteht die Möglichkeit einer Blutspende (Hämatokrit > 33 %), so ist NeoRecormon nach der Blutabnahme zu applizieren.
Während des gesamten Behandlungszeitraumes sollte ein Hämatokrit von 48 % nicht überschritten werden.
Die individuelle Dosis ist vom behandelnden Arzt in Abhängigkeit von der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozyten-Reserve des jeweiligen Patienten zu ermitteln:
1. Die erforderliche Menge an zu spendendem Eigenblut hängt ab vom erwarteten Blutverlust, dem Einsatz von blutsparenden Maßnahmen und dem körperlichen Zustand des Patienten.
Diese Menge sollte so bemessen sein, dass sie ausreicht, um homologe Transfusionen zu vermeiden.
Die erforderliche Menge an zu spendendem Eigenblut wird in Einheiten ausgedrückt, wobei eine Einheit im Nomogramm 180 ml roter Blutzellen entspricht.
2. Die Blutspendefähigkeit des Patienten hängt in erster Linie von seinem Blutvolumen und dem Ausgangshämatokritwert ab. Diese beiden Variablen bestimmen die endogene Erythrozyten-Reserve, die wie folgt berechnet wird:
Endogene Erythrozyten-Reserve [ml] = Blutvolumen [ml] x (Hkt ‑ 33) : 100
Frauen: Blutvolumen [ml] = 41 [ml/kg] x Körpergewicht [kg] + 1 200 [ml]
Männer: Blutvolumen [ml] = 44 [ml/kg] x Körpergewicht [kg] + 1 600 [ml]
(Körpergewicht > 45 kg)
Die Notwendigkeit für eine Behandlung mit NeoRecormon sowie gegebenenfalls die Einzeldosis werden aus der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozyten-Reserve anhand der folgenden Grafiken abgelesen:
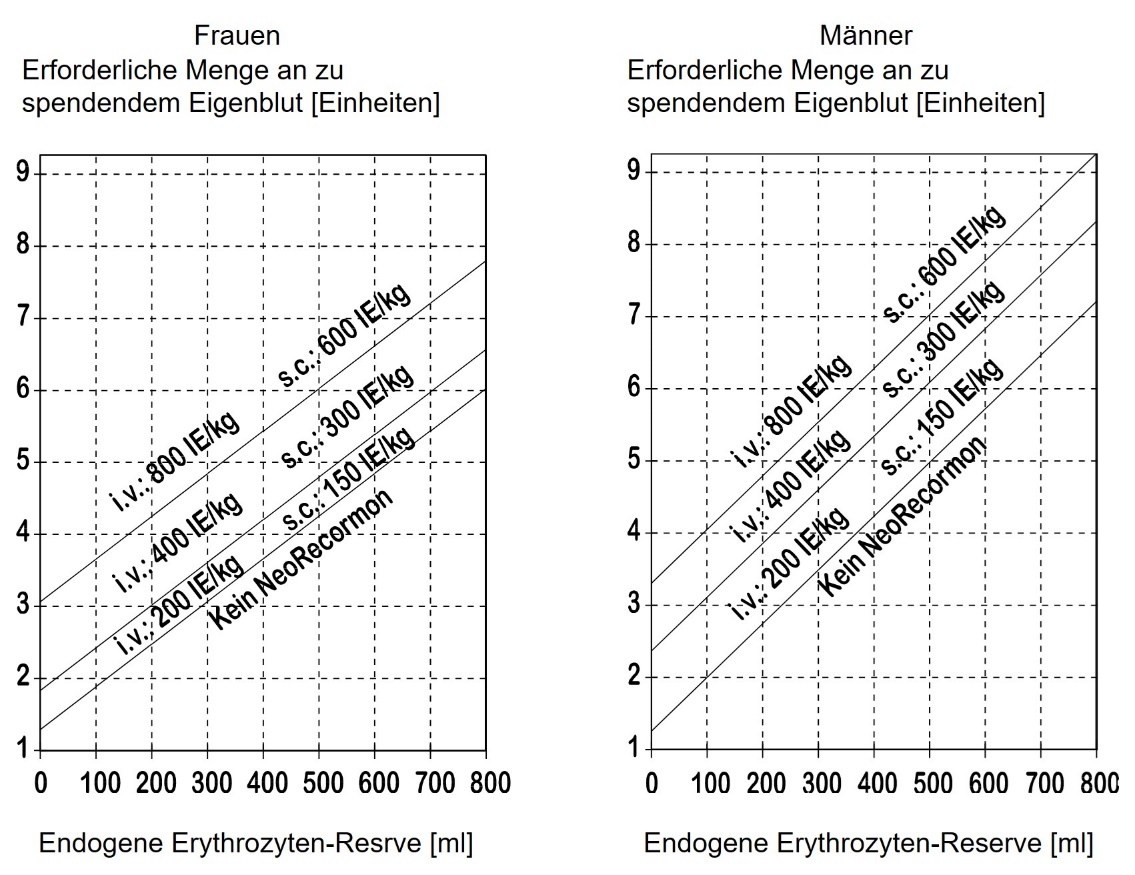
Die so bestimmte Einzeldosis wird 2-mal wöchentlich über 4 Wochen verabreicht. Bei intravenöser Gabe sollte eine maximale Dosis von 1 600 I.E./kg Körpergewicht und Woche, bei subkutaner Gabe eine maximale Dosis von 1 200 I.E./kg und Woche nicht überschritten werden.
Art der Anwendung
Die NeoRecormon Fertigspritze ist gebrauchsfertig. Es dürfen nur Lösungen injiziert werden, die klar oder leicht opaleszent, farblos und praktisch frei von sichtbaren Partikeln sind.
NeoRecormon in Fertigspritze ist ein steriles, jedoch nicht konserviertes Produkt. Es darf keinesfalls mehr als eine Dosis je Fertigspritze verabreicht werden; das Arzneimittel ist nur für den Einmalgebrauch bestimmt.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Schlecht kontrollierte Hypertonie.
Beim Anwendungsgebiet „Steigerung der Menge an Eigenblut“: Herzinfarkt oder Schlaganfall innerhalb eines Monats vor der Behandlung, instabile Angina pectoris, erhöhtes Risiko tiefer Venenthrombosen, wie z. B. bekannte venöse Thromboembolien.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
NeoRecormon sollte mit Vorsicht angewendet werden bei refraktärer Anämie mit Blastenexzess in Transformation, bei epileptiformen Erkrankungen, bei Thrombozytose sowie bei chronischer Leberinsuffizienz. Folsäure- und Vitamin-B12-Mangel sollten ausgeschlossen sein, da hierdurch die Wirksamkeit von NeoRecormon vermindert wird.
Vorsicht ist geboten bei der Steigerung der Dosis von NeoRecormon bei Patienten mit chronischer Niereninsuffizienz, da hohe kumulative Epoetin-Dosen mit einem erhöhten Risiko für Mortalität, schwerwiegende kardiovaskuläre und zerebrovaskuläre Ereignisse einhergehen können. Bei Patienten mit schlechtem Hämoglobin-Ansprechen auf Epoetine sollten alternative Ursachen für das schlechte Ansprechen in Betracht gezogen werden (siehe Abschnitte 4.2 und 5.1).
Um eine wirksame Erythropoiese sicherzustellen, sollte bei allen Patienten vor und während der Behandlung der Eisenwert bestimmt werden und gegebenenfalls eine Eisenersatztherapie gemäß den therapeutischen Richtlinien durchgeführt werden.
Die Wirksamkeit von NeoRecormon kann durch eine Aluminiumüberladung infolge der Therapie der chronischen Niereninsuffizienz abgeschwächt werden.
Über die Anwendung von NeoRecormon sollte bei Prädialyse-Patienten mit Nephrosklerose individuell entschieden werden, da eine beschleunigte Progression der Niereninsuffizienz bei diesen Patienten nicht mit Sicherheit ausgeschlossen werden kann.
Erythroblastopenie (pure red cell aplasia, PRCA)
In Verbindung mit einer Erythropoietin-Therapie, einschließlich der Gabe von NeoRecormon, wurde über eine durch neutralisierende Antikörper gegen Erythropoietin hervorgerufene PRCA berichtet. Für diese Antikörper konnte eine Kreuzreaktivität mit allen erythropoietischen Proteinen gezeigt werden. Patienten, bei denen der Verdacht auf neutralisierende Antikörper gegen Erythropoietin besteht oder bei denen diese nachgewiesen wurden, sollen deshalb nicht auf NeoRecormon umgestellt werden (siehe Abschnitt 4.8).
PRCA bei Patienten mit Hepatitis C
Eine paradoxe Hämoglobin-Abnahme und die Entwicklung einer schweren Anämie in Verbindung mit niedrigen Retikulozyten-Zahlen sollten zum Abbruch der Behandlung mit Epoetin und zur Durchführung von Tests auf Antikörper gegen Erythropoietin veranlassen. Es wurde über Fälle berichtet bei Patienten mit Hepatitis C, die mit Interferon und Ribavirin behandelt wurden und gleichzeitig Epoetine erhielten. Epoetine sind nicht zugelassen für die Behandlung einer Anämie in Verbindung mit Hepatitis C.
Blutdruckkontrolle
Es kann eine Erhöhung des Blutdrucks erfolgen bzw. die Verstärkung einer bereits bestehenden Hypertonie auftreten, insbesondere in Fällen eines schnellen Hämatokrit-Anstiegs. Diese Blutdruckerhöhungen lassen sich medikamentös behandeln. Wenn der Blutdruckanstieg nicht durch medikamentöse Therapie kontrolliert werden kann, wird eine vorübergehende Unterbrechung der Therapie mit NeoRecormon empfohlen. Insbesondere zu Beginn der Behandlung wird darüber hinaus eine regelmäßige Blutdruckkontrolle empfohlen, auch zwischen den Dialysen. Blutdruckentgleisungen mit Enzephalopathie-ähnlicher Symptomatik können auftreten, die eine sofortige ärztliche Untersuchung und intensivmedizinische Maßnahmen erfordern. Plötzlich auftretende stechende migräneartige Kopfschmerzen sind als mögliches Warnzeichen besonders zu beachten.
Es wurde über schwere arzneimittelinduzierte Hautreaktionen (SCARs), einschließlich Stevens-Johnson-Syndrom (SJS) und toxisch epidermaler Nekrolyse (TEN), die lebensbedrohlich oder tödlich sein können, im Zusammenhang mit Epoetin-Behandlungen berichtet. Schwerere Fälle wurden im Zusammenhang mit langwirkenden Epoetinen beobachtet. Zum Zeitpunkt der Verschreibung sollten die Patienten auf die Anzeichen und Symptome hingewiesen und engmaschig im Hinblick auf Hautreaktionen überwacht werden. Wenn Anzeichen und Symptome, die auf diese Reaktionen hinweisen, auftreten, sollte die Behandlung mit NeoRecormon unverzüglich beendet und eine alternative Behandlung in Betracht gezogen werden. Wenn ein Patient aufgrund der Anwendung von NeoRecormon eine schwere Hautreaktion, wie SJS oder TEN, entwickelt, darf bei dem Patienten die Behandlung mit Erythropoese stimulierenden Mitteln (erythropoiesis stimulating agent - ESA) zu keinem Zeitpunkt erneut begonnen werden.
Chronische Niereninsuffizienz
Bei Patienten mit chronischer Niereninsuffizienz kann es insbesondere bei intravenöser Anwendung zu einem mäßiggradigen dosisabhängigen Anstieg der Thrombozytenzahl innerhalb des Normbereiches kommen, der im Verlauf der Therapie wieder zurückgeht. Es wird empfohlen, die Thrombozytenzahl in den ersten 8 Wochen der Therapie regelmäßig zu kontrollieren.
Hämoglobinkonzentration
Bei Patienten mit chronischer Niereninsuffizienz sollte in der Erhaltungsphase die Hämoglobinkonzentration die in Abschnitt 4.2 empfohlene Obergrenze der angestrebten Hämoglobinkonzentration nicht überschreiten. In klinischen Studien wurde ein erhöhtes Sterberisiko und ein erhöhtes Risiko für schwerwiegende kardiovaskuläre Ereignisse oder zerebrovaskuläre Ereignisse einschließlich Schlaganfall beobachtet, wenn ESAs verabreicht wurden, um ein Hämoglobin von mehr als 12 g/dl (7,45 mmol/l) zu erzielen.
In kontrollierten klinischen Studien wurde kein signifikanter Nutzen für die Anwendung von Epoetinen gezeigt, wenn die Hämoglobinkonzentration über den für die Kontrolle der Symptome einer Anämie und zur Vermeidung von Bluttransfusionen benötigten Spiegel erhöht wurde.
Bei Frühgeborenen kann die Thrombozytenzahl insbesondere in den ersten zwei Lebenswochen leicht ansteigen, deshalb sollte die Thrombozytenzahl regelmäßig bestimmt werden.
Auswirkung auf das Tumorwachstum
Epoetine sind Wachstumsfaktoren, welche in erster Linie die Produktion von roten Blutkörperchen stimulieren. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden. Wie bei allen Wachstumsfaktoren besteht der Verdacht, dass auch Epoetine das Wachstum von Tumoren stimulieren könnten. In mehreren kontrollierten Studien mit Patienten, die eine Anämie im Zusammenhang mit einer Krebserkrankung aufwiesen, wurde keine Verbesserung des Gesamtüberlebens bzw. keine Verringerung des Risikos der Tumorprogression durch Epoetine gezeigt.
In kontrollierten klinischen Studien hat die Anwendung von NeoRecormon und anderen ESAs Folgendes gezeigt:
Eine verkürzte Zeit bis zur Tumorprogression bei Patienten mit fortgeschrittenen Kopf-Hals-Tumoren, die eine Strahlentherapie erhielten, wenn ein Hämoglobinzielwert von mehr als 14 g/dl (8,69 mmol/l) angestrebt wurde,
ein verkürztes Gesamtüberleben und eine erhöhte Letalität, aufgrund einer Krankheitsprogression nach 4 Monaten bei Patientinnen mit metastasiertem Brustkrebs, die eine Chemotherapie erhielten, wenn ein Hämoglobinzielbereich von 12 ‑ 14 g/dl (7,45 ‑ 8,69 mmol/l) angestrebt wurde,
ein erhöhtes Sterberisiko, wenn bei Patienten mit aktiven malignen Erkrankungen, die weder eine Chemotherapie noch eine Strahlentherapie erhielten, ein Hämoglobinzielwert von 12 g/dl (7,45 mmol/l) angestrebt wurde. ESA sind nicht für die Anwendung bei dieser Patientenpopulation indiziert.
In Abhängigkeit von der klinischen Situation sollte die Behandlung mit Bluttransfusionen bei Krebspatienten mit Chemotherapie assoziierter Anämie bevorzugt werden. Einer Entscheidung zur Gabe von rekombinantem Erythropoietin sollte eine Nutzen-Risiko-Bewertung unter Einbeziehung des Patienten vorausgehen, die die spezifische klinische Situation berücksichtigt. Die Nutzen-Risiko-Abwägung sollte die folgenden Faktoren einschließen: Art und Stadium des Tumors, Schwere der Anämie, die Prognose der Erkrankung, das Umfeld, in dem der Patient behandelt wird sowie die Behandlungspräferenz des Patienten (siehe Abschnitt 5.1).
Es kann zu einem Anstieg des Blutdrucks kommen, der medikamentös behandelt werden kann. Insbesondere zu Beginn der Behandlung sollte deshalb der Blutdruck bei Krebspatienten kontrolliert werden.
Thrombozytenzahl und Hämoglobinkonzentration sollten bei Krebspatienten in regelmäßigen Abständen überprüft werden.
Bei Patienten in einem Eigenblutspendeprogramm kann es zu einem Anstieg der Thrombozytenzahl, in der Regel innerhalb des Normbereiches, kommen. Es wird daher empfohlen, die Thrombozytenzahl mindestens einmal wöchentlich zu kontrollieren. Beträgt die Steigerung mehr als 150 x 109/l oder liegt die Thrombozytenzahl über dem Normbereich, sollte die Therapie mit NeoRecormon abgebrochen werden.
Bei Frühgeborenen konnte das potentielle Risiko, dass Erythropoietin eine Retinopathie auslöst, nicht ausgeschlossen werden. Deshalb ist Vorsicht geboten und bei der Entscheidung, ob ein Frühgeborenes behandelt wird, sollten die möglichen Nutzen und Risiken dieser Behandlung und verfügbarer alternativer Therapiemöglichkeiten gegeneinander abgewogen werden.
Bei Patienten mit chronischer Niereninsuffizienz ist im Verlauf der Therapie mit NeoRecormon aufgrund des gesteigerten Hämatokritwertes häufig eine Erhöhung der Heparin-Dosis während der Hämodialyse notwendig. Bei nicht optimaler Heparinisierung ist ein Verschluss des Dialyse-Systems möglich.
Eine frühzeitige Shunt-Revision und eine Thrombose-Prophylaxe, z. B. durch Gabe von Acetylsalicylsäure, sollte bei Patienten mit chronischer Niereninsuffizienz und mit dem Risiko einer Shunt-Thrombose in Betracht gezogen werden.
Serum-Kalium- und -Phosphat-Spiegel sollten während der Behandlung mit NeoRecormon regelmäßig überprüft werden. Bei einigen urämischen Patienten wurde unter einer Behandlung mit NeoRecormon über erhöhte Kaliumspiegel berichtet, ohne dass ein kausaler Zusammenhang gezeigt wurde. Sollten erhöhte oder ansteigende Kaliumspiegel beobachtet werden, dann sollte eine Unterbrechung der Behandlung mit NeoRecormon in Betracht gezogen werden, bis die Hyperkalämie korrigiert ist.
Für den Einsatz von NeoRecormon im Rahmen der Eigenblutspende müssen die offiziellen Richtlinien zur Blutspende berücksichtigt werden, insbesondere:
nur Patienten mit einem Hämatokritwert ≥ 33 % (Hämoglobinwert ≥ 11 g/dl [6,83 mmol/l]) dürfen Blut spenden;
Patienten mit einem Körpergewicht unter 50 kg sollten besonders sorgfältig beobachtet werden;
das Volumen einer einzelnen Blutspende sollte nicht größer als ca. 12 % des Blutvolumens des Patienten sein.
Die Behandlung sollte auf Patienten beschränkt werden, bei denen die Vermeidung von Fremdbluttransfusionen nach deren Nutzen-Risiko-Abschätzung als besonders wichtig angesehen wird.
Missbräuchliche Anwendung
Missbräuchliche Anwendung bei Gesunden kann zu einer übermäßigen Steigerung des Hämatokritwertes führen. Dies kann mit lebensbedrohlichen Komplikationen des Herz-Kreislauf-Systems verbunden sein.
Sonstige Bestandteile
NeoRecormon in Fertigspritze enthält bis zu 0,3 mg Phenylalanin pro Fertigspritze als sonstigen Bestandteil. Dieses sollte bei Patienten mit schweren Formen der Phenylketonurie berücksichtigt werden.
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Fertigspritze, d. h. es ist nahezu „natriumfrei“.
Dieses Arzneimittel enthält Polysorbat 20 (0,034 mg pro Fertigspritze mit einem Nominalvolumen von 0,3 ml und 0,063 mg pro Fertigspritze mit einem Nominalvolumen von 0,6 ml). Polysorbate können allergische Reaktionen hervorrufen.
Aus den bisher vorliegenden klinischen Daten ergeben sich keine Hinweise auf Wechselwirkungen von NeoRecormon mit anderen Arzneimitteln.
Untersuchungen an Tieren haben gezeigt, dass Epoetin beta die Knochenmarkstoxizität von zytostatisch wirksamen Arzneimitteln wie Etoposid, Cisplatin, Cyclophosphamid, Fluorouracil nicht verstärkt.
Schwangerschaft
Es liegen keine klinischen Daten zur Anwendung von Epoetin beta bei schwangeren Frauen vor.
Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten.
Stillzeit
Es ist nicht bekannt, ob Epoetin beta in die Muttermilch übergeht.
Die Entscheidung, weiter zu stillen oder nicht oder die Behandlung mit Epoetin beta weiterzuführen oder nicht, sollte auf der Basis des Nutzens des Stillens für das Kind und des Nutzens der Therapie mit Epoetin beta für die Frau getroffen werden.
Fertilität
Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung schließen (siehe Abschnitt 5.3).
NeoRecormon hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Basierend auf Ergebnissen klinischer Studien mit insgesamt 1 725 Patienten sind bei ungefähr 8 % der mit NeoRecormon behandelten Patienten Nebenwirkungen zu erwarten.
Anämie bei Patienten mit chronischer Niereninsuffizienz
Die häufigste Nebenwirkung unter der Therapie mit NeoRecormon ist eine Erhöhung des Blutdrucks bzw. die Verstärkung einer bereits bestehenden Hypertonie, insbesondere in Fällen eines schnellen Hämatokrit-Anstieges (siehe Abschnitt 4.4). Vereinzelt können auch bei Patienten mit ansonsten normalem oder niedrigem Blutdruck Blutdruckentgleisungen mit Enzephalopathie-ähnlicher Symptomatik (z. B. Kopfschmerzen, Verwirrtheitszustände, senso-motorische Störungen - wie Sprachstörungen, Gangstörungen etc. - bis hin zu generalisierten tonisch-klonischen Krämpfen) auftreten (siehe Abschnitt 4.4).
Shunt-Thrombosen können auftreten, insbesondere bei Patienten, die zu hypotonen Reaktionen neigen oder deren arteriovenöse Fisteln Komplikationen (z. B. Stenosen, Aneurysmen) aufweisen, siehe Abschnitt 4.4. Parallel zum Anstieg des Hämatokritwertes kommt es in den meisten Fällen zu einer Abnahme der Serum-Ferritin-Werte (siehe Abschnitt 4.4). Weiterhin wurde vereinzelt eine vorübergehende Erhöhung des Serum-Kalium- und -Phosphat-Spiegels beobachtet (siehe Abschnitt 4.4).
In Einzelfällen wurde unter der Therapie mit NeoRecormon über neutralisierende Antikörper gegen Erythropoietin mit Antikörper-vermittelter PRCA berichtet. Wird die Diagnose einer anti-Erythropoietin Antikörper induzierten PRCA gestellt, muss die Behandlung mit NeoRecormon abgebrochen werden. Die betreffenden Patienten dürfen nicht auf ein anderes erythropoietisches Protein umgestellt werden (siehe Abschnitt 4.4).
Die Nebenwirkungen sind untenstehend in Tabelle 1 aufgelistet.
Patienten mit Krebserkrankungen
Häufig Kopfschmerzen und Bluthochdruck bedingt durch eine Behandlung mit Epoetin beta, die medikamentös behandelt werden können (siehe Abschnitt 4.4).
Bei einigen Patienten wurde eine Abnahme der Serum-Eisen-Parameter beobachtet (siehe Abschnitt 4.4).
In klinischen Studien wurde ein vermehrtes Auftreten thromboembolischer Ereignisse bei mit NeoRecormon behandelten Krebspatienten im Vergleich zu unbehandelten Kontroll- oder Placebo-Patienten beobachtet. Bei Patienten, die mit NeoRecormon behandelt wurden, traten diese Ereignisse in 7 % der Fälle auf im Vergleich zu 4 % bei den Kontroll-Patienten; verglichen mit der Kontrollgruppe ist dies jedoch nicht verbunden mit einem Anstieg der Mortalität aufgrund thromboembolischer Ereignisse.
Die Nebenwirkungen sind untenstehend in Tabelle 2 aufgelistet.
Patienten in einem Eigenblutspendeprogramm
Bei Patienten in einem Eigenblutspendeprogramm wurde über eine leichte Zunahme von thromboembolischen Ereignissen berichtet. Ein kausaler Zusammenhang mit der NeoRecormon Behandlung konnte jedoch nicht gezeigt werden.
In placebokontrollierten Studien war ein zeitweiser Eisenmangel bei mit NeoRecormon behandelten Patienten ausgeprägter als in der Kontrollgruppe (siehe Abschnitt 4.4).
Die Nebenwirkungen sind untenstehend in Tabelle 3 aufgelistet.
Es wurde über schwere arzneimittelinduzierte Hautreaktionen (SCARs), einschließlich Stevens-Johnson-Syndrom (SJS) und toxisch epidermaler Nekrolyse (TEN), die lebensbedrohlich oder tödlich sein können, im Zusammenhang mit Epoetin-Behandlungen berichtet (siehe Abschnitt 4.4).
Tabellarische Auflistung der Nebenwirkungen
Nebenwirkungen werden gemäß MedDRA Systemorganklasse und Häufigkeitskategorie aufgelistet. Die Häufigkeitskategorien sind gemäß folgender Konvention definiert:
sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1: Nebenwirkungen aus kontrollierten klinischen Studien in Verbindung mit der NeoRecormon Behandlung bei Patienten mit chronischer Nierenerkrankung
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
Gefäßerkrankungen |
Bluthochdruck Hypertensive Krise |
Häufig |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Häufig |
Erkrankungen des Blutes und des Lymphsystems |
Shunt-Thrombose |
Selten |
Tabelle 2: Nebenwirkungen aus kontrollierten klinischen Studien in Verbindung mit der NeoRecormon Behandlung bei Patienten mit Krebserkrankungen
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
Gefäßerkrankungen |
Bluthochdruck |
Häufig |
Erkrankungen des Blutes und des Lymphsystems |
Thromboembolische Ereignisse |
Häufig |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Häufig |
Tabelle 3: Nebenwirkungen aus kontrollierten klinischen Studien in Verbindung mit der NeoRecormon Behandlung bei Patienten in einem Eigenblutspendeprogramm
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Häufig |
Frühgeborene
Eine Abnahme der Serum-Ferritin-Werte ist sehr häufig (siehe Abschnitt 4.4).
Beschreibung ausgewählter Nebenwirkungen
Selten kann es in Verbindung mit einer Epoetin-beta-Behandlung zu Hautreaktionen wie Ausschlag, Juckreiz, Nesselsucht oder Reaktionen an der Injektionsstelle kommen. In sehr seltenen Fällen wurde in Verbindung mit einer Epoetin-beta-Behandlung über anaphylaktoide Reaktionen berichtet. In kontrollierten klinischen Studien ergab sich jedoch kein Hinweis auf ein vermehrtes Auftreten von Überempfindlichkeitsreaktionen.
In sehr seltenen Fällen wurden in Verbindung mit einer Epoetin-beta-Behandlung insbesondere zu Beginn der Behandlung Grippe-ähnliche Symptome wie Fieber, Frösteln, Kopfschmerzen, Gliederschmerzen, Unwohlsein und/oder Knochenschmerzen berichtet. Diese Reaktionen waren mild bis mäßiggradig und verschwanden nach wenigen Stunden oder Tagen.
Daten aus einer kontrollierten klinischen Studie mit Epoetin alfa oder Darbepoetin alfa haben das Auftreten eines Schlaganfalls als häufig beschrieben.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
53175 Bonn
Website: http://www.bfarm.de
anzuzeigen.
Die therapeutische Breite von NeoRecormon ist sehr groß. Auch bei sehr hohen Serumspiegeln sind Vergiftungserscheinungen nicht beobachtet worden.
Pharmakotherapeutische Gruppe: Antianämika, ATC-Code: B03XA01
Wirkmechanismus
Erythropoietin ist ein Glykoprotein, das als mitoseanregender Faktor und Differenzierungshormon die Bildung von Erythrozyten aus ihren determinierten Vorläuferzellen stimuliert.
Epoetin beta, der Wirkstoff von NeoRecormon, ist in seiner Aminosäure- und Kohlenhydrat-Zusammensetzung identisch mit Erythropoietin, das aus dem Urin anämischer Patienten isoliert wurde.
Die biologische Wirksamkeit von Epoetin beta wurde nach intravenöser und subkutaner Gabe an verschiedenen Tiermodellen in vivo (normale und urämische Ratten, polyzythämische Mäuse, Hunde) nachgewiesen. Nach Epoetin-beta-Gabe steigen die Zahl der Erythrozyten, die Hb-Werte bzw. Retikulozytenzahlen ebenso an wie die 59Fe-Einbaurate.
In vitro (Maus-Milzzell-Kultur) wurde nach Inkubation mit Epoetin beta ein erhöhter 3H-Thymidin-Einbau in die erythroiden kernhaltigen Milzzellen festgestellt.
Mit Hilfe von Zellkulturen menschlicher Knochenmarkszellen konnte gezeigt werden, dass Epoetin beta spezifisch die Erythropoiese stimuliert und die Leukopoese nicht beeinflusst. Zytotoxische Wirkungen von Epoetin beta auf die Knochenmarkszellen oder auf menschliche Hautzellen konnten nicht festgestellt werden.
Nach Einmalgabe von Epoetin beta konnte keine Beeinflussung des Verhaltens und der Motorik von Mäusen sowie der Kreislauf- und Atemfunktion von Hunden beobachtet werden.
Klinische Wirksamkeit und Sicherheit
In einer randomisierten, doppelblinden, Placebo-kontrollierten Studie mit 4 038 Patienten mit chronischer Niereninsuffizienz und Typ 2 Diabetes, die nicht dialysiert wurden und Hämoglobinwerte von ≤ 11 g/dl hatten, erhielten die Patienten entweder eine Behandlung mit Darbepoetin alfa, um die Zielhämoglobinwerte von 13 g/dl zu erreichen, oder Placebo (siehe Abschnitt 4.4). Die Studie erreichte weder das primäre Ziel einer Reduktion des Risikos der Gesamtmortalität, der kardiovaskulären Morbidität noch der terminalen Niereninsuffizienz (TNI). Die Analyse der individuellen Komponenten der zusammengesetzten Endpunkte zeigte die folgenden HRs (95‑%‑KI): Tod 1,05 (0,92; 1,21), Schlaganfall 1,92 (1,38; 2,68), kongestive Herzinsuffizienz (CHF) 0,89 (0,74; 1,08), Myokardinfarkt (MI) 0,96 (0,75; 1,23), Hospitalisierung aufgrund einer Myokardischämie 0,84 (0,55; 1,27), TNI 1,02 (0,87; 1,18).
Von klinischen Studien mit ESAs bei Patienten mit chronischer Niereninsuffizienz (dialysepflichtige und nicht dialysepflichtige Patienten mit oder ohne Diabetes) wurden gepoolte post-hoc Analysen durchgeführt. Im Zusammenhang mit höheren kumulativen ESA-Dosen, unabhängig vom Diabetes- oder Dialysestatus, wurde eine Tendenz zu höheren Risiko-Schätzwerten für die Gesamtmortalität sowie für kardiovaskuläre und zerebrovaskuläre Ereignisse beobachtet (siehe Abschnitte 4.2 und 4.4).
Erythropoietin ist ein Wachstumsfaktor, welcher in erster Linie die Produktion von roten Blutkörperchen stimuliert. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden.
Das Überleben und die Tumorprogression wurden in fünf großen kontrollierten Studien, darunter vier doppelblinde, placebokontrollierte Studien und eine offene Studie, an insgesamt 2 833 Patienten untersucht. In zwei Studien wurden Patienten eingeschlossen, die eine Chemotherapie erhielten. In zwei Studien wurde eine Hämoglobinkonzentration von > 13 g/dl angestrebt, in den verbleibenden drei Studien 12 ‑ 14 g/dl. In der offenen Studie gab es keine Unterschiede im Gesamtüberleben zwischen den Patienten, die mit rekombinantem humanen Erythropoietin behandelt wurden, und der Kontrollgruppe. In den vier placebokontrollierten Studien bewegte sich die Hazard Ratio für das Gesamtüberleben zwischen 1,25 und 2,47 zugunsten der Kontrollgruppe. In diesen Studien zeigte sich ein durchgängig ungeklärter, statistisch signifikanter Anstieg der Mortalität bei Patienten mit Anämie infolge verschiedener häufiger Krebsarten, die rekombinantes humanes Erythropoietin erhielten, im Vergleich zur Kontrollgruppe. Das Ergebnis des Gesamtüberlebens in den Studien konnte nicht hinreichend durch Unterschiede bei der Inzidenz von Thrombose und den damit verbundenen Komplikationen zwischen Patienten, die rekombinantes humanes Erythropoietin erhielten, und Patienten der Kontrollgruppe erklärt werden.
Eine auf individuelle Patientendaten basierende Metaanalyse, die Daten von allen 12 mit NeoRecormon durchgeführten, kontrollierten klinischen Studien in anämischen Krebspatienten einschloss (n = 2 301), ergab einen Gesamtschätzwert der Hazard Ratio für das Überleben von 1,13 zugunsten der Kontrollgruppe (95‑%‑KI: 0,87; 1,46). Bei Patienten mit einem Ausgangshämoglobin von ≤ 10 g/dl (n = 899) war der Schätzwert der Hazard Ratio für das Überleben 0,98 (95‑%‑KI: 0,68 bis 1,40). Ein erhöhtes relatives Risiko für thromboembolische Ereignisse wurde in der Gesamtpopulation beobachtet (RR 1,62; 95‑%‑KI: 1,13; 2,31).
Eine Datenanalyse auf Patientenebene wurde ebenfalls für mehr als 13 900 Krebspatienten (unter Chemo-, Radio-, Chemoradiotherapie oder ohne Therapie) durchgeführt, die an 53 kontrollierten klinischen Studien mit verschiedenen Epoetinen teilgenommen haben. Eine Metaanalyse der Daten zum Gesamtüberleben ergab eine Punktschätzung der Hazard Ratio von 1,06 zugunsten der Kontrollgruppe (95‑%‑KI: 1,00; 1,12; 53 Studien und 13 933 Patienten) und für Krebspatienten unter Chemotherapie lag die Hazard Ratio für das Gesamtüberleben bei 1,04 (95‑%‑KI: 0,97; 1,11; 38 Studien und 10 441 Patienten). Metaanalysen weisen auch übereinstimmend auf ein signifikant erhöhtes relatives Risiko für thromboembolische Ereignisse bei Krebspatienten hin, die mit rekombinanten humanen Erythropoietinen behandelt werden (siehe Abschnitt 4.4).
In sehr seltenen Fällen traten unter Therapie mit rHuEPO neutralisierende Erythropoietin-Antikörper mit oder ohne PRCA auf.
Die pharmakokinetischen Untersuchungen an gesunden Probanden und urämischen Patienten zeigen, dass die Halbwertszeit von intravenös verabreichtem Epoetin beta zwischen 4 und 12 Stunden liegt, und dass der Verteilungsraum etwa dem Ein- bis Zweifachen des Plasmavolumens entspricht. Analoge Ergebnisse wurden auch im Tierversuch bei urämischen und normalen Ratten gefunden.
Nach subkutaner Gabe von Epoetin beta bei urämischen Patienten führte die verzögerte Aufnahme aus dem Gewebe zu einem plateauartigen Verlauf der Serumkonzentration. Maximale Konzentrationen wurden im Mittel nach 12 bis 28 Stunden erreicht. Die terminale Halbwertszeit ist länger als nach intravenöser Gabe und beträgt durchschnittlich 13 bis 28 Stunden.
Die Bioverfügbarkeit von Epoetin beta nach subkutaner Gabe liegt zwischen 23 und 42 % im Vergleich zur intravenösen Gabe.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Eine an Mäusen durchgeführte Karzinogenitätsstudie mit homologem Erythropoietin hat keine Hinweise auf ein proliferatives oder kanzerogenes Potenzial gegeben.
Harnstoff,
Natriumchlorid,
Polysorbat 20,
Natriumdihydrogenphosphat‑Dihydrat,
Natriummonohydrogenphosphat‑Dodecahydrat (Ph.Eur.),
Calciumchlorid‑Dihydrat,
Glycin,
L-Leucin,
L-Isoleucin,
L-Threonin,
L-Glutaminsäure,
L-Phenylalanin,
Wasser für Injektionszwecke.
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
2 Jahre.
Im Kühlschrank lagern (2 ºC – 8 ºC).
Die Fertigspritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Im Rahmen der ambulanten Anwendung darf der Patient das Arzneimittel einmalig für einen Zeitraum von bis zu 3 Tagen außerhalb des Kühlschrankes bei Raumtemperatur (nicht über 25 ºC) lagern.
Fertigspritze (Glas Typ I) mit einer Verschlusskappe und einem Kolbenstopfen (teflonisiertes Gummi-Material).
NeoRecormon 500 I.E., 2 000 I.E., 3 000 I.E., 4 000 I.E., 5 000 I.E. und 6 000 I.E:
Jede Fertigspritze enthält 0,3 ml Lösung.
NeoRecormon 10 000 I.E., 20 000 I.E. und 30 000 I.E:
Jede Fertigspritze enthält 0,6 ml Lösung.
NeoRecormon ist in den folgenden Packungsgrößen erhältlich:
NeoRecormon 500 I.E. Injektionslösung in Fertigspritze
1 Fertigspritze mit 1 Nadel (30G1/2) oder 6 Fertigspritzen mit 6 Nadeln (30G1/2).
NeoRecormon 2 000 I.E., 3 000 I.E., 4 000 I.E., 5 000 I.E., 6 000 I.E., 10 000 I.E. und 20 000 I.E Injektionslösung in Fertigspritze
1 Fertigspritze mit 1 Nadel (27G1/2) oder 6 Fertigspritzen mit 6 Nadeln (27G1/2).
NeoRecormon 30 000 I.E Injektionslösung in Fertigspritze
1 Fertigspritze mit 1 Nadel (27G1/2) oder 4 Fertigspritzen mit 4 Nadeln (27G1/2).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Waschen Sie zuerst Ihre Hände!
Nehmen Sie eine Fertigspritze aus der Verpackung und überprüfen Sie, ob die Lösung klar, farblos und praktisch frei von sichtbaren Schwebeteilen ist. Entfernen Sie die Kappe von der Fertigspritze.
Nehmen Sie eine Nadel aus der Packung, setzen Sie diese auf die Spritze und entfernen Sie die Schutzkappe von der Nadel.
Entfernen Sie die Luft aus der Spritze und der Nadel, indem Sie die Spritze senkrecht nach oben halten und den Kolben leicht nach oben drücken. Drücken Sie den Kolben danach so weit nach oben, dass die verordnete Menge an NeoRecormon in der Spritze verbleibt.
Desinfizieren Sie die Haut an der Einstichstelle mit einem Alkoholtupfer. Bilden Sie mit Hilfe von Daumen und Zeigefinger eine Hautfalte. Halten Sie die Spritze in der Nähe der Nadel fest und stechen Sie die Nadel ruckartig in die Hautfalte. Spritzen Sie die NeoRecormon Lösung. Ziehen Sie die Nadel schnell heraus und drücken Sie einen trockenen sterilen Tupfer fest auf die Einstichstelle.
Dieses Arzneimittel ist nur für den Einmalgebrauch bestimmt. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Roche Registration GmbH
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Deutschland
EU/1/97/031/025 – 026
EU/1/97/031/029 – 030
EU/1/97/031/031 – 032
EU/1/97/031/033 – 034
EU/1/97/031/035 – 036
EU/1/97/031/037 – 038
EU/1/97/031/041 – 042
EU/1/97/031/043 – 044
EU/1/97/031/045 – 046
Datum der Erteilung der Zulassung: 16. Juli 1997
Datum der letzten Verlängerung der Zulassung: 25. Juni 2007
Mai 2025
Verschreibungspflichtig
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Telefon (07624) 14-0
Telefax (07624) 1019
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.