Madopar® Depot
Hartkapseln, retardiert
Levodopa 100 mg
Benserazid 25 mg (als Benserazidhydrochlorid)
Jede Hartkapsel, retardiert, enthält 100 mg Levodopa und 28,5 mg Benserazidhydrochlorid, entsprechend 25 mg Benserazid.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Hartkapsel, retardiert.
Madopar Depot sind grün-hellblaue Hartkapseln. Sie tragen auf einer Seite die Aufschrift „ROCHE“.
Als Zusatzbehandlung von Morbus Parkinson bei Patienten, die bereits Levodopa in Kombination mit einem Decarboxylasehemmer erhalten.
Es liegen weder ausreichende klinische Erfahrungen mit Madopar Depot bei nicht mit Levodopa vorbehandelten Patienten noch in Kombination mit anderen Antiparkinsonmitteln oder in der Langzeitbehandlung vor.
Hinweis:
Madopar Depot dient nicht der Behandlung medikamentös induzierter extrapyramidalmotorischer Erscheinungen und nicht der Behandlung der Huntington-Krankheit.
Zur Vermeidung von Fluktuationen im therapeutischen Ansprechen kann die Anwendung von Madopar in einer nicht retardierten Darreichungsform durch Madopar Depot ersetzt werden.
Dosierung
Die Dosierung von Madopar Depot richtet sich nach dem Schweregrad des Parkinson-Syndroms, wobei die optimale Wirksamkeit durch sorgfältige Dosisanpassung individuell ermittelt werden muss.
Die Umstellung von nicht retardiertem Madopar auf Madopar Depot sollte bevorzugt von einem auf den anderen Tag erfolgen. Als tägliche Startdosis wird im Allgemeinen die Beibehaltung der bisherigen morgendlichen Madopar Gabe in der nicht retardierten Standardform empfohlen, der dann die Applikation von Madopar Depot folgt. Die weitere Abfolge muss durch Dosistitration bestimmt werden. Gegebenenfalls muss die Dosis von Madopar Depot im Vergleich zu Madopar in der Standardformulierung nach 2 bis 3 Tagen um ca. 50 % erhöht werden, da Madopar Depot Hartkapseln, retardiert, eine geringere Bioverfügbarkeit aufweisen. Die klinische Wirkung von Madopar Depot kann schneller erreicht werden, wenn Madopar Depot gleichzeitig mit nicht retardiertem Madopar oder Madopar LT eingenommen wird. Diese Kombination hat sich vor allem morgens mit der ersten Levodopa-Dosis als nützlich erwiesen.
Die Behandlung mit nicht retardiertem Madopar oder mit Madopar LT, Tabletten zur Herstellung einer Suspension zum Einnehmen, sollte wieder aufgenommen werden, falls das Ansprechen auf Madopar Depot ungenügend ist.
Unter der Behandlung von Madopar Depot können Dyskinesien auftreten, die durch eine Verlängerung des Dosierungsintervalls behoben werden können. Die Einzeldosen von Madopar Depot sollten jedoch nicht reduziert werden.
Ist eine verlängerte Wirksamkeit für den Bereich der Nacht erwünscht, werden vor dem Zu-Bett-Gehen 1 bis 2 Kapseln Madopar Depot zusätzlich zur unveränderten Tagestherapie verabreicht.
Spezielle Dosierungsanweisungen
Nierenfunktionsstörung
Bei Patienten mit leichten bis mäßigen Nierenfunktionsstörungen (Creatinin-Clearance ≥ 30 ml/min) ist keine Dosisanpassung erforderlich (siehe Abschnitt 4.3).
Bei älteren Patienten muss die Behandlung langsam und einschleichend erfolgen.
Parkinson-Patienten, die bereits mit einem anderen Antiparkinson-Präparat behandelt werden, können zusätzlich Madopar Depot einnehmen. Sobald jedoch der Wirkungseintritt von Madopar Depot ersichtlich ist, sollte die Dosierung der anderen Medikamente überprüft und gegebenenfalls langsam reduziert und dann abgesetzt werden.
Art der Anwendung
Madopar Depot Hartkapseln, retardiert, sollen nur als Ganzes geschluckt werden und dürfen nicht gekaut werden. Sie können zusammen mit oder unabhängig von einer Mahlzeit eingenommen werden (siehe Abschnitt 5.2).
Madopar Depot wird in der Regel über einen längeren Zeitraum eingenommen (Substitutionstherapie). Die Anwendung ist bei guter Verträglichkeit nicht begrenzt.
Überempfindlichkeit gegen die Wirkstoffe, Soja, Erdnuss oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
Patienten unter 25 Jahren (die skelettale Entwicklung muss abgeschlossen sein),
schwere endokrine Funktionsstörungen, wie z. B. Schilddrüsenüberfunktion, Cushing-Syndrom und Phäochromozytom,
schwere Stoffwechsel-, Leber-, Nieren- und Knochenmarkserkrankungen,
schwere Herzerkrankungen, wie z. B. schwere Tachykardien, schwere Herzrhythmusstörungen und Herzversagen,
endogene und exogene Psychosen,
Behandlung mit Reserpin,
Behandlung mit nicht selektiven MAO-Hemmern oder einer Kombination von MAO-A und MAO-B-Hemmern wegen dem Risiko des Auftretens von hypertensiven Krisen (siehe Abschnitt 4.5),
Engwinkelglaukom.
Madopar Depot darf von Schwangeren oder Frauen im gebärfähigen Alter ohne gesicherten Empfängnisschutz nicht eingenommen werden (siehe Abschnitt 4.6). Wenn es bei einer Frau, die mit Madopar behandelt wird, zu einer Schwangerschaft kommt, muss das Arzneimittel nach Anweisung des verschreibenden Arztes abgesetzt werden.
Überempfindlichkeitsreaktionen können bei hierfür empfindlichen Individuen auftreten.
Veränderungen des Blutbildes (hämolytische Anämie, Leukopenie und Thrombozytopenie) wurden berichtet (siehe Abschnitt 4.8). Einzelfälle von Agranulozytose und Panzytopenie wurden von Patienten mit Levodopa/Benserazid-Behandlung berichtet; ein Zusammenhang mit der Madopar Behandlung konnte weder belegt noch vollständig ausgeschlossen werden. Deshalb sollte das Blutbild der Patienten in der Einstellungsphase häufig und während der Dauer der Behandlung regelmäßig kontrolliert werden.
Bei Patienten mit Herzinfarktanamnese, bestehenden Herzrhythmusstörungen, koronaren Durchblutungsstörungen oder Herzversagen ist Vorsicht geboten. Kreislauf- und EKG-Kontrollen sollen deshalb in der Einstellungsphase häufig und während der Dauer der Behandlung regelmäßig vorgenommen werden.
Patienten mit Magen-Darm-Ulcera in der Vorgeschichte sowie Osteomalazie sollten ärztlich besonders beobachtet werden.
Bei Patienten mit Weitwinkelglaukom sind regelmäßige Kontrollen des intraokulären Druckes angezeigt, da Levodopa theoretisch das Potenzial besitzt, den Augeninnendruck zu erhöhen.
Bei Patienten mit Risikofaktoren (z. B. ältere Patienten, gleichzeitige Einnahme von Blutdrucksenkern oder anderen Medikamenten mit orthostatischem Potenzial) können gelegentlich hypotone orthostatische Kreislaufregulationsstörungen auftreten (siehe Abschnitt 4.8). Diese Patienten sollten, ebenso wie Patienten mit hypotonen orthostatischen Kreislaufregulationsstörungen, besonders zu Beginn der Behandlung oder bei Dosissteigerungen sorgfältig überwacht werden. Hypothone orthostatische Kreislaufstörungen können aber in der Regel durch Dosisreduktion von Madopar Depot beherrscht werden.
Gastrointestinale Nebenwirkungen wie Übelkeit, Erbrechen und Diarrhö (siehe Abschnitt 4.8), die vor allem bei Behandlungsbeginn auftreten, können weitgehend durch Einnahme von Madopar Depot mit etwas proteinarmer Nahrung (z. B. Gebäck, Zwieback oder Ähnliches), Flüssigkeit oder durch langsamere Dosissteigerung beherrscht werden.
Unter der Behandlung mit Madopar Depot können Depressionen auftreten (siehe Abschnitt 4.8). Diese können jedoch bei Patienten mit Parkinson-Krankheit auch Teil des klinischen Krankheitsbildes sein. Alle Patienten sollten deshalb sorgfältig auf psychische Veränderungen und Depressionen mit und ohne Suizidgedanken überwacht werden.
Dopaminerges Dysregulations-Syndrom (DDS): Eine kleine Gruppe von Patienten leidet unter kognitiven und Verhaltensstörungen, die direkt der Einnahme zunehmend hoher Dosen des Arzneimittels, entgegen dem medizinischen Rat, zugeordnet werden können.
Eine Behandlung mit Madopar Depot darf nicht plötzlich beendet werden. Nach langjähriger Behandlung mit Präparaten, die Levodopa enthalten, kann ein plötzliches Absetzen zu einem malignen Levodopa-Entzugssyndrom mit Hyperpyrexie, Muskelrigidität, gegebenenfalls psychischen Auffälligkeiten und einem Anstieg der Serumkreatin-Phosphokinase führen. In schweren Fällen kann es auch zu Myoglobinurie, Rhabdomyolyse und akutem Nierenversagen oder einer akinetischen Krise kommen. Diese Zustände sind lebensbedrohlich. Falls diese Symptome auftreten, muss der Patient überwacht und erforderlichenfalls stationär aufgenommen werden. Es muss umgehend eine geeignete symptomatische Behandlung eingeleitet werden, einschließlich einer möglichen Wiederaufnahme der Therapie mit Madopar Depot nach angemessener Prüfung. Aus therapeutischen Gründen indizierte Levodopa-Pausen dürfen daher nur in der Klinik durchgeführt werden.
Dyskinesien (z. B. choreiform oder athetotisch; siehe Abschnitt 4.8) im fortgeschrittenen Stadium der Behandlung können in der Regel durch Dosisreduktion beherrscht werden.
Fluktuationen im therapeutischen Ansprechen („Freezing”-, „End‑of‑Dose”- und „ON‑OFF”-Phänomene; siehe Abschnitt 4.8) können nach Langzeitbehandlung auftreten und werden gewöhnlich durch Dosisanpassung und durch häufigere Gabe kleiner Dosen vermindert oder tolerabel. Ein Versuch, die Dosis von Levodopa zur Verbesserung der therapeutischen Wirkung wieder anzuheben, kann dann stufenweise unternommen werden (siehe Abschnitt 4.2).
Im Falle einer Allgemeinanästhesie soll die Behandlung mit Madopar so weit wie möglich bis zum Zeitpunkt der Operation fortgesetzt werden, außer wenn Halothan gegeben wird. Falls eine Allgemeinanästhesie mit Halothan benötigt wird, muss Madopar 12 bis 48 Stunden vor der Operation abgesetzt werden, da es bei der gleichzeitigen Verabreichung von Madopar und Halothan zu Blutdruckschwankungen und/oder zu Arrhythmien kommen kann. Nach der Operation kann die Therapie mit Madopar wieder, mit langsam ansteigender Dosierung bis auf die Ausgangswerte vor der Operation, aufgenommen werden.
Levodopa wurde mit Somnolenz und plötzlich auftretenden Schlafattacken in Verbindung gebracht. In sehr seltenen Fällen wurde über plötzlich auftretende Schlafattacken während der Aktivitäten des täglichen Lebens berichtet, welche in manchen Fällen unbewusst oder völlig unerwartet auftraten. Patienten müssen darüber informiert und darauf hingewiesen werden, während einer Behandlung mit Levodopa im Straßenverkehr oder beim Bedienen von Maschinen vorsichtig zu sein. Patienten, bei denen Somnolenz und/oder plötzlich auftretende Schlafattacken aufgetreten sind, dürfen kein Fahrzeug führen und keine Maschinen bedienen. Darüber hinaus sollte eine Dosisreduktion oder eine Beendigung der Therapie erwogen werden (siehe Abschnitt 4.7).
Impulskontrollstörungen
Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten und/oder anderen dopaminergen, Levodopa-haltigen Arzneimitteln, einschließlich Madopar, behandelt werden, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen auftreten können. Hierunter fallen pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang. Die Überprüfung der Behandlung wird empfohlen, wenn solche Symptome auftreten.
Laboruntersuchungen
Während der Behandlung mit Madopar sollten regelmäßige Kontrollen des Blutbildes sowie der Leber-, Nieren- und Herzfunktion durchgeführt werden. Bei Diabetikern sollen die Blutzuckerwerte öfter überprüft und die Dosierung der antidiabetischen Therapie an die Blutzuckerwerte angepasst werden.
Malignes Melanom
Epidemiologische Untersuchungen haben gezeigt, dass Parkinson-Patienten im Vergleich zur Allgemeinbevölkerung ein ca. 2- bis 6‑fach erhöhtes Risiko haben, Melanome zu entwickeln. Es ist nicht bekannt, ob das erhöhte Risiko der Krankheit selbst oder anderen Faktoren, wie z. B. der Behandlung mit Levodopa, zuzuschreiben ist. Deshalb sollten Patienten und medizinisches Fachpersonal bei einer Madopar Behandlung die Haut regelmäßig auf verdächtige Veränderungen hin untersuchen, die auf ein Melanom hinweisen können. Die regelmäßigen Hautuntersuchungen sollten durch geeignete Fachkräfte (z. B. Dermatologen) erfolgen.
Pharmakokinetische Wechselwirkungen
Die gleichzeitige Anwendung des anticholinergen Arzneimittels Trihexyphenidyl mit einer Standard-Levodopa-Benserazid-Darreichungsform reduziert die Geschwindigkeit, nicht aber den Umfang der Levodopa-Resorption. Die gleichzeitige Anwendung von Trihexyphenidyl und der retardierten Levodopa-Benserazid-Darreichungsformen beeinflusst die Pharmakokinetik von Levodopa nicht.
Die gleichzeitige Anwendung von Antazida und retardierten Levodopa-Benserazid-Darreichungsformen reduziert das Ausmaß der Resorption von Levodopa um 32 %.
Eisensulfat erniedrigt die maximale Plasmakonzentration und die AUC von Levodopa um 30 % ‑ 50 %. Die pharmakokinetischen Veränderungen, die während einer gleichzeitigen Behandlung mit Eisensulfat beobachtet wurden, scheinen bei einigen, aber nicht bei allen Patienten, klinisch signifikant zu sein.
Metoclopramid erhöht die Geschwindigkeit der Levodopa-Resorption.
Domperidon kann als Ergebnis einer erhöhten Resorption von Levodopa im Darm die Bioverfügbarkeit von Levodopa erhöhen. Möglicherweise besteht durch gleichzeitige Einnahme von Levodopa und Domperidon ein erhöhtes Risiko kardialer Arrhythmien.
Die maximale Plasmakonzentration von Levodopa ist um 2 Stunden verzögert, wenn Madopar Depot zusammen mit Nahrung eingenommen wird (siehe Abschnitt 5.2).
Pharmakodynamische Wechselwirkungen
Arzneimittel mit Wirkung auf das extrapyramidalmotorische System:
Die Wirkung von Madopar Depot wird eingeschränkt durch Opioide, reserpinhaltige Antihypertensiva und Neuroleptika.
Antipsychotika
Die gleichzeitige Anwendung von Antipsychotika mit dopaminrezeptorblockierenden Eigenschaften, insbesondere D2-Rezeptorantagonisten, kann die Wirkung von Madopar hemmen und sollte deshalb mit Vorsicht erfolgen. Die Patienten sollten hinsichtlich eines möglichen Verlustes der Wirkung und einer Verschlechterung der Parkinson-Symptomatik sorgfältig überwacht werden.
MAO-Hemmstoffe
Madopar Depot darf nicht gleichzeitig mit einem irreversiblen, nicht selektiven Monoaminoxidase(MAO)-Hemmer verabreicht werden. Die Gabe eines reinen MAO‑B-Hemmers (z. B. Selegilin, bis zu 10 mg täglich, oder Rasagilin) oder eines selektiven MAO‑A-Hemmers (z. B. Moclobemid) ist nicht kontraindiziert. Selegilin kann unter Umständen die Antiparkinson-Wirkung von Levodopa verstärken, ohne gefährliche Interaktionen auszulösen.
Die gleichzeitige Gabe von MAO‑A- und MAO‑B-Hemmern entspricht in der Wirkung einer nicht selektiven MAO-Hemmung. Aus diesem Grund darf diese Kombination nicht gleichzeitig mit Madopar Depot verabreicht werden (siehe Abschnitt 4.3).
Bei gleichzeitiger Gabe eines nicht selektiven, irreversiblen MAO-Hemmers (z. B. Tranylcypromin) kann es – unter Umständen bis zu 2 Wochen nach Absetzen des MAO-Hemmstoffes – zu hypertensiven Krisen kommen. Zwischen dem Absetzen einer Therapie mit einem nicht selektiven MAO-Hemmer und dem Beginn einer Behandlung mit Madopar Depot muss deshalb ein behandlungsfreies Intervall von mindestens 2 Wochen liegen.
Sympathomimetika
Die gleichzeitige Einnahme von Madopar Depot und Sympathomimetika, wie Epinephrin, Norepinephrin, Isoproterenol oder Amphetamin, kann deren Wirkung verstärken und wird deshalb nicht empfohlen. Sollte eine gleichzeitige Anwendung notwendig sein, ist eine engmaschige Überwachung des kardiovaskulären Systems unverzichtbar und die Dosierung des Sympathomimetikums muss gegebenenfalls reduziert werden.
Andere Antiparkinsonmittel
In Analogie zu der Standardformulierung ist anzunehmen, dass Madopar Depot mit allen bekannten Antiparkinsonmitteln (z. B. Dopaminagonisten, Amantadin, Anticholinergika, Selegilin, Bromocriptin) kombinierbar ist. Dabei können jedoch sowohl die erwünschten als auch die unerwünschten Wirkungen der Behandlung verstärkt und eine Dosisverminderung von Madopar Depot oder der anderen Substanzen notwendig werden. Wenn eine adjuvante Therapie mit einem COMT-Hemmer begonnen wird, kann eine Reduzierung der Dosis von Madopar Depot notwendig werden. Zusätzliche Untersuchungen mit Madopar Depot zu Wechselwirkungen mit anderen Parkinsonmitteln wurden nicht durchgeführt. Eine Reduktion der anderen Substanzen bzw. von Madopar Depot kann notwendig werden. Bei Ergänzung einer Therapie um den Bestandteil Madopar Depot sollte die vorbestehende Behandlung mit Anticholinergika nicht abrupt beendet werden, da die Levodopa-Wirkung nicht sofort einsetzt.
Antihypertensiva
Symptomatische orthostatische Blutdruckabfälle wurden beobachtet, wenn Levodopa in Kombination mit einem Decarboxylasehemmer bei Patienten angewendet wurde, die bereits Antihypertensiva erhielten. Da es zu einer verstärkten Wirkung von Antihypertensiva kommen kann, muss der Blutdruck regelmäßig kontrolliert werden und es müssen, soweit erforderlich, Dosisanpassungen vorgenommen werden.
Proteinreiche Mahlzeiten
Daten zur Auswirkung von proteinreichen Mahlzeiten auf die Wirksamkeit von Madopar Depot sind nicht verfügbar.
Veränderungen von labordiagnostischen Messungen:
Es können verschiedene labordiagnostische Messungen gestört sein:
Levodopa kann die labordiagnostischen Messergebnisse von Katecholaminen, Creatinin, Harnsäure und Glucose (bei Glucosurie) beeinflussen;
falsch‑positiver Ketonnachweis bei Verwendung von Teststreifen (durch Kochen der Urinprobe wird diese Reaktion nicht verändert);
falsch‑negativer Harnzuckernachweis bei Verwendung der Glucose‑Oxidase‑Methode;
falsch‑positiver Coombs‑Test.
Hinweis
Allgemeinanästhesie mit Halothan
Falls eine Allgemeinanästhesie mit Halothan benötigt wird, muss Madopar Depot 12 bis 48 Stunden vor der Operation abgesetzt werden, da es zu Blutdruckschwankungen und/oder zu Arrhythmien kommen kann.
Zur Allgemeinanästhesie mit anderen Narkotika siehe Abschnitt 4.4.
Fertilität
Es wurden keine Fertilitätsstudien durchgeführt.
Schwangerschaft
Vor Beginn der Behandlung wird ein Schwangerschaftstest empfohlen, um eine Schwangerschaft auszuschließen. Madopar Depot darf in der Schwangerschaft nicht angewendet werden (siehe Abschnitt 4.3), da keine Erfahrungen beim Menschen vorliegen und in Tierversuchen für beide Wirkstoffe Reproduktionstoxizität beschrieben wurde (siehe Abschnitt 5.3). Frauen im gebärfähigen Alter müssen während der Behandlung mit Madopar Depot geeignete Maßnahmen zur Empfängnisverhütung ergreifen. Bei Eintreten einer Schwangerschaft muss Madopar Depot unter schrittweiser Dosisreduktion abgesetzt werden.
Stillzeit
Levodopa hemmt die Prolaktinausschüttung und somit die Laktation. Da nicht bekannt ist, ob Benserazid in die Muttermilch übergeht, und da bei heranwachsenden Tieren nach Gabe von Benserazid degenerative Skelettveränderungen beobachtet wurden, dürfen Frauen während der Behandlung mit Madopar Depot nicht stillen. Ist eine Behandlung mit Madopar Depot während der Stillzeit erforderlich, muss abgestillt werden.
Madopar kann einen großen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben.
Wenn es bei Patienten unter der Einnahme von Madopar Depot zu Somnolenz und/oder plötzlich auftretenden Schlafattacken kommt, müssen sie darüber informiert werden, dass sie kein Fahrzeug führen oder Tätigkeiten ausüben dürfen, bei denen eine Beeinträchtigung der Aufmerksamkeit das Risiko schwerwiegender Verletzungen oder des Todes für sich selbst oder andere nach sich ziehen kann, bis Somnolenz und Schlafattacken nicht mehr auftreten (siehe Abschnitt 4.4).
Bei der Einnahme von Madopar Depot kann es zu den nachstehenden Nebenwirkungen kommen, deren Häufigkeit nicht bekannt ist, d. h. auf Grundlage der verfügbaren Daten nicht abgeschätzt werden kann.
Der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (≥ 1/10)
Häufig (≥ 1/100, < 1/10)
Gelegentlich (≥ 1/1 000, < 1/100)
Selten (≥ 1/10 000, < 1/1 000)
Sehr selten (< 1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen: | |
Nicht bekannt |
Fieberhafte Infektionen, Bronchitis, Schnupfen |
Erkrankungen des Blutes und des Lymphsystems: | |
Nicht bekannt |
Hämolytische Anämie, Thrombozytopenie, Leukopenie |
Stoffwechsel- und Ernährungsstörungen: | |
Nicht bekannt |
Anorexie |
Psychiatrische Erkrankungen: | |
Nicht bekannt |
Dopaminerges Dysregulations-Syndrom (DDS), Verwirrtheit, Depressionen, innere Unruhe*, Ängstlichkeit*, Schlafstörungen*, Halluzinationen*, Wahnvorstellungen*, zeitliche Desorientierung*, pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken, Esszwang |
Erkrankungen des Nervensystems: | |
Nicht bekannt |
Geschmacksverlust, Änderungen des Geschmacksempfindens, Dyskinesie (choreiform und athetotisch), Fluktuationen im therapeutischen Ansprechen („Freezing”-, „End-of-Dose”- und „ON-OFF”-Phänomene) , Müdigkeit, übermäßige Tagesmüdigkeit, plötzlich auftretende Schlafattacken, Schwindel, Kopfschmerzen, Mundtrockenheit |
Herzerkrankungen: | |
Nicht bekannt |
Arrhythmie |
Gefäßerkrankungen: | |
Nicht bekannt |
Orthostatische Hypotonie |
Erkrankungen des Gastrointestinaltrakts: | |
Nicht bekannt |
Übelkeit, Erbrechen, Diarrhö, Verfärbungen von Speichel, Zunge, Zähnen und Mundschleimhaut |
Leber- und Gallenerkrankungen: | |
Nicht bekannt |
Erhöhte Lebertransaminasen, alkalische Phosphatase und γ-Glutamyltransferase |
Erkrankungen der Haut und des Unterhautgewebes: | |
Nicht bekannt |
Allergische Hautreaktionen (z. B. Pruritus, Rash) |
Erkrankungen der Nieren und Harnwege: | |
Nicht bekannt |
Erhöhte Harnstoff-Stickstoff-Werte (BUN), Chromaturie |
* Diese Nebenwirkungen können insbesondere bei älteren Patienten oder bei Patienten mit entsprechender Anamnese auftreten.
Impulskontrollstörungen
Pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten oder anderen dopaminergen, Levodopa-haltigen Arzneimitteln, einschließlich Madopar, behandelt werden (siehe Abschnitt 4.4).
Erkrankungen des Nervensystems
Im fortgeschrittenen Stadium der Behandlung mit Madopar können Dyskinesien auftreten (z. B. choreiform oder athetotisch) (siehe Abschnitt 4.4). Diese können normalerweise durch Dosisreduktion verhindert oder erträglich gemacht werden.
Nach Langzeitbehandlung können auch Fluktuationen im therapeutischen Ansprechen auftreten („Freezing”-, „End‑of‑Dose”- und „ON‑OFF”-Phänomene) (siehe Abschnitt 4.4). Auch diese Ereignisse können normalerweise durch Dosisanpassung oder häufigere Gabe kleinerer Dosen verhindert oder erträglich gemacht werden. Ein Versuch, die Dosis von Levodopa zur Verbesserung der therapeutischen Wirkung wieder anzuheben, kann dann stufenweise unternommen werden.
Madopar wurde mit Müdigkeit, sehr selten mit übermäßiger Tagesmüdigkeit und plötzlich auftretenden Schlafattacken in Verbindung gebracht (siehe Abschnitt 4.4).
Gefäßerkrankungen
Orthostatische Ereignisse verbessern sich üblicherweise nach Dosisreduktion.
Erkrankungen des Gastrointestinaltrakts
Unerwünschte gastrointestinale Wirkungen, die meist zu Behandlungsbeginn auftreten, können in der Regel durch die Einnahme von Madopar zusammen mit etwas proteinarmer Nahrung (z. B. Gebäck, Zwieback oder Ähnliches), Flüssigkeit oder durch langsame Dosissteigerung kontrolliert werden.
Untersuchungen
Harnverfärbungen (meist eine leichte Rotfärbung, die sich bei längerem Stehenlassen dunkel färbt). Andere Körperflüssigkeiten und Gewebe, einschließlich Speichel, Zunge, Zähne oder Mundschleimhaut können auch von einer Farbänderung betroffen oder gefärbt sein.
Hydriertes Pflanzenöl kann sehr selten allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
53175 Bonn
Website: www.bfarm.de
anzuzeigen.
Symptome einer Überdosierung
Die Symptome und Anzeichen einer Überdosierung entsprechen qualitativ den Nebenwirkungen von Madopar Depot in therapeutischer Dosierung, sie können jedoch stärker ausgeprägt sein. Eine Überdosierung kann somit zu kardiovaskulären Nebenwirkungen (z. B. kardialen Arrhythmien), psychiatrischen Störungen (z. B. Verwirrtheit und Schlaflosigkeit), gastrointestinalen Nebenwirkungen (z. B. Übelkeit und Erbrechen) und unwillkürlichen Bewegungen führen (siehe Abschnitt 4.8).
Wenn ein Patient eine Überdosierung einer retardierten Levodopa-Benserazid-Darreichungsform genommen hat, können das Einsetzen der Symptome und die Anzeichen einer Überdosierung aufgrund der verzögerten Resorption des Wirkstoffs im Magen verspätet auftreten.
Behandlung einer Überdosierung
Die Vitalparameter des Patienten sind zu beobachten und unterstützende Maßnahmen entsprechend dem klinischen Bild des Patienten sind zu ergreifen. Insbesondere können kardiovaskuläre Nebenwirkungen die Anwendung von Antiarrhythmika und zentralnervöse Nebenwirkungen die Gabe von Atemstimulanzien oder Neuroleptika erforderlich machen.
Zusätzlich sollte bei der Anwendung retardierter Darreichungsformen die weitere Resorption des Wirkstoffs durch geeignete Maßnahmen verhindert werden.
Pharmakotherapeutische Gruppe: Levodopa und Decarboxylaseinhibitor, ATC‑Code: N04BA02.
Wirkmechanismus
Levodopa ist eine Aminosäure, die in Kombination mit dem peripheren Decarboxylasehemmer Benserazid der Substitution eines zentralnervösen Dopaminmangels dient.
Klinische Wirksamkeit und Sicherheit
Da wenigstens 95 % des oral verabreichten Levodopa bereits in extrazerebralen Organen (Darm, Leber, Niere, Herz, Magen) decarboxyliert werden, gelangen bei einer Levodopa‑Monotherapie nur geringe Mengen in das Zentralnervensystem. Aufgrund des extrazerebral gebildeten Dopamin und der aus ihm entstehenden adrenergen Substanzen wurden zahlreiche gastrointestinale und kardiovaskuläre Nebenwirkungen der Monotherapie mit Levodopa berichtet.
Der Decarboxylasehemmer Benserazid tritt in der vorliegenden Dosierung nicht in nennenswertem Umfang in das Gehirn über (weniger als 6 % der Plasmakonzentration). Durch die gleichzeitige Gabe von Benserazid wird die Decarboxylierung von Levodopa in der Peripherie, vor allem in der Darmschleimhaut, nahezu vollständig verhindert. Dadurch kann die Dosis Levodopa, die zur Erreichung vergleichbarer klinischer Effekte notwendig ist, auf ca. 20 % der bei der Monotherapie notwendigen Dosis gesenkt werden. Die gastrointestinalen und kardiovaskulären Nebenwirkungen von peripher gebildetem Dopamin werden dadurch weitgehend vermieden.
Der Benserazid‑Anteil in der Kombination führt infolge der Decarboxylasehemmung zu einer Erhöhung der Prolaktinkonzentration.
Madopar Depot hat andere pharmakokinetische Eigenschaften als die nicht retardierten Kapseln und Tabletten.
Resorption
Die Wirkstoffe werden aus Madopar Depot langsam über 4 ‑ 5 Stunden freigesetzt, sodass relevante Plasmakonzentrationen für 6 ‑ 8 Stunden nach der Einnahme bestehen. Die maximale Plasmakonzentration von Levodopa, die ca. 20 % bis 30 % niedriger ist als bei den konventionellen Präparateformen, wird etwa 3 Stunden nach der Einnahme erreicht. Sie wird nicht beeinflusst, wenn Madopar Depot zusammen mit Nahrung eingenommen wird, tritt aber zwei Stunden später auf als nach der Einnahme ohne Nahrung. Die Plasmahalbwertszeit von Levodopa beträgt etwa eine Stunde. Die Plasmakonzentrationskurve zeigt eine längere Halbwertszeit als bei den nicht retardierten Darreichungsformen, was auf die Eigenschaft der retardierten Hartkapsel hindeutet, die Wirkstoffe gesteuert und kontinuierlich freizusetzen.
Verteilung
Levodopa überwindet die Magenschleimhaut und die Blut-Hirn-Schranke durch einen sättigbaren Transportmechanismus. Es wird nicht an Plasmaproteine gebunden. Sein Verteilungsvolumen beträgt 57 Liter. Die AUC von Levodopa in der Zerebrospinalflüssigkeit beträgt 12 % von derjenigen im Plasma.
Im Gegensatz zu Levodopa überwindet Benserazid in therapeutischen Dosen nicht die Blut-Hirn-Schranke. Die Benserazid-Konzentrationen sind in den Nieren, in der Lunge, im Dünndarm und in der Leber am höchsten. Benserazid passiert die Plazenta.
Biotransformation
Levodopa wird hauptsächlich durch Decarboxylierung, O‑Methylierung, Transaminierung und Oxidation metabolisiert. Die Decarboxylierung von Levodopa zu Dopamin erfolgt durch die aromatische Aminosäure-Decarboxylase, die zusätzlich zur Leber im Verdauungstrakt, den Nieren und dem Herzen reichlich vorhanden ist . Die Hauptmetaboliten sind Homovanillinsäure und Dihydroxyphenylessigsäure.
Die Methoxylierung von Levodopa zu 3‑O‑Methyldopa durch die Catechol‑O‑Methyltransferase (COMT) stellt einen zweiten Metabolisierungsweg dar. Die Eliminationshalbwertszeit von 3‑O‑Methyldopa beträgt 15 Stunden. Daher akkumuliert dieser Metabolit bei Patienten, die therapeutische Dosen von Madopar Depot erhalten.
Gleichzeitige Verabreichung von Levodopa und Benserazid verringert die periphere Decarboxylierung. Dies zeigt sich in erhöhten Plasmaspiegeln von Aminosäuren (Levodopa, 3‑O‑Methyldopa) und niedrigeren Plasmaspiegeln von Katecholaminen (Dopamin, Noradrenalin) und Phenylcarbonsäuren (Homovanillinsäure, Dihydroxyphenylessigsäure).
Benserazid wird in der Darmwand und in der Leber zu Trihydroxybenzylhydrazin hydroxyliert. Dieser Metabolit ist ein wirkungsvoller Inhibitor der aromatischen Aminosäure-Decarboxylase.
Elimination
Bei peripherer Hemmung der Levodopa-Decarboxylase beträgt die Eliminationshalbwertszeit von Levodopa etwa 1,5 Stunden. Bei älteren Parkinson-Patienten (Alter 65 ‑ 78 Jahre) ist die Eliminationshalbwertszeit um ca. 25 % verlängert. Die Clearance von Levodopa beträgt 430 ml/min.
Benserazid wird fast vollständig in Form von Metaboliten eliminiert. Die Metaboliten werden hauptsächlich über die Niere (64 %) und zu einem geringeren Anteil über die Fäzes (24 %) ausgeschieden.
Pharmakokinetische Zusammenhänge
Die Bioverfügbarkeit beträgt im Vergleich zu den Standardformen 60 % ‑ 70 % und wird durch Nahrung nicht beeinflusst.
Eine im Jahr 1992 durchgeführte Bioverfügbarkeitsuntersuchung an 18 Probanden mit Parkinsonerkrankung ergab bei täglicher Einnahme von 3 Retardkapseln Madopar Depot im Vergleich zu 3 Kapseln mit schneller Wirkstoff-Freisetzung (entsprechend 600 mg Levodopa plus Benserazid) im Steady State (Messung am 7. Tag):
Testpräparat |
Referenz |
|
Cmax (ng/ml) |
1 383 ± 611 |
2 238 ± 697 |
tmax (h) |
3,5 ± 1,7 |
1,7 ± 0,8 |
AUCO-τ (h ng/ml) |
4 219 ± 1 407 |
4 866 ± 1 134 |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung)
Abb. 1: Mittlere Plasmaspiegelverläufe von Madopar 125 mg, Hartkapseln, und Madopar Depot, Hartkapseln retardiert, in einem Konzentrations-Zeit-Diagramm.
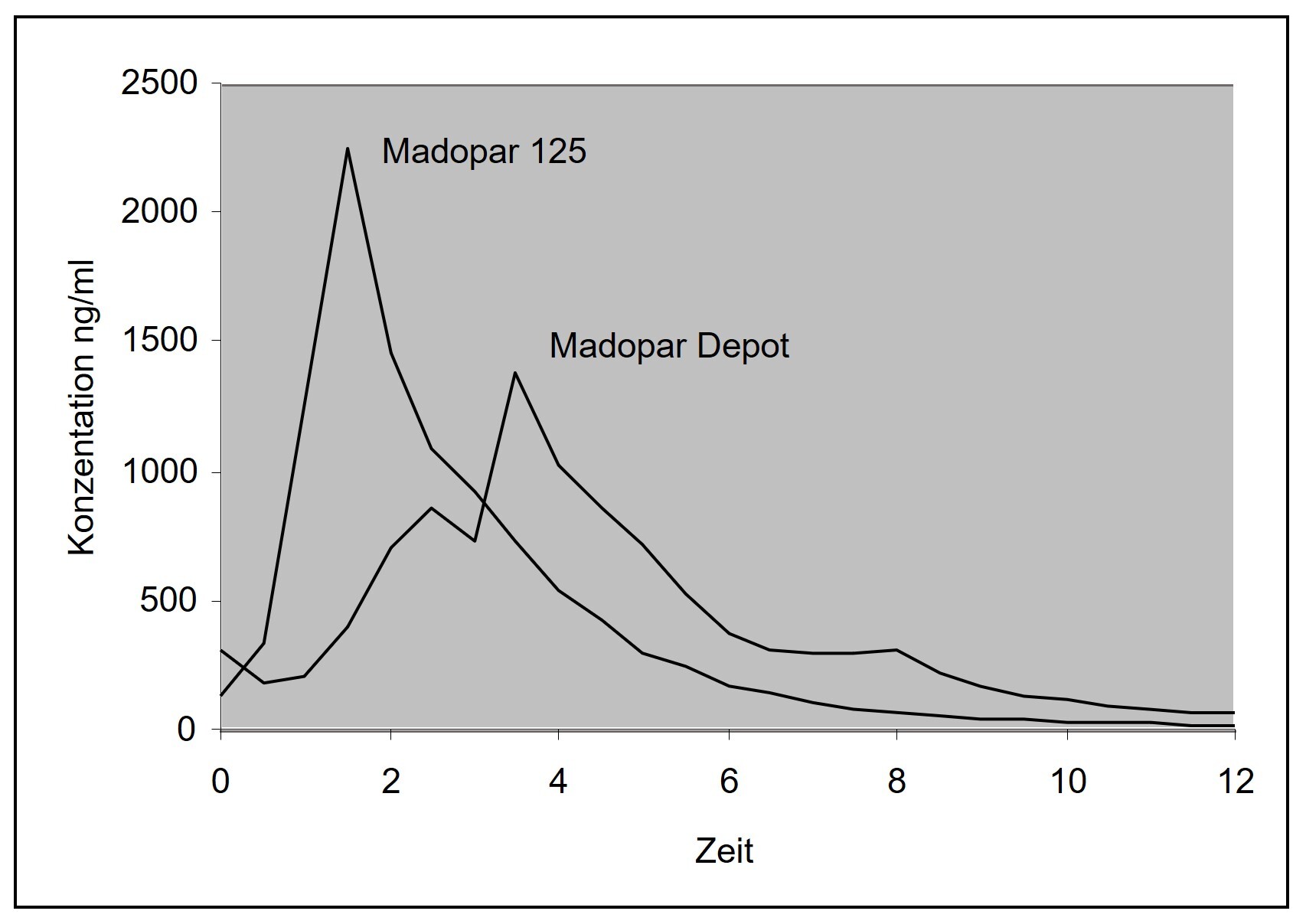
Chronische Toxizität
In Studien zur chronischen Toxizität an Ratten verursachte die orale Gabe von Levodopa plus Benserazid dosisabhängig ausgeprägte Skelettveränderungen, die ihren Ausgangspunkt von den noch nicht geschlossenen Epiphysenfugen nahmen. Knochenveränderungen traten nur im wachsenden Organismus auf und wurden durch Benserazid verursacht. Bei Hunden wurden dosisabhängig ein Anstieg der Leberenzyme sowie eine Leberverfettung, eine Verlängerung der Thromboplastinzeit sowie eine Verminderung des blutbildenden Gewebes im Knochenmark nach hohen Dosen beobachtet.
Genotoxizität
Im Ames-Test konnte für Madopar bzw. seine wirksamen Bestandteile Levodopa und Benserazid keine mutagene Wirkung beobachtet werden. Weitere Befunde liegen nicht vor.
Karzinogenes Potenzial
Studien zur Karzinogenität liegen nicht vor.
Reproduktionstoxizität
Mit Levodopa/Benserazid wurden keine Fertilitätsstudien durchgeführt.
Studien zur Reproduktionstoxizität von Levodopa/Benserazid zeigten bei Mäusen (400 mg/kg), Ratten (600 mg/kg; 250 mg/kg) und Kaninchen (120 mg/kg; 150 mg/kg) keine teratogene Wirkung oder Beeinflussung der Skelettentwicklung.
Dosierungen im maternaltoxischen Bereich verursachten bei Kaninchen eine Erhöhung der Embryoletalität und bei Ratten eine Gewichtsabnahme beim Fötus.
Calciumhydrogenphosphat
Hypromellose
Hydriertes Pflanzenöl
Povidon K 30
Magnesiumstearat (Ph.Eur.)
Mannitol (Ph.Eur.)
Talkum
Kapselhülle
Eisen(III)-hydroxid-oxid (E172)
Titandioxid (E171)
Indigocarmin (E132)
Gelatine
Drucktinte
Schellack
Propylenglykol
Kaliumhydroxid
Eisen(III)‑oxid (E172)
Nicht zutreffend.
3 Jahre.
Nicht über 30 °C lagern. Die Flasche fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
Behältnis
Flaschen aus braunem Glas, Glasart III (Ph.Eur.), zu 70 ml bzw. 160 ml.
Verschluss
Stopfen aus Polyethylen mit Kammer für Trocknungsmittel (Silicagel)
Packungsgrößen:
20 Hartkapseln, retardiert
50 Hartkapseln, retardiert
100 Hartkapseln, retardiert
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Keine besonderen Anforderungen.
Roche Pharma AG
Emil‑Barell‑Straße 1
79639 Grenzach‑Wyhlen
Telefon (07624) 14‑0
Telefax (07624) 10 19
17010.00.00
Datum der Erteilung der Zulassung: 17. Juli 1995
Datum der letzten Verlängerung der Zulassung: 19. Dezember 2003
August 2024
Verschreibungspflichtig