RotaTeq® Lösung zum Einnehmen
Rotavirus-Impfstoff (lebend)
Eine Dosis (2 ml) enthält:
Rotaviren*, Typ G1 |
mind. 2,2 x 106 IE1,2 |
Rotaviren*, Typ G2 |
mind. 2,8 x 106 IE1,2 |
Rotaviren*, Typ G3 |
mind. 2,2 x 106 IE1,2 |
Rotaviren*, Typ G4 |
mind. 2,0 x 106 IE1,2 |
Rotaviren*, Typ P1A[8] |
mind. 2,3 x 106 IE1,2 |
* lebende human-bovine Rotavirus-Reassortanten, gezüchtet in Vero-Zellen
1 Infektiöse Einheiten
2 untere Vertrauensgrenze (p = 0,95)
Sonstige Bestandteile mit bekannter Wirkung
Dieser Impfstoff enthält 1.080 Milligramm Sucrose und 37,6 Milligramm Natrium (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Lösung zum Einnehmen
Klare, blassgelbe Lösung, eventuell mit rosa Farbstich.
RotaTeq ist indiziert zur aktiven Immunisierung von Säuglingen ab einem Alter von 6 bis 32 Wochen zur Prävention von Gastroenteritis, die durch Rotaviren verursacht wird (siehe Abschnitte 4.2, 4.4 und 5.1).
RotaTeq ist gemäß den offiziellen Impfempfehlungen zu verabreichen.
Dosierung
Von der Geburt bis zu einem Alter von 6 Wochen
RotaTeq ist bei Säuglingen dieser Altersgruppe nicht indiziert.
Die Sicherheit und Wirksamkeit von RotaTeq bei Säuglingen von der Geburt bis zu einem Alter von 6 Wochen ist nicht erwiesen.
Ab einem Alter von 6 bis 32 Wochen
Die vollständige Immunisierung besteht aus drei Dosen.
Die erste Dosis kann ab Vollendung der 6. Lebenswoche, sollte jedoch nicht später als im Alter von 12 Wochen verabreicht werden.
RotaTeq kann Frühgeborenen, die mit einem Gestationsalter von mindestens 25 Wochen geboren wurden, verabreicht werden. Diese Säuglinge sollten die erste Dosis RotaTeq frühestens 6 Wochen nach der Geburt erhalten (siehe Abschnitte 4.4 und 5.1).
Ein Abstand von mindestens 4 Wochen zwischen den einzelnen Dosen sollte eingehalten werden.
Die Grundimmunisierung mit drei Dosen sollte vorzugsweise bis zur Vollendung der 20. bis 22. Lebenswoche abgeschlossen sein. Falls nötig, kann die dritte (letzte) Dosis bis zur Vollendung der 32. Lebenswoche verabreicht werden (siehe Abschnitt 5.1).
Es stehen keine Daten zur Austauschbarkeit von RotaTeq mit anderen Rotavirus-Impfstoffen zur Verfügung; daher sollte für die noch ausstehenden Dosen bei Säuglingen, deren Grundimmunisierung mit RotaTeq begonnen wurde, der gleiche Impfstoff verwendet werden.
Wenn man beobachtet oder stark vermutet, dass eine Dosis nicht vollständig verabreicht wurde (z. B. weil der Säugling den Impfstoff ausspuckt oder erbricht), kann während des gleichen Impftermins eine Ersatzdosis verabreicht werden; dies wurde jedoch nicht in klinischen Prüfungen untersucht. Wenn sich das Problem wiederholt, sollte keine weitere Ersatzdosis mehr verabreicht werden.
Nach Abschluss der Grundimmunisierung mit 3 Dosen werden keine weiteren Dosen empfohlen (weitere Informationen zur Dauer des Schutzes finden sich in den Abschnitten 4.4 und 5.1).
Ab einem Alter von 33 Wochen bis zu 18 Jahren
RotaTeq ist in dieser Altersgruppe nicht indiziert.
Art der Anwendung
RotaTeq darf nur oral verabreicht werden.
RotaTeq DARF KEINESFALLS ALS INJEKTION VERABREICHT WERDEN.
RotaTeq kann unabhängig von der Aufnahme von Nahrung, Getränken oder Muttermilch verabreicht werden.
Handhabungshinweise siehe Abschnitt 6.6.
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Überempfindlichkeitsreaktion nach einer früheren Verabreichung eines Rotavirus-Impfstoffs.
Invagination in der Anamnese.
Angeborene Fehlbildung des Gastrointestinaltrakts, die möglicherweise für eine Invagination prädisponieren könnte.
Bekannte oder vermutete Immundefizienz (siehe Abschnitte 4.4 und 4.8).
Die Gabe von RotaTeq sollte bei Säuglingen, die an einer akuten, schweren fieberhaften Erkrankung leiden, verschoben werden. Eine leichte Infektion ist keine Kontraindikation für eine Impfung.
Bei Säuglingen mit akutem Durchfall oder Erbrechen sollte die Gabe von RotaTeq verschoben werden.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Wie bei allen Impfstoffen sollten für den Fall einer anaphylaktischen Reaktion nach Gabe des Impfstoffs geeignete Behandlungsmöglichkeiten unmittelbar zur Verfügung stehen (siehe Abschnitt 4.8).
Es liegen keine Daten aus klinischen Prüfungen vor zur Sicherheit oder Wirksamkeit von RotaTeq bei immunsupprimierten Säuglingen, bei denjenigen, die in utero einer immunsuppressiven Therapie ausgesetzt waren, bei HIV-infizierten Säuglingen oder Säuglingen, die innerhalb von 42 Tagen vor der Verabreichung von RotaTeq Bluttransfusionen oder Immunglobuline erhalten haben. Es ist nicht zu erwarten, dass eine asymptomatische HIV-Infektion die Sicherheit oder Wirksamkeit von RotaTeq beeinflusst. Da jedoch keine ausreichenden Daten vorliegen, wird die Verabreichung von RotaTeq bei Säuglingen mit asymptomatischer HIV-Infektion nicht empfohlen. Die Verabreichung von RotaTeq an Säuglinge, die in utero einer immunsuppressiven Behandlung ausgesetzt waren, sollte auf einer sorgfältigen Abwägung der möglichen Nutzen und Risiken beruhen.
Nach der Markteinführung wurden Fälle von Gastroenteritis in Zusammenhang mit dem Impfvirus bei Säuglingen mit schwerem kombiniertem Immundefekt (SCID) beobachtet (siehe Abschnitt 4.3).
In Studien wurde RotaTeq bei 8,9 % der geimpften Säuglinge fast ausschließlich in der Woche nach der ersten Dosis mit dem Stuhl ausgeschieden und nur bei einem geimpften Säugling (0,3 %) nach der dritten Dosis. Das Maximum der Ausscheidung wurde innerhalb der ersten 7 Tage nach der Impfung erreicht. Nach der Markteinführung wurde die Übertragung von Impfvirus-Stämmen auf nicht geimpfte Kontaktpersonen beobachtet. RotaTeq sollte Säuglingen mit engem Kontakt zu immungeschwächten Personen (z. B. Personen mit malignen Erkrankungen oder solche, deren Immunsystem aus einem anderen Grund supprimiert ist oder Personen, die mit Immunsuppressiva behandelt werden) nur nach sorgfältiger Nutzen-Risiko-Abwägung verabreicht werden. Auch sollten Personen, die kurz zuvor geimpfte Säuglinge versorgen, sorgfältig auf Hygiene achten, vor allem wenn sie mit deren Exkrementen umgehen.
In einer klinischen Studie wurde RotaTeq ungefähr 1.000 Säuglingen verabreicht, die mit einem Gestationsalter von 25 bis 36 Wochen geboren worden waren. Die erste Dosis wurde frühestens 6 Wochen nach der Geburt verabreicht. Die Sicherheit und Wirksamkeit von RotaTeq waren in dieser Säuglingsuntergruppe und bei zum Termin geborenen Säuglingen vergleichbar. Nur 19 der etwa 1.000 Säuglinge wurden jedoch mit einem Gestationsalter von 25 bis 28 Wochen geboren, 55 wurden mit einem Gestationsalter von 29 bis 31 Wochen geboren, die restlichen mit einem Gestationsalter von 32 bis 36 Wochen. Siehe Abschnitte 4.2 und 5.1.
Invagination
Der Arzt bzw. das medizinische Fachpersonal sollte als Vorsichtsmaßnahme auf Symptome, die auf eine Invagination hinweisen können (starke Bauchschmerzen, anhaltendes Erbrechen, blutige Stühle, aufgeblähter Bauch und/oder hohes Fieber), besonders achten, da Daten aus Beobachtungsstudien auf ein erhöhtes Risiko für eine Invagination hauptsächlich innerhalb der ersten 7 Tage nach der Rotavirus-Impfung hinweisen (siehe Abschnitt 4.8). Eltern/Erziehungsberechtigte sind anzuweisen, solche Symptome umgehend einem Arzt mitzuteilen.
Personen mit Prädisposition für eine Invagination siehe Abschnitt 4.3.
Es liegen keine Daten zur Sicherheit oder Wirksamkeit bei Säuglingen mit einer floriden Erkrankung des Gastrointestinaltrakts (einschließlich chronischen Durchfalls) oder mit Gedeihstörungen vor. Die Anwendung von RotaTeq bei diesen Säuglingen kann erwogen werden, wenn nach Meinung des Arztes der Verzicht auf die Impfung das größere Risiko darstellt.
Das Maß der Schutzwirkung von RotaTeq basiert auf der vollständigen Gabe aller 3 Dosen. Wie bei anderen Impfstoffen auch sind nach Impfung mit RotaTeq möglicherweise nicht alle geimpften Säuglinge vollständig geschützt. RotaTeq schützt nicht vor Gastroenteritis, die durch andere Krankheitserreger als Rotaviren verursacht werden.
Klinische Prüfungen zur Wirksamkeit gegen Rotavirus(RV)-bedingte Gastroenteritis wurden in Europa, den USA, Lateinamerika und Asien durchgeführt. Während dieser Prüfungen war der am häufigsten zirkulierende Rotavirus-Genotyp G1P[8], während die Rotavirus-Genotypen G2P[4], G3P[8], G4P[8] und G9P[8] weniger häufig nachgewiesen wurden. Inwieweit RotaTeq vor anderen Rotavirus-Typen oder in anderen Populationen schützt, ist nicht bekannt.
Es liegen keine klinischen Daten zur postexpositionellen Prophylaxe mit RotaTeq vor.
Bei der Grundimmunisierung von sehr unreifen Frühgeborenen (Geburt ≤ 28. Schwangerschaftswoche), insbesondere von solchen mit einer Lungenunreife in der Vorgeschichte, sollte das potenzielle Risiko einer Apnoe berücksichtigt und die Notwendigkeit einer Atemüberwachung über 48 – 72 Stunden erwogen werden. Da der Nutzen der Impfung gerade bei dieser Säuglingsgruppe hoch ist, sollte die Impfung Frühgeborenen nicht vorenthalten und auch nicht aufgeschoben werden.
RotaTeq DARF KEINESFALLS ALS INJEKTION VERABREICHT WERDEN.
Sucrose
RotaTeq enthält Sucrose. Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption oder Sucrase-Isomaltase-Mangel sollten nicht mit RotaTeq geimpft werden (siehe Abschnitt 2).
Natrium
Dieser Impfstoff enthält 37,6 mg Natrium pro Dosiereinheit, entsprechend 1,88 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g (siehe Abschnitt 2).
Die zeitgleiche Verabreichung von RotaTeq mit Impfstoffen, die eines oder mehrere der folgenden Antigene enthalten, an Säuglinge im Alter von etwa 2, 4 und 6 Monaten zeigte, dass die Immunantworten und die Verträglichkeitsprofile der verabreichten Impfstoffe nicht beeinflusst wurden:
Diphtherie-Tetanus-azellulärer Pertussis-Impfstoff (DTaP),
Haemophilus-influenzae-Typ-b-Impfstoff (Hib),
inaktivierter Polio-Impfstoff (IPV),
Hepatitis-B-Impfstoff (HBV),
Pneumokokken-Konjugatimpfstoff (PCV).
Die zeitgleiche Verabreichung von RotaTeq mit DTaP-IPV-HBV-Hib-Impfstoff (Infanrix hexa) an Säuglinge im Alter von etwa 2, 3 und 4 Monaten zeigte, dass die Immunantworten und die Verträglichkeitsprofile der zeitgleich verabreichten Impfstoffe im Vergleich zu einer zeitversetzten Verabreichung nicht beeinflusst wurden.
Die zeitgleiche Verabreichung von RotaTeq mit einem konjugierten Meningokokken-C-Impfstoff (MenCC, der untersuchte Impfstoff war ein Tetanus-Konjugatimpfstoff) im Alter von 3 und 5 Monaten (und zumeist zeitgleicher Gabe eines DTaP-IPV-Hib-Impfstoffs), gefolgt von einer 3. Dosis RotaTeq im Alter von etwa 6 Monaten, zeigte, dass die Immunantworten auf RotaTeq und MenCC nicht beeinflusst wurden. Die zeitgleiche Verabreichung ergab ein akzeptables Verträglichkeitsprofil.
Die zeitgleiche Anwendung von RotaTeq und oralem Polio-Impfstoff (OPV) beeinflusste die Immunreaktion auf die Poliovirus-Antigene nicht. Obwohl die zeitgleiche Anwendung von OPV die Immunreaktion auf den Rotavirus-Impfstoff geringfügig verringerte, gibt es gegenwärtig keine Hinweise, dass die klinische Wirksamkeit gegen schwere Rotavirus-Gastroenteritiden beeinflusst wird. Die Immunreaktion auf RotaTeq wurde nicht beeinflusst, wenn OPV mindestens zwei Wochen nach RotaTeq verabreicht wurde.
Daher kann RotaTeq zeitgleich mit monovalenten oder Kombinationsimpfstoffen für Kinder gegeben werden, die eines oder mehrere der folgenden Antigene enthalten: DTaP, Hib, IPV oder OPV, HBV, PCV und MenCC.
RotaTeq ist nur zur Anwendung bei Säuglingen indiziert. Es gibt daher keine Daten aus klinischen Studien über die Anwendung in der Schwangerschaft oder während der Stillzeit; Studien an Tieren zur Fertilität oder Reproduktionsfähigkeit wurden nicht durchgeführt.
Nicht zutreffend.
a. Zusammenfassung des Verträglichkeitsprofils
In einer Untergruppe von Säuglingen aus drei placebokontrollierten klinischen Prüfungen (n = 6.130 RotaTeq Empfänger und 5.560 Placebo-Empfänger) wurden nach der Impfung 42 Tage lang alle unerwünschten Ereignisse bewertet, unabhängig davon, ob zeitgleich auch andere pädiatrische Impfstoffe angewendet wurden. Insgesamt traten bei 47 % aller mit RotaTeq geimpften Säuglinge Nebenwirkungen auf, im Vergleich zu 45,8 % in der Placebo-Gruppe. Die am häufigsten berichteten Nebenwirkungen waren Fieber (20,9 %), Durchfall (17,6 %) und Erbrechen (10,1 %); diese Nebenwirkungen traten in der RotaTeq Gruppe häufiger auf als in der Placebo-Gruppe.
Schwerwiegende Nebenwirkungen wurden bei allen Probanden aus drei klinischen Prüfungen bis zu 42 Tage nach Gabe der einzelnen Impfdosen bewertet (36.150 in der RotaTeq Gruppe und 35.536 in der Placebo-Gruppe). Insgesamt war die Häufigkeit dieser schwerwiegenden Nebenwirkungen 0,1 % in der RotaTeq Gruppe und 0,2 % in der Placebo-Gruppe.
b. Tabellarische Zusammenfassung der Nebenwirkungen
Nachfolgend werden Nebenwirkungen, die in der Impfstoff-Gruppe in klinischen Prüfungen häufiger auftraten als in der Placebo-Gruppe, nach Systemorganklasse und ihrer Häufigkeit aufgeführt. Basierend auf gepoolten Daten aus drei klinischen Prüfungen, in denen 6.130 Säuglinge RotaTeq und 5.560 Säuglinge Placebo erhielten, traten die aufgeführten Nebenwirkungen bei RotaTeq Empfängern zwischen 0,2 % und 2,5 % häufiger auf als bei Placebo-Empfängern.
Die folgenden Häufigkeitsangaben wurden zugrunde gelegt:
Sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1.000, < 1/100); selten (≥ 1/10.000, < 1/1.000); sehr selten (< 1/10.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Nebenwirkungen nach Anwendung von RotaTeq in klinischen Prüfungen und unerwünschte Ereignisse aus der Post-Marketing-Beobachtung (kursiv) | ||
Systemorganklasse |
Häufigkeit |
Nebenwirkung/unerwünschtes Ereignis |
Infektionen und parasitäre Erkrankungen |
Häufig |
Infektionen der oberen Atemwege |
Gelegentlich |
Nasopharyngitis, Otitis media |
|
Erkrankungen des Immunsystems |
Nicht bekannt |
Anaphylaktische Reaktion‡ |
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Selten |
Bronchospasmus |
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Durchfall, Erbrechen |
Gelegentlich |
Hämatochezie†, Oberbauchschmerzen |
|
Sehr selten |
Invaginationα * |
|
Nicht bekannt |
Gastroenteritis‡ § |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Gelegentlich |
Ausschlag |
Selten |
Urtikaria† |
|
Nicht bekannt |
Angioödem‡ |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr häufig |
Fieber |
Nicht bekannt |
Reizbarkeit‡ |
|
† Diese Nebenwirkung wurde während der Post-Marketing-Überwachung beobachtet. Die Häufigkeitskategorie wurde auf der Grundlage relevanter klinischer Prüfungen abgeschätzt. | ||
c. Beschreibung ausgewählter Nebenwirkungen
Bei 5 von 36.150 geimpften Säuglingen (< 0,1 %) und bei 1 von 35.536 mit Placebo behandelten Säuglingen (< 0,1 %) trat ein Kawasaki-Syndrom auf. Dies entspricht einem relativen Risiko (RR) von 4,9 [95 % KI: 0,6 – 239,1] (statistisch nicht signifikant). In einer großen Post-Marketing-Beobachtungsstudie zur Sicherheit wurde kein erhöhtes Risiko für das Auftreten eines Kawasaki-Syndroms bei Säuglingen, die RotaTeq erhielten, beobachtet (siehe Abschnitt 5.1).
Invagination
Daten aus in mehreren Ländern durchgeführten Beobachtungsstudien zur Sicherheit deuten darauf hin, dass Rotavirus-Impfstoffe ein erhöhtes Risiko für das Auftreten einer Invagination beinhalten: Es wurden innerhalb von 7 Tagen nach der Impfung bis zu 6 zusätzliche Fälle pro 100.000 Säuglinge beobachtet. Es gibt begrenzte Hinweise darauf, dass das Risiko nach Gabe der zweiten Dosis weniger hoch ist. Die Hintergrundinzidenz für eine Invagination bei Säuglingen unter einem Jahr betrug in diesen Ländern zwischen 25 und 101 Fälle pro 100.000 Säuglinge pro Jahr. Es bleibt unklar, ob die bei längeren Nachbeobachtungsperioden resultierende Gesamtinzidenz von Invaginationen durch Rotavirus-Impfstoffe beeinflusst wird (siehe Abschnitt 4.4).
d. Weitere spezielle Personenkreise
Apnoe bei sehr unreifen Frühgeborenen (Geburt ≤ 28. Schwangerschaftswoche) (siehe Abschnitt 4.4).
Nach der Markteinführung wurde Gastroenteritis im Zusammenhang mit Ausscheidung des Impfvirus im Stuhl bei Säuglingen mit schwerem kombiniertem Immundefekt (SCID) beobachtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51 – 59, 63225 Langen, Tel.: +49 6103 77 0, Fax: +49 6103 77 1234, Website: www.pei.de, anzuzeigen.
Es gibt Fälle, bei denen RotaTeq in einer höheren als der empfohlenen Dosierung angewendet wurde.
Das Nebenwirkungsprofil bei Überdosierung war im Allgemeinen mit dem bei empfohlener Dosierung vergleichbar.
Pharmakotherapeutische Gruppe: Impfstoffe, viraler Impfstoff, ATC-Code: J07BH02
Wirksamkeit
In klinischen Prüfungen wurde die Wirksamkeit gegen Gastroenteritis, verursacht durch Rotaviren der Genotypen G1P[8], G2P[4], G3P[8], G4P[8] und G9P[8], nachgewiesen.
Die Wirksamkeit von RotaTeq wurde in einer placebokontrollierten Studie (Rotavirus Efficacy and Safety Trial [REST]) auf zwei Arten untersucht:
Bei 5.673 geimpften Säuglingen (2.834 Säuglinge erhielten den Impfstoff) wurde die Wirksamkeit anhand der Abnahme der Inzidenz RV-bedingter Gastroenteritis durch die Impfstoff-G-Genotypen (G1 bis G4), die frühestens 14 Tage nach Gabe der dritten Dosis RotaTeq auftraten, über die gesamte erste Rotavirus-Saison nach Impfung gemessen.
Bei 68.038 geimpften Säuglingen (34.035 Säuglinge erhielten den Impfstoff) wurde die Wirksamkeit anhand der Senkung der Krankenhaus- und Notfallbehandlungen bei RV-bedingter Gastroenteritis, beginnend 14 Tage nach Gabe der dritten Dosis, untersucht.
Die Ergebnisse dieser Analysen sind in den nachfolgenden Tabellen dargestellt.
Abnahme der Inzidenz RV-bedingter Gastroenteritis über eine volle Rotavirus-Saison nach Gabe des Impfstoffs | ||||||
Wirksamkeit gegen jeglichen Schweregrad nach Rotavirus-Genotyp |
||||||
Schwere* Erkrankung |
Jeglicher Schweregrad |
G1 |
G2 |
G3 |
G4 |
G9 |
98,0 % |
74,0 % |
74,9 % |
63,4 % |
82,7 % |
48,1 % |
65,4 % |
* Eine schwere Erkrankung war definiert als ein Verhältnis > 16/24, unter Verwendung eines validierten klinischen Score-Systems, basierend auf der Intensität und Dauer der Symptome (Fieber, Erbrechen, Durchfall und Verhaltensänderungen)
† Statistisch signifikant
Senkung der Krankenhaus- und Notfallbehandlungen bei RV-bedingter Gastroenteritis bis max. 2 Jahre nach der Impfung | |||||
G1 – G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
94,5 % |
95,1 % |
87,6 % |
93,4 % |
89,1 % |
100 % |
† Statistisch signifikant
Die Inzidenz schwerer RV-bedingter Gastroenteritis, ausgelöst durch die Genotypen G1 bis G4 in der zweiten Rotavirus-Saison nach der Impfung, konnte um 88,0 % [95 % KI: 49,4; 98,7] und von Gastroenteritis jedes Schweregrades um 62,6 % [95 % KI: 44,3; 75,4] gesenkt werden.
Die Evidenz für die Schutzwirkung vor Rotaviren der Genotypen G2P[4], G3P[8], G4P[8] und G9P[8] basiert auf geringeren Fallzahlen als für den Typ G1. Die beobachtete Wirksamkeit gegen G2P[4] resultierte höchstwahrscheinlich aus der G2-Komponente des Impfstoffs.
Eine kombinierte Post-hoc-Analyse der REST- und einer anderen Phase-III-Studie ergab bei Säuglingen, die im Alter von 26 bis 32 Wochen ihre dritte Dosis erhalten hatten, bezüglich RV-Genotyp G1-, G2-, G3- und G4-bedingten Gastroenteritiden jeglichen Schweregrades eine Wirksamkeit des Impfstoffs von 61,5 % (95 % KI:14,2; 84,2).
In Finnland wurde die REST-Studie über einen längeren Zeitraum durchgeführt. Diese sogenannte Finnish Extension Study (FES) schloss eine Untergruppe von 20.736 Studienteilnehmern ein, die ursprünglich an der REST-Studie teilgenommen hatten. Diese Säuglinge wurden in der FES-Studie über einen Zeitraum von drei Jahren nach Abschluss der Impfung beobachtet.
In der REST-Studie kam es zu 403 Krankenhaus- und Notfallbehandlungen (20 in der Impfstoff-Gruppe, 383 in der Placebo-Gruppe) in der Per-Protocol-Population, die mit RV(G1-G4 und G9)-bedingter Gastroenteritis in Verbindung gebracht wurden. Die zusätzlichen Daten der FES-Studie erhöhten die Anzahl der Krankenhaus- und Notfallbehandlungen um insgesamt 136, darunter 9 in der Impfstoff-Gruppe und 127 in der Placebo-Gruppe. Insgesamt ereigneten sich 31 % bzw. 25 % der Krankenhaus- und Notfallbehandlungen in der jeweiligen Gruppe während der FES-Studie.
Die kombinierten Daten der REST- und der FES-Studie ergeben, dass die Rate an Krankenhaus- und Notfallbehandlungen bis 3 Jahre nach Abschluss der Impfung reduziert werden konnte: um 94,4 % (95 % KI: 91,6; 96,2) für die Genotypen G1 – G4, um 95,5 % (95 % KI: 92,8; 97,2) für den Genotyp G1, um 81,9 % (95 % KI: 16,1; 98,0) für den Genotyp G2, um 89,0 % (95 % KI: 53,3; 98,7) für den Genotyp G3, um 83,4 % (95 % KI: 51,2; 95,8) für den Genotyp G4 und um 94,2 % (95 % KI: 62,2; 99,9) für den Genotyp G9. Während des dritten Jahres gab es aufgrund RV-bedingter Gastroenteritis keinen Fall von Krankenhaus- und Notfallbehandlung in der Impfstoff-Gruppe (n = 3.112) und einen Fall von Krankenhaus- und Notfallbehandlung (nicht typisierbare RV) in der Placebo-Gruppe (n = 3.126).
Es sollten alle drei vorgeschriebenen Dosen RotaTeq verabreicht werden (siehe Abschnitt 4.2), um die volle Wirksamkeit und den Langzeitschutz vor RV-bedingter Gastroenteritis zu erreichen, die in klinischen Studien nachgewiesen wurden. Allerdings zeigen Post-hoc-Analysen, dass RotaTeq schon vor Abschluss der 3-Dosen-Impfserie (d. h. etwa 14 Tage nach der ersten Dosis) die Häufigkeit RV-bedingter Gastroenteritis, deren Schweregrad zu Krankenhaus- und Notfallbehandlungen führt, senkt.
Wirksamkeit bei Frühgeborenen
Im Rahmen der REST-Studie wurde RotaTeq ungefähr 1.000 Frühgeborenen (Gestationsalter von 25 bis 36 Wochen) verabreicht. Die Wirksamkeit von RotaTeq war in dieser Säuglingsuntergruppe und bei zum Termin geborenen Säuglingen vergleichbar.
Post-Marketing-Beobachtungsstudie zur Sicherheit
In einer großen prospektiven Post-Marketing-Beobachtungsstudie in den USA wurden Daten von 85.150 Säuglingen hinsichtlich des Auftretens eines Kawasaki-Syndroms nach Verabreichung von einer oder mehr Dosen RotaTeq ausgewertet (17.433 Personen-Jahre Nachbeobachtungszeit).
Innerhalb von 30 Tagen nach Verabreichung des Impfstoffs gab es keinen statistisch signifikanten Unterschied in der Häufigkeit des Auftretens eines Kawasaki-Syndroms im Vergleich zur erwarteten Hintergrundhäufigkeit. Darüber hinaus gab es kein statistisch signifikant erhöhtes Risiko für das Auftreten dieses unerwünschten Ereignisses in einer Nachbeobachtungszeit bis zu 30 Tagen im Vergleich zu einer Kontrollgruppe ausschließlich mit DTaP (nicht RotaTeq) geimpfter Säuglinge (n = 62.617, 12.339 Personen-Jahre Nachbeobachtungszeit). Sowohl in der RotaTeq Gruppe als auch in der DTaP-Kontrollgruppe wurde je ein durch die Krankenakte bestätigter Fall erfasst (relatives Risiko = 0,7; 95 % KI: 0,01 – 55,56). In den allgemeinen Sicherheitsanalysen wurde kein spezifisches Sicherheitsrisiko festgestellt.
Studiendaten zur Wirksamkeit
Post-Marketing-Studien, die die Wirksamkeit des Impfstoffs bei der Prävention der RV-bedingten Gastroenteritis (RVGE) zeigen
Studiendesign |
Studienpopulation |
Endpunkte |
Wirksamkeit |
RV-Saison |
Analyse einer Schadensfalldatenbank (USA) |
33.140 geimpfte Kinder und |
Krankenhaus- und Notfallbehandlungen wegen RVGE |
100 % [87, 100] |
2007 – 2008 |
Kohortenstudie |
1.895 mit 3 Dosen geimpfte Kinder |
Krankenhausbehandlungen wegen RVGE |
98 % [83, 100] |
2007 – 2008 |
Fall-Kontroll-Studie (USA) |
402 Fälle |
Krankenhaus- und Notfallbehandlungen wegen RVGE |
80 % [74, 84] |
2011 – 2012 |
|
Stammspezifisch |
|
|||
Altersspezifisch |
|
|||
* Kontrollfälle mit RV-negativer akuter Gastroenteritis | ||||
Immunogenität
Der immunologische Mechanismus, aufgrund dessen RotaTeq vor RV-bedingter Gastroenteritis schützt, ist noch nicht vollständig erforscht. Derzeit gibt es noch kein immunologisches Korrelat für die Schutzwirkung von Rotavirus-Impfstoffen. In Phase-III-Studien wurde nach Verabreichung von 3 Dosen bei 92,5 bis 100 % der mit RotaTeq geimpften Säuglinge ein signifikanter Anstieg von Anti-Rotavirus-IgA im Serum nachgewiesen. Der Impfstoff induziert eine Immunantwort (d. h. Bildung neutralisierender Serum-Antikörper) gegen alle fünf humanen Rotavirus-Proteine, die auf den Reassortanten (G1, G2, G3, G4 und P[8]) exprimiert werden.
Nicht zutreffend.
Die Ergebnisse einer Toxizitätsstudie mit einer bzw. wiederholt oral verabreichten Dosen bei Mäusen lassen keine besonderen Gefahren für den Menschen erkennen. Die Mäuse erhielten eine Dosis von ca. 2,79 x 108 infektiösen Einheiten pro kg (das entspricht etwa dem 14-Fachen der für Säuglinge vorgesehenen Dosierung).
Sucrose
Natriumcitrat
Natriumdihydrogenphosphat-Monohydrat
Natriumhydroxid
Polysorbat 80
Nährmedien (enthalten anorganische Salze, Aminosäuren und Vitamine)
Gereinigtes Wasser
Da keine Kompatibilitätsstudien durchgeführt wurden, darf der Impfstoff nicht mit anderen Arzneimitteln gemischt werden.
2 Jahre
RotaTeq sollte unmittelbar nach Entnahme aus dem Kühlschrank verabreicht werden.
Kühl lagern und transportieren (2 °C – 8 °C).
Die Dosiertube in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
2 ml Lösung in einer vorgefüllten ausdrückbaren Tube (LDPE) mit einem Twist-off-Verschluss (HDPE) in einer Schutzhülle, Packungsgrößen: 1 x 1 und 10 x 1 vorgefüllte ausdrückbare Tube(n).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Der Impfstoff muss oral verabreicht werden und darf nicht mit anderen Impfstoffen oder Lösungen gemischt werden. Nicht verdünnen!
Hinweise zur Anwendung des Impfstoffs: | |
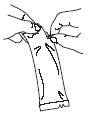 |
Schutzhülle aufreißen und Dosiertube entnehmen. |
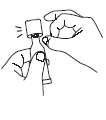 |
Tube senkrecht halten und durch leichtes Klopfen gegen den Twist-off-Verschluss die in der Dosierspitze befindliche Lösung entfernen. |
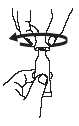 |
Öffnen der Dosiertube mit zwei einfachen Drehungen: 1. Durch Drehung der Verschlusskappe im Uhrzeigersinn bis zum Anschlag wird die Dosierspitze durchstochen. |
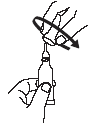 |
2. Durch Drehung gegen den Uhrzeigersinn wird die Verschlusskappe abgezogen. |
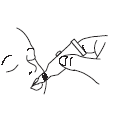 |
Dosiertube durch leichten Druck in den Mund des Säuglings in Richtung der Wangentasche entleeren (dabei kann ein Resttropfen in der Spitze der Tube verbleiben). |
Leere Dosiertube und Verschlusskappe entsprechend den lokalen Bestimmungen in dafür zugelassenen Behältern für biologische Abfälle entsorgen. |
|
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu beseitigen.
Merck Sharp & Dohme B.V., Waarderweg 39, 2031 BN Haarlem, Niederlande.
EU/1/06/348/001
EU/1/06/348/002
Datum der Erteilung der Zulassung: 27. Juni 2006
Datum der letzten Verlängerung der Zulassung: 18. Mai 2011
Dezember 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Für weitere Informationen zu diesem Präparat wenden Sie sich bitte an die deutsche Vertretung des Zulassungsinhabers:
MSD Sharp & Dohme GmbH
Levelingstr. 4a
81673 München
Tel.: +49 (0) 89 20 300 4500
E-Mail: medinfo@msd.de
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der Chargen-Bezeichnung, der Angabe der Krankheit, gegen die geimpft wurde, sowie Name, Anschrift und Unterschrift des impfenden Arztes in einen Impfausweis eingetragen werden.
Häufig unterbleiben indizierte Impfungen, weil bestimmte Umstände irrtümlicherweise als Kontraindikationen angesehen werden. Einzelheiten hierzu und weitere Informationen finden Sie in den jeweils aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut, aktuell abrufbar über www.stiko.de.
RCN: 000028288-DE
FACH-9000237-0007