Implanon® NXT, 68 mg Implantat zur subkutanen Anwendung
Implanon NXT ist ein röntgendichtes, biologisch nicht abbaubares, flexibles Implantat, das nur Gestagen enthält und in einem sterilen Einmalapplikator vorgeladen ist.
Jedes röntgendichte Implantat enthält 68 mg Etonogestrel. Die Freisetzungsrate beträgt ungefähr 60‑70 Mikrogramm/Tag in den Wochen 5‑6 und sinkt zum Ende des ersten Jahres auf ca. 35‑45 Mikrogramm/Tag, zum Ende des zweiten Jahres auf ca. 30‑40 Mikrogramm/Tag und zum Ende des dritten Jahres auf ca. 25‑30 Mikrogramm/Tag. Der Applikator wurde so konstruiert, dass er sich mit einer Hand bedienen lässt und die korrekte subkutane Einlage des Implantats erleichtert.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Implantat zur subkutanen Anwendung.
Röntgendichtes, biologisch nicht abbaubares, weißes bis cremefarbenes, weiches, flexibles Stäbchen mit einer Länge von 4 cm und einem Durchmesser von 2 mm.
Kontrazeption.
Sicherheit und Wirksamkeit wurden an Frauen im Alter zwischen 18 und 40 Jahren nachgewiesen.
Dosierung
1 Implantat mit einer Liegedauer von bis zu 3 Jahren.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Implanon NXT bei Jugendlichen unter 18 Jahren sind nicht erwiesen.
Art der Anwendung
Vor der Einlage von Implanon NXT muss eine Schwangerschaft ausgeschlossen werden.
Es wird dringend empfohlen, dass nur jene Ärzte Implanon NXT einlegen und entfernen, die ein Training zur Anwendung des Implanon NXT Applikators und den Techniken der Einlage und der Entfernung des Implanon NXT Implantats absolviert haben. Gegebenenfalls ist vor der Einlage oder Entfernung des Implantats um fachliche Unterstützung zu bitten.
Vor der Einlage des Implantats lesen Sie die Anweisungen sorgfältig durch und folgen Sie den Anweisungen für die Einlage und Entfernung des Implantats aus Abschnitt 4.2 „Wie wird Implanon NXT eingelegt“ und „Wie ist Implanon NXT zu entfernen“.
Videos, die die Einlage und Entfernung des Implantats demonstrieren, können online unter www.implanonnxtvideos.eu abgerufen werden. Bei Fragen wenden Sie sich bitte an den örtlichen Vertreter des pharmazeutischen Unternehmers: Organon Healthcare GmbH, Pestalozzistr. 31, 80469 München. |
Wenn Sie sich nicht sicher sind, welche Schritte für eine sichere Einlage und/oder Entfernung von Implanon NXT notwendig sind, versuchen Sie nicht, diese Verfahren durchzuführen.
Wie ist Implanon NXT anzuwenden
Implanon NXT ist ein lang wirkendes hormonelles Kontrazeptivum. Ein einzelnes Implantat wird subkutan für einen Zeitraum von drei Jahren eingelegt. Das Implantat muss spätestens drei Jahre nach dem Einlagedatum entfernt werden. Die Anwenderin sollte wissen, dass das Implantat jederzeit auf ihren Wunsch hin wieder entfernt werden kann. Bei Frauen mit höherem Körpergewicht kann der Arzt einen früheren Austausch des Implantats in Betracht ziehen (siehe Abschnitt 4.4). Der kontrazeptive Schutz bleibt erhalten, wenn das Implantat entfernt und sofort durch ein neues ersetzt wird. Wenn keine weitere Anwendung von Implanon NXT, jedoch ein weiterer Konzeptionsschutz erwünscht ist, sollte eine andere Methode der Empfängnisverhütung empfohlen werden.
Die Implanon NXT Packung enthält eine Patientenkarte für die Anwenderin, auf der die Chargenbezeichnung des Implantats steht. Die Ärzte werden ersucht, das Datum der Einlage, den Arm der Einlage und das beabsichtigte Datum der Entfernung auf der Patientenkarte einzutragen. Die Anwenderinnen müssen darauf hingewiesen werden, die Patientenkarte sorgfältig aufzubewahren und sie bei jedem Arztbesuch, der mit der Anwendung ihres Implantats in Verbindung steht, vorzuzeigen. Die Patientenkarte enthält außerdem Anweisungen für die Anwenderin, das Implantat gelegentlich vorsichtig zu ertasten, um sich zu vergewissern, dass es noch an der Einlagestelle liegt. Die Anwenderinnen müssen angewiesen werden, sich unverzüglich an ihren Arzt zu wenden, wann immer sie das Implantat nicht mehr ertasten können. Für die Patientenakte beim Arzt enthält die Packung außerdem Klebeetiketten mit der Chargenbezeichnung. Diese Information sollte in die elektronische Patientenakte der Anwenderin aufgenommen werden, falls eine solche verwendet wird.
Voraussetzung für eine erfolgreiche Anwendung und spätere Entfernung von Implanon NXT ist eine gemäß den Anweisungen korrekt und sorgfältig durchgeführte subkutane Einlage des Implantats.
Wird das Implantat nicht entsprechend den Anweisungen bzw. nicht am richtigen Tag eingelegt, könnte dies zu einer ungewollten Schwangerschaft führen (siehe Abschnitt 4.2 „Wie wird Implanon NXT eingelegt“ und „Wann ist Implanon NXT einzulegen“).
Ein tiefer als subkutan eingelegtes Implantat (tiefe Einlage) kann unter Umständen nicht ertastbar sein und die Lokalisation und/oder die Entfernung könnte(n) Schwierigkeiten bereiten (siehe Abschnitt 4.2 „Wie ist Implanon NXT zu entfernen“ und Abschnitt 4.4).
Das Implanon NXT Implantat muss subkutan, DIREKT UNTER DIE HAUT, an der Innenseite des weniger beanspruchten Oberarms eingelegt werden. Die Einlagestelle liegt über dem Trizeps mit einem Abstand von ca. 8 – 10 cm (3 – 4 Inches) vom medialen Epikondylus des Oberarmknochens und 3 – 5 cm (1,25 – 2 Inches) hinter (unter) dem Sulcus (der Furche) zwischen Bizeps und Trizeps. Durch diese Einlagestelle werden die großen Blutgefäße und Nerven umgangen, die in und um den Sulcus liegen (siehe Abbildungen 2a, 2b und 2c).
Unmittelbar nach Einlage muss durch Ertasten verifiziert werden, dass das Implantat vorhanden ist. Kann das Implantat nicht ertastet werden oder bestehen Zweifel, dass das Implantat vorhanden ist, siehe Abschnitt 4.2 „Wie wird Implanon NXT eingelegt“ Unterabschnitt „Wenn das Implantat nach Einlage nicht ertastet werden kann“.
Wann ist Implanon NXT einzulegen
WICHTIG: Vor der Einlage des Implantats ist eine Schwangerschaft auszuschließen.
Wie nachfolgend dargestellt, richtet sich der Einlagezeitpunkt nach der unmittelbar vorhergehenden Kontrazeption der Anwenderin:
Im vorangegangenen Monat wurde kein hormonelles Kontrazeptivum angewendet
Das Implantat soll zwischen Tag 1 (erster Tag der Menstruationsblutung) und Tag 5 des Menstruationszyklus eingelegt werden, auch dann, wenn die Blutung noch andauert.
Erfolgte die Einlage wie empfohlen, ist kein zusätzlicher Empfängnisschutz erforderlich. Wird vom empfohlenen Einlagezeitpunkt abgewichen, soll der Anwenderin geraten werden, bis zu 7 Tage nach Einlage des Implantats eine Barrieremethode anzuwenden. Eine Schwangerschaft ist auszuschließen, falls die Anwenderin bereits Geschlechtsverkehr hatte.
Wechsel von einer anderen hormonellen Verhütungsmethode zu Implanon NXT
Wechsel von einem kombinierten hormonellen Kontrazeptivum (kombiniertes orales Kontrazeptivum [KOK], Vaginalring oder transdermales Pflaster)
Das Implantat soll möglichst am Tag nach Einnahme der letzten wirksamen Tablette (der letzten wirkstoffhaltigen Tablette) des bisher verwendeten kombinierten oralen Kontrazeptivums oder an dem Tag, an dem der Vaginalring oder das transdermale Pflaster entfernt wurde, eingelegt werden. Das Implantat ist spätestens an dem Tag einzulegen, an dem nach dem üblichen Tabletten-freien-, Ring-freien-, Pflaster-freien- oder Placebo-Intervall des bisher angewendeten kombinierten hormonellen Kontrazeptivums die nächste Anwendung fällig wäre. Es kann sein, dass nicht alle kontrazeptiven Methoden (transdermales Pflaster, Vaginalring) in allen Ländern verfügbar sind.
Erfolgte die Einlage wie empfohlen, ist kein zusätzlicher Empfängnisschutz erforderlich. Wird vom empfohlenen Einlagezeitpunkt abgewichen, soll der Anwenderin geraten werden, bis zu 7 Tage nach Einlage des Implantats eine Barrieremethode anzuwenden. Eine Schwangerschaft ist auszuschließen, falls die Anwenderin bereits Geschlechtsverkehr hatte.
Wechsel von einem Gestagenmonopräparat (z. B. Gestagenmonopille, Injektion, Implantat oder einem intrauterinen Gestagen-Freisetzungssystem [IUS])
Da es verschiedene Arten von Gestagenmonopräparaten gibt, muss die Einlage des Implantats wie folgt durchgeführt werden:
Injizierbare Kontrazeptiva: Legen Sie das Implantat an dem Tag ein, an dem die nächste Injektion fällig wäre.
Gestagenmonopille: Die Anwenderin kann an jedem beliebigen Tag eines Monats von der Gestagenmonopille zu Implanon NXT wechseln. Das Implantat soll innerhalb von 24 Stunden nach der letzten Tabletteneinnahme eingelegt werden.
Implantat/Intrauterines Gestagen-Freisetzungssystem (IUS): Legen Sie das Implantat am gleichen Tag ein, an dem das vorherige Implantat oder das IUS entfernt wurde.
Erfolgte die Einlage wie empfohlen, ist kein zusätzlicher Empfängnisschutz erforderlich. Wird vom empfohlenen Einlagezeitpunkt abgewichen, soll der Anwenderin geraten werden, bis zu 7 Tage nach Einlage des Implantats eine Barrieremethode anzuwenden. Eine Schwangerschaft ist auszuschließen, falls die Anwenderin bereits Geschlechtsverkehr hatte.
Nach einem Abort oder einer Fehlgeburt
Das Implantat kann unmittelbar nach einem Abort oder einer Fehlgeburt eingelegt werden.
Erstes Trimenon: Erfolgt die Einlage innerhalb von 5 Tagen, ist kein zusätzlicher Empfängnisschutz erforderlich.
Zweites Trimenon: Erfolgt die Einlage innerhalb von 21 Tagen, ist kein zusätzlicher Empfängnisschutz erforderlich.
Wenn nach dem empfohlenen Einlagezeitpunkt eingelegt wird, soll der Anwenderin geraten werden, bis zu 7 Tage nach Einlage des Implantats eine Barrieremethode anzuwenden. Eine Schwangerschaft ist vor der Einlage auszuschließen, falls die Anwenderin bereits Geschlechtsverkehr hatte.
Post partum
Das Implantat kann unmittelbar post partum sowohl bei stillenden als auch bei nicht stillenden Frauen, auf der Grundlage einer individuellen Nutzen-Risiko-Bewertung, eingelegt werden.
Erfolgt die Einlage innerhalb von 21 Tagen, ist kein zusätzlicher Empfängnisschutz erforderlich.
Erfolgt die Einlage nach 21 Tagen post partum, soll der Anwenderin geraten werden, bis zu 7 Tage nach Einlage des Implantats eine Barrieremethode anzuwenden. Eine Schwangerschaft ist vor der Einlage auszuschließen, falls die Anwenderin bereits Geschlechtsverkehr hatte.
Wie wird Implanon NXT eingelegt
Voraussetzung für eine erfolgreiche Anwendung und spätere Entfernung von Implanon NXT ist eine gemäß den Anweisungen korrekt und sorgfältig durchgeführte Einlage des Implantats unter die Haut in den weniger beanspruchten Arm. Sowohl der Arzt als auch die Anwenderin müssen nach Einlage das Implantat unter der Haut der Anwenderin fühlen können.
Das Implantat muss subkutan direkt unter die Haut an der Innenseite des weniger beanspruchten Oberarms eingelegt werden.
Ein tiefer als subkutan eingelegtes Implantat (tiefe Einlage) kann unter Umständen nicht ertastbar sein und die Lokalisation und/oder die Entfernung könnte(n) Schwierigkeiten bereiten (siehe Abschnitt 4.2 „Wie ist Implanon NXT zu entfernen“ und Abschnitt 4.4).
Wird das Implantat tief eingelegt, könnte es zu Nerven- oder Gefäßverletzungen kommen. Tiefe oder inkorrekte Einlagen waren verbunden mit Parästhesien (durch Nervenschädigung) und Wanderungen des Implantats (durch Einlage in den Muskel oder die Faszie) sowie in seltenen Fällen Einlage im Gefäß.
Die Einlage von Implanon NXT soll nur unter aseptischen Bedingungen und ausschließlich von einem mit dieser Technik vertrauten qualifizierten Arzt durchgeführt werden. Die Einlage des Implantats darf nur mit dem vorgeladenen Applikator durchgeführt werden.
Einlageverfahren
Um sicherzustellen, dass das Implantat direkt unter die Haut eingelegt wird, sollte sich der Arzt so positionieren, dass die Nadelbewegung im Arm mit einem Blick von der Seite und nicht von oben auf den Applikator verfolgt werden kann. Aus der Seitenperspektive ist die Einlagestelle und die Bewegung der Nadel direkt unter der Haut deutlich zu sehen.
Zur Veranschaulichung zeigen die Abbildungen die Innenseite des linken Arms.
Bitten Sie die Anwenderin, sich mit dem Rücken auf die Untersuchungsliege zu legen und den weniger beanspruchten Arm am Ellenbogen nach außen abzuwinkeln, sodass sich ihre Hand unter dem (oder so nah wie möglich am) Kopf befindet (Abbildung 1).
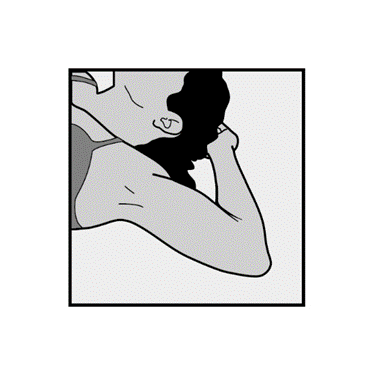
Abbildung 1
Bestimmen Sie die Einlagestelle an der Innenseite des weniger beanspruchten Oberarms. Die Einlagestelle liegt über dem Trizeps mit einem Abstand von ca. 8 – 10 cm (3 – 4 Inches) vom medialen Epikondylus des Oberarmknochens und 3 – 5 cm (1,25 – 2 Inches) hinter (unter) dem Sulcus (der Furche) zwischen Bizeps und Trizeps (Abbildungen 2a, 2b und 2c). Durch diese Einlagestelle werden die großen Blutgefäße und Nerven umgangen, die in und um den Sulcus liegen. Falls es nicht möglich ist, das Implantat an dieser Stelle einzulegen (z. B. bei Frauen mit dünnen Armen), muss es so weit wie möglich hinter dem Sulcus eingelegt werden.
Setzen Sie zwei Markierungen mit einem chirurgischen Marker: Markieren Sie zuerst den Punkt, an dem das Implantat eingelegt wird, und setzen Sie dann, 5 Zentimeter (2 Inches) proximal (in Richtung Schulter) von der ersten Markierung, eine zweite Markierung (Abbildungen 2a und 2b). Diese zweite Markierung (Leitmarkierung) dient später als Orientierungshilfe beim Einlegen.
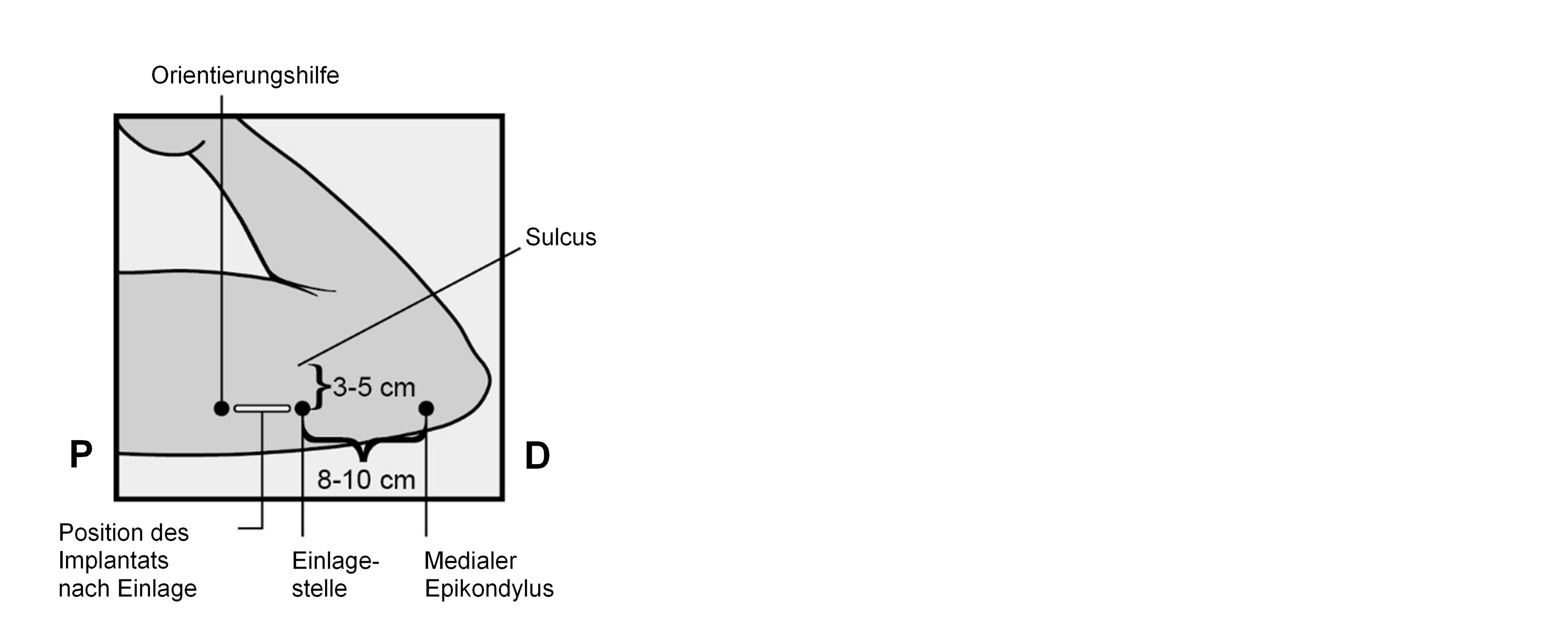
Abbildung 2a
P, proximal (in Richtung Schulter);
D, distal (in Richtung Ellenbogen)

Abbildung 2b
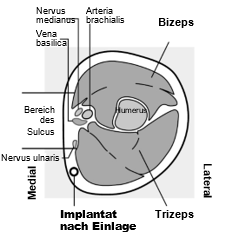
Abbildung 2c
Querschnitt des linken Oberarms, vom Ellenbogen aus gesehen
Medial (Innenseite des Arms)
Lateral (Außenseite des Arms)
Vergewissern Sie sich nach Markierung des Arms, dass sich die Stelle am richtigen Ort an der Innenseite des Arms befindet.
Reinigen Sie die Haut von der Einlagestelle bis zur Leitmarkierung mit einem Desinfektionsmittel.
Betäuben Sie die Fläche rund um die Einlagestelle (z. B. mit einem lokalanästhetischen Spray oder mit 2 ml Lidocain [1 %], das direkt unter die Haut entlang des vorgesehenen Insertionskanals gespritzt wird).
Entnehmen Sie den sterilen, vorgeladenen Implanon NXT Einmalapplikator, der das Implantat enthält, aus der Blisterpackung. Überprüfen Sie die Verpackung vor der Verwendung visuell auf Beschädigungen (z. B. zerrissen, durchstochen usw.). Verwenden Sie den Applikator nicht, wenn die Verpackung sichtbare Schäden aufweist, die die Sterilität beeinträchtigen könnten.
Fassen Sie den Applikator genau oberhalb der Nadel an der strukturierten Oberfläche. Entfernen Sie die transparente Schutzkappe von der Nadel, indem Sie diese horizontal in Pfeilrichtung wegschieben (Abbildung 3). Sollte sich die Schutzkappe nicht mühelos entfernen lassen, darf der Applikator nicht verwendet werden. Mit einem Blick in die Nadelspitze sollten Sie das weiße Implantat sehen. Berühren Sie nicht den lila Schieber, bis Sie die Nadel komplett unter die Haut eingeführt haben, da dadurch die Nadel zurückgezogen und das Implantat zu früh aus dem Applikator freigesetzt würde.
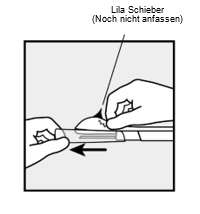
Abbildung 3
Wurde der lila Schieber zu früh ausgelöst, wiederholen Sie das Verfahren mit einem neuen Applikator.
Spannen Sie mit Ihrer freien Hand die Haut um die Einlagestelle in Richtung Ellenbogen (Abbildung 4).
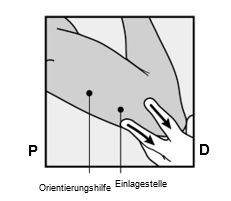
Abbildung 4
Das Implantat muss subkutan direkt unter die Haut eingelegt werden (siehe Abschnitt 4.4).
Um sicherzustellen, dass das Implantat direkt unter die Haut eingelegt wird, sollten Sie sich so positionieren, dass Sie die Nadelbewegung mit einem seitlichen Blick auf den Applikator und nicht durch einen Blick von oben auf den Arm verfolgen. Aus der Seitenperspektive können Sie die Einlagestelle und die Bewegung der Nadel direkt unter der Haut deutlich sehen (siehe Abbildung 6).
Durchstechen Sie die Haut mit der Nadelspitze in einem leichten Winkel von weniger als 30° (Abbildung 5a).
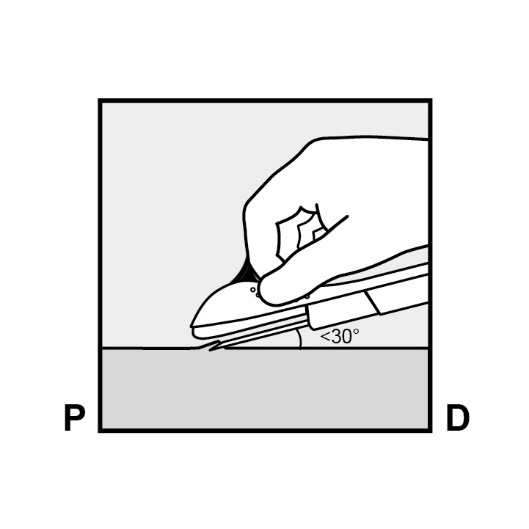
Abbildung 5a
Führen Sie die Nadel ein, bis sich die abgeschrägte Kante (abgeschrägte Öffnung der Spitze) direkt unter der Haut befindet (jedoch nicht weiter) (Abbildung 5b). Sollten Sie die Nadel tiefer als bis zur abgeschrägten Kante eingeführt haben, ziehen Sie die Nadel so weit zurück, bis nur noch die abgeschrägte Kante unter der Haut ist.
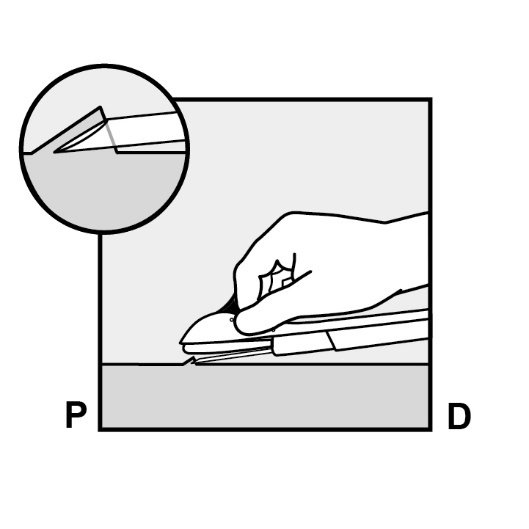
Abbildung 5b
Senken Sie den Applikator in eine nahezu horizontale Position. Um eine subkutane Platzierung zu ermöglichen, heben Sie mit der Nadel die Haut an, während Sie die Nadel in ihrer gesamten Länge einführen (Abbildung 6). Sie könnten einen leichten Widerstand spüren, wenden Sie jedoch keinen überhöhten Kraftaufwand an. Wenn die Nadel nicht in ihrer vollen Länge eingeführt wird, kann das Implantat nicht richtig eingelegt werden.
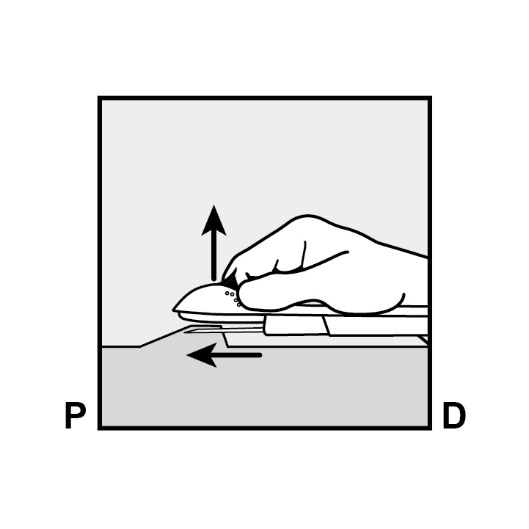
Abbildung 6
Sollte die Nadelspitze aus der Haut hervortreten, bevor die Nadel komplett eingeführt wurde, muss die Nadel zurückgezogen und wieder in eine subkutane Position gebracht werden, um die Einlage fortzuführen.
Halten Sie den Applikator in seiner Position, die Nadel bleibt dabei in ihrer vollen Länge eingeführt (Abbildung 7). Falls notwendig, können Sie Ihre freie Hand dazu benutzen den Applikator zu stabilisieren.
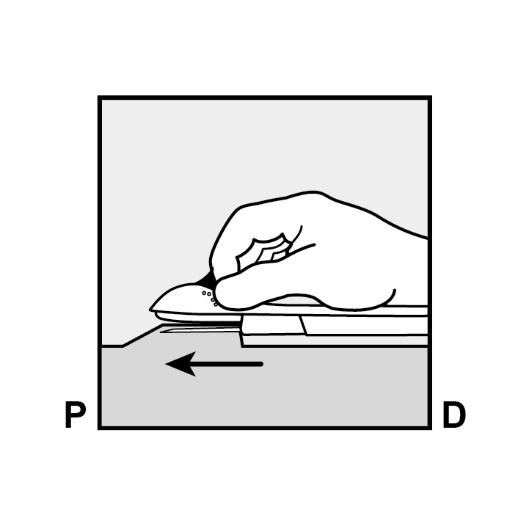
Abbildung 7
Entriegeln Sie den lila Schieber durch einen leichten Druck nach unten (Abbildung 8a). Bewegen Sie den Schieber bis zum Anschlag nach hinten.
Bewegen Sie nicht den Applikator (

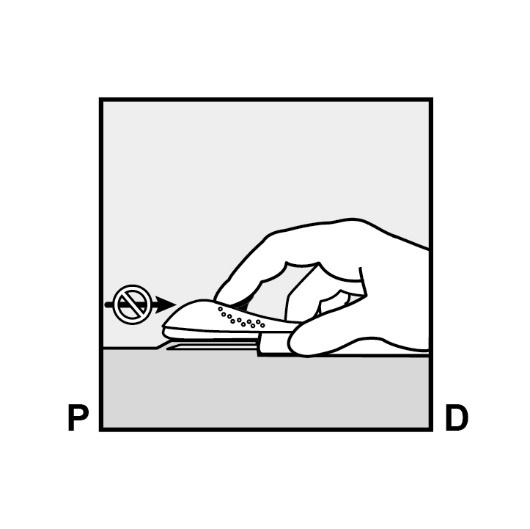
Abbildung 8a
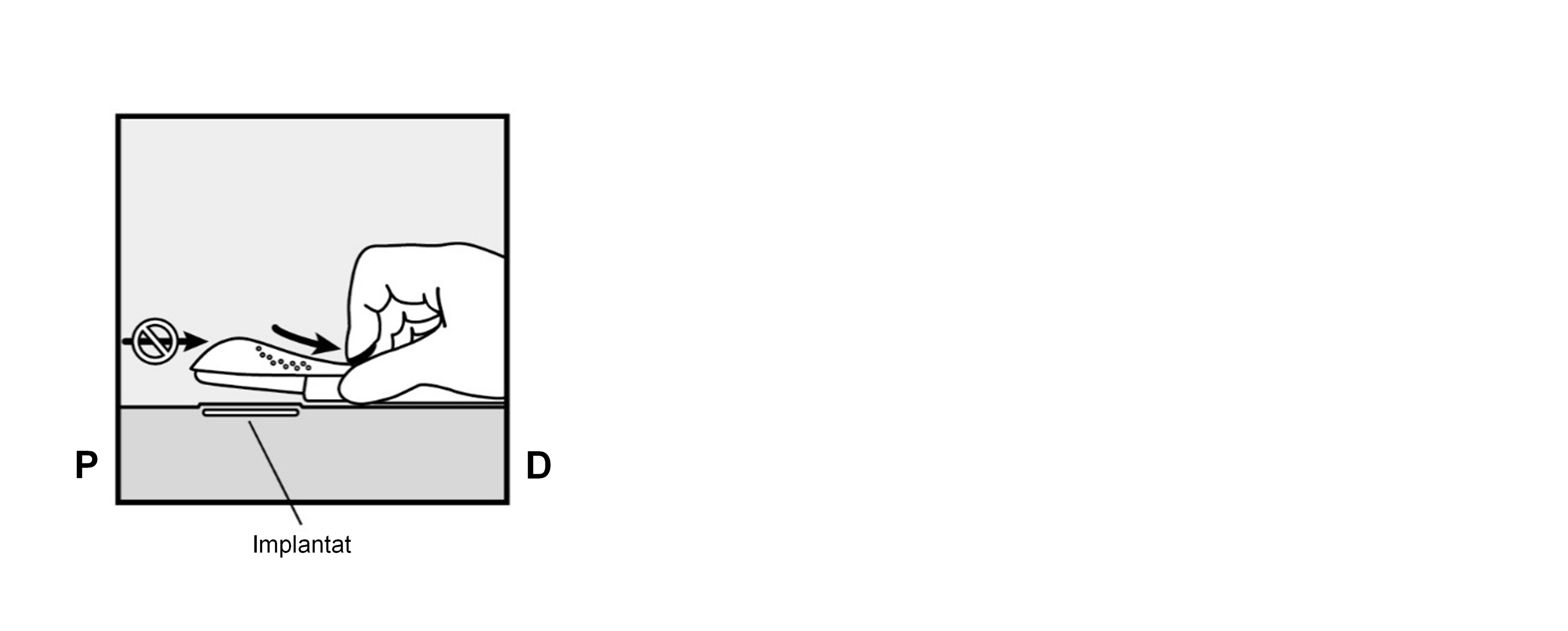
Abbildung 8b
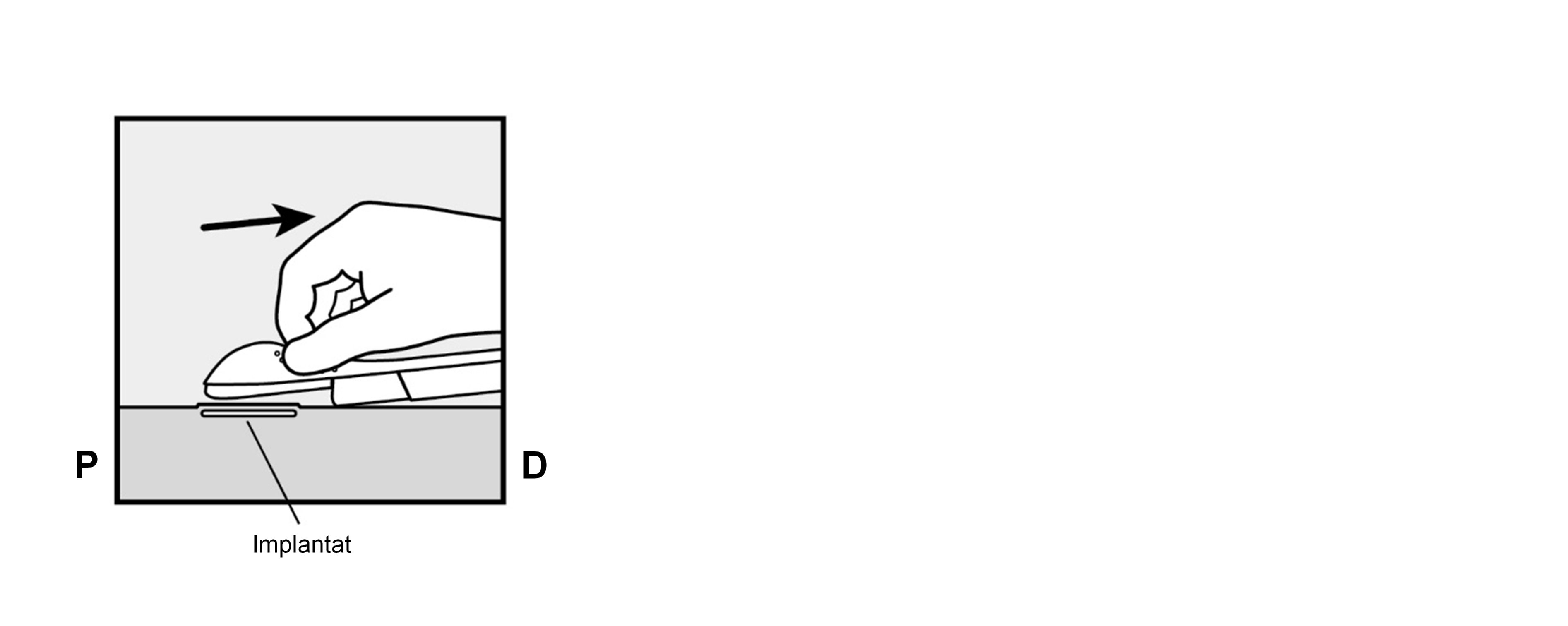
Abbildung 8c
Verbleibt der Applikator während dieses Prozederes nicht in seiner Position oder wird der lila Schieber nicht komplett zum Anschlag zurückgeschoben, wird das Implantat nicht richtig eingelegt und könnte aus der Einlagestelle herausstehen.
Steht das Implantat aus der Einlagestelle heraus, entfernen Sie das Implantat und wiederholen Sie das Verfahren an derselben Einlagestelle mit einem neuen Applikator. Schieben Sie das herausstehende Implantat nicht zurück in die Inzision.
Bringen Sie einen kleinen Pflasterverband über der Einlagestelle an.
Überprüfen Sie immer unmittelbar nach Einlage durch Ertasten, ob sich das Implantat im Arm der Anwenderin befindet. Durch Ertasten der beiden Enden des Implantats sollte es möglich sein, zu bestätigen, dass das 4 cm lange Stäbchen vorhanden ist (Abbildung 9). Siehe nachfolgenden Abschnitt „Wenn das Implantat nach Einlage nicht ertastet werden kann“.
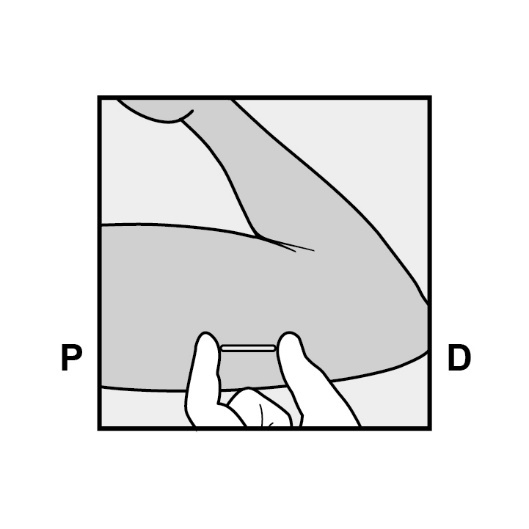
Abbildung 9
Bitten Sie die Anwenderin, das Implantat zu ertasten.
Legen Sie eine sterile Gaze mit einem Druckverband an, um Blutergüsse zu vermeiden. Die Anwenderin kann den Druckverband nach 24 Stunden und den kleinen Pflasterverband über der Einlagestelle nach 3 – 5 Tagen entfernen.
Füllen Sie die Patientenkarte aus und händigen Sie diese der Anwenderin zur Aufbewahrung aus. Füllen Sie außerdem die Klebeetiketten aus und kleben Sie diese in die Patientenakte der Anwenderin. Bei Verwendung einer elektronischen Patientenakte sollten die auf dem Klebeetikett eingetragenen Informationen gespeichert werden.
Der Applikator ist nur zur einmaligen Anwendung bestimmt und muss entsprechend den lokalen gesetzlichen Vorschriften zur Beseitigung von biologisch bedenklichem Abfall sachgerecht entsorgt werden.
Wenn das Implantat nach Einlage nicht ertastet werden kann:
Wenn Sie das Implantat nicht ertasten können oder wenn Sie daran zweifeln, dass es vorhanden ist, könnte das Implantat nicht oder tief eingelegt worden sein:
Überprüfen Sie den Applikator. Die Nadel muss vollständig eingezogen und nur die lila Spitze des Obturators sichtbar sein.
Benutzen Sie andere Methoden, um zu bestätigen, dass das Implantat vorhanden ist. Aufgrund der röntgendichten Beschaffenheit des Implantats sind zweidimensionales Röntgen und Röntgencomputertomografie (CT-Scan) geeignete Methoden zur Lokalisation. Ultraschalluntersuchung (US) mit einem hochfrequenten Linear-Array-Schallkopf (10 MHz oder höher) oder Kernspintomografie (MRT) können ebenfalls verwendet werden. Ist das Implantat mit diesen bildgebenden Verfahren nicht auffindbar, wird empfohlen, das Vorhandensein des Implantats durch Messung des Etonogestrelspiegels mittels einer Blutprobe der Anwenderin nachzuweisen. In diesem Fall kontaktieren Sie den örtlichen Vertreter des pharmazeutischen Unternehmers, der das geeignete Prüfverfahren zur Verfügung stellen wird.
Solange Sie nicht bestätigen können, dass das Implantat vorhanden ist, muss die Anwenderin eine nicht hormonelle Verhütungsmethode anwenden.
Tief eingelegte Implantate müssen lokalisiert und so bald wie möglich entfernt werden, um eine mögliche Wanderung an eine andere Stelle zu vermeiden (siehe Abschnitt 4.4).
Wie ist Implanon NXT zu entfernen
Die Entfernung des Implantats soll nur unter aseptischen Bedingungen und von einem Arzt durchgeführt werden, der mit der Technik zur Entfernung vertraut ist. Sind Sie mit der Technik zur Entfernung nicht vertraut, kontaktieren Sie den örtlichen Vertreter des pharmazeutischen Unternehmers für weitere Informationen: Organon Healthcare GmbH, Pestalozzistr. 31, 80469 München.
Bevor mit der Entfernung begonnen wird, muss der Arzt feststellen, wo sich das Implantat befindet. Stellen Sie durch Ertasten die genaue Lage des Implantats im Arm fest.
Sollte das Implantat nicht ertastbar sein, verifizieren Sie anhand der Patientenkarte oder der Patientenakte den Arm, in den das Implantat eingelegt wurde. Falls das Implantat nicht ertastet werden kann, könnte es tief positioniert oder an eine andere Stelle gewandert sein. Bedenken Sie, dass es nahe an Blutgefäßen und Nerven liegen könnte. Das Entfernen eines nicht ertastbaren Implantats sollte nur von einem Arzt durchgeführt werden, der Erfahrung in der Entfernung von tief platzierten Implantaten hat und der mit der Lokalisation des Implantats und der Anatomie des Arms vertraut ist. Kontaktieren Sie den örtlichen Vertreter des pharmazeutischen Unternehmers für weitere Informationen.
Siehe nachfolgenden Abschnitt zu „Lokalisation und Entfernung nicht ertastbarer Implantate“, falls das Implantat nicht ertastet werden kann.
Vorgehen bei der Entfernung von ertastbaren Implantaten
Zur Veranschaulichung zeigen die Abbildungen die Innenseite des linken Arms.
Bitten Sie die Anwenderin, sich mit dem Rücken auf die Untersuchungsliege zu legen. Der Arm sollte am Ellenbogen nach außen abgewinkelt werden, sodass sich ihre Hand unter dem (oder so nah wie möglich am) Kopf befindet. (Siehe Abbildung 10).

Abbildung 10
Lokalisieren Sie das Implantat durch Ertasten. Drücken Sie das der Schulter am nächsten gelegene Ende des Implantats nach unten (Abbildung 11), um es zu stabilisieren; es sollte eine Wölbung zum Vorschein kommen, die die dem Ellenbogen am nächsten gelegene Spitze des Implantats andeutet. Falls die Spitze nicht erscheint, könnte die Entfernung des Implantats Schwierigkeiten bereiten und sollte von einem Spezialisten mit Erfahrung in der Entfernung von tiefliegenden Implantaten durchgeführt werden. Kontaktieren Sie den örtlichen Vertreter des pharmazeutischen Unternehmers für weitere Informationen.
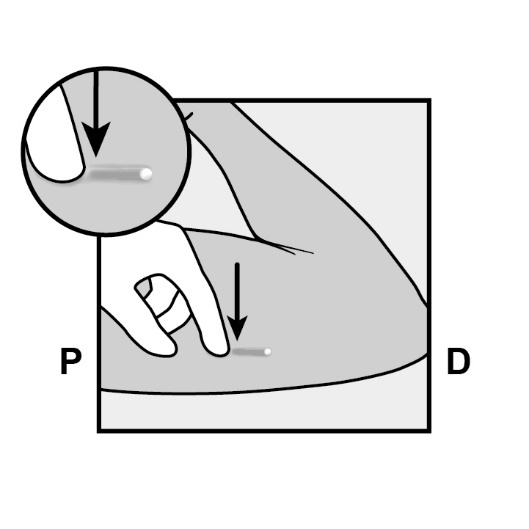
Abbildung 11
P , proximal (in Richtung Schulter)
D, distal (in Richtung Ellenbogen)
Markieren Sie das distale Ende (das dem Ellenbogen am nächsten gelegene Ende), zum Beispiel mit einem chirurgischen Marker.
Reinigen Sie die Stelle, an der der Schnitt gesetzt werden soll, mit einem Desinfektionsmittel.
Betäuben Sie die Stelle, die für die Inzision vorgesehen ist, zum Beispiel mit 0,5 – 1 ml Lidocain (1 %) (Abbildung 12). Stellen Sie sicher, dass das Lokalanästhetikum unterhalb des Implantats appliziert wird, damit das Implantat nahe der Hautoberfläche verbleibt. Eine Injektion des Lokalanästhetikums über dem Implantat kann die Entfernung erschweren.
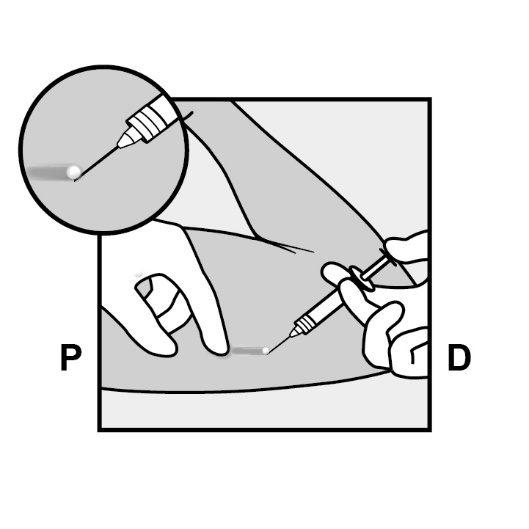
Abbildung 12
Drücken Sie das der Schulter am nächsten gelegene Ende des Implantats nach unten (Abbildung 13), um es während des gesamten Verfahrens zu stabilisieren. Beginnend an der dem Ellenbogen am nächsten gelegenen Spitze des Implantats setzen Sie einen Längsschnitt (parallel zum Implantat) von 2 mm in Richtung des Ellenbogens. Achten Sie darauf, dass Sie die Spitze des Implantats nicht abschneiden.
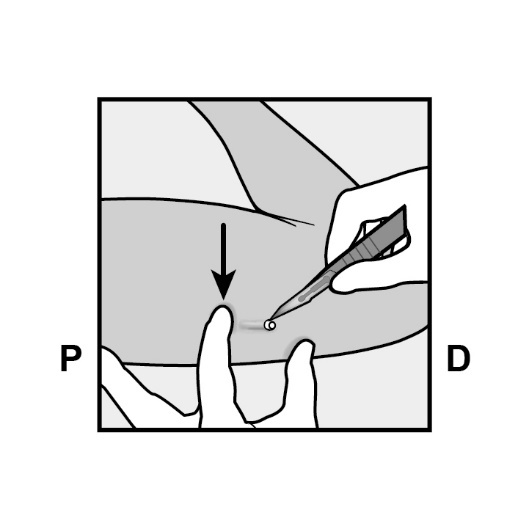
Abbildung 13
Die Spitze des Implantats sollte aus der Inzisionsstelle herausstehen. Falls nicht, schieben Sie das Implantat vorsichtig zur Inzisionsstelle, bis die Spitze sichtbar ist. Fassen Sie das Implantat mit einer Klemme und, wenn möglich, ziehen Sie das Implantat heraus (Abbildung 14).
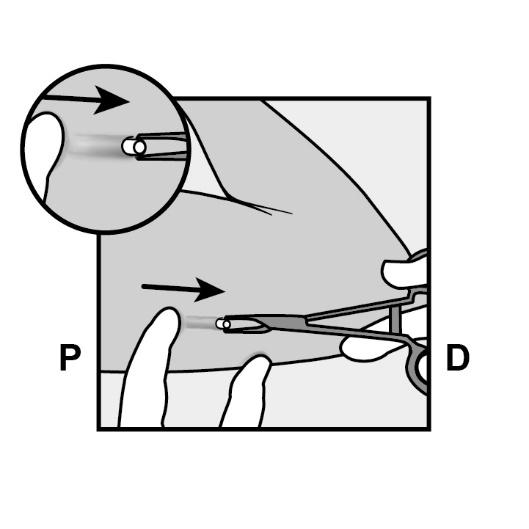
Abbildung 14
Falls notwendig, entfernen Sie vorsichtig mittels stumpfer Dissektion anhaftendes Gewebe von der Spitze des Implantats. Ist die Spitze des Implantats nach stumpfer Dissektion nicht freigelegt, schneiden Sie die Gewebehülle auf und ziehen dann das Implantat mit der Klemme heraus (Abbildungen 15 und 16).
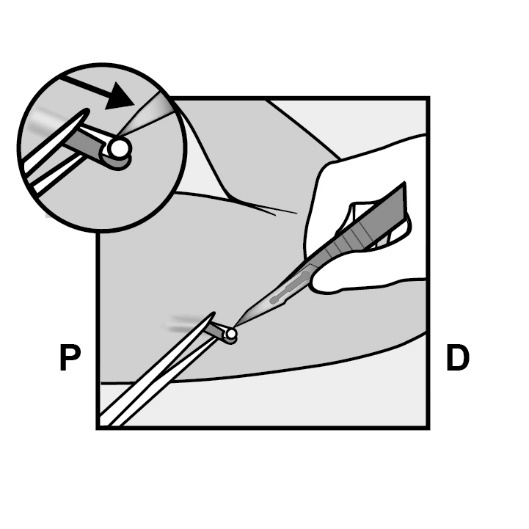 Abbildung 15 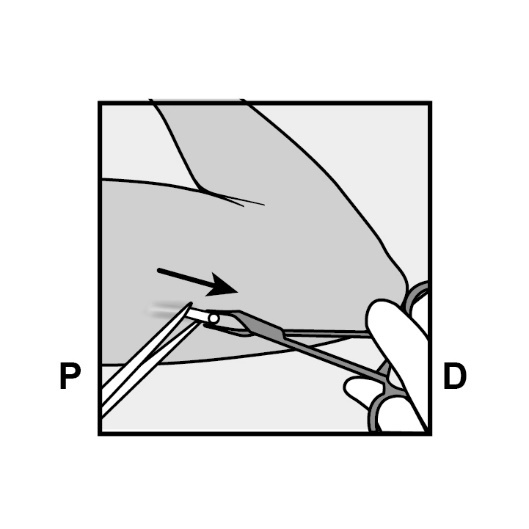 Abbildung 16 |
Falls die Spitze des Implantats nicht an der Inzision zu sehen ist, führen Sie behutsam eine Klemme (möglichst eine gebogene „Moskito-Klemme“, mit nach oben zeigenden Spitzen) oberflächlich in die Inzision ein (Abbildung 17).
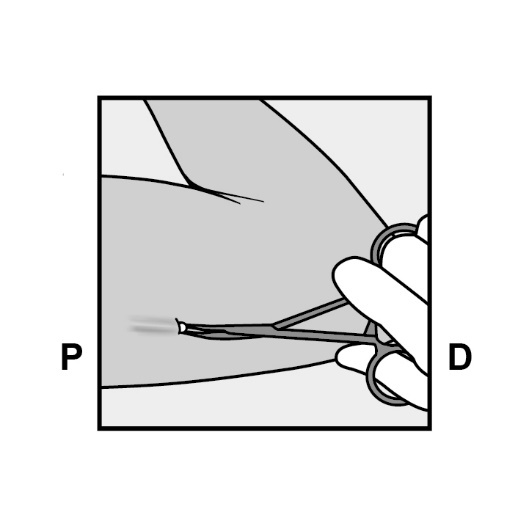
Abbildung 17
Fassen Sie das Implantat vorsichtig mit der Klemme und nehmen Sie die Klemme dann in die andere Hand (Abbildung 18).
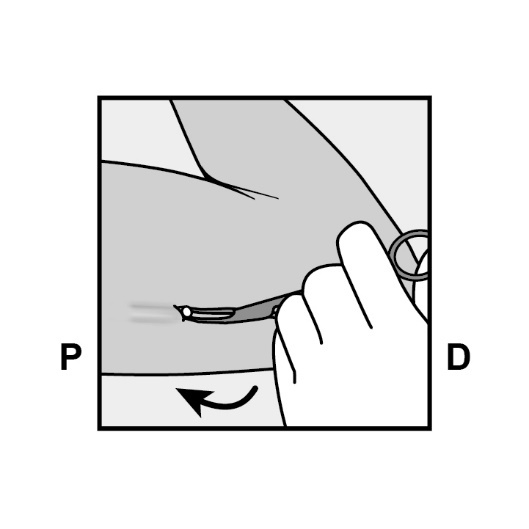
Abbildung 18
Spalten Sie mit einer zweiten Klemme vorsichtig das Gewebe um das Implantat und fassen Sie das Implantat (Abbildung 19). Dann kann das Implantat herausgezogen werden.
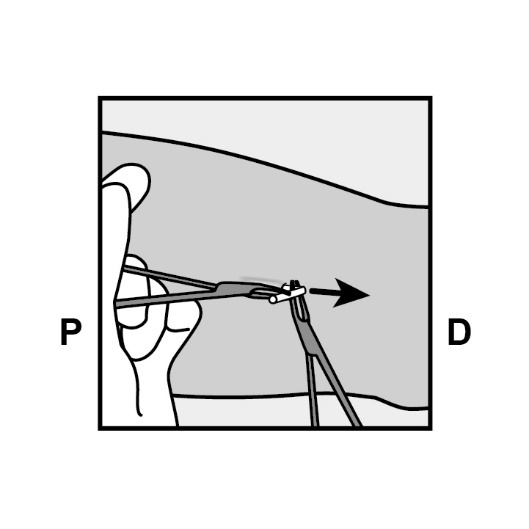
Abbildung 19
Falls das Implantat nicht greifbar ist, beenden Sie den Eingriff und verweisen Sie die Anwenderin an einen Arzt, der Erfahrung mit komplizierten Entfernungen hat. Oder kontaktieren Sie den örtlichen Vertreter des pharmazeutischen Unternehmers.
Vergewissern Sie sich, dass das komplette Stäbchen, das eine Länge von 4 cm aufweist, entfernt wurde, indem Sie seine Länge messen. Es liegen Meldungen über gebrochene Implantate im Arm der Anwenderinnen vor. In einigen Fällen wurde berichtet, dass es schwierig war, das gebrochene Implantat zu entfernen. Wurde das Implantat nur teilweise entfernt (weniger als 4 cm), ist das verbleibende Stück gemäß den Anweisungen in diesem Abschnitt zu entfernen.
Falls eine Fortsetzung der Anwendung von Implanon NXT erwünscht ist, kann, unmittelbar nachdem das alte Implantat entfernt wurde, durch die gleiche Inzision ein neues Implantat eingelegt werden, sofern sich die Inzision an der richtigen Stelle befindet (siehe Abschnitt 4.2 „Wie ist Implanon NXT zu ersetzen“).
Nachdem das Implantat entfernt wurde, verschließen Sie die Inzision mit einem sterilen selbstklebenden Wundverschluss.
Legen Sie eine sterile Gaze mit einem Druckverband an, um Blutergüsse zu vermeiden. Die Anwenderin kann den Druckverband nach 24 Stunden und den sterilen selbstklebenden Wundverschluss nach 3 – 5 Tagen entfernen.
Lokalisation und Entfernung nicht ertastbarer Implantate
Es gibt Einzelfallberichte über eine Wanderung des Implantats; üblicherweise handelt es sich dabei um eine geringfügige Verschiebung gegenüber der ursprünglichen Position (siehe auch Abschnitt 4.4). Dies kann jedoch dazu führen, dass das Implantat nicht an der Stelle ertastet werden kann, an der es eingelegt wurde. Ein Implantat, das tief eingelegt wurde oder gewandert ist, kann gegebenenfalls nicht ertastet werden, so dass für die Lokalisation die Anwendung bildgebender Verfahren, wie nachfolgend beschrieben, erforderlich ist.
Ein nicht ertastbares Implantat muss immer lokalisiert werden, bevor versucht wird, es zu entfernen. Aufgrund der röntgendichten Beschaffenheit des Implantats sind zweidimensionales Röntgen und Röntgencomputertomografie (CT-Scan) geeignete Methoden zur Lokalisation. Ultraschalluntersuchung (US) mit einem hochfrequenten Linear-Array-Schallkopf (10 MHz oder höher) oder Kernspintomografie (MRT) können ebenfalls verwendet werden. Nachdem das Implantat im Arm lokalisiert wurde, wird empfohlen, es von einem Arzt entfernen zu lassen, der Erfahrung in der Entfernung von tief platzierten Implantaten hat und mit der Anatomie des Arms vertraut ist. Die Durchführung der Entfernung unter Ultraschallüberwachung ist dabei zu erwägen.
Wenn das Implantat nach umfangreichen Versuchen der Lokalisation nicht im Arm aufgefunden werden kann, muss die Anwendung bildgebender Verfahren für den Brustkorb erwogen werden, da in extrem seltenen Fällen eine Wanderung in das Gefäßsystem der Lungen beschrieben wurde. Liegt das Implantat im Brustkorb, können chirurgische oder endovaskuläre Eingriffe erforderlich sein; es sollten mit der Anatomie des Brustkorbs vertraute Ärzte konsultiert werden.
Wann immer diese bildgebenden Verfahren zur Lokalisation des Implantats versagen sollten, kann eine Etonogestrel-Bestimmung im Blut zum Nachweis, dass das Implantat vorhanden ist, verwendet werden. Kontaktieren Sie hierzu bitte den örtlichen Vertreter des pharmazeutischen Unternehmers für weitere Anleitungen.
Falls das Implantat innerhalb des Arms wandert, kann die Entfernung einen kleineren chirurgischen Eingriff mit einer längeren Inzision oder einen chirurgischen Eingriff in einem Operationssaal erfordern. Um eine Verletzung tiefer neuraler oder vaskulärer Strukturen im Arm zu vermeiden, muss die Entfernung tief eingelegter Implantate mit höchster Vorsicht durchgeführt werden.
Nicht ertastbare und tief eingelegte Implantate müssen von einem Arzt entfernt werden, der mit der Anatomie des Arms und der Entfernung von tief eingelegten Implantaten vertraut ist.
Von einer explorativen chirurgischen Entfernung ohne Kenntnis der genauen Lage des Implantats wird dringend abgeraten.
Kontaktieren Sie bitte den örtlichen Vertreter des pharmazeutischen Unternehmers für weitere Anleitungen.
Wie ist Implanon NXT zu ersetzen
Ein Austausch kann unmittelbar, nachdem das vorhergehende Implantat entfernt wurde, erfolgen. Die Vorgehensweise ist ähnlich dem Verfahren, wie in Abschnitt 4.2 „Wie wird Implanon NXT eingelegt“ beschrieben.
Das neue Implantat kann in den gleichen Arm und durch die gleiche Inzision eingelegt werden, durch die das vorherige Implantat entfernt wurde. Bedingung ist, dass sich die Inzision an der richtigen Stelle befindet, d. h. 8 – 10 cm vom medialen Epikondylus des Oberarmknochens entfernt und 3 – 5 cm hinter (unter) dem Sulcus (siehe Abschnitt 4.2 „Wie wird Implanon NXT eingelegt“). Wird die gleiche Inzision zur Einlage eines neuen Implantats verwendet, betäuben Sie die Einlagestelle, indem Sie ein Lokalanästhetikum einspritzen (z. B. 2 ml Lidocain [1 %]). Beginnen Sie direkt unter der Haut, an der Inzision der Entfernung, und spritzen Sie entlang des „Insertionskanals“. Befolgen Sie dann die weiteren Schritte des Einlageverfahrens.
Aktive venöse thromboembolische Erkrankungen.
Bekannte oder vermutete Sexualhormon-abhängige Tumoren.
Bestehende oder vorausgegangene (benigne oder maligne) Lebertumoren.
Bestehende oder vorausgegangene schwere Lebererkrankungen, solange sich die Leberfunktionswerte noch nicht normalisiert haben.
Nicht abgeklärte vaginale Blutungen.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei Vorliegen eines der im Folgenden erwähnten Zustände/Risikofaktoren muss der Nutzen einer Gestagenbehandlung gegen die möglichen Risiken individuell abgewogen und mit der Anwenderin besprochen werden, bevor sie sich für die Anwendung von Implanon NXT entscheidet. Bei einer Verschlechterung, Verschlimmerung oder einem erstmaligen Auftreten eines der beschriebenen Zustandsbilder soll sich die Anwenderin mit ihrem Arzt in Verbindung setzen. Der Arzt muss dann entscheiden, ob die Anwendung von Implanon NXT abgebrochen werden sollte.
Mammakarzinome
Das Brustkrebsrisiko steigt allgemein mit zunehmendem Alter. Während der Einnahme von (kombinierten) oralen Kontrazeptiva ist das Risiko der Diagnosestellung eines Mammakarzinoms geringfügig erhöht. Dieses erhöhte Risiko verringert sich innerhalb von 10 Jahren nach Absetzen oraler Kontrazeptiva kontinuierlich und ist unabhängig von der Dauer der Anwendung, jedoch abhängig vom Alter der Frau während der Einnahme des oralen Kontrazeptivums. Die erwartete Zahl diagnostizierter Fälle pro 10.000 Frauen, die kombinierte orale Kontrazeptiva anwenden (bis zu 10 Jahre nach dem Absetzen), im Vergleich zu Nicht-Anwenderinnen im gleichen Zeitraum wurde für die jeweiligen Altersgruppen folgendermaßen errechnet: 4,5/4 (16‑19 Jahre), 17,5/16 (20‑24 Jahre), 48,7/44 (25‑29 Jahre), 110/100 (30‑34 Jahre), 180/160 (35‑39 Jahre) und 260/230 (40‑44 Jahre). Möglicherweise liegt das Risiko bei Verwendung von kontrazeptiven Methoden, die nur Gestagen enthalten, in einer ähnlichen Größenordnung wie bei kombinierten oralen Kontrazeptiva. Jedoch ist für diese Methoden der Beweis weniger schlüssig. Verglichen mit dem Risiko, im Laufe des Lebens jemals an Brustkrebs zu erkranken, ist die Risikoerhöhung durch die Anwendung oraler Kontrazeptiva gering. Die Mammakarzinomfälle, die bei Frauen, die ein orales Kontrazeptivum eingenommen haben, diagnostiziert worden waren, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein orales Kontrazeptivum eingenommen haben. Die beobachtete Risikoerhöhung kann sowohl auf eine frühzeitigere Diagnosestellung als auch auf biologische Wirkungen von oralen Kontrazeptiva oder auf beide Faktoren gemeinsam zurückzuführen sein.
Lebererkrankung
Bei akuten oder chronischen Störungen der Leberfunktion ist die Anwenderin zur Untersuchung und Beratung an einen Spezialisten zu verweisen.
Thrombotische und andere vaskuläre Ereignisse
Epidemiologische Studien lassen vermuten, dass die Anwendung von kombinierten oralen Kontrazeptiva (Estrogen und Gestagen) mit einem vermehrten Auftreten von venösen Thromboembolien (VTE, tiefe Venenthrombose und Lungenembolie) und arteriellen Thromboembolien (ATE, Herzinfarkt und ischämischer Schlaganfall) verbunden ist. Die klinische Relevanz dieser Ergebnisse für die Verwendung von Etonogestrel (dem biologisch aktiven Metaboliten von Desogestrel) in einem rein Gestagen-basierten Kontrazeptivum ohne Estrogen-Komponente ist nicht bekannt.
Begrenzte epidemiologische Daten weisen nicht auf ein erhöhtes VTE- oder ATE-Risiko für Frauen hin, die das Implantat anwenden; es wurden jedoch nach Markteinführung VTE und ATE bei Frauen berichtet, die Etonogestrel-Implantate anwenden. Es wird empfohlen, Risikofaktoren mit in die Bewertung einzubeziehen, die bekanntermaßen das VTE- und ATE-Risiko erhöhen.
Frauen mit thromboembolischen Erkrankungen in der Anamnese müssen auf ein mögliches Wiederauftreten hingewiesen werden. Das Implantat soll bei Auftreten einer Thrombose entfernt werden. Die Entfernung des Implantats sollte ebenso bei längerfristiger Immobilisation aufgrund einer Operation oder Erkrankung in Erwägung gezogen werden.
Blutdruckerhöhung
Wenn sich während der Anwendung von Implanon NXT eine anhaltende Hypertonie entwickelt oder ein signifikanter Anstieg des Blutdrucks durch Antihypertensiva nicht ausreichend zu behandeln ist, soll Implanon NXT entfernt werden.
Auswirkungen auf den Kohlenhydratstoffwechsel
Die Anwendung von gestagenhaltigen Kontrazeptiva kann die periphere Insulinresistenz und Glukosetoleranz beeinflussen. Diabetikerinnen müssen daher in den ersten Monaten der Anwendung von Implanon NXT sorgfältig überwacht werden.
Chloasma
Insbesondere bei Frauen mit anamnestisch bekanntem Chloasma gravidarum kann es bisweilen zu einem Chloasma kommen. Bei erhöhter Chloasmaneigung soll während der Anwendung von Implanon NXT direkte Sonneneinstrahlung oder UV-Strahlung vermieden werden.
Körpergewicht
Die kontrazeptive Wirkung von Implanon NXT hängt von den Plasmaspiegeln des Etonogestrels ab, welche umgekehrt proportional zum Körpergewicht sind und mit der Zeit nach der Einlage abnehmen. Die klinische Erfahrung bei Frauen mit höherem Körpergewicht im 3. Jahr der Anwendung ist begrenzt. Es kann daher nicht ausgeschlossen werden, dass die kontrazeptive Wirkung bei diesen Frauen im 3. Jahr der Anwendung geringer ist als bei normalgewichtigen Frauen. Der Arzt kann daher bei Frauen mit höherem Körpergewicht einen früheren Austausch des Implantats in Betracht ziehen.
Komplikationen bei der Einlage
Es liegen Berichte über eine Wanderung des Implantats im Arm, weg von der ursprünglichen Einlagestelle, vor, die im Zusammenhang mit einer tiefen Einlage (siehe Abschnitt 4.2 "Wie wird Implanon NXT eingelegt") oder äußerer Krafteinwirkung (z. B. Manipulation des Implantats oder bei Kontaktsportarten) stehen können. Zudem wurde nach Markteinführung selten über Implantate berichtet, die in den Blutgefäßen des Arms und der Pulmonalarterie aufgefunden wurden, was mit einer tiefen oder intravaskulären Einlage in Zusammenhang stehen kann. In Fällen, in denen das Implantat im Arm von der Einlagestelle weggewandert ist, kann die Lokalisation des Implantats erschwert sein. Die Entfernung kann einen kleineren chirurgischen Eingriff mit einer längeren Inzision oder einen chirurgischen Eingriff in einem Operationssaal erfordern. In Fällen, in denen das Implantat in die Pulmonalarterie gewandert ist, können chirurgische oder endovaskuläre Eingriffe zur Entfernung erforderlich sein (siehe Abschnitt 4.2 "Wie ist Implanon NXT zu entfernen"). Wann immer das Implantat nicht ertastet werden kann, muss es lokalisiert werden. Eine Entfernung wird so bald wie medizinisch vertretbar empfohlen. Wird das Implantat nicht entfernt, ist damit zu rechnen, dass die Kontrazeption und das Risiko von Gestagen-Nebenwirkungen länger als erwünscht bestehen bleiben können.
Das Implantat kann ausgestoßen werden, insbesondere dann, wenn es nicht entsprechend den Anweisungen in Abschnitt 4.2 "Wie wird Implanon NXT eingelegt" eingelegt wurde oder als Folge einer lokalen Entzündung.
Ovarialzysten
Wie bei allen niedrigdosierten hormonellen Kontrazeptiva kommt es zu einer Follikelentwicklung und gelegentlich kann ein Follikel über die Größe, die er in einem normalen Zyklus erreichen würde, hinauswachsen. Im Allgemeinen verschwinden diese vergrößerten Follikel spontan wieder. Meist sind sie asymptomatisch; in einigen Fällen sind sie mit leichten Abdominalschmerzen verbunden. In seltenen Fällen ist eine chirurgische Intervention erforderlich.
Ektope Schwangerschaften
Bei traditionellen Gestagenmonopräparaten ist der Schutz vor ektopen Schwangerschaften nicht so gut wie bei kombinierten oralen Kontrazeptiva, was mit dem gehäuften Auftreten von Ovulationen während der Anwendung dieser Methoden in Verbindung gebracht wird. Obwohl Implanon NXT die Ovulation hemmt, sollte bei Amenorrhö oder Bauchschmerzen eine ektope Schwangerschaft bei der Differentialdiagnose in Betracht gezogen werden.
Psychiatrische Erkrankungen
Depressive Verstimmung und Depression stellen bei der Anwendung hormoneller Kontrazeptiva allgemein bekannte Nebenwirkungen dar (siehe Abschnitt 4.8). Depressionen können schwerwiegend sein und sind ein allgemein bekannter Risikofaktor für suizidales Verhalten und Suizid. Frauen sollte geraten werden, sich im Falle von Stimmungsschwankungen und depressiven Symptomen - auch wenn diese kurz nach Einleitung der Behandlung auftreten - mit ihrem Arzt in Verbindung zu setzen.
Weitere Erkrankungen
Folgende Erkrankungen wurden sowohl während der Schwangerschaft als auch während der Einnahme von Sexualhormonen beobachtet, ein Zusammenhang mit der Anwendung von Gestagenen konnte jedoch bislang nicht hergestellt werden: Gelbsucht und/oder Pruritus aufgrund einer Cholestase; Bildung von Gallensteinen; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Chorea minor Sydenham (Veitstanz); Herpes gestationis; otosklerosebedingter Hörverlust und (hereditäres) Angioödem.
Medizinische Untersuchung/Beratung
Vor (Wieder-)Einlage von Implanon NXT muss eine komplette medizinische Anamnese (einschließlich Familienanamnese) erhoben werden. Eine Schwangerschaft muss ausgeschlossen werden. Der Blutdruck sollte gemessen und eine körperliche Untersuchung durchgeführt werden, unter Berücksichtigung der Kontraindikationen (siehe Abschnitt 4.3) und Warnhinweise (siehe Abschnitt 4.4). Es wird empfohlen, dass die Anwenderin 3 Monate nach Einlage von Implanon NXT zu einer Nachuntersuchung kommt. Bei dieser Untersuchung sollte der Blutdruck gemessen und die Anwenderin auf mögliche Fragen, Beschwerden oder das Auftreten von Nebenwirkungen angesprochen werden. Die Häufigkeit und Art der Folgeuntersuchungen sollten für jede Anwenderin individuell und der medizinischen Beurteilung entsprechend festgelegt werden. Das Implantat muss bei jeder Kontrolluntersuchung ertastet werden. Die Anwenderin muss angewiesen werden, unverzüglich ihren Arzt aufzusuchen, wann immer sie ihr Implantat zwischen den Kontrollen nicht ertasten kann.
Die Anwenderinnen sollten darauf hingewiesen werden, dass Implanon NXT keinen Schutz vor HIV (AIDS) oder anderen sexuell übertragbaren Erkrankungen bietet.
Verminderte Wirksamkeit durch gleichzeitig angewendete Arzneimittel
Die Wirksamkeit von Implanon NXT kann bei gleichzeitiger Anwendung anderer Arzneimittel, die die Plasmakonzentration von Etonogestrel erniedrigen, beeinträchtigt sein (siehe Abschnitt 4.5).
Veränderungen des Blutungsverhaltens der Menstruationsblutung
Während der Anwendung von Implanon NXT ist es wahrscheinlich, dass bei den Anwenderinnen eine Änderung des Blutungsverhaltens der Menstruationsblutung eintritt, welche im Voraus schwer einschätzbar ist. Dies kann das Auftreten eines unregelmäßigen Blutungsverhaltens (ausbleibend, seltener, öfter oder andauernd) und Änderungen in der Intensität der Blutungen (vermindert oder verstärkt) oder der Dauer umfassen. 1 von 5 Anwenderinnen berichtete über Amenorrhö, während wiederum 1 von 5 Frauen über vermehrte und/oder länger anhaltende Blutungen berichtete. Bei vielen Anwenderinnen lässt das Blutungsverhalten während der ersten drei Monate der Anwendung allgemein eine Vorhersage für das künftige Blutungsverhalten zu. Information, Beratung und die Benutzung eines Blutungskalenders können die Akzeptanz des Blutungsverhaltens der Frauen erhöhen. Eine Beurteilung der vaginalen Blutungen sollte ad hoc erfolgen und kann eine Untersuchung zum Ausschluss gynäkologischer Erkrankungen oder einer Schwangerschaft umfassen.
Unter Anwendung gebrochenes oder verbogenes Implantat
Es liegen Meldungen vor, dass das Implantat im Arm der Anwenderin gebrochen ist oder sich verbogen hat, was auf äußere Krafteinwirkungen zurückzuführen sein könnte. Zudem wurde von Fällen berichtet, bei denen das gebrochene Implantat-Fragment im Arm gewandert ist. Basierend auf In-vitro-Daten könnte sich die Freisetzungsrate von Etonogestrel geringfügig erhöhen, wenn das Implantat bricht oder sich verbiegt. Klinisch relevante Effekte sind durch diese Veränderung nicht zu erwarten.
Jedoch sollte ein gebrochenes Implantat entfernt werden und es ist wichtig, dieses gänzlich zu entfernen. Siehe Abschnitt 4.2 für Erläuterungen zur Prozedur der Implantat-Entfernung (entweder ertastbares oder nicht ertastbares Implantat).
Hinweis: Die Fachinformationen von Begleitmedikationen müssen zu Rate gezogen werden, um mögliche Wechselwirkungen zu identifizieren.
Wirkungen anderer Arzneimittel auf Implanon NXT
Wechselwirkungen können mit Arzneimitteln auftreten, die mikrosomale Enzyme induzieren, was zu einer erhöhten Clearance von Sexualhormonen und zu Menstruationsblutungen und/oder Versagen des Konzeptionsschutzes führen kann.
Management
Eine Enzyminduktion kann bereits nach wenigen Behandlungstagen beobachtet werden. Die maximale Enzyminduktion tritt üblicherweise innerhalb weniger Wochen auf. Nach Beendigung der Arzneimitteltherapie kann die Enzyminduktion für ca. 4 Wochen anhalten.
Frauen, die enzyminduzierende Arzneimittel oder pflanzliche Präparate erhalten, sollten darauf hingewiesen werden, dass die Wirksamkeit von Implanon NXT vermindert sein kann. Es ist nicht notwendig, das Implantat zu entfernen. Um jedoch einen maximalen Schutz aufrecht zu erhalten, sollte den Frauen geraten werden, während der gesamten Dauer der Anwendung und 28 Tage nach deren Beendigung zusätzlich eine nicht hormonelle Verhütungsmethode anzuwenden.
Über die folgenden Wechselwirkungen wird in der Literatur berichtet (hauptsächlich in Zusammenhang mit kombinierten Kontrazeptiva, gelegentlich jedoch auch mit rein gestagenhaltigen Kontrazeptiva, einschließlich Implanon NXT).
Substanzen, die die Clearance hormoneller Kontrazeptiva erhöhen (verminderte Wirksamkeit hormoneller Kontrazeptiva durch Enzyminduktion), z. B.:
Barbiturate, Bosentan, Carbamazepin, Phenytoin, Primidon, Rifampicin und HIV/HCV-Arzneimittel (wie Efavirenz, Boceprevir, Nevirapin) und möglicherweise auch Felbamat, Griseofulvin, Oxcarbazepin, Topiramat und Präparate, die das pflanzliche Arzneimittel Johanniskraut (Hypericum perforatum) enthalten.
Substanzen mit unterschiedlichen Auswirkungen auf die Clearance hormoneller Kontrazeptiva
Bei gleichzeitiger Anwendung mit hormonellen Kontrazeptiva können viele Kombinationen von HIV-Protease-Inhibitoren und Nicht-nukleosidischen Reverse-Transkriptase-Inhibitoren, einschließlich Kombinationen mit HCV-Inhibitoren, die Plasmakonzentrationen von Gestagenen, einschließlich Etonogestrel, erhöhen oder erniedrigen. In einigen Fällen kann der Nettoeffekt dieser Veränderungen klinisch relevant sein.
Daher sollten die Fachinformationen der gleichzeitig angewendeten HIV/HCV-Arzneimittel konsultiert werden, um sich über mögliche Wechselwirkungen und alle damit verbundenen Empfehlungen zu informieren. Im Zweifelsfall sollten Frauen eine zusätzliche Barrieremethode zur Verhütung anwenden, wenn sie mit einem Protease-Inhibitor oder Nicht-nukleosidischen Reverse-Transkriptase-Inhibitoren behandelt werden.
Substanzen, die die Clearance hormoneller Kontrazeptiva erniedrigen (Enzymhemmer)
Eine gleichzeitige Verabreichung von starken (z. B. Ketoconazol, Itraconazol, Clarithromycin) oder mäßig starken (z. B. Fluconazol, Diltiazem, Erythromycin) CYP3A4-Hemmern kann die Serumkonzentrationen von Gestagenen, einschließlich Etonogestrel, erhöhen.
Wirkung von Implanon NXT auf andere Arzneimittel
Es besteht die Möglichkeit, dass hormonelle Kontrazeptiva den Metabolismus bestimmter anderer Wirkstoffe beeinflussen. Folglich können die Plasma- und Gewebekonzentrationen entweder ansteigen (z. B. Ciclosporin) oder abfallen (z. B. Lamotrigin).
Laborwerte
Daten von kombinierten oralen Kontrazeptiva haben gezeigt, dass kontrazeptive Steroide einige Laborwerte beeinflussen können, einschließlich biochemischer Parameter der Leber-, Schilddrüsen-, Nebennieren- und Nierenfunktion, Serumspiegel von (Träger-)Proteinen (z. B. kortikosteroidbindendes Globulin und Lipid-/Lipoproteinfraktionen), Parameter des Kohlenhydratstoffwechsels sowie der Blutgerinnung und Fibrinolyse. Die Werte bleiben jedoch im Regelfall im Normbereich. In welchem Ausmaß dies auch auf Gestagenmonopräparate zutrifft, ist nicht bekannt.
Schwangerschaft
Implanon NXT ist während der Schwangerschaft nicht angezeigt. Tritt während der Anwendung von Implanon NXT eine Schwangerschaft ein, muss das Implantat entfernt werden. Tierversuche haben gezeigt, dass sehr hohe Dosen gestagenartiger Substanzen zu einer Maskulinisierung weiblicher Föten führen können. Umfangreiche epidemiologische Studien haben weder ein erhöhtes Risiko von Geburtsschäden bei Kindern gezeigt, deren Mütter vor der Schwangerschaft orale Kontrazeptiva benutzt haben, noch teratogene Effekte, wenn orale Kontrazeptiva während der Schwangerschaft irrtümlich angewendet wurden. Obwohl dies wahrscheinlich für alle oralen Kontrazeptiva zutrifft, ist nicht klar, ob dies auch für Implanon NXT gilt.
Arzneimittelsicherheitsdaten zu verschiedenen etonogestrel- und desogestrelhaltigen Produkten (Etonogestrel ist ein Metabolit von Desogestrel) weisen nicht auf ein erhöhtes Risiko hin.
Stillzeit
Klinische Daten weisen darauf hin, dass Implanon NXT weder die Produktion noch die Qualität (Protein-, Laktose- oder Fettgehalt) der Muttermilch beeinflusst. Kleine Mengen Etonogestrel gehen jedoch in die Muttermilch über. Ausgehend von einer durchschnittlichen täglichen Milchmenge von 150 ml je Kilogramm Körpergewicht beträgt die durchschnittlich vom Kind aufgenommene Etonogestreldosis ungefähr 27 Nanogramm pro Kilogramm Körpergewicht und Tag, kalkuliert nach der Freisetzung im ersten Anwendungsmonat. Dies entspricht ungefähr 2,2 % der täglichen gewichtsadjustierten Dosis der Mutter und etwa 0,2 % der geschätzten täglichen absoluten Dosis der Mutter. Danach vermindert sich die Etonogestrelkonzentration innerhalb der Stillperiode.
Limitierte Langzeitdaten liegen für 38 Kinder vor, bei deren Müttern 4 bis 8 Wochen nach der Geburt ein Implantat eingelegt worden war. Sie wurden für eine durchschnittliche Dauer von 14 Monaten gestillt und bis zu einem Alter von 36 Monaten nachuntersucht. Die Auswertung von Wachstum, körperlicher und psychomotorischer Entwicklung zeigte keinerlei Unterschiede im Vergleich zu gestillten Kindern, deren Mütter ein IUP (n = 33) benutzten. Dennoch sollten Wachstum und Entwicklung des Kindes sorgfältig verfolgt werden. Basierend auf den verfügbaren Daten kann Implanon NXT in der Stillzeit angewandt werden.
Auf Basis des pharmakodynamischen Profils ist anzunehmen, dass Implanon NXT keinen oder einen vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen hat.
Während der Anwendung von Implanon NXT ist es wahrscheinlich, dass bei den Anwenderinnen eine Änderung des Blutungsverhaltens der Menstruationsblutung eintritt, welche im Voraus schwer einschätzbar ist. Dies kann das Auftreten eines unregelmäßigen Blutungsverhaltens (ausbleibend, seltener, öfter oder andauernd) und Änderungen in der Intensität der Blutungen (vermindert oder verstärkt) oder der Dauer umfassen. 1 von 5 Anwenderinnen berichtete über Amenorrhö, während wiederum 1 von 5 Frauen über vermehrte und/oder länger andauernde Blutungen berichtete. Gelegentlich wurde von sehr starken Blutungen berichtet. In klinischen Studien waren Änderungen im Blutungsverhalten der häufigste Grund (ca. 11 %) dafür, dass die Anwendung abgebrochen wurde. Bei vielen Anwenderinnen lässt das Blutungsverhalten während der ersten drei Monate der Anwendung allgemein eine Vorhersage für das künftige Blutungsverhalten zu.
Möglicherweise in Zusammenhang stehende Nebenwirkungen, die während klinischer Studien berichtet wurden, sind in der nachfolgenden Tabelle aufgelistet.
Systemorganklasse |
Nebenwirkungen benannt nach dem MedDRA-Terminus1 |
||
Sehr häufig |
Häufig |
Gelegentlich |
|
Infektionen und parasitäre Erkrankungen |
Infektionen der Vagina; |
Pharyngitis; Rhinitis; |
|
Erkrankungen des Immunsystems |
Überempfind-lichkeit; |
||
Stoffwechsel- und Ernährungs-störungen |
Appetitzunahme; |
||
Psychiatrische Erkrankungen |
emotionale Labilität; depressive Zustände; Nervosität; verminderte Libido; |
Angstzustände; Insomnie; |
|
Erkrankungen des Nervensystems |
Kopfschmerzen; |
Schwindel; |
Migräne; Somnolenz; |
Gefäßerkrankungen |
Hitzewallungen; |
||
Erkrankungen des Gastrointestinal-trakts |
abdominale Schmerzen; Nausea; Flatulenz; |
Erbrechen; Obstipation; Diarrhö; |
|
Erkrankungen der Haut und des Unterhautzell-gewebes |
Akne; |
Alopezie; |
Hypertrichose; Hautausschlag; Juckreiz; |
Skelettmuskulatur-, Bindegewebs- und Knochen-erkrankungen |
Rückenschmerzen; Arthralgien; Myalgien; Schmerzen des Muskel- und Skelettsystems; |
||
Erkrankungen der Nieren und der Harnwege |
Dysurie; |
||
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustspannen; Brustschmerzen; Zyklusstörungen; |
Dysmenorrhö; Ovarialzyste; |
Fluor genitalis; vulvovaginale Beschwerden; Galaktorrhö; Vergrößerung der Brust; genitaler Pruritus; |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schmerzen an der Einlagestelle; Reaktionen an der Einlagestelle; Müdigkeit; grippeähnliche Erkrankung; Schmerzen; |
Fieber; Ödeme; |
|
Untersuchungen |
Gewichtszu-nahme; |
Gewichtsabnahme; |
|
1In der Tabelle ist der passendste MedDRA-Terminus (Version 10.1) zur Beschreibung einer bestimmten unerwünschten Arzneimittelwirkung aufgeführt. Synonyme oder ähnliche Erkrankungsbilder sind nicht aufgeführt, sollten jedoch ebenfalls in Betracht gezogen werden.
Nach Markteinführung wurde in seltenen Fällen ein klinisch relevanter Anstieg des Blutdrucks beobachtet. Darüber hinaus wurde über idiopathische intrakranielle Hypertension berichtet. Seborrhö wurde ebenso berichtet. Anaphylaktische Reaktionen, Urtikaria, Angioödem, Verschlimmerung von Angioödemen und/oder Verschlimmerung von hereditären Angioödemen können auftreten.
Die folgenden Nebenwirkungen wurden im Zusammenhang mit dem Einlegen oder Entfernen des Implantats berichtet:
Die Einlage oder die Entfernung des Implantats kann Blutergüsse, in einigen Fällen auch Hämatome, leichte lokale Irritationen, Schmerzen oder Jucken verursachen.
Das Einlegen des Implantats kann vasovagale Reaktionen hervorrufen (wie Hypotonie, Schwindel oder Synkope).
An der Implantationsstelle kann Fibrose auftreten, es kann sich eine Narbe bilden oder ein Abszess entwickeln. Parästhesien oder parästhesieähnliche Ereignisse können auftreten. Ein Ausstoßen oder Wandern des Implantats, in seltenen Fällen auch in den Brustkorb, wurde berichtet. In seltenen Fällen wurden Implantate im Gefäßsystem einschließlich der Pulmonalarterie gefunden. In einigen Fällen, bei denen das Implantat in der Pulmonalarterie gefunden wurde, wurden Brustschmerz und/oder Atemwegsbeschwerden (wie z. B. Dyspnoe, Husten, Hämoptyse) berichtet, andere wurden als asymptomatisch beschrieben (siehe Abschnitt 4.4). Falls die Anweisungen nicht befolgt werden (siehe Abschnitt 4.2), kann es zu inkorrekten Einlagen, schwieriger Lokalisation und Problemen bei der Entfernung des Implantats kommen. Zur Entfernung des Implantats könnte ein operativer Eingriff notwendig sein.
In seltenen Fällen wurden ektope Schwangerschaften berichtet (siehe Abschnitt 4.4).
Unter der Anwendung von (kombinierten oralen) Kontrazeptiva wurde eine Anzahl von (schwerwiegenden) Nebenwirkungen berichtet. Darunter sind venöse thromboembolische Erkrankungen, arterielle thromboembolische Erkrankungen, hormonabhängige Tumoren (z. B. Lebertumoren, Brustkrebs) und Chloasma. Einige dieser Nebenwirkungen sind in Abschnitt 4.4 "Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung" näher beschrieben.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
Ein Implantat ist vor Einlage eines neuen stets zu entfernen. Es sind keine Daten hinsichtlich einer Überdosierung mit Etonogestrel verfügbar. Generell ist über schwerwiegende unerwünschte Wirkungen im Falle einer Überdosis von Kontrazeptiva nicht berichtet worden.
Pharmakotherapeutische Gruppe: Hormonelle Kontrazeptiva zur systemischen Anwendung, Gestagene, ATC-Code: G03AC08
Wirkmechanismus
Das Implanon NXT Implantat ist ein biologisch nicht abbaubares röntgendichtes Implantat zur subkutanen Applikation, das Etonogestrel enthält und in einem sterilen Einmalapplikator vorgeladen ist. Etonogestrel ist der biologisch aktive Metabolit von Desogestrel, einem in oralen Kontrazeptiva häufig eingesetzten Gestagen. Es ist strukturell vom 19-Nortestosteron abgeleitet und weist eine hohe Bindungsaffinität zu den Gestagenrezeptoren der Zielorgane auf. Die kontrazeptive Wirkung von Etonogestrel beruht primär auf einer Hemmung der Ovulation. Ovulationen wurden in den ersten zwei Jahren der Anwendung des Implantats nie, im dritten Jahr nur selten beobachtet. Neben der Hemmung der Ovulation bewirkt Etonogestrel auch eine Veränderung des Zervikalschleims, wodurch die Passage der Spermien verhindert wird.
Klinische Wirksamkeit und Sicherheit
Klinische Studien wurden mit Frauen zwischen 18 und 40 Jahren durchgeführt. Obwohl kein direkter Vergleich angestellt wurde, scheint die kontrazeptive Wirksamkeit mindestens mit jener kombinierter oraler Kontrazeptiva vergleichbar zu sein. Während klinischer Studien wurden in einer Exposition von 35.057 beobachteten Zyklen keine Schwangerschaften festgestellt; es wurde ein Pearl-Index von 0,00 verzeichnet (95 % Konfidenzintervall: 0,00 – 0,14). Es ist jedoch zu bedenken, dass in der Praxis keine Methode eine 100%ige Wirksamkeit aufweist. Dieser hohe Schutz vor einer Schwangerschaft wird unter anderem dadurch erreicht, dass er nicht von einer regelmäßigen Einnahme der Anwenderin abhängig ist. Die kontrazeptive Wirkung von Etonogestrel ist reversibel, was sich durch eine rasche Normalisierung des Menstruationszyklus nach der Entfernung des Implantats zeigt. Obwohl die Ovulation durch Etonogestrel gehemmt wird, wird die ovarielle Aktivität nicht vollständig unterdrückt. Die mittleren Estradiolkonzentrationen bleiben oberhalb der Werte der frühen Follikelphase. In einer Zweijahresstudie an 44 Anwenderinnen wurde die Knochendichte mit einer Kontrollgruppe von 29 IUP-Anwenderinnen verglichen und es wurden keine unerwünschten Einflüsse auf die Knochenmasse beobachtet. Es wurden keine klinisch relevanten Wirkungen auf den Lipidmetabolismus beobachtet. Die Anwendung von gestagenhaltigen Kontrazeptiva kann einen Einfluss auf die Insulinresistenz und Glukosetoleranz haben. Außerdem zeigen klinische Studien, dass bei Anwenderinnen von Implanon NXT schmerzhafte Menstruationsblutungen (Dysmenorrhö) oft weniger ausgeprägt sind.
Resorption
Nach der Einlage des Implantats wird Etonogestrel rasch in den Blutkreislauf resorbiert. Ovulationshemmende Konzentrationen werden innerhalb eines Tages erreicht. Maximale Serumkonzentrationen (zwischen 472 und 1.270 pg/ml) werden innerhalb von 1 bis 13 Tagen erreicht. Die Wirkstofffreisetzung des Implantats sinkt mit der Zeit. Aus diesem Grund nehmen die Serumkonzentrationen während der ersten Monate schnell ab. Am Ende des ersten Jahres wird eine mittlere Konzentration von ca. 200 pg/ml (150‑261 pg/ml) gemessen, die bis Ende des dritten Jahres langsam auf 156 pg/ml (111‑202 pg/ml) absinkt. Die beobachteten Schwankungen der Serumkonzentrationen können teilweise auf unterschiedliches Körpergewicht zurückgeführt werden.
Verteilung
Etonogestrel wird zu 95,5‑99 % an Serumproteine, vorwiegend an Albumin und in geringerem Maße an sexualhormonbindendes Globulin, gebunden. Das zentrale bzw. gesamte Verteilungsvolumen beträgt 27 l bzw. 220 l und verändert sich während der gesamten Anwendungsdauer von Implanon NXT kaum.
Biotransformation
Etonogestrel unterliegt der Hydroxylierung und Reduktion. Die Metaboliten werden zu Sulfaten und Glukuroniden konjugiert. Tierstudien haben gezeigt, dass der enterohepatische Kreislauf wahrscheinlich nicht zur gestagenen Aktivität von Etonogestrel beiträgt.
Elimination
Nach intravenöser Anwendung von Etonogestrel beträgt die mittlere Eliminationshalbwertszeit ca. 25 Stunden und die Serumclearance liegt bei ca. 7,5 l/Stunde. Beide Parameter bleiben während der Anwendung von Implanon NXT konstant. Die Ausscheidung von Etonogestrel und dessen Metaboliten, in Form von freien Steroiden oder als Konjugate, erfolgt über den Urin und die Fäzes (Verhältnis 1,5 : 1). Nach Einlage bei stillenden Frauen wird während der ersten vier Monate Etonogestrel in einem Verhältnis der Milch-/Serumkonzentration von 0,44‑0,50 in die Muttermilch ausgeschieden. Bei stillenden Frauen beträgt der mittlere Übergang von Etonogestrel auf den Säugling ca. 0,2 % der geschätzten absoluten täglichen mütterlichen Dosis (2,2 % wenn sich die Werte pro kg Körpergewicht normalisiert haben). Die Konzentration zeigt eine graduelle, statistisch signifikante Abnahme über die Zeit der Anwendung.
In toxikologischen Studien wurden, unabhängig von der Art der Verabreichung, keine Effekte beobachtet außer jenen, die durch die hormonellen Eigenschaften von Etonogestrel erklärt werden können.
Implantat
Innen: 43 mg Poly(ethylen-co-vinylacetat) 28 % Vinylacetat, 15 mg Bariumsulfat, 0,1 mg Magnesiumstearat (Ph. Eur.).
Außen: 15 mg Poly(ethylen-co-vinylacetat) 15 % Vinylacetat.
Nicht zutreffend.
5 Jahre
Implanon NXT darf nach Ablauf des auf dem Behältnis angegebenen Verfalldatums nicht mehr eingelegt werden.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
In der Original-Blisterpackung aufbewahren.
Die Blisterpackung enthält 1 Implantat (4 cm Länge und 2 mm Durchmesser), das in einer rostfreien Stahlnadel eines gebrauchsfertigen, sterilen Einmalapplikators vorgeladen ist. Der Applikator, der das Implantat enthält, ist in einer Blisterpackung aus transparentem Polyethylenterephthalatglycol (PETG) verpackt, die mit einem Überzug aus High-Density-Polyethylen (HDPE) versiegelt ist. Der Inhalt der Blisterpackung ist steril, wenn die Packung nicht beschädigt oder geöffnet wurde.
Packungsgrößen: Faltschachtel mit 1 Blisterpackung, Faltschachtel mit 5 Blisterpackungen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Siehe Abschnitt 4.2.
Der Applikator ist zum einmaligen Gebrauch bestimmt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Organon Healthcare GmbH
Pestalozzistr. 31
80469 München
E-Mail: dpoc.germany@organon.com
44868.00.00
Datum der Erteilung der Zulassung: 15. Februar 1999
Datum der letzten Verlängerung der Zulassung: 2. August 2013
08/2025
Verschreibungspflichtig