Ofev® 25 mg Weichkapseln
Ofev® 100 mg Weichkapseln
Ofev® 150 mg Weichkapseln
Ofev 25 mg Weichkapseln
Eine Weichkapsel enthält 25 mg Nintedanib (als Esilat)
Sonstiger Bestandteil mit bekannter Wirkung
Jede 25 mg-Weichkapsel enthält 0,3 mg Phospholipide aus Sojabohnen.
Ofev 100 mg Weichkapseln
Eine Weichkapsel enthält 100 mg Nintedanib (als Esilat)
Sonstiger Bestandteil mit bekannter Wirkung
Jede 100 mg-Weichkapsel enthält 1,2 mg Phospholipide aus Sojabohnen.
Ofev 150 mg Weichkapseln
Eine Weichkapsel enthält 150 mg Nintedanib (als Esilat)
Sonstiger Bestandteil mit bekannter Wirkung
Jede 150 mg-Weichkapsel enthält 1,8 mg Phospholipide aus Sojabohnen.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Weichkapsel (Kapsel)
Ofev 25 mg Weichkapseln
Ofev 25 mg Weichkapseln sind orangefarbene, opake, ovale Weichgelatinekapseln (ca. 8 × 5 mm), mit dem schwarzen Aufdruck „25“ auf einer Seite.
Ofev 100 mg Weichkapseln
Ofev 100 mg Weichkapseln sind pfirsichfarbene, opake, längliche Weichgelatinekapseln (ca. 16 × 6 mm), auf einer Seite markiert mit dem Boehringer Ingelheim Firmensymbol und „100“.
Ofev 150 mg Weichkapseln
Ofev 150 mg Weichkapseln sind braune, opake, längliche Weichgelatinekapseln (ca. 18 × 7 mm), auf einer Seite markiert mit dem Boehringer Ingelheim Firmensymbol und „150“.
Ofev wird angewendet bei Erwachsenen zur Behandlung der idiopathischen Lungenfibrose (IPF).
Ofev wird außerdem angewendet bei Erwachsenen zur Behandlung anderer chronischer progredient fibrosierender interstitieller Lungenerkrankungen (ILDs) (siehe Abschnitt 5.1).
Ofev wird angewendet bei Kindern und Jugendlichen im Alter von 6 bis 17 Jahren zur Behandlung von klinisch signifikanten progredient fibrosierenden interstitiellen Lungenerkrankungen (ILDs) (siehe Abschnitte 4.2 und 5.1).
Ofev wird angewendet zur Behandlung einer interstitiellen Lungenerkrankung bei Erwachsenen, Jugendlichen und Kindern ab 6 Jahren mit systemischer Sklerose (SSc‑ILD).
Erwachsene: Die Behandlung sollte von Ärzten begonnen werden, die Erfahrung mit der Behandlung der Erkrankungen haben, für die Ofev zugelassen ist.
Kinder und Jugendliche: Die Behandlung sollte nur nach Einbeziehen eines multidisziplinären Teams (Ärzte, Radiologen, Pathologen) begonnen werden, die Erfahrung mit der Diagnose und Behandlung von fibrosierenden interstitiellen Lungenerkrankungen (ILDs) haben.
Dosierung
Erwachsene
Idiopathische Lungenfibrose (IPF)
Andere chronisch fibrosierende interstitielle Lungenerkrankungen (ILDs) mit progredientem Phänotyp
Interstitielle Lungenerkrankung bei systemischer Sklerose (SSc-ILD)
Die empfohlene Dosis beträgt 150 mg Nintedanib zweimal täglich, die im Abstand von ca. 12 Stunden eingenommen wird.
Die Anwendung der Dosis von 100 mg zweimal täglich wird nur bei Patienten empfohlen, die die Dosis von 150 mg zweimal täglich nicht tolerieren.
Wenn eine Einnahme versäumt wird, sollte die Einnahme zum nächsten geplanten Zeitpunkt mit der empfohlenen Dosis fortgesetzt werden. Wenn eine Einnahme versäumt wird, sollte der Patient keine zusätzliche Dosis einnehmen. Die empfohlene maximale Tagesdosis von 300 mg sollte nicht überschritten werden.
Dosisanpassungen
Neben einer gegebenenfalls indizierten symptomatischen Therapie können Nebenwirkungen von Ofev (siehe Abschnitte 4.4 und 4.8) durch Dosisreduktion oder vorübergehende Therapieunterbrechung behandelt werden, bis die spezifische Nebenwirkung so weit abgeklungen ist, dass eine Fortsetzung der Therapie möglich ist. Die Behandlung mit Ofev kann mit der vollen Dosis (150 mg zweimal täglich bei erwachsenen Patienten) oder einer reduzierten Dosis (100 mg zweimal täglich bei erwachsenen Patienten) wiederaufgenommen werden. Falls ein erwachsener Patient 100 mg zweimal täglich nicht verträgt, sollte die Behandlung mit Ofev abgebrochen werden.
Wenn Diarrhoe, Übelkeit und/oder Erbrechen trotz entsprechender unterstützender Therapiemaßnahmen (einschließlich einer antiemetischen Therapie) anhalten, kann eine Dosisreduktion oder eine Unterbrechung der Behandlung erforderlich sein. Die Behandlung kann mit einer reduzierten Dosis (100 mg zweimal täglich bei erwachsenen Patienten) oder der vollen Dosis (150 mg zweimal täglich bei erwachsenen Patienten) wiederaufgenommen werden. Bei anhaltender schwerer Diarrhoe, Übelkeit und/oder Erbrechen trotz symptomatischer Behandlung sollte die Therapie mit Ofev abgebrochen werden (siehe Abschnitt 4.4).
Bei Unterbrechungen der Behandlung aufgrund von Erhöhungen der Aspartat‑Aminotransferase (AST) oder Alanin‑Aminotransferase (ALT) auf > 3 × oberer Normgrenzwert (ULN, upper limit of normal) kann die Behandlung nach Rückgang der Transaminasen auf das Ausgangsniveau mit einer reduzierten Dosis von Ofev (100 mg zweimal täglich bei erwachsenen Patienten) wiederaufgenommen und die Dosis anschließend auf die volle Dosis (150 mg zweimal täglich bei erwachsenen Patienten) erhöht werden (siehe Abschnitte 4.4 und 4.8).
Spezielle Empfehlungen zur Dosisreduktion zum Umgang mit Nebenwirkungen bei Kindern und Jugendlichen sind in Tabelle 1 zu finden.
Kinder und Jugendliche im Alter von 6 bis 17 Jahren
Behandlung von klinisch signifikanten progredienten fibrosierenden interstitiellen Lungenerkrankungen (ILDs)
Behandlung der interstitieller Lungenerkrankung bei systemischer Sklerose (SSc-ILD)
Das Wachstum muss regelmäßig kontrolliert werden und eine Bewertung der Änderungen an den epiphysären Wachstumsfugen durch jährliche Knochenuntersuchungen mittels bildgebender Verfahren wird bei Patienten mit offenen Epiphysenfugen empfohlen. Eine Behandlungsunterbrechung sollte bei Patienten in Betracht gezogen werden, die Anzeichen von Wachstumsstörungen oder Änderungen an den epiphysären Wachstumsfugen entwickeln (siehe Abschnitte 4.4 und 4.8).
Bis zum Abschluss der Zahnentwicklung müssen regelmäßig, mindestens alle 6 Monate, orale Zahnuntersuchungen durchgeführt werden (siehe Abschnitte 4.4 und 4.8).
Die empfohlene Ofev-Dosis für Kinder und Jugendliche im Alter von 6 bis 17 Jahren basiert auf dem Gewicht des Patienten und wird zweimal täglich im Abstand von ca. 12 Stunden eingenommen (siehe Tabelle 1). Die Dosis ist im weiteren Behandlungsverlauf entsprechend dem Gewicht anzupassen.
Tabelle 1: Empfehlung zur Dosis und reduzierten Dosis von Ofev in Milligramm (mg) nach Körpergewicht in Kilogramm (kg) bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren
Gewichtsbereich |
Ofev-Dosis |
Reduzierte Dosis von Ofev* |
13,5**‑22,9 kg |
50 mg (zwei 25 mg-Kapseln) zweimal täglich |
25 mg (eine 25 mg-Kapsel) zweimal täglich |
23,0‑33,4 kg |
75 mg (drei 25 mg-Kapseln) zweimal täglich |
50 mg (zwei 25 mg-Kapseln) zweimal täglich |
33,5‑57,4 kg |
100 mg (eine 100 mg-Kapsel oder vier 25 mg-Kapseln) zweimal täglich |
75 mg (drei 25 mg-Kapseln) zweimal täglich |
57,5 kg und darüber |
150 mg (eine 150 mg-Kapsel oder sechs 25 mg-Kapseln) zweimal täglich |
100 mg (eine 100 mg-Kapsel oder vier 25 mg-Kapseln) zweimal täglich |
*Reduzierte Dosis wird empfohlen bei Kindern und Jugendlichen mit leichter Leberfunktionsstörung (Child Pugh A) und zum Umgang mit Nebenwirkungen bei pädiatrischen Patienten. Weitere Informationen zum Umgang mit Nebenwirkungen von Arzneimitteln finden Sie oben. | ||
**Gewicht unter 13,5 kg: | ||
Besondere Patientengruppen
Ältere Patienten (≥ 65 Jahre)
Für ältere Patienten wurden insgesamt keine Unterschiede bezüglich der Sicherheit und Wirksamkeit beobachtet. Bei älteren Patienten ist nicht grundsätzlich eine Dosisanpassung erforderlich. Bei Patienten ≥ 75 Jahren kann allerdings zum Umgang mit Nebenwirkungen eine Dosisreduktion erforderlich sein (siehe Abschnitt 5.2).
Nierenfunktionsstörung
Eine Anpassung der Anfangsdosis bei erwachsenen und pädiatrischen Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung ist nicht erforderlich. Die Sicherheit, Wirksamkeit und Pharmakokinetik von Nintedanib wurden bei erwachsenen und pädiatrischen Patienten mit schwerer Nierenfunktionsstörung (< 30 ml/min Kreatinin‑Clearance) nicht untersucht.
Leberfunktionsstörung
Bei erwachsenen Patienten mit leichter Leberfunktionsstörung (Child Pugh A) beträgt die empfohlene Dosis von Ofev 100 mg zweimal täglich im Abstand von ca. 12 Stunden. Bei pädiatrischen Patienten mit leichter Leberfunktionsstörung (Child Pugh A) wird eine reduzierte Anfangsdosis empfohlen (siehe Tabelle 1). Zur Behandlung von Nebenwirkungen sollte bei erwachsenen und pädiatrischen Patienten mit leichter Leberfunktionsstörung (Child Pugh A) eine Unterbrechung oder ein Absetzen der Therapie in Betracht gezogen werden.
Die Sicherheit und Wirksamkeit von Nintedanib wurden bei erwachsenen und pädiatrischen Patienten mit als Child Pugh B und C klassifizierter Leberfunktionsstörung nicht untersucht. Die Behandlung mit Ofev wird bei erwachsenen und pädiatrischen Patienten mit mittelschwerer (Child Pugh B) und schwerer (Child Pugh C) Leberfunktionsstörung nicht empfohlen (siehe Abschnitt 5.2).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Nintedanib wurden bei pädiatrischen Patienten unter 6 Jahren nicht untersucht. Daher wird die Behandlung von Kindern unter 6 Jahren mit Nintedanib nicht empfohlen. Nintedanib wurde nicht bei Patienten mit einem Gewicht von unter 13,5 kg untersucht und wird daher bei dieser Population nicht empfohlen (siehe Abschnitt 5.1).
Art der Anwendung
Ofev ist zum Einnehmen. Die Kapseln sollten zu einer Mahlzeit eingenommen werden; sie sollten im Ganzen mit Wasser geschluckt und nicht zerkaut werden. Die Kapsel darf nicht geöffnet oder zerkleinert werden (siehe Abschnitt 6.6). Ofev-Kapseln können mit einer kleinen Menge (ein Teelöffel) kalter oder auf Raumtemperatur gebrachter weicher Nahrung wie Apfelmus oder Schokoladenpudding eingenommen werden und müssen sofort unzerkaut geschluckt werden, um sicherzustellen, dass die Kapsel intakt bleibt.
Schwangerschaft (siehe Abschnitt 4.6)
Überempfindlichkeit gegen Nintedanib, Erdnuss oder Soja oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Erkrankungen des Gastrointestinaltrakts
Diarrhoe
In den klinischen Studien war Diarrhoe die häufigste gastrointestinale Nebenwirkung (siehe Abschnitt 4.8). Die Nebenwirkung war bei den meisten Patienten von leichter bis mittelschwerer Intensität und trat in den ersten 3 Behandlungsmonaten auf.
Nach Markteinführung wurden schwerwiegende Fälle von Diarrhoe, die zu Dehydratation und Elektrolytstörungen führten, berichtet. Die Patienten sollten bei den ersten Anzeichen mit ausreichender Flüssigkeitszufuhr und Antidiarrhoika, z. B. Loperamid, behandelt werden; die Diarrhoe kann eine Dosisreduktion oder Unterbrechung der Behandlung erfordern. Die Behandlung mit Ofev kann mit einer reduzierten Dosis oder der vollen Dosis wiederaufgenommen werden (siehe Abschnitt 4.2). Bei anhaltender schwerer Diarrhoe trotz symptomatischer Behandlung sollte die Therapie mit Ofev abgebrochen werden.
Übelkeit und Erbrechen
Übelkeit und Erbrechen waren häufig berichtete gastrointestinale Nebenwirkungen (siehe Abschnitt 4.8). Bei den meisten Patienten, die an Übelkeit und Erbrechen litten, waren diese Ereignisse von leichter bis mittelschwerer Intensität. In klinischen Studien führte Übelkeit bei bis zu 2,1 % der Patienten zum Abbruch der Behandlung mit Ofev, und Erbrechen führte bei bis zu 1,4 % der Patienten zum Abbruch der Behandlung mit Ofev.
Wenn die Symptome trotz entsprechender unterstützender Therapiemaßnahmen (einschließlich einer antiemetischen Therapie) anhalten, kann eine Dosisreduktion oder eine Unterbrechung der Behandlung erforderlich sein. Die Behandlung kann mit einer reduzierten Dosis oder der vollen Dosis wiederaufgenommen werden (siehe Abschnitt 4.2 „Dosisanpassungen“). Bei anhaltenden schweren Symptomen sollte die Therapie mit Ofev abgebrochen werden.
Leberfunktion
Die Sicherheit und Wirksamkeit von Ofev wurden bei Patienten mit mittelschwerer (Child Pugh B) und schwerer (Child Pugh C) Leberfunktionsstörung nicht untersucht. Daher wird die Behandlung mit Ofev bei solchen Patienten nicht empfohlen (siehe Abschnitt 4.2). Aufgrund erhöhter Exposition kann das Risiko für Nebenwirkungen bei Patienten mit leichter Leberfunktionsstörung (Child Pugh A) erhöht sein. Erwachsene Patienten mit leichter Leberfunktionsstörung (Child Pugh A) sollten mit einer reduzierten Dosis von Ofev behandelt werden (siehe Abschnitte 4.2 und 5.2).
Bei der Behandlung mit Nintedanib wurden Fälle arzneimittelbedingter Leberschäden beobachtet, darunter Fälle schwerer Leberschäden mit tödlichem Verlauf. Die meisten hepatischen Ereignisse traten innerhalb der ersten drei Behandlungsmonate auf. Daher sollten die Lebertransaminasen- und Bilirubinspiegel vor Beginn und im ersten Monat einer Behandlung mit Ofev überprüft werden. Danach sollten Patienten in den darauffolgenden zwei Behandlungsmonaten in regelmäßigen Abständen und anschließend periodisch (z. B. bei jedem Patientenbesuch oder wenn klinisch indiziert) überprüft werden.
Erhöhungen der Leberenzyme (ALT, AST, alkalische Phosphatase [AP] im Blut, Gamma-Glutamyltransferase [GGT], siehe Abschnitt 4.8) und des Bilirubins waren in den meisten Fällen nach Dosisreduktion oder Unterbrechung der Therapie reversibel. Wenn Transaminaseerhöhungen (AST oder ALT) von > 3 × ULN gemessen werden, wird eine Dosisreduktion oder Unterbrechung der Therapie mit Ofev empfohlen, und der Patient sollte engmaschig überwacht werden. Nach Rückgang der Transaminasen auf das Ausgangsniveau kann die Behandlung mit Ofev in der vollen Dosis wiederaufgenommen oder zunächst wieder mit einer reduzierten Dosis begonnen werden, die anschließend auf die volle Dosis erhöht werden kann (siehe Abschnitt 4.2 „Dosisanpassungen“). Bei jeglichen Erhöhungen von Leberwerten, die mit klinischen Anzeichen oder Symptomen eines Leberschadens, z. B. Gelbsucht, einhergehen, sollte die Behandlung mit Ofev dauerhaft abgesetzt werden. Andere Ursachen der Leberenzymerhöhungen sollten abgeklärt werden.
Erwachsene Patienten mit geringem Körpergewicht (< 65 kg), Patienten asiatischer Herkunft und Frauen haben ein höheres Risiko für eine Erhöhung der Leberenzyme. Die Plasmaspiegel von Nintedanib stiegen linear mit dem Patientenalter an, was ebenfalls zu einem höheren Risiko der Entwicklung von Leberenzymerhöhungen führen kann (siehe Abschnitt 5.2). Bei Patienten mit diesen Risikofaktoren wird eine engmaschige Überwachung empfohlen.
Nierenfunktion
Bei der Anwendung von Nintedanib wurde über Fälle von Nierenfunktionsstörungen bzw. Nierenversagen berichtet, von denen einige tödlich verliefen (siehe Abschnitt 4.8).
Während der Therapie mit Nintedanib sollten die Patienten überwacht werden, insbesondere solche Patienten, die Risikofaktoren für eine Nierenfunktionsstörung bzw. ein Nierenversagen aufweisen. Bei einer Nierenfunktionsstörung bzw. einem Nierenversagen ist eine Anpassung der Therapie in Erwägung zu ziehen (siehe Abschnitt 4.2 „Dosisanpassungen“).
Blutungen
Eine Hemmung des vaskulären endothelialen Wachstumsfaktorrezeptors (vascular endothelial growth factor receptor, VEGFR) ist möglicherweise mit einem erhöhten Blutungsrisiko verbunden.
Patienten mit bekanntem Blutungsrisiko, einschließlich Patienten mit erblich bedingter Blutungsneigung oder Patienten, die eine Vollantikoagulation erhalten, wurden in den klinischen Studien nicht eingeschlossen. Nach Markteinführung wurden nicht schwerwiegende und schwerwiegende Blutungsereignisse, von denen einige tödlich verliefen, berichtet (einschließlich Patienten mit oder ohne Behandlung mit Antikoagulanzien oder anderen Arzneimitteln, die Blutungen hervorrufen könnten). Daher sollten diese Patienten nur dann mit Ofev behandelt werden, wenn der voraussichtliche Nutzen das mögliche Risiko überwiegt.
Arterielle thromboembolische Ereignisse
Patienten mit kürzlich aufgetretenem Myokardinfarkt oder Schlaganfall wurden von den klinischen Studien ausgeschlossen.
In den klinischen Studien mit erwachsenen Patienten wurde über arterielle thromboembolische Ereignisse selten berichtet (in INPULSIS 2,5 % unter Ofev bzw. 0,7 % unter Placebo; in INBUILD 0,9 % unter Ofev bzw. 0,9 % unter Placebo und in SENSCIS 0,7 % unter Ofev bzw. 0,7 % unter Placebo). In den INPULSIS‑Studien erlitt in der Ofev-Gruppe ein höherer Prozentsatz der Patienten (1,6 %) einen Myokardinfarkt als in der Placebogruppe (0,5 %), wohingegen unerwünschte Ereignisse, die auf eine ischämische Herzerkrankung deuten, zwischen der Ofev- und der Placebogruppe ausgeglichen waren. In der INBUILD‑Studie war die Häufigkeit von Myokardinfarkten gering: 0,9 % unter Ofev und 0,9 % unter Placebo. In der SENSCIS‑Studie wurde Myokardinfarkt in der Placebogruppe mit geringer Häufigkeit (0,7 %) und in der Ofev-Gruppe nicht beobachtet.
Vorsicht ist geboten bei der Behandlung von Patienten mit einem höheren kardiovaskulären Risiko, einschließlich bekannter koronarer Herzkrankheit. Eine Behandlungsunterbrechung sollte bei Patienten in Betracht gezogen werden, die Anzeichen oder Symptome einer akuten myokardialen Ischämie entwickeln.
Aneurysmen und Arteriendissektionen
Die Verwendung von VEGF‑Signalweg-Hemmern bei Patienten mit oder ohne Hypertonie kann die Entstehung von Aneurysmen und/oder Arteriendissektionen begünstigen. Vor Beginn der Behandlung mit Ofev sollte dieses Risiko bei Patienten mit Risikofaktoren wie Hypertonie oder Aneurysmen in der Vorgeschichte sorgfältig abgewogen werden.
Venöse Thromboembolie
In den klinischen Studien wurde bei den mit Nintedanib behandelten Patienten kein erhöhtes Risiko für venöse Thromboembolien beobachtet. Bedingt durch den Wirkmechanismus von Nintedanib könnten Patienten ein erhöhtes Risiko für thromboembolische Ereignisse haben.
Gastrointestinale Perforationen und ischämische Kolitis
In den klinischen Studien mit erwachsenen Patienten kam es bei bis zu 0,3 % der Patienten in beiden Behandlungsgruppen zu einer Perforation. Bedingt durch den Wirkmechanismus von Nintedanib könnten Patienten ein erhöhtes Risiko für gastrointestinale Perforationen haben. Nach Markteinführung wurden Fälle von gastrointestinalen Perforationen und Fälle von ischämischer Kolitis berichtet, von denen einige tödlich verliefen. Besondere Vorsicht ist bei der Behandlung von Patienten mit vorangegangenen abdominalchirurgischen Eingriffen, früheren Magengeschwüren, Divertikulose oder bei gleichzeitiger Behandlung mit Corticosteroiden oder nichtsteroidalen Antirheumatika (NSAR) geboten. Mit der Einnahme von Ofev sollte frühestens 4 Wochen nach einer Bauchoperation begonnen werden. Die Therapie mit Ofev sollte bei Patienten, die eine gastrointestinale Perforation oder ischämische Kolitis entwickeln, dauerhaft abgesetzt werden. In Ausnahmefällen kann die Behandlung mit Ofev nach vollständigem Abklingen der ischämischen Kolitis sowie sorgfältiger Beurteilung des Zustands des Patienten und anderer Risikofaktoren wiederaufgenommen werden.
Nephrotische Proteinurie und thrombotische Mikroangiopathie
Nach der Markteinführung wurden sehr wenige Fälle von nephrotischer Proteinurie mit oder ohne Beeinträchtigung der Nierenfunktion gemeldet. Die histologischen Befunde stimmten in Einzelfällen mit einer glomerulären Mikroangiopathie mit oder ohne Thrombenbildung überein. Nach Absetzen von Ofev waren die Symptome reversibel, wobei in einigen Fällen eine anhaltende Proteinurie beobachtet wurde. Eine Behandlungsunterbrechung sollte bei Patienten in Betracht gezogen werden, die Anzeichen oder Symptome eines nephrotischen Syndroms entwickeln.
Die Anwendung von VEGF‑Signalweg-Hemmern wurde mit einer thrombotischen Mikroangiopathie (TMA) assoziiert, einschließlich sehr weniger Fallberichte für Nintedanib. Sollten bei einem Patienten, der Nintedanib erhält, mit einer TMA in Verbindung stehende Laborwerte oder klinische Befunde auftreten, ist die Behandlung mit Nintedanib abzusetzen und eine eingehende Untersuchung auf TMA durchzuführen.
Posteriores reversibles Enzephalopathiesyndrom (PRES)
Nach der Markteinführung wurden einige Fälle von posteriorem reversiblem Enzephalopathiesyndrom (PRES) gemeldet.
PRES ist eine neurologische Erkrankung (bestätigt mittels Magnetresonanztomographie), bei der Kopfschmerzen, Hypertonie, visuelle Störungen, Krämpfe, Lethargie, Verwirrtheit und andere visuelle sowie neurologische Störungen auftreten können, und die tödlich verlaufen kann. PRES wurde auch unter anderen VEGF-Inhibitoren berichtet.
Bei Verdacht auf ein PRES muss die Behandlung mit Nintedanib abgesetzt werden. Zur Wiederaufnahme der Nintedanib-Therapie bei Patienten, die zuvor ein PRES hatten, liegen keine Daten vor und die Entscheidung darüber obliegt dem behandelnden Arzt.
Hypertonie
Die Einnahme von Ofev kann zur Erhöhung des Blutdrucks führen. Der systemische Blutdruck sollte regelmäßig und wenn klinisch indiziert gemessen werden.
Pulmonale Hypertonie
Die Daten zur Anwendung von Ofev bei Patienten mit pulmonaler Hypertonie sind begrenzt.
Patienten mit signifikanter pulmonaler Hypertonie (Herzindex ≤ 2 l/min/m2, parenteral verabreichtes Epoprostenol/Treprostinil oder signifikante Rechtsherzinsuffizienz) waren von der INBUILD‑ und der SENSCIS‑Studie ausgeschlossen.
Ofev sollte bei Patienten mit schwerer pulmonaler Hypertonie nicht angewendet werden. Bei Patienten mit leichter bis mittelschwerer pulmonaler Hypertonie wird eine engmaschige Überwachung empfohlen.
Komplikationen bei der Wundheilung
In den klinischen Studien wurde keine erhöhte Häufigkeit von Wundheilungsstörungen beobachtet. Basierend auf dem Wirkmechanismus kann Nintedanib die Wundheilung beeinträchtigen. Es wurden keine speziellen Studien zur Untersuchung der Wirkung von Nintedanib auf die Wundheilung durchgeführt. Die Behandlung mit Ofev sollte daher nur eingeleitet oder im Falle einer perioperativen Unterbrechung wiederaufgenommen werden, wenn die Wundheilung klinisch als adäquat beurteilt wird.
Gleichzeitige Gabe mit Pirfenidon
In einer speziellen Pharmakokinetik (PK)-Studie wurde die gleichzeitige Behandlung mit Nintedanib und Pirfenidon bei Patienten mit IPF untersucht. Basierend auf diesen Ergebnissen gibt es keine Hinweise auf eine relevante pharmakokinetische Arzneimittelwechselwirkung zwischen Nintedanib und Pirfenidon, wenn diese in Kombination verabreicht wurden (siehe Abschnitt 5.2). Da die Sicherheitsprofile der beiden Arzneimittel ähnlich sind, ist mit weiteren Nebenwirkungen, einschließlich gastrointestinalen und hepatischen unerwünschten Ereignissen, zu rechnen. Das Nutzen-Risiko-Verhältnis der gleichzeitigen Behandlung mit Pirfenidon wurde nicht ermittelt.
Wirkung auf das QT‑Intervall
Im klinischen Studienprogramm wurden unter Nintedanib keine Anzeichen einer QT‑Verlängerung beobachtet (Abschnitt 5.1). Da einige andere Tyrosinkinaseinhibitoren bekanntlich eine Wirkung auf das QT‑Intervall ausüben, ist bei der Gabe von Nintedanib an Patienten, die eine QTc‑Verlängerung entwickeln können, Vorsicht geboten.
Allergische Reaktion
Diätetische Sojaprodukte sind bekannt dafür, dass sie bei Personen mit einer Sojaallergie allergische Reaktionen einschließlich einer schweren Anaphylaxie verursachen (siehe Abschnitt 4.3). Patienten mit bekannter Allergie gegen Erdnussprotein haben ein erhöhtes Risiko für schwere Reaktionen auf Sojapräparate.
Kinder und Jugendliche
Zur Anwendung von Nintedanib bei pädiatrischen Patienten liegen Daten lediglich zu einer kleinen Untergruppe von fibrosierenden interstitiellen Lungenerkrankungen vor (siehe Abschnitt 5.1). Diese Untergruppe deckt im Zusammenhang mit einer progredient fibrosierenden interstitiellen Lungenerkrankung bei pädiatrischen Patienten nicht alle Ätiologien ab.
Bei pädiatrischen Patienten besteht eine größere Unsicherheit bezüglich des Ausmaßes des Behandlungserfolgs als bei Erwachsenen.
Die oben für erwachsene Patienten aufgeführten Vorsichtsmaßnahmen müssen auch bei pädiatrischen Patienten befolgt werden.
Spezielle Empfehlungen zur Dosisreduktion bei Kindern und Jugendlichen, siehe Tabelle 1.
Besonderheiten bei Kindern und Jugendlichen sind wie folgt:
Knochenentwicklung und Wachstum
In präklinischen Studien wurden reversible Änderungen an den epiphysären Wachstumsfugen beobachtet (siehe Abschnitt 5.3). In der pädiatrischen klinischen Studie wurden während der Gabe von Nintedanib keine signifikanten Verminderungen der Wachstumsrate beobachtet. Allerdings sind keine Daten zur Langzeitsicherheit bei pädiatrischen Patienten verfügbar.
Das Wachstum muss regelmäßig kontrolliert werden und es wird empfohlen bei Patienten mit offenen Epiphysenfugen jährlich ein bildgebendes Verfahren zur Bewertung der Änderungen an den epiphysären Wachstumsfugens durchzuführen. Eine Behandlungsunterbrechung sollte bei Patienten in Betracht gezogen werden, die Anzeichen von Wachstumsstörungen oder Änderungen an den epiphysären Wachstumsfugen entwickeln.
Störungen bei der Zahnentwicklung
In präklinischen Studien wurden Störungen der Zahnentwicklung beobachtet (siehe Abschnitt 5.3). In der pädiatrischen klinischen Studie hat sich das Risiko von Zahnentwicklungsstörungen nicht bestätigt.
Als Vorsichtsmaßnahme müssen regelmäßig in Abständen von spätestens 6 Monaten Zahnuntersuchungen durchgeführt werden bis die Zahnentwicklung abgeschlossen ist.
P‑Glykoprotein (P‑gp)
Nintedanib ist ein P‑gp-Substrat (siehe Abschnitt 5.2). Die gleichzeitige Gabe des starken P‑gp‑Inhibitors Ketoconazol erhöhte die Plasmaspiegel von Nintedanib in einer speziellen Arzneimittelwechselwirkungsstudie auf das 1,61‑Fache bezogen auf die AUC und auf das 1,83‑Fache bezogen auf Cmax. In einer Arzneimittelwechselwirkungsstudie mit dem starken P‑gp-Induktor Rifampicin sanken die Plasmaspiegel von Nintedanib auf 50,3 % bezogen auf die AUC und auf 60,3 % bezogen auf Cmax bei gleichzeitiger Gabe mit Rifampicin im Vergleich zur alleinigen Gabe von Nintedanib. Bei gleichzeitiger Anwendung mit Ofev können starke P‑gp‑Inhibitoren (z. B. Ketoconazol, Erythromycin oder Ciclosporin) die Plasmaspiegel von Nintedanib erhöhen. In solchen Fällen sollten die Patienten engmaschig auf die Verträglichkeit von Nintedanib überwacht werden. Bei Nebenwirkungen kann eine Unterbrechung, Dosisreduktion oder ein Absetzen der Therapie mit Ofev erforderlich sein (siehe Abschnitt 4.2).
Starke P‑gp-Induktoren (z. B. Rifampicin, Carbamazepin, Phenytoin oder Johanniskraut) können die Plasmaspiegel von Nintedanib verringern. Die Wahl einer anderen Begleitmedikation, die kein oder ein minimales P‑gp-Induktionspotenzial besitzt, sollte in Betracht gezogen werden.
Cytochrom (CYP)-Enzyme
Die Biotransformation von Nintedanib erfolgt nur in geringem Umfang über CYP‑Stoffwechselwege. Nintedanib und dessen Metaboliten, der freie Säureanteil BIBF 1202 und dessen Glucuronid, zeigten in präklinischen Studien keine Inhibition oder Induktion von CYP‑Enzymen (siehe Abschnitt 5.2). Die Wahrscheinlichkeit von Arzneimittelwechselwirkungen mit Nintedanib basierend auf dem CYP‑Metabolismus wird daher als gering eingestuft.
Gleichzeitige Gabe mit anderen Arzneimitteln
Die gleichzeitige Gabe von Nintedanib und oralen hormonellen Kontrazeptiva hatte keinen nennenswerten Einfluss auf die Pharmakokinetik der oralen hormonellen Kontrazeptiva (siehe Abschnitt 5.2).
Die gleichzeitige Gabe von Nintedanib und Bosentan hatte keinen Einfluss auf die Pharmakokinetik von Nintedanib (siehe Abschnitt 5.2).
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
Frauen im gebärfähigen Alter/Kontrazeption
Nintedanib kann beim Menschen fetale Schäden verursachen (siehe Abschnitt 5.3). Frauen im gebärfähigen Alter sollten darauf hingewiesen werden, während der Behandlung mit Ofev eine Schwangerschaft zu vermeiden und zu Beginn, während der Behandlung und bis mindestens 3 Monate nach der letzten Dosis von Ofev sehr zuverlässige Verhütungsmethoden anzuwenden. Nintedanib hat keinen nennenswerten Einfluss auf die Plasmaspiegel von Ethinylestradiol und Levonorgestrel (siehe Abschnitt 5.2). Die Wirksamkeit oraler hormoneller Kontrazeptiva kann bei Erbrechen und/oder Diarrhoe sowie anderen Zuständen mit beeinträchtigter Resorption vermindert sein. Frauen, die orale hormonelle Kontrazeptiva einnehmen und bei denen solche Zustände auftreten, sollte geraten werden, eine andere sehr zuverlässige Verhütungsmethode anzuwenden.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Ofev bei Schwangeren vor. Präklinische tierexperimentelle Studien haben jedoch für diesen Wirkstoff eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Da Nintedanib auch beim Menschen fetale Schäden verursachen kann, darf es während der Schwangerschaft nicht angewendet werden (siehe Abschnitt 4.3). Vor der Behandlung mit Ofev muss ein Schwangerschaftstest durchgeführt werden, der während der Behandlung gegebenenfalls wiederholt wird.
Patientinnen sollten angewiesen werden, ihren Arzt oder Apotheker zu informieren, falls sie während der Therapie mit Ofev schwanger werden.
Wenn die Patientin während der Behandlung mit Ofev schwanger wird, ist die Behandlung abzubrechen und die Patientin sollte über die potenzielle Gefahr für den Fetus aufgeklärt werden.
Stillzeit
Es gibt keine Informationen darüber, ob Nintedanib und seine Metaboliten in die Muttermilch übergehen.
Präklinische Studien haben gezeigt, dass kleine Mengen von Nintedanib und seiner Metaboliten (≤ 0,5 % der verabreichten Dosis) in die Milch von säugenden Ratten übergingen. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden. Das Stillen soll während der Behandlung mit Ofev unterbrochen werden.
Fertilität
Präklinische Untersuchungen ergaben keine Hinweise auf eine Beeinträchtigung der männlichen Fertilität (siehe Abschnitt 5.3). Studien zur subchronischen und chronischen Toxizität bei Ratten ergaben keine Hinweise auf eine Beeinträchtigung der weiblichen Fertilität bei einer systemischen Exposition, die mit der Exposition der maximal empfohlenen Humandosis (maximum recommended human dose, MRHD) von 150 mg zweimal täglich vergleichbar war (siehe Abschnitt 5.3).
Ofev hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Patienten sollten darauf hingewiesen werden, während der Behandlung mit Ofev beim Führen eines Fahrzeugs oder Bedienen von Maschinen vorsichtig zu sein.
Zusammenfassung des Sicherheitsprofils
In klinischen Studien und laut Daten, die nach Markteinführung erhoben wurden, waren die häufigsten im Zusammenhang mit der Anwendung von Nintedanib berichteten Nebenwirkungen unter anderem Diarrhoe, Übelkeit und Erbrechen, Abdominalschmerz, Appetitverlust, Gewichtsverlust und erhöhte Leberenzyme.
Für die Behandlung ausgewählter Nebenwirkungen, siehe Abschnitt 4.4.
Tabellarische Zusammenfassung der Nebenwirkungen
Tabelle 2 ist eine Zusammenfassung der Nebenwirkungen nach MedDRA-Systemorganklassen (SOC) und ihrer Häufigkeit gemäß folgender Kategorien:
sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 2: Zusammenfassung der Nebenwirkungen nach Häufigkeitskategorie
Häufigkeit | |||
Systemorganklasse |
Idiopathische Lungenfibrose |
Andere chronische progredient fibrosierende ILDs |
Interstitielle Lungenerkrankung bei systemischer Sklerose |
Erkrankungen des Blutes und des Lymphsystems | |||
Thrombozytopenie |
Gelegentlich |
Gelegentlich |
Gelegentlich |
Stoffwechsel- und Ernährungsstörungen | |||
Gewichtsabnahme |
Häufig |
Häufig |
Häufig |
Appetit vermindert |
Häufig |
Sehr häufig |
Häufig |
Dehydratation |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Erkrankungen des Nervensystems | |||
Kopfschmerzen |
Häufig |
Häufig |
Häufig |
Posteriores reversibles Enzephalopathiesyndrom |
Nicht bekannt |
Nicht bekannt |
Nicht bekannt |
Herzerkrankungen | |||
Myokardinfarkt |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Gefäßerkrankungen | |||
Blutung (siehe Abschnitt 4.4) |
Häufig |
Häufig |
Häufig |
Hypertonie |
Gelegentlich |
Häufig |
Häufig |
Aneurysmen und Arteriendissektionen |
Nicht bekannt |
Nicht bekannt |
Nicht bekannt |
Erkrankungen des Gastrointestinaltrakts | |||
Diarrhoe |
Sehr häufig |
Sehr häufig |
Sehr häufig |
Übelkeit |
Sehr häufig |
Sehr häufig |
Sehr häufig |
Abdominalschmerz |
Sehr häufig |
Sehr häufig |
Sehr häufig |
Erbrechen |
Häufig |
Sehr häufig |
Sehr häufig |
Pankreatitis |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Kolitis |
Gelegentlich |
Gelegentlich |
Gelegentlich |
Leber- und Gallenerkrankungen | |||
Arzneimittelbedingter Leberschaden |
Gelegentlich |
Häufig |
Gelegentlich |
Leberenzym erhöht |
Sehr häufig |
Sehr häufig |
Sehr häufig |
Alanin-Aminotransferase (ALT) erhöht |
Häufig |
Sehr häufig |
Häufig |
Aspartat-Aminotransferase (AST) erhöht |
Häufig |
Häufig |
Häufig |
Gamma-Glutamyltransferase (GGT) erhöht |
Häufig |
Häufig |
Häufig |
Hyperbilirubinämie |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Alkalische Phosphatase (AP) im Blut erhöht |
Gelegentlich |
Häufig |
Häufig |
Erkrankungen der Haut und des Unterhautgewebes | |||
Ausschlag |
Häufig |
Häufig |
Gelegentlich |
Pruritus |
Gelegentlich |
Gelegentlich |
Gelegentlich |
Alopezie |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Erkrankungen der Nieren und Harnwege | |||
Nierenversagen (siehe Abschnitt 4.4) |
Nicht bekannt |
Nicht bekannt |
Gelegentlich |
Proteinurie |
Gelegentlich |
Gelegentlich |
Nicht bekannt |
Beschreibung ausgewählter Nebenwirkungen
Diarrhoe
In klinischen Studien (siehe Abschnitt 5.1) war Diarrhoe das am häufigsten berichtete gastrointestinale Ereignis. Bei den meisten Patienten war das Ereignis von leichter bis mittelschwerer Intensität. Mehr als zwei Drittel der Patienten, die Diarrhoe hatten, berichteten, dass diese bereits während der ersten drei Behandlungsmonate erstmals aufgetreten war. Bei den meisten Patienten wurde sie mit Antidiarrhoika, Dosisreduktion oder Behandlungsunterbrechung behandelt (siehe Abschnitt 4.4). Tabelle 3 enthält eine Übersicht über die berichteten Ereignisse von Diarrhoe in den klinischen Studien:
Tabelle 3: Diarrhoe in den klinischen Studien über 52 Wochen
INPULSIS |
INBUILD |
SENSCIS |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Diarrhoe |
18,4 % |
62,4 % |
23,9 % |
66,9 % |
31,6 % |
75,7 % |
Schwere Diarrhoe |
0,5 % |
3,3 % |
0,9 % |
2,4 % |
1,0 % |
4,2 % |
Diarrhoe mit nachfolgender Dosisreduktion von Ofev |
0 % |
10,7 % |
0,9 % |
16,0 % |
1,0 % |
22,2 % |
Diarrhoe mit nachfolgendem Absetzen von Ofev |
0,2 % |
4,4 % |
0,3 % |
5,7 % |
0,3 % |
6,9 % |
Leberenzym erhöht
In den INPULSIS‑Studien wurden Leberenzymerhöhungen (siehe Abschnitt 4.4) bei 13,6 % der mit Ofev und 2,6 % der mit Placebo behandelten Patienten berichtet. In der INBUILD‑Studie wurden Leberenzymerhöhungen bei 22,6 % der mit Ofev und 5,7 % der mit Placebo behandelten Patienten berichtet. In der SENSCIS‑Studie wurden Leberenzymerhöhungen bei 13,2 % der mit Ofev und 3,1 % der mit Placebo behandelten Patienten berichtet. Erhöhungen der Leberenzyme waren reversibel und nicht mit einer klinisch manifesten Lebererkrankung assoziiert.
Weitere Informationen zu besonderen Patientengruppen, empfohlenen Maßnahmen und Dosisanpassungen bei Diarrhoe und Erhöhung der Leberenzyme finden Sie zusätzlich in Abschnitt 4.4 bzw. 4.2.
Blutungen
In klinischen Studien war der Prozentsatz der Patienten, bei denen es zu Blutungen kam, bei mit Ofev behandelten Patienten geringfügig höher oder zwischen den Behandlungsgruppen vergleichbar (in INPULSIS 10,3 % unter Ofev bzw. 7,8 % unter Placebo; in INBUILD 11,1 % unter Ofev bzw. 12,7 % unter Placebo; in SENSCIS 11,1 % unter Ofev bzw. 8,3 % unter Placebo). Nicht schwerwiegende Epistaxis stellte das am häufigsten berichtete Blutungsereignis dar. Schwerwiegende Blutungsereignisse traten in beiden Behandlungsgruppen mit geringer Häufigkeit auf (in INPULSIS 1,3 % unter Ofev bzw. 1,4 % unter Placebo; in INBUILD 0,9 % unter Ofev bzw. 1,5 % unter Placebo; in SENSCIS 1,4 % unter Ofev bzw. 0,7 % unter Placebo).
Nach der Markteinführung berichtete Blutungsereignisse umfassen u. a. das gastrointestinale, respiratorische und zentralnervöse Organsystem, wobei gastrointestinale Blutungen am häufigsten sind (siehe Abschnitt 4.4).
Proteinurie
In klinischen Studien war der Prozentsatz der Patienten, bei denen es zu Proteinurie kam, niedrig und zwischen den Behandlungsgruppen vergleichbar (in INPULSIS 0,8 % unter Ofev bzw. 0,5 % unter Placebo; in INBUILD 1,5 % unter Ofev bzw. 1,8 % unter Placebo; in SENSCIS 1,0 % unter Ofev bzw. 0,0 % unter Placebo). Aus klinischen Studien liegen keine Berichte über das Auftreten eines nephrotischen Syndroms vor. Nach der Markteinführung wurden sehr wenige Fälle von nephrotischer Proteinurie mit oder ohne Beeinträchtigung der Nierenfunktion gemeldet. Die histologischen Befunde stimmten in Einzelfällen mit einer glomerulären Mikroangiopathie mit oder ohne Thrombenbildung überein. Nach Absetzen von Ofev waren die Symptome reversibel, wobei in einigen Fällen eine anhaltende Proteinurie beobachtet wurde. Eine Behandlungsunterbrechung sollte bei Patienten in Betracht gezogen werden, die Anzeichen oder Symptome eines nephrotischen Syndroms entwickeln (siehe Abschnitt 4.4).
Kinder und Jugendliche
Es gibt nur begrenzt Sicherheitsdaten für Nintedanib bei Kindern und Jugendlichen.
In einer randomisierten, doppelblinden, placebokontrollierten Studie über 24 Wochen, an die eine unverblindete Behandlung unterschiedlicher Dauer mit Nintedanib anschloss, wurden insgesamt 39 Patienten im Alter von 6 bis 17 Jahren behandelt (siehe Abschnitt 5.1). Übereinstimmend mit dem bekannten Sicherheitsprofil von erwachsenen Patienten mit IPF, anderen chronischen fibrosierenden ILDs mit progressivem Phänotyp und SSc‑ILD waren die häufigsten berichteten Nebenwirkungen unter Nintedanib während der placebokontrollierten Phase Diarrhoe (38,5 %), Erbrechen (26,9 %), Übelkeit (19,2 %), Abdominalschmerz (19,2 %) und Kopfschmerzen (11,5 %).
Unter Nintedanib berichtete Leber- und Gallenerkrankungen während der placebokontrollierten Phase waren Leberschaden (3,8 %) und erhöhter Leberfunktionstest (3,8 %). Aufgrund der begrenzten Daten ist nicht sicher, ob das Risiko für arzneimittelbedingte Leberschäden bei Kindern ähnlich ist wie bei Erwachsenen (siehe Abschnitt 4.4).
Aufgrund präklinischer Befunde wurden in der pädiatrischen klinischen Studie die Knochen, das Wachstum und die Zahnentwicklung hinsichtlich potenzieller Gefährdung überwacht (siehe Abschnitte 4.2, 4.4 und 5.3).
Der Anteil der Patienten mit behandlungsbedingten pathologischen Befunden in der epiphysären Wachstumsfuge, der in Woche 24 in allen Behandlungsgruppen vergleichbar war (7,7 % in beiden Behandlungsgruppen). Bis Woche 52 betrug der Anteil der Patienten mit pathologischen Befunden unter Nintedanib/Nintedanib: 11,5 % und unter Placebo/Nintedanib: 15,4 %.
Der Anteil der Patienten mit behandlungsbedingten pathologischen Befunden bei Zahn- oder bildgebenden Untersuchungen, der bis Woche 24 in der Nintedanib-Gruppe bei 46,2 % und in der Placebogruppe bei 38,5 % lag. Bis Woche 52 betrug der Anteil der Patienten mit pathologischen Befunden unter Nintedanib/Nintedanib: 50,0 % und unter Placebo/Nintedanib: 46,2 %.
Es sind keine Daten zur Langzeitsicherheit bei pädiatrischen Patienten verfügbar. Es bestehen Unklarheiten bezüglich der potenziellen Auswirkungen auf das Wachstum, die Zahnentwicklung, die Pubertät und das Risiko für Leberschäden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Es gibt kein spezifisches Antidot und keine spezifische Behandlung bei Überdosierung von Ofev. Zwei Patienten aus dem Onkologieprogramm erhielten bis zu acht Tage eine Überdosis von maximal 600 mg zweimal täglich. Die beobachteten Nebenwirkungen stimmten mit dem bekannten Sicherheitsprofil von Nintedanib überein; dies waren erhöhte Leberenzyme und gastrointestinale Symptome. Beide Patienten erholten sich von diesen Nebenwirkungen. In den INPULSIS‑Studien erhielt ein Patient versehentlich für insgesamt 21 Tage eine Dosis von 600 mg täglich. Im Zeitraum der fehlerhaften Dosierung trat ein nicht schwerwiegendes unerwünschtes Ereignis (Nasopharyngitis) auf und klang wieder ab. Das Auftreten weiterer Ereignisse wurde nicht berichtet. Bei Überdosierung sollte die Behandlung abgesetzt und gegebenenfalls allgemeine unterstützende Maßnahmen eingeleitet werden.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitoren, ATC‑Code: L01EX09
Wirkmechanismus
Nintedanib ist ein niedermolekularer Tyrosinkinaseinhibitor, der insbesondere folgende Rezeptoren hemmt: von Blutplättchen abgeleiteter Wachstumsfaktor-Rezeptor (platelet-derived growth factor receptor, PDGFR) α und ß, Fibroblasten-Wachstumsfaktor-Rezeptor (fibroblast growth factor receptor, FGFR) 1‑3 und VEGFR 1‑3. Darüber hinaus hemmt Nintedanib die Kinasen Lck (lymphocyte-specific tyrosine-protein kinase), Lyn (tyrosine-protein kinase lyn), Src (proto-oncogene tyrosine-protein kinase src) und CSF1R (colony stimulating factor 1 receptor). Nintedanib bindet kompetitiv an die Adenosintriphosphat (ATP)-Bindungstasche dieser Kinasen und blockiert so die intrazellulären Signalwege, die erwiesenermaßen an der Pathogenese fibrotischer Gewebeveränderungen bei interstitiellen Lungenerkrankungen beteiligt sind.
Pharmakodynamische Wirkungen
In-vitro-Studien mit Humanzellen haben gezeigt, dass Nintedanib Abläufe hemmt, die vermutlich am Einsetzen der fibrotischen Pathogenese, der Freisetzung profibrotischer Mediatoren aus Monozyten im peripheren Blut und der Polarisierung von Makrophagen mittels alternativem Aktivierungsweg beteiligt sind. Es wurde gezeigt, dass Nintedanib grundlegende Abläufe der Organfibrose, die Proliferation und Migration von Fibroblasten, die Umwandlung zum aktiven Myofibroblasten sowie die Sekretion extrazellulärer Matrix hemmt. In tierexperimentellen Studien wurde in verschiedenen Modellen zur IPF, SSc/SSc‑ILD, rheumatoiden Arthritis in Verbindung mit einer ILD (RA‑ILD) und zu anderen Organfibrosen gezeigt, dass Nintedanib entzündungshemmende und in Lunge, Haut, Herz, Niere und Leber antifibrotische Wirkungen hat. Nintedanib wirkte darüber hinaus auch auf die Gefäße. Es reduzierte die Apoptose mikrovaskulärer Endothelzellen in der Dermis und verzögerte Gefäßveränderungen in der Lunge, indem es die Proliferation der glatten Muskelzellen in den Gefäßen verminderte, die Dicke der Gefäßwände in den Lungen reduzierte und den Anteil verschlossener Lungengefäße senkte.
Klinische Wirksamkeit und Sicherheit
Idiopathische Lungenfibrose (IPF)
Die klinische Wirksamkeit von Nintedanib wurde bei IPF‑Patienten in zwei randomisierten, doppelblinden, placebokontrollierten Phase‑III-Studien mit identischem Design (INPULSIS‑1 [1199.32] und INPULSIS‑2 [1199.34]) untersucht. Patienten mit einem FVC‑Ausgangswert < 50 % des Sollwerts oder einem Ausgangswert < 30 % des Sollwerts der Kohlenmonoxid-Diffusionskapazität (DLCO, bezüglich Hämoglobin korrigiert) wurden von den Studien ausgeschlossen. Die Patienten wurden im Verhältnis 3:2 einer 52‑wöchigen Behandlung mit Ofev 150 mg zweimal täglich oder Placebo randomisiert zugeordnet.
Der primäre Endpunkt war die jährliche Abnahme der forcierten Vitalkapazität (FVC). Die wichtigsten sekundären Endpunkte waren die Veränderung des St. George’s Respiratory Questionnaire (SGRQ)-Gesamtscores gegenüber dem Ausgangswert nach 52 Wochen sowie die Zeit bis zur ersten akuten IPF‑Exazerbation.
Jährliche Rate der FVC‑Abnahme
Die jährliche Rate der FVC‑Abnahme (in ml) war bei den Patienten, die mit Nintedanib behandelt wurden, im Vergleich zu den Patienten, die Placebo erhielten, signifikant reduziert. Der Behandlungseffekt war in beiden Studien konsistent. Individuelle und gepoolte Ergebnisse der Studien sind der Tabelle 4 zu entnehmen.
Tabelle 4: Jährliche Rate der FVC-Abnahme (ml) in den Studien INPULSIS‑1, INPULSIS‑2 und deren gepoolte Daten – behandelte Population
INPULSIS‑1 |
INPULSIS‑2 |
INPULSIS‑1 und INPULSIS‑2 gepoolt |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Anzahl der analysierten Patienten |
204 |
309 |
219 |
329 |
423 |
638 |
Abnahmerate1 (SE) über 52 Wochen |
−239,9 (18,71) |
−114,7 (15,33) |
−207,3 (19,31) |
−113,6 (15,73) |
−223,5 (13,45) |
−113,6 (10,98) |
Vergleich vs. Placebo | ||||||
Unterschied1 |
125,3 |
93,7 |
109,9 |
|||
95 %‑KI |
(77,7; 172,8) |
(44,8; 142,7) |
(75,9; 144,0) |
|||
p‑Wert |
< 0,0001 |
0,0002 |
< 0,0001 |
|||
1 Schätzwert, basierend auf einem Regressionsmodell mit Zufallskoeffizient. | ||||||
In einer Sensitivitätsanalyse, die davon ausging, dass bei Patienten mit fehlenden Daten in Woche 52 die FVC‑Abnahme nach dem letzten beobachteten Wert die gleiche wäre wie bei allen Patienten unter Placebo, betrug der adjustierte Unterschied in der jährlichen Rate der Abnahme zwischen Nintedanib und Placebo 113,9 ml/Jahr (95 %‑KI 69,2; 158,5) in INPULSIS‑1 und 83,3 ml/Jahr (95 %‑KI 37,6; 129,0) in INPULSIS‑2.
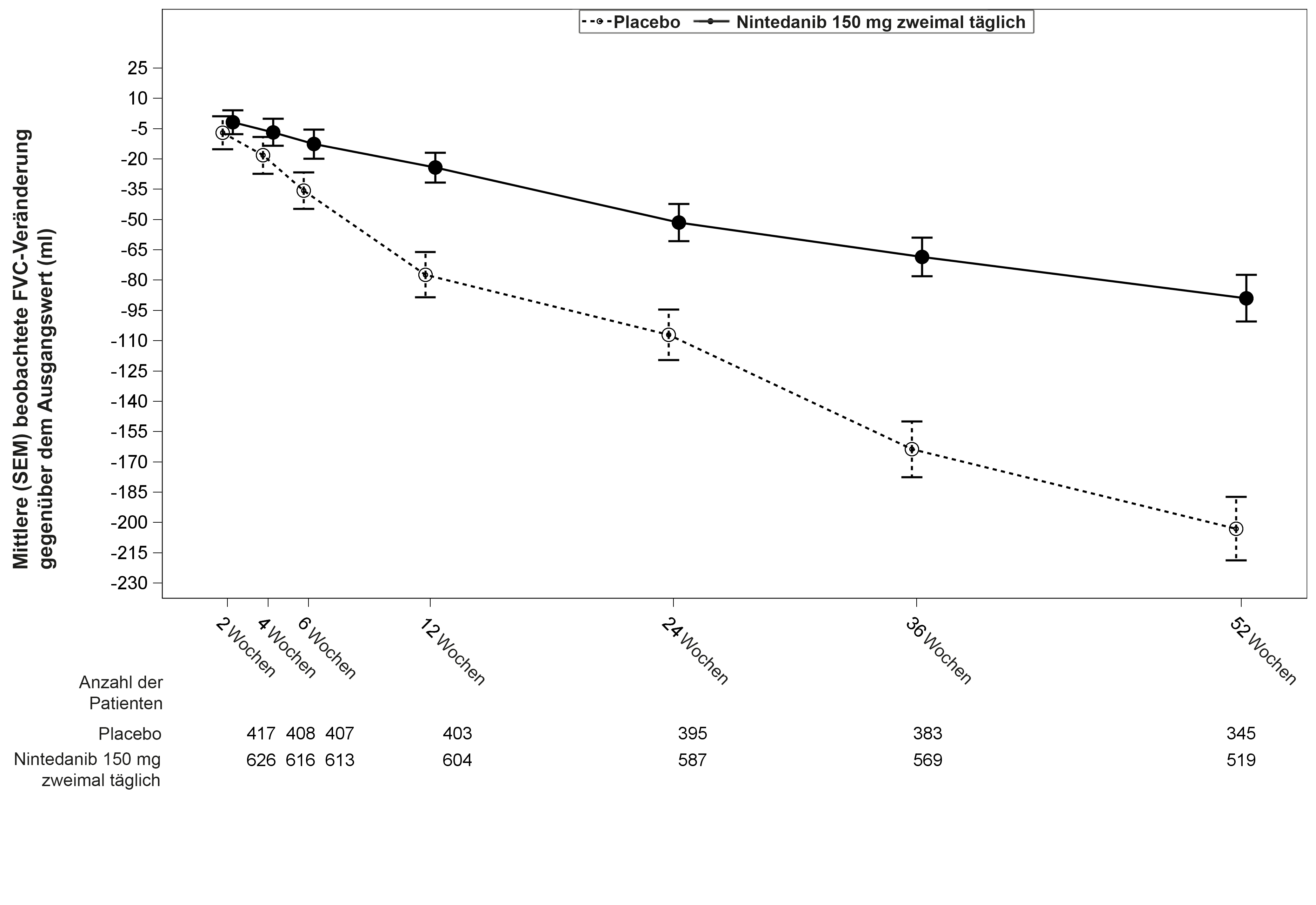
Abbildung 1 illustriert den zeitlichen Verlauf der Veränderungen gegenüber dem Ausgangswert für beide Behandlungsgruppen, auf Grundlage der gepoolten Analyse der Studien INPULSIS‑1 und INPULSIS‑2.
Abbildung 1: Mittlere (SEM) beobachtete FVC-Veränderung gegenüber dem Ausgangswert (ml) im Zeitverlauf, Studien INPULSIS‑1 und INPULSIS‑2 gepoolt
FVC‑Responder‑Analyse
In beiden INPULSIS‑Studien war der Anteil der FVC‑Responder, definiert als Patienten mit einer absoluten FVC‑Abnahme von maximal 5 % des Sollwerts (einem Schwellenwert für ein erhöhtes Mortalitätsrisiko bei IPF), in der Nintedanib-Gruppe signifikant höher als in der Placebogruppe. Ähnliche Ergebnisse wurden in Analysen mit einem konservativen Schwellenwert von 10 % beobachtet. Individuelle und gepoolte Ergebnisse der Studien sind der Tabelle 5 zu entnehmen.
Tabelle 5: Anteil der FVC-Responder nach 52 Wochen in den Studien INPULSIS‑1, INPULSIS‑2 und deren gepoolte Daten – behandelte Population
INPULSIS‑1 |
INPULSIS‑2 |
INPULSIS‑1 und INPULSIS‑2 gepoolt |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Anzahl der analysierten Patienten |
204 |
309 |
219 |
329 |
423 |
638 |
5 % Schwellenwert | ||||||
Anzahl (%) der FVC‑Responder1 |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53,0) |
Vergleich vs. Placebo | ||||||
Odds Ratio |
1,85 |
1,79 |
1,84 |
|||
95 %‑KI |
(1,28; 2,66) |
(1,26; 2,55) |
(1,43; 2,36) |
|||
p‑Wert2 |
0,0010 |
0,0011 |
< 0,0001 |
|||
10 % Schwellenwert | ||||||
Anzahl (%) der FVC‑Responder1 |
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
Vergleich vs. Placebo | ||||||
Odds Ratio |
1,91 |
1,29 |
1,58 |
|||
95 %‑KI |
(1,32; 2,79) |
(0,89; 1,86) |
(1,21; 2,05) |
|||
p‑Wert2 |
0,0007 |
0,1833 |
0,0007 |
|||
1 Responder sind Patienten mit absoluter FVC‑Abnahme von maximal 5 % oder 10 % des Sollwerts, je nach Schwellenwert und mit einer FVC‑Bestimmung nach 52 Wochen.
2 Basierend auf einer logistischen Regression.
Zeit bis zur Progression (≥ 10 % absolute Abnahme des FVC‑Sollwerts oder Tod)
In beiden INPULSIS‑Studien war das Progressionsrisiko bei den mit Nintedanib behandelten Patienten im Vergleich zu Placebo statistisch signifikant reduziert. In der gepoolten Analyse betrug die HR 0,60, was einer Reduktion des Progressionsrisikos um 40 % bei den mit Nintedanib behandelten Patienten im Vergleich zu Placebo entspricht.
Tabelle 6: Häufigkeit von Patienten mit absoluter FVC-Abnahme ≥ 10 % des Sollwerts oder Tod im Verlauf von 52 Wochen und Zeit bis zur Progression in den Studien INPULSIS‑1, INPULSIS‑2 und deren gepoolte Daten – behandelte Population
INPULSIS‑1 |
INPULSIS‑2 |
INPULSIS‑1 und INPULSIS‑2 gepoolt |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Anzahl Patienten unter Risiko |
204 |
309 |
219 |
329 |
423 |
638 |
Patienten mit Ereignissen, n (%) |
83 (40,7) |
75 |
92 |
98 |
175 |
173 |
Vergleich vs. Placebo1 | ||||||
p‑Wert2 |
0,0001 |
0,0054 |
< 0,0001 |
|||
Hazard Ratio3 |
0,53 |
0,67 |
0,60 |
|||
95 %‑KI |
(0,39; 0,72) |
(0,51; 0,89) |
(0,49; 0,74) |
|||
1 Basierend auf Daten bis Tag 372 (52 Wochen + Spanne von 7 Tagen). | ||||||
Änderung des SGRQ-Gesamtscores gegenüber dem Ausgangswert nach 52 Wochen
In der gepoolten Analyse der INPULSIS‑Studien lag der SGRQ-Ausgangswert in der Nintedanib-Gruppe bei 39,51 und in der Placebogruppe bei 39,58. Die geschätzte mittlere Änderung des SGRQ-Gesamtscores gegenüber dem Ausgangswert bis Woche 52 war in der Nintedanib-Gruppe geringer (3,53) als in der Placebogruppe (4,96), wobei der Unterschied zwischen den Behandlungsgruppen ‑1,43 betrug (95 %‑KI ‑3,09; 0,23; p = 0,0923). Insgesamt war die Wirkung von Nintedanib auf die mit dem SGRQ-Gesamtscore beurteilte gesundheitsbezogene Lebensqualität moderat, was auf eine gegenüber Placebo geringere Verschlechterung hindeutet.
Zeit bis zur ersten akuten IPF‑Exazerbation
In der gepoolten Analyse der INPULSIS‑Studien wurde bei Patienten unter Nintedanib ein im Vergleich zu Placebo numerisch geringeres Risiko für eine erste akute Exazerbation beobachtet. Individuelle und gepoolte Ergebnisse der Studien sind der Tabelle 7 zu entnehmen.
Tabelle 7: Häufigkeit von Patienten mit akuten IPF‑Exazerbationen im Verlauf von 52 Wochen und Analyse der Zeit bis zur ersten Exazerbation, basierend auf vom Prüfarzt berichteten Ereignissen in den Studien INPULSIS‑1, INPULSIS‑2 und deren gepoolte Daten – behandelte Population
INPULSIS‑1 |
INPULSIS‑2 |
INPULSIS‑1 und INPULSIS‑2 gepoolt |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Anzahl Patienten unter Risiko |
204 |
309 |
219 |
329 |
423 |
638 |
Patienten mit Ereignissen, n (%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
Vergleich vs. Placebo1 | ||||||
p‑Wert2 |
0,6728 |
0,0050 |
0,0823 |
|||
Hazard Ratio3 |
1,15 |
0,38 |
0,64 |
|||
95 %‑KI |
(0,54; 2,42) |
(0,19; 0,77) |
(0,39; 1,05) |
|||
1 Basierend auf Daten bis Tag 372 (52 Wochen + Spanne von 7 Tagen). | ||||||
In einer präspezifizierten Sensitivitätsanalyse war der Prozentsatz der Patienten mit mindestens einer adjudizierten Exazerbation innerhalb von 52 Wochen in der Nintedanib-Gruppe geringer (1,9 % der Patienten) als in der Placebogruppe (5,7 % der Patienten). Die gepoolte Analyse der Zeit bis zur ersten adjudizierten Exazerbation ergab eine Hazard Ratio (HR) von 0,32 (95 %‑KI 0,16; 0,65; p = 0,0010).
Überlebensanalyse
In der präspezifizierten gepoolten Analyse der Überlebensdaten der INPULSIS‑Studien war die Gesamtmortalität im Verlauf von 52 Wochen in der Nintedanib-Gruppe geringer (5,5 %) als in der Placebogruppe (7,8 %). Die Analyse der Zeit bis zum Tod ergab eine HR von 0,70 (95 %‑KI 0,43; 1,12; p = 0,1399). Die Ergebnisse aller Überlebensendpunkte (z. B. Mortalität während der Behandlung, respiratorisch bedingte Mortalität) zeigten einen konsistenten numerischen Unterschied zugunsten von Nintedanib.
Tabelle 8: Gesamtmortalität im Verlauf von 52 Wochen in den Studien INPULSIS‑1, INPULSIS‑2 und deren gepoolte Daten – behandelte Population
INPULSIS‑1 |
INPULSIS‑2 |
INPULSIS‑1 und INPULSIS‑2 gepoolt |
||||
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
Anzahl Patienten unter Risiko |
204 |
309 |
219 |
329 |
423 |
638 |
Patienten mit Ereignissen, n (%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
Vergleich vs. Placebo1 | ||||||
p‑Wert2 |
0,2880 |
0,2995 |
0,1399 |
|||
Hazard Ratio3 |
0,63 |
0,74 |
0,70 |
|||
95 %‑KI |
(0,29; 1,36) |
(0,40; 1,35) |
(0,43; 1,12) |
|||
1 Basierend auf Daten bis Tag 372 (52 Wochen + Spanne von 7 Tagen). | ||||||
Langzeitbehandlung mit Ofev bei Patienten mit IPF (INPULSIS‑ON)
Eine unverblindete Verlängerungsstudie zu Ofev umfasste 734 Patienten mit IPF. Patienten, die den 52‑wöchigen Behandlungszeitraum einer INPULSIS‑Studie abgeschlossen hatten, erhielten im Rahmen der Verlängerungsstudie INPULSIS‑ON unverblindet Ofev. Die mediane Expositionsdauer der Patienten, die im Rahmen der INPULSIS‑Studien und in der Verlängerungsstudie (INPULSIS‑ON) mit Ofev behandelt wurden, betrug 44,7 Monate (Bereich 11,9‑68,3). Die explorativen Wirksamkeitsendpunkte umfassten die jährliche Rate der FVC‑Abnahme über 192 Wochen. Diese betrug bei allen behandelten Patienten ‑135,1 (5,8) ml/Jahr und stimmte mit der jährlichen Rate der FVC‑Abnahme, die im Rahmen der INPULSIS‑Phase‑III-Studien bei den mit Ofev behandelten Patienten ermittelt wurde, überein (‑113,6 ml/Jahr). Das Profil der unerwünschten Ereignisse, die in INPULSIS‑ON unter Ofev beobachtet wurden, entsprach dem in den INPULSIS‑Phase‑III-Studien.
Patienten mit IPF und fortgeschrittener Lungenfunktionseinschränkung (INSTAGE)
INSTAGE war eine multizentrische, multinationale, prospektive, randomisierte, doppelblinde, klinische Parallelgruppenstudie über 24 Wochen bei Patienten mit IPF und fortgeschrittener Lungenfunktionseinschränkung (DLCO ≤ 35 % des Sollwerts). 136 Patienten erhielten Ofev als Monotherapie. Das Ergebnis für den primären Endpunkt zeigte eine Reduktion des SGRQ‑Gesamtscores um ‑0,77 Einheiten in Woche 12, berechnet als die adjustierte mittlere Veränderung gegenüber dem Ausgangswert. Ein Post‑hoc-Vergleich ergab, dass die Abnahme der FVC bei diesen Patienten mit der Abnahme der FVC bei Patienten mit weniger weit fortgeschrittener Erkrankung, die in den INPULSIS‑Studien der Phase III mit Ofev behandelt wurden, übereinstimmte.
Das Sicherheits‑ und Verträglichkeitsprofil von Ofev bei Patienten mit IPF und fortgeschrittener Lungenfunktionseinschränkung stimmte mit dem in den INPULSIS‑Studien der Phase III beobachteten Profil überein.
Weitere Daten aus der Phase IV‑Studie INJOURNEY mit zweimal täglicher Gabe von 150 mg Ofev und zusätzlich Pirfenidon
Die gleichzeitige Behandlung mit Nintedanib und Pirfenidon wurde in einer explorativen, unverblindeten, randomisierten Studie zur zweimal täglichen Gabe von 150 mg Nintedanib und zusätzlich Pirfenidon (Titration auf 801 mg dreimal täglich) im Vergleich zur alleinigen Gabe von 150 mg Nintedanib zweimal täglich bei 105 randomisierten Patienten über einen Zeitraum von 12 Wochen untersucht. Der primäre Endpunkt war der Prozentsatz der Patienten mit gastrointestinalen unerwünschten Ereignissen von Studienbeginn bis Woche 12. Gastrointestinale unerwünschte Ereignisse traten häufig auf, was mit dem belegten Sicherheitsprofil für jede der Substanzen übereinstimmt. Diarrhoe, Übelkeit und Erbrechen waren die häufigsten unerwünschten Ereignisse, die bei Patienten nach Behandlung mit Pirfenidon zusätzlich zu Nintedanib versus Nintedanib allein gemeldet wurden.
Die mittleren (SE) absoluten Veränderungen der FVC zwischen Studienbeginn und Woche 12 betrugen ‑13,3 (17,4) ml bei den mit Nintedanib plus Pirfenidon behandelten Patienten (n = 48) im Vergleich zu ‑40,9 (31,4) ml bei Patienten, die nur Nintedanib erhielten (n = 44).
Andere chronische progredient fibrosierende interstitielle Lungenerkrankungen (ILDs)
Die klinische Wirksamkeit von Ofev wurde bei Patienten mit anderen chronischen progredient fibrosierenden ILDs in einer doppelblinden, randomisierten, placebokontrollierten Phase‑III-Studie (INBUILD) untersucht. Patienten mit IPF waren ausgeschlossen. Patienten mit klinisch diagnostizierter chronischer fibrosierender ILD wurden ausgewählt, wenn ihr HRCT-Scan bedeutsame Fibrose (mehr als 10 % fibrotische Merkmale) ergab und sie klinische Anzeichen für eine Progression zeigten (definiert als FVC‑Abnahme ≥ 10 %, FVC‑Abnahme ≥ 5 % und < 10 % mit Verschlechterung der Symptomatik oder des Bildgebungsbefunds oder aber Verschlechterung der Symptomatik und des Bildgebungsbefunds, alle in den 24 Monaten vor dem Screening). Die Patienten mussten eine FVC größer oder gleich 45 % des Sollwerts und eine DLCO von 30 % bis unter 80 % des Sollwerts aufweisen. Bei den Patienten musste außerdem trotz einer Behandlung, die für die einschlägige ILD des Patienten als in der klinischen Praxis angemessen beurteilt wurde, eine Krankheitsprogression vorliegen.
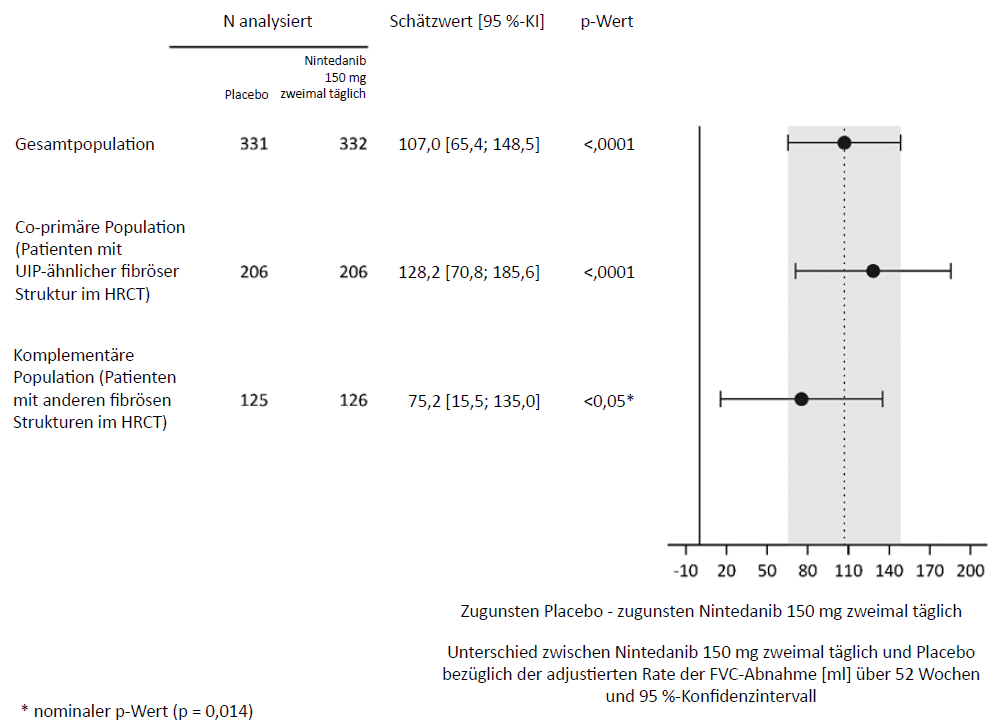
Insgesamt 663 Patienten wurden im Verhältnis 1:1 einer mindestens 52‑wöchigen Behandlung mit Ofev 150 mg zweimal täglich oder entsprechendem Placebo randomisiert zugeordnet. Die mediane Exposition gegenüber Ofev über die gesamte Studie betrug 17,4 Monate und die mittlere Exposition gegenüber Ofev über die gesamte Studie 15,6 Monate. Die Randomisierung war nach der durch zentrale Auswerter beurteilten fibrösen Struktur im hochauflösenden Computertomogramm (HRCT) stratifiziert. Danach wurden 412 Patienten mit UIP (usual interstitial pneumonia)-ähnlicher fibröser Struktur im HRCT und 251 Patienten mit anderen fibrösen Strukturen im HRCT randomisiert. Für die Analysen in dieser Studie wurden zwei co-primäre Populationen festgelegt: alle Patienten (die Gesamtpopulation) sowie Patienten mit UIP‑ähnlicher fibröser Struktur im HRCT. Patienten mit anderen fibrösen Strukturen im HRCT stellten die „komplementäre“ Population dar.
Der primäre Endpunkt war die jährliche Abnahme der forcierten Vitalkapazität (FVC, in ml) über 52 Wochen. Die wichtigsten sekundären Endpunkte waren die absolute Veränderung des King's Brief Interstitial Lung Disease Questionnaire (K‑BILD)-Gesamtscores gegenüber dem Ausgangswert nach 52 Wochen, die Zeit bis zur ersten akuten ILD‑Exazerbation oder bis zum Tod über 52 Wochen sowie die Zeit bis zum Tod über 52 Wochen.
Die Patienten hatten ein mittleres (Standardabweichung [SD; Min‑Max]) Alter von 65,8 (9,8; 27‑87) Jahren und einen mittleren FVC‑Sollwert von 69,0 % (15,6; 42‑137). Die zugrundeliegenden klinischen ILD‑Diagnosen in den in der Studie dargestellten Gruppen waren Überempfindlichkeitspneumonitis (26,1 %), autoimmune ILDs (25,6 %), idiopathische unspezifische interstitielle Pneumonie (18,9 %), nicht klassifizierbare idiopathische interstitielle Pneumonie (17,2 %) und andere ILDs (12,2 %).
Die INBUILD‑Studie war weder dafür konzipiert noch darauf ausgelegt, Evidenzdaten für einen Nutzen von Nintedanib in spezifischen diagnostischen Subgruppen zu liefern. Einheitliche Wirkungen wurden in nach ILD‑Diagnosen eingeteilten Subgruppen nachgewiesen. Die Erfahrungen mit Nintedanib bei sehr seltenen progredient fibrosierenden ILDs sind begrenzt.
Jährliche Rate der FVC‑Abnahme
Die jährliche Rate der FVC‑Abnahme (in ml) über 52 Wochen war bei Patienten unter Ofev im Vergleich zu Patienten unter Placebo um 107,0 ml signifikant reduziert (Tabelle 9), was einem relativen Behandlungseffekt von 57,0 % entspricht.
Tabelle 9: Jährliche Rate der FVC-Abnahme (ml) über 52 Wochen
Placebo |
Ofev |
|
Anzahl der analysierten Patienten |
331 |
332 |
Abnahmerate1 (SE) über 52 Wochen |
‑187,8 (14,8) |
‑80,8 (15,1) |
Vergleich vs. Placebo | ||
Unterschied1 |
107,0 |
|
95 %‑KI |
(65,4; 148,5) |
|
p‑Wert |
< 0,0001 |
|
1 Basierend auf einem Regressionsmodell mit Zufallskoeffizient mit festen kategorischen Effekten für Behandlung, HRCT‑Struktur, festen kontinuierlichen Zeiteffekten, FVC‑Ausgangswert [ml] und unter Berücksichtigung von zeitbezogenen Behandlungseffekten und zeitbezogenen Ausgangseffekten
Vergleichbare Ergebnisse wurden in der co-primären Population von Patienten mit UIP‑ähnlicher fibröser Struktur im HRCT beobachtet. Der Behandlungseffekt war in der komplementären Population von Patienten mit anderen fibrösen Strukturen im HRCT konsistent (p‑Wert für den Effekt 0,2268) (Abbildung 2).
Abbildung 2 Forest-Plot der jährlichen Rate der FVC-Abnahme (ml) über 52 Wochen in den Patientenpopulationen
Die Ergebnisse der Wirkung von Ofev hinsichtlich der Reduzierung der Rate der jährlichen FVC‑Abnahme wurden in allen präspezifizierten Sensitivitätsanalysen bestätigt, und die Ergebnisse in den präspezifizierten Wirksamkeits-Subgruppen nach Geschlecht, Altersgruppe, ethnischer Zugehörigkeit, FVC‑Ausgangswert in Prozent des Sollwerts und ursprünglich zugrundeliegender klinischer ILD‑Diagnose in den Gruppen waren konsistent.
Abbildung 3 illustriert den zeitlichen Verlauf der FVC‑Veränderung gegenüber dem Ausgangswert für die Behandlungsgruppen.
Abbildung 3 Mittlere (SEM) beobachtete FVC-Veränderung gegenüber dem Ausgangswert (ml) über 52 Wochen
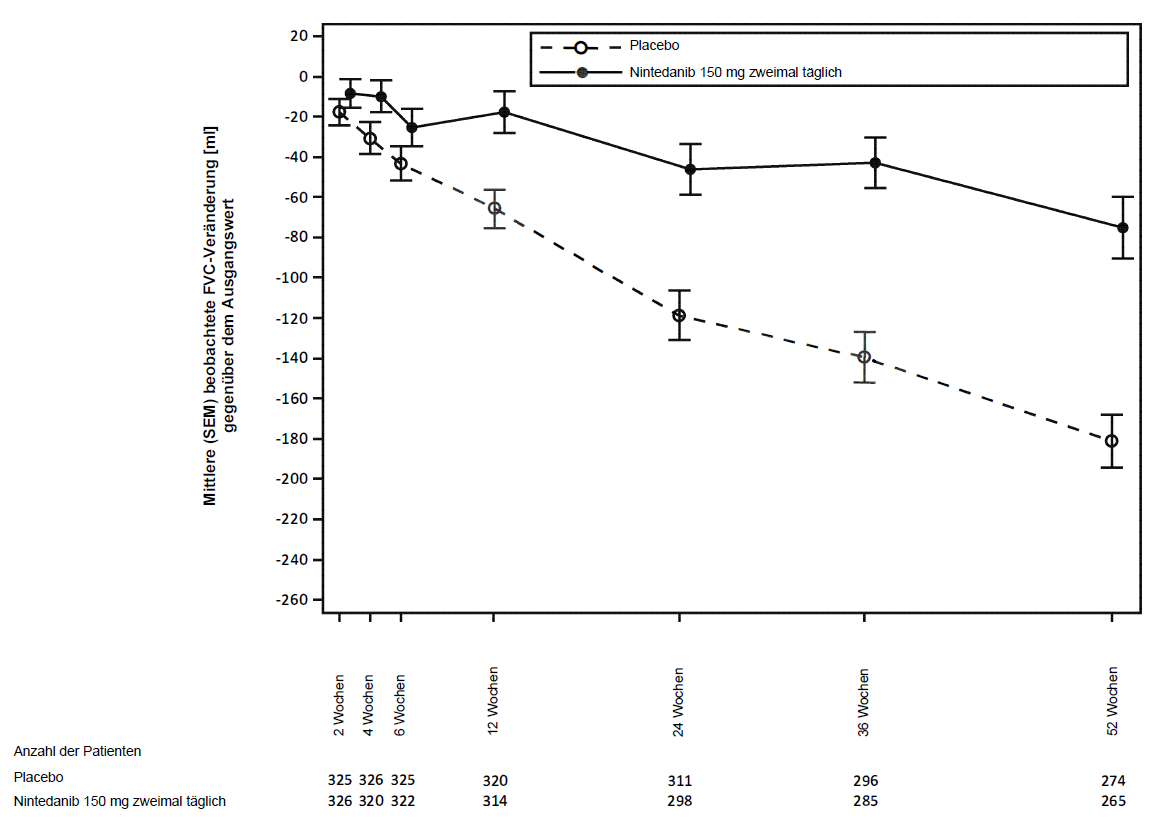
Darüber hinaus wurden positive Wirkungen von Ofev auf den adjustierten Mittelwert der absoluten Veränderung des FVC‑Sollwerts in Woche 52 gegenüber dem Ausgangswert beobachtet. Der adjustierte Mittelwert der absoluten Veränderung des FVC‑Sollwerts bis Woche 52 gegenüber dem Ausgangswert war in der Nintedanib-Gruppe niedriger (‑2,62 %) als in der Placebogruppe (‑5,86 %). Der adjustierte mittlere Unterschied zwischen den Behandlungsgruppen betrug 3,24 (95 %‑KI 2,09; 4,40; nominaler p‑Wert < 0,0001).
FVC‑Responder-Analyse
Der Anteil der FVC‑Responder, definiert als Patienten mit einer relativen FVC‑Abnahme von maximal 5 % des Sollwerts, war in der Ofev-Gruppe höher als in der Placebogruppe. Ähnliche Ergebnisse wurden in Analysen mit einem Schwellenwert von 10 % beobachtet (Tabelle 10).
Tabelle 10: Anteil der FVC-Responder nach 52 Wochen in der INBUILD‑Studie
Placebo |
Ofev |
|
Anzahl der analysierten Patienten |
331 |
332 |
5 % Schwellenwert | ||
Anzahl (%) der FVC‑Responder1 |
104 (31,4) |
158 (47,6) |
Vergleich vs. Placebo | ||
Odds Ratio² |
2,01 |
|
95 %‑KI |
(1,46; 2,76) |
|
Nominaler p‑Wert |
< 0,0001 |
|
10 % Schwellenwert | ||
Anzahl (%) der FVC‑Responder1 |
169 (51,1) |
197 (59,3) |
Vergleich vs. Placebo | ||
Odds Ratio² |
1,42 |
|
95 %‑KI |
(1,04; 1,94) |
|
Nominaler p‑Wert |
0,0268 |
|
1 Responder sind Patienten mit relativer FVC‑Abnahme von maximal 5 % oder 10 % des Sollwerts, je nach Schwellenwert und mit einer FVC‑Bestimmung nach 52 Wochen (Patienten mit fehlenden Daten in Woche 52 wurden als Non-Responder eingestuft).
2 Basierend auf einem logistischen Regressionsmodell mit dem FVC‑Ausgangswert [% des Sollwerts] als kontinuierlicher Kovariate und der HRCT‑Struktur als binärer Kovariate.
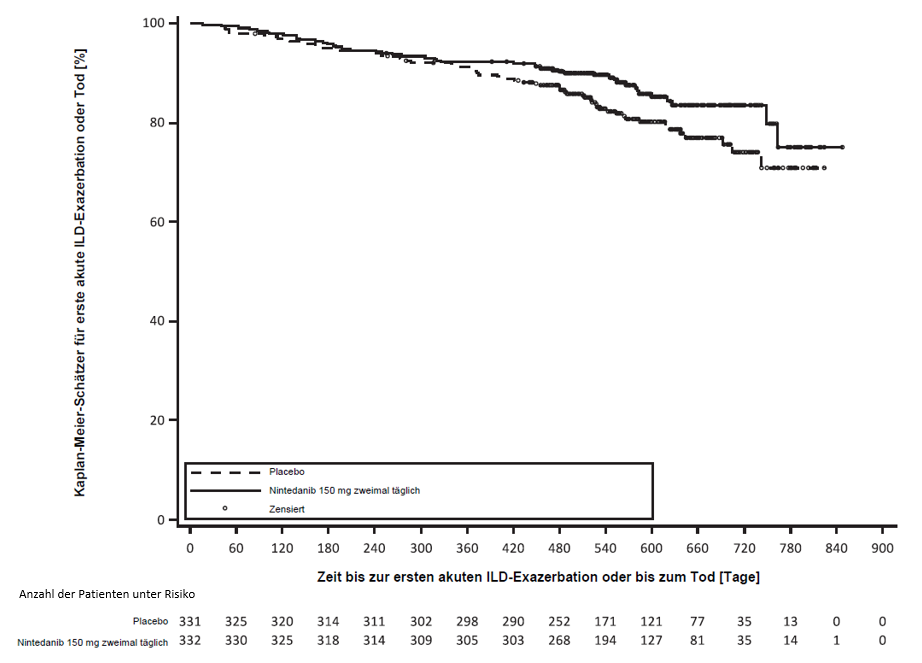
Zeit bis zur ersten akuten ILD‑Exazerbation oder bis zum Tod
Über die gesamte Studie betrug der Anteil der Patienten mit mindestens einem Ereignis einer ersten akuten ILD‑Exazerbation oder Tod in der Ofev-Gruppe 13,9 % und in der Placebogruppe 19,6 %. Die HR betrug 0,67 (95 %‑KI 0,46; 0,98; nominaler p‑Wert = 0,0387), was auf eine Senkung des Risikos für eine erste akute ILD‑Exazerbation oder Tod von 33 % bei Patienten unter Ofev verglichen mit Patienten unter Placebo hindeutet (Abbildung 4).
Abbildung 4 Kaplan-Meier-Plot der Zeit bis zur ersten akuten ILD-Exazerbation oder bis zum Tod über die gesamte Studie
Überlebensanalyse
Das Sterberisiko war in der Ofev-Gruppe niedriger als in der Placebogruppe. Die HR betrug 0,78 (95 %‑KI 0,50; 1,21; nominaler p‑Wert = 0,2594), was eine Senkung des Sterberisikos bei Patienten unter Ofev um 22 % verglichen mit Patienten unter Placebo erkennen ließ.
Zeit bis zur Progression (≥ 10 % absolute Abnahme des FVC‑Sollwerts) oder bis zum Tod
In der INBUILD‑Studie war das Progressionsrisiko (≥ 10 % absolute Abnahme des FVC‑Sollwerts) bzw. Sterberisiko bei den mit Ofev behandelten Patienten reduziert. Der Anteil der Patienten mit einem Ereignis betrug in der Ofev-Gruppe 40,4 % und in der Placebogruppe 54,7 %. Die HR betrug 0,66 (95 %‑KI 0,53; 0,83; p = 0,0003), was auf eine Senkung des Progressionsrisikos (≥ 10 % absolute Abnahme des FVC‑Sollwerts) bzw. Sterberisikos um 34 % bei den mit Ofev behandelten Patienten im Vergleich zu den Patienten unter Placebo hindeutet.
Lebensqualität
Die adjustierte mittlere Veränderung des K‑BILD‑Gesamtscores in Woche 52 gegenüber dem Ausgangswert betrug ‑0,79 Einheiten in der Placebogruppe und 0,55 in der Ofev-Gruppe. Der Unterschied zwischen den Behandlungsgruppen lag bei 1,34 (95 %‑KI ‑0,31; 2,98; nominaler p‑Wert = 0,1115).
Der adjustierte Mittelwert der absoluten Veränderung des L‑PF (Living with Pulmonary Fibrosis)-Symptomscores für den Bereich Dyspnoe in Woche 52 gegenüber dem Ausgangswert betrug in der Ofev-Gruppe 4,28 verglichen mit 7,81 in der Placebogruppe. Der adjustierte mittlere Unterschied zwischen den Gruppen lag bei ‑3,53 zugunsten von Ofev (95 %‑KI ‑6,14; ‑0,92; nominaler p‑Wert = 0,0081). Der adjustierte Mittelwert der absoluten Veränderung des L‑PF‑Symptomscores für den Bereich Husten in Woche 52 gegenüber dem Ausgangswert betrug in der Ofev-Gruppe ‑1,84 verglichen mit 4,25 in der Placebogruppe. Der adjustierte mittlere Unterschied zwischen den Gruppen lag bei ‑6,09 zugunsten von Ofev (95 %‑KI ‑9,65; ‑2,53; nominaler p‑Wert = 0,0008).
Interstitielle Lungenerkrankung bei systemischer Sklerose (SSc‑ILD)
Die klinische Wirksamkeit von Ofev wurde bei Patienten mit SSc‑ILD in einer doppelblinden, randomisierten, placebokontrollierten Phase‑III-Studie (SENSCIS) untersucht. Bei den Patienten wurde gemäß den Kriterien des American College of Rheumatology/der European League Against Rheumatism für SSc von 2013 und einem in den vorangegangenen 12 Monaten angefertigten hochauflösenden Computertomografie (HRCT)-Scan des Thorax eine SSc‑ILD diagnostiziert. Insgesamt wurden 580 Patienten in einem Verhältnis von 1:1 einer mindestens 52‑wöchigen Behandlung mit Ofev 150 mg zweimal täglich oder einem entsprechenden Placebo randomisiert zugeordnet. 576 dieser Patienten wurden behandelt. Die Randomisierung war nach dem Status der Antikörper gegen Topoisomerasen (ATA) stratifiziert. Einzelne Patienten erhielten bis zu 100 Wochen lang die verblindete Prüfmedikation (mediane Ofev-Exposition 15,4 Monate; mittlere Ofev‑Exposition 14,5 Monate).
Der primäre Endpunkt war die jährliche Abnahme der FVC über 52 Wochen. Die wichtigsten sekundären Endpunkte waren die absolute Veränderung des modifizierten Rodnan-Skin-Scores (mRSS) gegenüber dem Ausgangswert nach 52 Wochen sowie die absolute Veränderung im Gesamtscore des St. George’s Respiratory Questionnaire (SGRQ) gegenüber dem Ausgangswert nach 52 Wochen.
75,2 % der Patienten in der Gesamtpopulation waren weiblich. Das mittlere (Standardabweichung [SD]; Min.-Max.) Alter betrug 54,0 (12,2; 20‑79) Jahre. Insgesamt 51,9 % der Patienten wiesen eine diffuse kutane systemische Sklerose (SSc) und 48,1 % eine limitiert-kutane SSc auf. Die mittlere (SD) Zeit seit dem ersten Auftreten eines Non-Raynaud-Symptoms betrug 3,49 (1,7) Jahre. 49,0 % der Patienten erhielten zu Studienbeginn eine stabile Therapie mit Mycophenolat (46,5 % Mycophenolat-Mofetil, 1,9 % Mycophenolat-Natrium, 0,5 % Mycophenolsäure). Das Sicherheitsprofil war bei Patienten mit oder ohne Mycophenolat zu Studienbeginn vergleichbar.
Jährliche Rate der FVC‑Abnahme
Die jährliche Rate der FVC‑Abnahme (in ml) über 52 Wochen war bei den Patienten, die Ofev erhielten, im Vergleich zu den Patienten, die Placebo erhielten, um 41,0 ml signifikant reduziert (Tabelle 11), was einem relativen Behandlungseffekt von 43,8 % entspricht.
Tabelle 11: Jährliche Rate der FVC-Abnahme (ml) über 52 Wochen
Placebo |
Ofev |
|
Anzahl analysierter Patienten |
288 |
287 |
Abnahmerate1 (SE) über 52 Wochen |
‑93,3 (13,5) |
‑52,4 (13,8) |
Vergleich vs. Placebo |
||
Unterschied1 |
41,0 |
|
95 %‑KI |
(2,9; 79,0) |
|
p‑Wert |
< 0,05 |
1 Basierend auf einer Mehrebenenanalyse mit festen kategorischen Effekten für Behandlung, ATA‑Status. Geschlecht, feste kontinuierliche Zeiteffekte, FVC‑Ausgangswert (ml), Alter, Körpergröße und unter Berücksichtigung von zeitbezogenen Behandlungseffekten und zeitbezogenen Ausgangseffekten. Patientenspezifische Schnittpunkte und Zeiten wurden mit Zufallseffekten berücksichtigt. Messfehler innerhalb eines Patienten wurden mithilfe einer unstrukturierten Varianz-Kovarianz-Matrix modelliert. Die Variabilität zwischen den Patienten wurde mithilfe einer Varianz-Kovarianz-Matrix mit Varianzkomponenten modelliert.
Die Wirkung von Ofev in Bezug auf die Reduktion der jährlichen Rate der FVC‑Abnahme war in allen präspezifizierten Sensitivitätsanalysen ähnlich und in den präspezifizierten Subgruppen (z. B. Alter, Geschlecht, Anwendung von Mycophenolat) wurde keine Heterogenität festgestellt.
Außerdem wurden ähnliche Effekte auf andere Lungenfunktionsendpunkte beobachtet, z. B. die absolute Veränderung der FVC in ml gegenüber dem Ausgangswert nach 52 Wochen (Abbildung 5 und Tabelle 12) und die Rate der FVC‑Abnahme in % des Sollwerts über 52 Wochen (Tabelle 13), welche die Wirkungen von Ofev auf die Verlangsamung der Progression der SSc‑ILD ebenfalls untermauern. Darüber hinaus wiesen weniger Patienten in der Ofev-Gruppe eine absolute FVC‑Abnahme um > 5 % des Sollwerts auf (20,6 % in der Ofev-Gruppe und 28,5 % in der Placebogruppe; OR = 0,65; p = 0,0287). Die relative FVC‑Abnahme in ml um > 10 % war zwischen den beiden Gruppen vergleichbar (16,7 % in der Ofev-Gruppe und 18,1 % in der Placebogruppe; OR = 0,91; p = 0,6842). In diesen Analysen wurden fehlende FVC‑Werte nach 52 Wochen mit dem schlechtesten Wert des Patienten während der Behandlung ersetzt.
Eine explorative Analyse von Daten über bis zu 100 Wochen (maximale Behandlungsdauer in SENSCIS) deutete darauf hin, dass die behandlungsbedingte Wirkung von Ofev in Bezug auf eine Verlangsamung der Progression der SSc‑ILD über 52 Wochen hinaus anhält.
Abbildung 5: Mittlere (SEM) beobachtete FVC-Veränderung (ml) gegenüber dem Ausgangswert über 52 Wochen
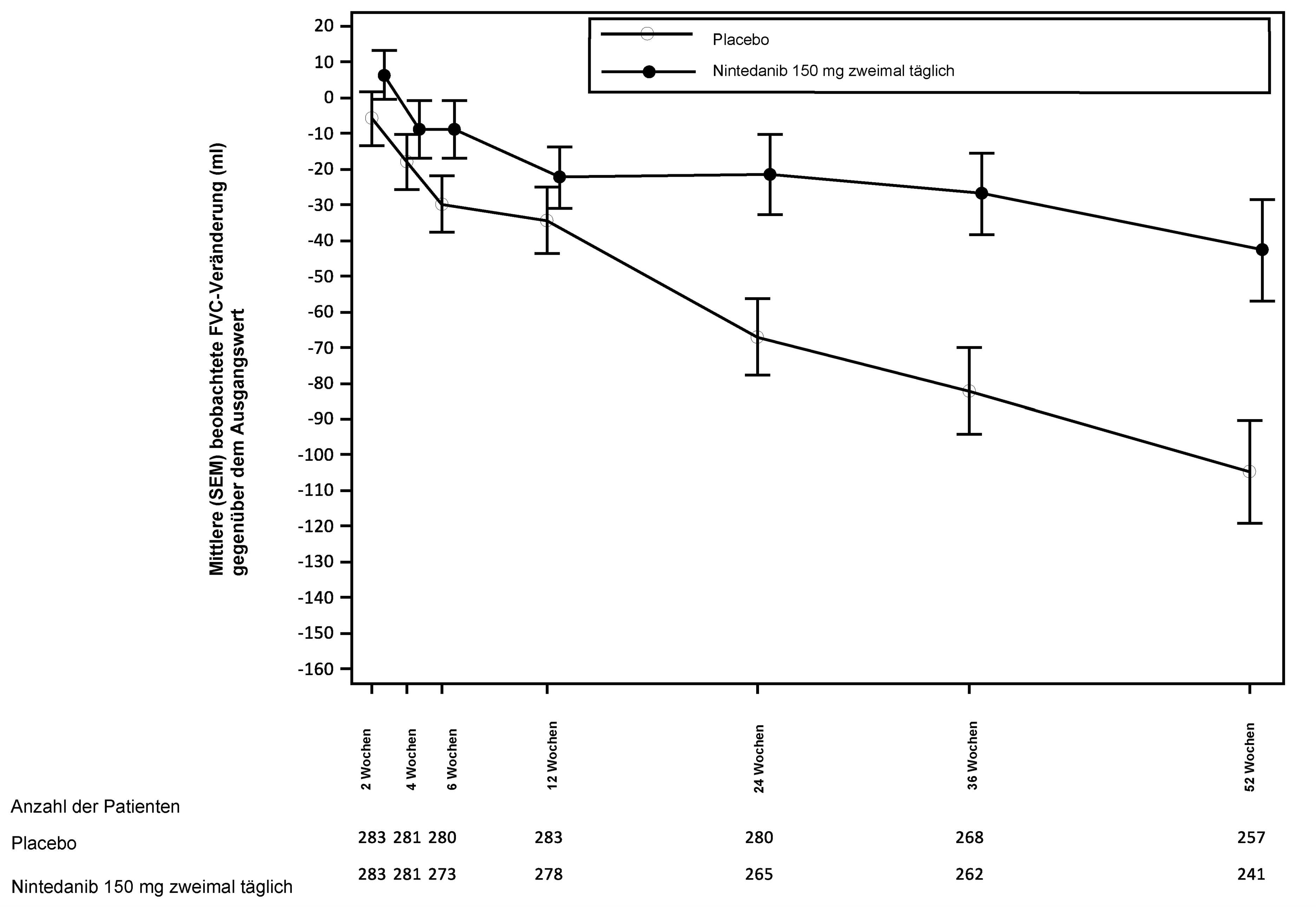
Tabelle 12: Absolute FVC-Veränderung (ml) gegenüber dem Ausgangswert nach 52 Wochen
Placebo |
Ofev |
|
Anzahl analysierter Patienten |
288 |
288 |
Mittlerer Ausgangswert (SD) |
2 541,0 (815,5) |
2 458,5 (735,9) |
Mittlere1 (SE) Veränderung gegenüber dem Ausgangswert nach 52 Wochen |
‑101,0 (13,6) |
‑54,6 (13,9) |
Vergleich vs. Placebo |
||
Mittelwert1 |
46,4 |
|
95 %‑KI |
(8,1; 84,7) |
|
p‑Wert |
< 0,05 |
1 Basierend auf einem gemischten Modell mit wiederholten Messungen mit festen kategorischen Effekten für ATA‑Status, Visite, visitenbezogene Behandlungseffekte, visitenbezogene Effekte auf die Ausgangswerte, Alter, Geschlecht und Körpergröße. Visite war die wiederholte Messung. Messfehler innerhalb eines Patienten wurden mithilfe einer unstrukturierten Varianz-Kovarianz-Matrix modelliert. Der adjustierte Mittelwert beruhte auf sämtlichen mit dem Modell analysierten Patienten (nicht nur den Patienten mit Ausgangswert und Messung in Woche 52).
Tabelle 13: Jährliche Rate der FVC-Abnahme (% des Sollwerts) über 52 Wochen
Placebo |
Ofev |
|
Anzahl analysierter Patienten |
288 |
287 |
Abnahmerate1 (SE) über 52 Wochen |
‑2,6 (0,4) |
‑1,4 (0,4) |
Vergleich vs. Placebo |
||
Unterschied1 |
1,15 |
|
95 %‑KI |
(0,09; 2,21) |
|
p‑Wert |
< 0,05 |
1 Basierend auf einer Mehrebenenanalyse mit festen kategorischen Effekten für Behandlung, ATA‑Status, feste kontinuierliche Zeiteffekte, FVC‑Ausgangswert (% des Sollwerts) und unter Berücksichtigung von zeitbezogenen Behandlungseffekten und zeitbezogenen Ausgangseffekten. Patientenspezifische Schnittpunkte und Zeiten wurden mit Zufallseffekten berücksichtigt. Messfehler innerhalb eines Patienten wurden mithilfe einer unstrukturierten Varianz-Kovarianz-Matrix modelliert. Die Variabilität zwischen den Patienten wurde mithilfe einer Varianz-Kovarianz-Matrix mit Varianzkomponenten modelliert.
Änderung des modifizierten Rodnan-Skin-Scores (mRSS) gegenüber dem Ausgangswert nach 52 Wochen
Der adjustierte Mittelwert der absoluten Veränderung des mRSS gegenüber dem Ausgangswert nach 52 Wochen war zwischen der Ofev-Gruppe (‑2,17 [95 %‑KI ‑2,69; ‑1,65]) und der Placebogruppe (‑1,96 [95 %‑KI ‑2,48; ‑1,45]) vergleichbar. Der adjustierte mittlere Unterschied zwischen den Behandlungsgruppen betrug ‑0,21 (95 %‑KI ‑0,94; 0,53; p = 0,5785).
Änderung des Gesamtscores im St. George’s Respiratory Questionnaire (SGRQ) gegenüber dem Ausgangswert nach 52 Wochen
Der adjustierte Mittelwert der absoluten Veränderung des SGRQ-Gesamtscores gegenüber dem Ausgangswert nach 52 Wochen war zwischen der Ofev-Gruppe (0,81 [95 %‑KI ‑0,92; 2,55]) und der Placebogruppe (‑0,88 [95 %‑KI ‑2,58; 0,82]) vergleichbar. Der adjustierte mittlere Unterschied zwischen den Behandlungsgruppen betrug 1,69 (95 %‑KI ‑0,73; 4,12; p = 0,1711).
Überlebensanalyse
Die Mortalität im Verlauf der gesamten Studie war zwischen der Ofev-Gruppe (n = 10; 3,5 %) und der Placebogruppe (n = 9; 3,1 %) vergleichbar. Die Analyse der Zeit bis zum Tod im Verlauf der gesamten Studie ergab eine HR von 1,16 (95 %‑KI 0,47; 2,84; p = 0,7535).
QT-Intervall
In einer entsprechenden Studie an Patienten mit Nierenzellkarzinom wurden QT‑/QTc‑Messungen aufgezeichnet, die zeigten, dass eine orale Einzeldosis von 200 mg Nintedanib und orale Mehrfachdosierung von 200 mg Nintedanib zweimal täglich über 15 Tage das QTcF‑Intervall nicht verlängerten.
Kinder und Jugendliche
Klinisch signifikante progredient fibrosierende interstitielle Lungenerkrankungen (ILDs) und interstitielle Lungenerkrankung bei systemischer Sklerose (SSc-ILD) bei Kindern und Jugendlichen im Alter von 6 bis 17 Jahren
Die klinische Sicherheit und Wirksamkeit von Ofev bei Kindern und Jugendlichen im Alter zwischen 6 und 17 Jahren mit klinisch signifikanten fibrosierenden interstitiellen Lungenerkrankungen (ILDs) wurden in einer explorativen, randomisierten, doppelblinden, placebokontrollierten Phase‑III-Studie (InPedILD 1199.337) untersucht.
Die Patienten wurden im Verhältnis 2:1 einer 24‑wöchigen Behandlung mit Ofev zweimal täglich (Dosen adjustiert nach Gewicht, einschließlich der Anwendung einer 25 mg‑Kapsel) oder einem entsprechenden Placebo randomisiert zugeordnet, gefolgt von einer unverblindeten Gabe von Nintedanib mit variabler Behandlungsdauer. Die Anwendung einer Standardbehandlung, die vom behandelnden Arzt als klinisch indiziert erachtet wurde, war zulässig.
Die primären Ziele der InPedILD-Studie waren die Beurteilung der Dosisexposition und Sicherheit von Nintedanib bei Kindern und Jugendlichen mit klinisch signifikanter fibrosierender ILD. Die Wirksamkeit wurde lediglich als sekundäres Ziel beurteilt.
In die Studie InPedILD wurden Kinder und Jugendliche im Alter von 6 bis 17 Jahren mit klinisch signifikanter fibrosierender ILD und einer FVC in % des Sollwerts von mindestens 25 % eingeschlossen. Die Patienten wurden auf Grundlage des Nachweises einer Fibrose in zwei HRCT-Scans (wobei einer der HRCT-Scans innerhalb der letzten 12 Monate durchgeführt wurde) oder auf dem Nachweis einer Fibrose in einer Lungenbiopsie und eines höchstens 12 Monate zurückliegenden HRCT-Scans mit fibrosierender ILD klassifiziert.
Eine klinisch signifikante Erkrankung war definiert als Fan-Score ≥ 3 oder dokumentierter Nachweis einer klinischen Progression im Laufe der Zeit. Der Nachweis klinischer Progression stützte sich auf eine relative Abnahme der FVC in % des Sollwerts um ≥ 10 %, eine relative Abnahme der FVC in % des Sollwerts um 5‑10 % mit Verschlechterung der Symptome, eine sich verschlechternde Fibrose gemäß HRCT-Scan oder andere Parameter einer klinischen Verschlechterung, die auf eine progressive Lungenfibrose zurückgeführt wurden (z. B. erhöhter Sauerstoffbedarf, verminderte Diffusionskapazität). Für die Aufnahme von Patienten mit einem Fan-Score von ≥ 3 war dies allerdings keine Voraussetzung.
Insgesamt wurden 39 Patienten randomisiert (61,5 % weiblich). Ausgangsmerkmale:
6‑11 Jahre: 12 Patienten, 12‑17 Jahre: 27 Patienten. Das mittlere (Standardabweichung [SD]) Alter betrug 12,6 (3,3) Jahre.
Das mittlere (SD) Gewicht lag bei 42,2 kg (17,8 kg); 6‑11 Jahre: 26,6 kg (10,4 kg), 12‑17 Jahre: 49,1 kg (16,0 kg).
Der Z-Wert (SD) des mittleren altersangepassten BMI zu Studienbeginn betrug insgesamt ‑0,6 (1,8).
Der Z-Wert (SD) der mittleren FVC zu Studienbeginn betrug insgesamt ‑3,5 (1,9).
Die häufigsten zugrundeliegenden ILD‑Einzeldiagnosen bei den eingeschlossenen Patienten waren:
„Surfactant-Protein-Mangel“ (Nintedanib: 26,9 %, Placebo: 38,5 %),
„Systemische Sklerose“ (Nintedanib: 15,4 %, Placebo: 23,1 %),
„Toxin-/Strahlen-/Arzneimittel-induzierte Pneumonitis“ (Nintedanib: 11,5 %, Placebo: 7,7 %),
„Chronische Hypersensitivitätspneumonie“ wurde bei 2 Patienten berichtet (Nintedanib: 7,7 %),
Die übrigen, für jeweils 1 Patienten berichteten zugrundeliegenden ILD‑Diagnosen, waren:
Fibrose nach HSZT,
juvenile rheumatoide Arthritis,
juvenile idiopathische Arthritis,
Dermatomyositis (DM),
desquamative interstitielle Pneumonitis,
H1N1‑Influenza,
Ungeklärt (chronische diffuse Lungenerkrankung),
COPA‑Syndrom,
COPA‑Genmutation,
undifferenzierte Erkrankung des Bindegewebes,
postinfektiöse Bronchiolitis obliterans,
nicht näher spezifizierte ILD,
idiopathische ILD,
STING-assoziierte Vaskulopathie.
Die Ergebnisse des primären Endpunktes waren:
Exposition gegenüber Nintedanib:
Die Exposition gegenüber Nintedanib in Form der AUCτ,ss, basierend auf der Probennahme im Steady State, war bei Kindern und Jugendlichen allgemein ähnlich und mit der AUCτ,ss von Erwachsenen vergleichbar (siehe Abschnitt 5.2).
Behandlungsbedingte unerwünschte Ereignisse (Woche 24):
Nintedanib-Gruppe: 84,6 % der Patienten (6‑11 Jahre: 75,0 %, 12‑17 Jahre: 88,9 %)
Placebogruppe: 84,6 % der Patienten (6‑11 Jahre: 100 %, 12‑17 Jahre: 77,8 %)
Die Änderung der forcierten Vitalkapazität (FVC in % des Sollwerts) gegenüber Studienbeginn wurde als sekundärer Wirksamkeitsendpunkt untersucht. Ergebnisse (Abbildung 6):
Woche 24:
Nintedanib-Gruppe: adjustierte mittlere Änderung = 0,31 (95 %‑KI ‑2,36; 2,98)
Placebogruppe: adjustierte mittlere Änderung = ‑0,89 (95 %-KI ‑4,61; 2,82)
Unterschied der FVC in % des Sollwerts 1,21 (95 %-KI ‑3,40; 5,81) zugunsten von Nintedanib.
Woche 52:
Randomisierte Nintedanib-Gruppe: adjustierte mittlere Änderung = 0,79 (95 %-KI -2,95; 4,53)
Randomisierte Placebogruppe: adjustierte mittlere Änderung = -0,98 (95 %-KI -6,26; 4,30)
Für den Endpunkt FVC in % des Sollwerts und eine Reihe anderer explorativer Wirksamkeitsendpunkte wurde bei Kindern und Jugendlichen eine hohe Variabilität beim Ansprechen auf die Behandlung mit Nintedanib beobachtet.
Abbildung 6: Adjustierter Mittelwert (SE) der absoluten Veränderung in % des Sollwerts der FVC gegenüber dem Ausgangswert nach 52 Wochen ‑ behandelte Population*
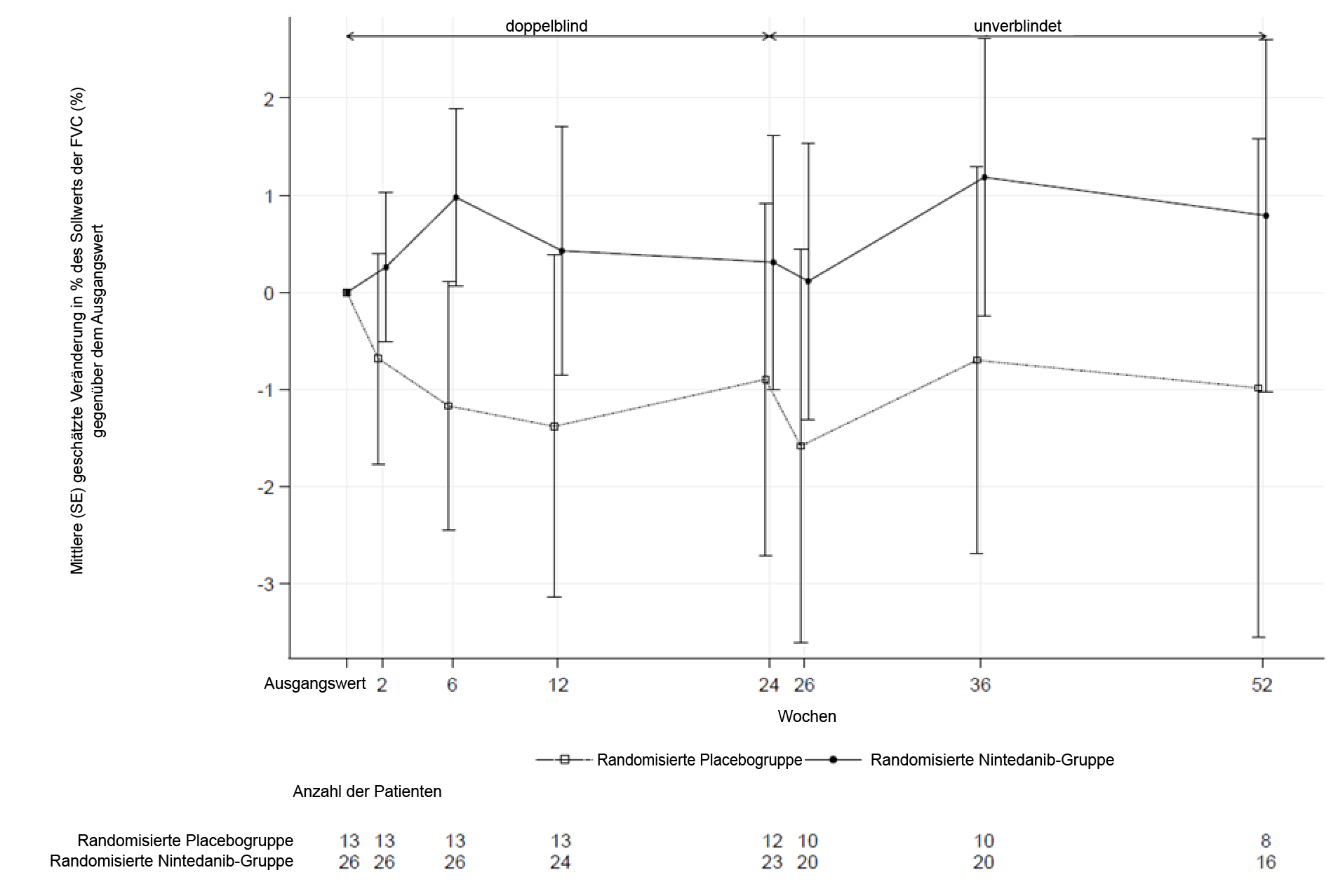
* Nach 24 Behandlungswochen erhielten alle Patienten Nintedanib im unverblindeten Teil der Studie.
Die Europäische Arzneimittel-Agentur hat für Ofev eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei IPF gewährt.
Die Europäische Arzneimittel-Agentur hat für Ofev eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien bei Kindern unter 6 Jahren bei fibrosierenden ILDs gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Resorption
Nintedanib erreichte maximale Plasmakonzentrationen ca. 2‑4 Std. nach oraler Gabe als Weichgelatinekapsel nach Nahrungsaufnahme (Bereich 0,5‑8 Std.). Die absolute Bioverfügbarkeit einer 100 mg-Dosis betrug bei Probanden 4,69 % (90 %‑KI: 3,615‑6,078). Resorption und Bioverfügbarkeit werden durch Transportereffekte und einen erheblichen First-Pass-Effekt verringert. Die Exposition gegenüber Nintedanib stieg im Dosisbereich von 50‑450 mg einmal täglich und 150‑300 mg zweimal täglich dosisproportional an. Steady-State-Plasmakonzentrationen wurden spätestens nach einwöchiger Einnahme erreicht.
Nach Nahrungsaufnahme war die Nintedanib-Exposition im Vergleich zur Einnahme im Nüchternzustand um etwa 20 % erhöht (KI: 95,3‑152,5 %), die Resorption war verzögert (mediane tmax nüchtern: 2,00 Std.; nicht nüchtern: 3,98 Std.).
In einer In-vitro-Studie hatte das Mischen von Nintedanib-Kapseln mit einer kleinen Menge Apfelmus oder Schokoladenpudding für bis zu 15 Minuten keine Auswirkungen auf die pharmazeutische Qualität. Bei längerer Expositionsdauer gegenüber weicher Nahrung wurde aufgrund der Wasseraufnahme der Gelatinehülle ein Aufquellen und eine Verformung der Kapseln beobachtet. Daher ist bei Einnahme der Kapseln mit weicher Nahrung nicht mit einer veränderten klinischen Wirkung zu rechnen, wenn die Einnahme sofort erfolgt.
In einer Einzeldosis-Studie zur relativen Bioverfügbarkeit von Nintedanib, in der männliche, erwachsene Probanden entweder eine 100 mg-Weichgelatinekapsel oder vier 25 mg-Weichgelatinekapseln erhielten, war die Bioverfügbarkeit bei beiden Behandlungen vergleichbar.
Verteilung
Nintedanib folgt mindestens einer zweiphasigen Dispositionskinetik. Nach intravenöser Infusion wurde ein hohes Verteilungsvolumen (Vss: 1 050 l, 45,0 % gKV) beobachtet.
Die In-vitro-Proteinbindung von Nintedanib in menschlichem Plasma war mit einem gebundenen Anteil von 97,8 % hoch. Serumalbumin wird als das Hauptbindungsprotein betrachtet. Nintedanib wird vorzugsweise in Plasma verteilt, mit einem Blut-zu-Plasma-Verhältnis von 0,869.
Biotransformation
Die vorherrschende Stoffwechselreaktion für Nintedanib ist die hydrolytische Spaltung durch Esterasen, die den freien Säureanteil BIBF 1202 ergibt. BIBF 1202 wird anschließend durch Glucuronidierung mittels Uridin‑5'‑diphospho-Glucuronosyltransferase (UGT)-Enzymen (UGT 1A1, UGT 1A7, UGT 1A8 und UGT 1A10) in BIBF‑1202‑Glucuronid überführt.
Die Biotransformation von Nintedanib erfolgte nur in geringem Umfang über CYP‑Stoffwechselwege, wobei CYP 3A4 das überwiegend beteiligte Enzym war. Der CYP‑abhängige Hauptmetabolit konnte in der ADME-Studie am Menschen im Plasma nicht nachgewiesen werden. In vitro machte der CYP‑abhängige Stoffwechsel etwa 5 % im Vergleich zu etwa 25 % Esterspaltung aus. Nintedanib, BIBF 1202 und BIBF‑1202‑Glucuronid bewirkten in präklinischen Studien auch keine Hemmung oder Induktion von CYP‑Enzymen. Arzneimittelwechselwirkungen zwischen Nintedanib und CYP‑Substraten, CYP‑Inhibitoren oder CYP‑Induktoren sind daher nicht zu erwarten.
Elimination
Die Gesamt-Plasmaclearance nach intravenöser Infusion war hoch (CL: 1 390 ml/min, 28,8 % gKV). Die renale Ausscheidung des unveränderten Wirkstoffs innerhalb von 48 Std. nach oraler Gabe betrug etwa 0,05 % der Dosis (31,5 % gKV) und nach intravenöser Verabreichung etwa 1,4 % der Dosis (24,2 % gKV); die renale Clearance betrug 20 ml/min (32,6 % gKV). Der Hauptweg der Elimination von radioaktiv markiertem [14C] Nintedanib nach oraler Gabe erfolgte über fäkale/biliäre Ausscheidung (93,4 % der Dosis, 2,61 % gKV). Der Beitrag der renalen Ausscheidung zur Gesamt-Clearance war gering (0,649 % der Dosis, 26,3 % gKV). Die Gesamtrückgewinnung (Recovery) wurde innerhalb von 4 Tagen nach der Dosierung als abgeschlossen (über 90 %) betrachtet. Die terminale Halbwertszeit von Nintedanib betrug zwischen 10 und 15 Std. (gKV % ca. 50 %).
Linearität/Nicht-Linearität
Die Pharmakokinetik (PK) von Nintedanib kann bezüglich der Zeit als linear betrachtet werden (d. h. Einzeldosisdaten können auf Mehrfachdosisdaten extrapoliert werden). Die Akkumulation nach Mehrfachgabe betrug das 1,04‑Fache für Cmax und das 1,38‑Fache für AUCτ. Die Nintedanib-Talspiegel blieben für mehr als ein Jahr stabil.
Transport
Nintedanib ist ein Substrat von P‑gp. Zum Wechselwirkungspotenzial von Nintedanib mit diesem Transporter, siehe Abschnitt 4.5. Für Nintedanib wurde in vitro gezeigt, dass es kein Substrat oder Inhibitor von OATP‑1B1, OATP‑1B3, OATP‑2B1, OCT‑2 oder MRP‑2 ist. Nintedanib ist auch kein Substrat von BCRP. In vitro wurde nur ein schwaches inhibitorisches Potenzial auf OCT‑1, BCRP und P‑gp beobachtet, dem geringe klinische Bedeutung beigemessen wird. Das Gleiche gilt für Nintedanib als Substrat von OCT‑1.
Populationspharmakokinetische Analyse bei besonderen Patientengruppen
Die pharmakokinetischen Eigenschaften von Nintedanib waren bei Probanden, Patienten mit IPF, Patienten mit anderen chronischen progredient fibrosierenden ILDs, Patienten mit SSc‑ILD und Krebspatienten ähnlich. In einer populationspharmakokinetischen (PopPK)-Analyse von Patienten mit IPF und nicht-kleinzelligem Lungenkarzinom (NSCLC) (n = 1 191) sowie deskriptiver Untersuchungen wurde die Nintedanib-Exposition nicht durch Geschlecht (korrigiert nach Körpergewicht), leichte und mittelschwere Nierenfunktionsstörung (geschätzt anhand der Kreatinin-Clearance), Alkoholkonsum oder P‑gp‑Genotyp beeinflusst.
Die PopPK‑Analysen ergaben moderate Auswirkungen auf die Nintedanib-Exposition, die von Alter, Körpergewicht und ethnischer Zugehörigkeit abhängig waren (siehe unten). Aufgrund der hohen interindividuellen Variabilität der Exposition werden diese beobachteten moderaten Effekte als nicht klinisch relevant betrachtet (siehe Abschnitt 4.4).
Alter
Die Nintedanib-Exposition nahm mit dem Alter linear zu. Relativ zu einem Patienten mit einem medianen Alter von 62 Jahren verringerte sich die AUCτ,ss bei einem 45‑jährigen Patienten um 16 % und stieg bei einem 76‑jährigen Patienten um 13 % an. Der durch die Analyse abgedeckte Altersbereich lag zwischen 29 und 85 Jahren; etwa 5 % der Population waren älter als 75 Jahre. Auf Basis eines PopPK‑Modells wurde bei Patienten ≥ 75 Jahren eine Zunahme der Nintedanib-Exposition von etwa 20‑25 % im Vergleich zu Patienten unter 65 Jahren beobachtet.
Kinder und Jugendliche
Laut der Analyse pharmakokinetischer Daten aus der Studie InPedILD (1199.337) führte die orale Anwendung von Nintedanib gemäß gewichtsbasiertem Dosierungsalgorithmus zu einer Exposition in dem bei erwachsenen Patienten beobachteten Bereich. Die beobachteten geometrischen mittleren Expositionen in Form der AUCτ,ss (geometrischer Variationskoeffizient) betrugen 175 ng/ml*h (85,1 %) bei 10 Patienten im Alter zwischen 6 und 11 Jahren bzw. 167 ng/ml*h (83,6 %) bei 23 Patienten im Alter zwischen 12 und 17 Jahren.
Expositions-Wirkungs-Analysen der Daten aus der Studie InPedILD wiesen auf einen Emax-ähnlichen Zusammenhang zwischen Exposition und FVC in % des Sollwerts sowie des Z-Wertes der FVC hin, unterstützt durch Daten von Erwachsenen. Der EC50-Wert betrug bei der FVC in % des Sollwerts 4,4 ng/ml (relativer Standardfehler: 28,6 %) und beim Z-Wert des FVC 5,0 ng/ml (relativer Standardfehler: 75,3 %).
Nintedanib wurde nicht bei Kindern und Jugendlichen mit Leberfunktionsstörung untersucht.
Populationspharmakokinetische Modelle zeigen, dass bei Kindern und Jugendlichen mit fibrosierenden ILDs und leichter Leberfunktionsstörung (Child‑Pugh-Klasse A) die empfohlenen Dosisreduktionen (siehe Abschnitt 4.2) zu Expositionen führen würden, die bei der jeweils empfohlenen reduzierten Dosis mit den Nintedanib-Expositionen bei erwachsenen Patienten mit leichter Leberfunktionsstörung (Child‑Pugh-Klasse A) übereinstimmen.
Körpergewicht
Es wurde eine inverse Korrelation zwischen Körpergewicht und der Nintedanib-Exposition beobachtet. Die AUCτ,ss stieg bei einem 50 kg schweren Patienten (5. Perzentil) um 25 % an und verringerte sich bei einem 100 kg schweren Patienten (95. Perzentil) um 19 % relativ zu einem Patienten mit einem medianen Gewicht von 71,5 kg.
Ethnische Zugehörigkeit
Im Vergleich zu Kaukasiern war die mittlere Nintedanib-Exposition der Population bei chinesischen, taiwanesischen und indischen Patienten um 33‑50 % und bei japanischen Patienten um 16 % höher, während sie bei Koreanern um 16‑22 % niedriger war (gemäß Körpergewicht korrigiert). Daten von schwarzen Menschen waren sehr begrenzt, lagen jedoch im gleichen Bereich wie für Kaukasier.
Leberfunktionsstörung
In einer gezielten Einzeldosisstudie der Phase I war die Nintedanib‑Exposition basierend auf Cmax und AUC bei Patienten mit leichter Leberfunktionsstörung (Child Pugh A) im Vergleich zu Probanden 2,2‑fach höher (90 %‑KI 1,3‑3,7 für Cmax bzw.1,2‑3,8 für AUC). Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child Pugh B) war die Exposition im Vergleich zu Probanden basierend auf Cmax 7,6‑fach höher (90 %‑KI 4,4‑13,2) und basierend auf AUC 8,7‑fach höher (90 %-KI 5,7‑13,1). Patienten mit schwerer Leberfunktionsstörung (Child Pugh C) wurden nicht untersucht.
Begleittherapie mit Pirfenidon
In einer speziellen Pharmakokinetik (PK)-Studie wurde die gleichzeitige Behandlung mit Nintedanib und Pirfenidon bei Patienten mit IPF untersucht. Gruppe 1 erhielt eine Einzeldosis von 150 mg Nintedanib vor und nach Eindosierung auf eine stabile Konzentration von 801 mg Pirfenidon dreimal täglich (n = 20 behandelte Patienten). Gruppe 2 erhielt eine dauerhafte Behandlung mit 801 mg Pirfenidon dreimal täglich, und das PK‑Profil wurde bei diesen Patienten vor und nach mindestens 7 Tagen der gleichzeitigen Gabe von zweimal täglich 150 mg Nintedanib ermittelt (n = 17 behandelte Patienten). In Gruppe 1 betrugen die adjustierten Verhältnisse der geometrischen Mittelwerte (90 %‑KI) 93 % (57 %‑151 %) bzw. 96 % (70 %‑131 %) für die Cmax bzw. AUC0‑tz von Nintedanib (n = 12 für den intraindividuellen Vergleich). Die adjustierten Verhältnisse der geometrischen Mittelwerte (90 %‑KI) in Gruppe 2 lagen bei 97 % (86 %‑110 %) bzw. 95 % (86 %‑106 %) für die Cmax,ss bzw. AUCτ,ss von Pirfenidon (n = 12 für den intraindividuellen Vergleich).
Ausgehend von diesen Ergebnissen gibt es keine Hinweise auf eine relevante pharmakokinetische Arzneimittelwechselwirkung zwischen Nintedanib und Pirfenidon, wenn diese Wirkstoffe in Kombination verabreicht wurden (siehe Abschnitt 4.4).
Begleittherapie mit Bosentan
In einer speziellen PK‑Studie wurde die gleichzeitige Behandlung mit Ofev und Bosentan bei Probanden untersucht. Die Probanden erhielten eine Einzeldosis von 150 mg Ofev vor und nach mehrfacher Gabe von 125 mg Bosentan zweimal täglich im Steady State. Die adjustierten Verhältnisse der geometrischen Mittelwerte (90 %‑KI) betrugen 103 % (86 %‑124 %) bzw. 99 % (91 %‑107 %) für die Cmax bzw. AUC0‑tz von Nintedanib (n = 13), was darauf hindeutet, dass die gleichzeitige Gabe von Nintedanib und Bosentan keine Auswirkungen auf die Pharmakokinetik von Nintedanib hatte.
Begleittherapie mit oralen hormonellen Kontrazeptiva
In einer speziellen PK‑Studie erhielten weibliche Patienten mit SSc‑ILD eine Einzeldosis einer Kombination aus 30 µg Ethinylestradiol und 150 µg Levonorgestrel vor und nach der zweimal täglichen Gabe von 150 mg Nintedanib über mindestens 10 Tage. Die adjustierten Verhältnisse der geometrischen Mittelwerte (90 %‑KI) betrugen 117 % (108 %‑127 %; Cmax) bzw. 101 % (93 %‑111 %; AUC0‑tz) für Ethinylestradiol und 101 % (90 %‑113 %; Cmax) bzw. 96 % (91 %‑102 %; AUC0‑tz) für Levonorgestrel (n = 15), was darauf hindeutet, dass die gleichzeitige Gabe von Nintedanib keine nennenswerten Auswirkungen auf die Plasmaspiegel von Ethinylestradiol und Levonorgestrel hat.
Expositions-Wirkungs-Beziehung
Expositions-Wirkungs-Analysen bei Patienten mit IPF und anderen chronischen progredient fibrosierenden ILDs wiesen auf eine schwache Beziehung zwischen der Nintedanib-Plasmaexposition und erhöhten ALT- und/oder AST-Werten hin. Die tatsächlich verabreichte Dosis ist möglicherweise der bessere Prädiktor für das Risiko, Diarrhoe jeglichen Schweregrads zu entwickeln, selbst wenn eine Plasmaexposition als risikobestimmender Faktor nicht ausgeschlossen werden konnte (siehe Abschnitt 4.4).
Informationen zu Expositions-Wirkungs-Analysen bei Kindern und Jugendlichen, siehe Unterabschnitt „Kinder und Jugendliche“.
Allgemeine Toxikologie
Toxizitätsstudien an Ratten und Mäusen zeigten nach einmaliger Gabe ein geringes akutes toxisches Potenzial von Nintedanib. In Toxizitätsstudien nach wiederholter Gabe an jungen Ratten wurden bleibende Veränderungen im Zahnschmelz und Dentin in den schnell nachwachsenden Schneidezähnen beobachtet, jedoch nicht in den Prämolaren und Molaren. Darüber hinaus wurde eine Verdickung der epiphysären Wachstumsfugen während der Knochenwachstumsphasen beobachtet, die nach Absetzen reversibel war. Diese Veränderungen sind von anderen VEGFR‑2‑Inhibitoren bekannt und können als Klasseneffekte betrachtet werden.
Diarrhoe und Erbrechen, begleitet von reduzierter Futteraufnahme und Körpergewichtsverlust, wurden in Toxizitätsstudien an Nicht-Nagern beobachtet.
Es gab keine Anzeichen von erhöhten Leberenzymen bei Ratten, Hunden und Cynomolgus-Affen. Ein leichter Anstieg von Leberenzymen, der nicht auf schwere Nebenwirkungen wie Diarrhoe zurückzuführen war, wurde ausschließlich bei Rhesusaffen beobachtet.
Reproduktionstoxizität
Bei Ratten wurden embryofetale Letalität und teratogene Wirkungen bei Expositionen unter der humantherapeutischen Exposition bei der MRHD von 150 mg zweimal täglich beobachtet. Auswirkungen auf die Entwicklung des Achsenskeletts und auf die Entwicklung der großen Arterien wurden ebenfalls bei subtherapeutischen Expositionen festgestellt.
Bei Kaninchen wurden eine embryofetale Letalität und teratogene Wirkungen bei einer Exposition beobachtet, die etwa 3‑fach höher als die MRHD war, jedoch wurden uneindeutige Auswirkungen auf die embryofetale Entwicklung des Achsenskeletts und des Herzens bereits bei einer Exposition festgestellt, die niedriger war als die MRHD von 150 mg zweimal täglich.
In einer prä- und postnatalen Entwicklungsstudie an Ratten wurden Auswirkungen auf die prä- und postnatale Entwicklung bei einer Exposition beobachtet, die geringer war als die MRHD.
Eine Studie an Ratten zur männlichen Fertilität und frühen embryonalen Entwicklung bis zur Implantation zeigte keine Auswirkungen auf die männlichen Fortpflanzungsorgane und die männliche Fertilität.
Bei Ratten wurden geringe Mengen von radioaktiv markiertem Nintedanib und/oder seinen Metaboliten (≤ 0,5 % der verabreichten Dosis) in die Milch ausgeschieden.
Zweijährige Karzinogenitätsstudien an Mäusen und Ratten erbrachten keine Hinweise auf ein kanzerogenes Potenzial von Nintedanib.
Studien zur Genotoxizität zeigten kein mutagenes Potenzial für Nintedanib.
Kapselinhalt
Mittelkettige Triglyceride
Hartfett
Phospholipide aus Sojabohnen (E322)
Kapselhülle
Gelatine
Glycerol (85 %)
Titandioxid (E171)
Eisen(III)-oxid (E172)
Eisen(III)-hydroxid-oxid × H2O (E172)
Drucktinte (nur bei Ofev 25 mg Weichkapseln)
Schellack
Eisen(II,III)-oxid (E172)
Propylenglycol (E1520)
Nicht zutreffend.
Ofev 25 mg Weichkapseln
4 Jahre
Ofev 100 mg und 150 mg Weichkapseln
3 Jahre
Blisterpackung
Nicht über 25 °C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Flasche
Nicht über 25 °C lagern. Die Flasche fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
Ofev 25 mg Weichkapseln
Ofev 25 mg Weichkapseln sind in folgenden Packungsgrößen erhältlich:
- 60 × 1 Weichkapsel in perforierten Einzeldosis-Blisterpackungen aus Aluminium/Aluminium
- 60 Weichkapseln in einer Flasche aus HDPE (Kunststoff) mit Schraubdeckel
- 120 Weichkapseln in einer Flasche aus HDPE (Kunststoff) mit Schraubdeckel
- 180 Weichkapseln in einer Flasche aus HDPE (Kunststoff) mit Schraubdeckel
Ofev 100 mg Weichkapseln
Ofev 100 mg Weichkapseln sind in folgenden Packungsgrößen erhältlich:
- 30 × 1 Weichkapsel in perforierten Einzeldosis-Blisterpackungen aus Aluminium/Aluminium
- 60 × 1 Weichkapsel in perforierten Einzeldosis-Blisterpackungen aus Aluminium/Aluminium
Ofev 150 mg Weichkapseln
Ofev 150 mg Weichkapseln sind in folgenden Packungsgrößen erhältlich:
- 30 × 1 Weichkapsel in perforierten Einzeldosis-Blisterpackungen aus Aluminium/Aluminium
- 60 × 1 Weichkapsel in perforierten Einzeldosis-Blisterpackungen aus Aluminium/Aluminium
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Bei Kontakt mit dem Kapselinhalt sollten die Hände unverzüglich mit reichlich Wasser abgewaschen werden (siehe Abschnitt 4.2).
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Boehringer Ingelheim International GmbH
Binger Straße 173
55216 Ingelheim am Rhein
Deutschland
Ofev 25 mg Weichkapseln
EU/1/14/979/009
EU/1/14/979/010
EU/1/14/979/011
EU/1/14/979/012
Ofev 100 mg Weichkapseln
EU/1/14/979/001
EU/1/14/979/002
Ofev 150 mg Weichkapseln
EU/1/14/979/003
EU/1/14/979/004
Datum der Erteilung der Zulassung: 15. Januar 2015
Datum der letzten Verlängerung der Zulassung: 23. September 2019
März 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.