PREVYMIS® 240 mg Konzentrat zur Herstellung einer Infusionslösung
PREVYMIS® 480 mg Konzentrat zur Herstellung einer Infusionslösung
PREVYMIS 240 mg Konzentrat zur Herstellung einer Infusionslösung
Jede Durchstechflasche enthält 240 mg (12 ml pro Durchstechflasche) Letermovir.
Jeder Milliliter enthält 20 mg Letermovir.
PREVYMIS 480 mg Konzentrat zur Herstellung einer Infusionslösung
Jede Durchstechflasche enthält 480 mg (24 ml pro Durchstechflasche) Letermovir.
Jeder Milliliter enthält 20 mg Letermovir.
Sonstige Bestandteile mit bekannter Wirkung
Dieses Arzneimittel enthält 23 mg (1 mmol) Natrium pro 240-mg-Durchstechflasche.
Dieses Arzneimittel enthält 46 mg (2 mmol) Natrium pro 480-mg-Durchstechflasche.
Dieses Arzneimittel enthält 1 800 mg Hydroxypropylbetadex (Cyclodextrin) pro 240-mg-Durchstechflasche.
Dieses Arzneimittel enthält 3 600 mg Hydroxypropylbetadex (Cyclodextrin) pro 480-mg-Durchstechflasche.
Für weitere Informationen siehe Abschnitt 4.2.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Konzentrat zur Herstellung einer Infusionslösung (steriles Konzentrat)
Klare, farblose Flüssigkeit
pH zwischen 7 und 8
PREVYMIS wird zur Prophylaxe einer Cytomegalievirus(CMV)-Reaktivierung und -Erkrankung bei erwachsenen und pädiatrischen CMV‑seropositiven Empfängern [R+] einer allogenen hämatopoetischen Stammzelltransplantation (hematopoietic stem cell transplant [HSCT]) mit einem Gewicht von mindestens 5 kg angewendet.
PREVYMIS wird zur Prophylaxe einer CMV-Erkrankung bei CMV-seronegativen erwachsenen und pädiatrischen Patienten mit einem Gewicht von mindestens 40 kg angewendet, die eine Nierentransplantation von einem CMV-seropositiven Spender erhalten haben [D+/R−].
Offizielle Leitlinien zur fachgerechten Anwendung von antiviralen Wirkstoffen sollten beachtet werden.
Die Behandlung mit Letermovir sollte durch einen Arzt eingeleitet werden, der über Erfahrungen in der Behandlung von Patienten verfügt, die eine allogene hämatopoetische Stammzelltransplantation oder eine Nierentransplantation erhalten haben.
Dosierung
Letermovir ist auch für die orale Anwendung (240-mg- und 480-mg-Filmtabletten und 20 mg und 120 mg Granulat im Beutel) erhältlich.
Letermovir Tabletten, Granulat im Beutel und das Konzentrat zur Herstellung einer Infusionslösung sind austauschbar. Die jeweilige Anwendung liegt im Ermessen des Arztes. Bei pädiatrischen Patienten mit einem Gewicht unter 30 kg kann eine Dosisanpassung erforderlich sein, wenn zwischen oraler und intravenöser Darreichungsform gewechselt wird. Hinweise zur Dosierung finden Sie in der Fachinformation für die Letermovir Filmtabletten oder das Letermovir Granulat im Beutel.
HSCT
Mit der Anwendung von Letermovir sollte nach einer HSCT begonnen werden. Mit der Anwendung von Letermovir kann am Tag der Transplantation begonnen werden und nicht später als 28 Tage nach der HSCT. Mit der Anwendung von Letermovir kann vor oder nach dem Engraftment (Anwachsen des Transplantats) begonnen werden. Eine Prophylaxe mit Letermovir sollte über einen Zeitraum von 100 Tagen nach HSCT fortgeführt werden.
Eine verlängerte Prophylaxe mit Letermovir, die über 100 Tage nach HSCT hinausgeht, kann für manche Patienten, bei denen ein hohes Risiko für eine späte CMV‑Reaktivierung besteht, von Nutzen sein (siehe Abschnitt 5.1). Die Sicherheit und Wirksamkeit der Anwendung von Letermovir über einen Zeitraum von mehr als 200 Tagen wurde in klinischen Studien nicht untersucht.
Erwachsene und pädiatrische Patienten mit einem Gewicht von mindestens 30 kg, die eine HSCT erhalten haben
Die empfohlene Dosis von Letermovir beträgt 480 mg einmal täglich.
Dosisanpassung bei erwachsenen und pädiatrischen Patienten mit einem Gewicht von mindestens 30 kg, die eine HSCT erhalten haben
Wenn Letermovir in Kombination mit Ciclosporin angewendet wird, sollte die Dosis von Letermovir auf 240 mg einmal täglich reduziert werden (siehe Abschnitte 4.5 und 5.2).
Wird Ciclosporin nach dem Beginn der Behandlung mit Letermovir eingeleitet, sollte die nächste Dosis von Letermovir auf 240 mg einmal täglich reduziert werden.
Wird Ciclosporin nach dem Beginn der Behandlung mit Letermovir abgesetzt, sollte die nächste Dosis von Letermovir auf 480 mg einmal täglich erhöht werden.
Wird die Ciclosporin-Dosierung aufgrund von zu hohen Ciclosporin-Spiegeln vorübergehend unterbrochen, ist keine Dosisanpassung von Letermovir erforderlich.
Pädiatrische Patienten mit einem Gewicht unter 30 kg, die eine HSCT erhalten haben
Die empfohlenen Dosen von Letermovir für pädiatrische Patienten mit einem Gewicht unter 30 kg sind in Tabelle 1 aufgeführt (siehe auch Abschnitt 5.2). Letermovir sollte einmal täglich gegeben werden.
Dosisanpassung bei pädiatrischen Patienten mit einem Gewicht unter 30 kg, die eine HSCT erhalten haben
Wenn intravenöses Letermovir gleichzeitig mit Ciclosporin gegeben wird, ist keine Anpassung der Letermovir-Dosis erforderlich, wie in Tabelle 1 dargestellt (siehe auch Abschnitte 4.5 und 5.2).
Tabelle 1: Empfohlene Dosis von Letermovir Konzentrat zur Herstellung einer Infusionslösung ohne oder mit Ciclosporin bei pädiatrischen Patienten mit einem Gewicht unter 30 kg
Körpergewicht | Intravenöse Tagesdosis mit oder ohne Ciclosporin |
15 kg bis unter 30 kg | 120 mg |
7,5 kg bis unter 15 kg | 60 mg |
5 kg bis unter 7,5 kg | 40 mg |
Nierentransplantation
Letermovir sollte am Tag der Transplantation und spätestens 7 Tage nach der Nierentransplantation begonnen und bis 200 Tage nach der Transplantation fortgesetzt werden.
Erwachsene und pädiatrische Patienten mit einem Gewicht von mindestens 40 kg, die eine Nierentransplantation erhalten haben
Die empfohlene Dosis von Letermovir beträgt 480 mg einmal täglich.
Dosisanpassung bei erwachsenen und pädiatrischen Patienten mit einem Gewicht von mindestens 40 kg, die eine Nierentransplantation erhalten haben
Wenn Letermovir in Kombination mit Ciclosporin angewendet wird, sollte die Dosis von Letermovir auf 240 mg einmal täglich reduziert werden (siehe Abschnitte 4.5 und 5.2).
Wird Ciclosporin nach dem Beginn der Behandlung mit Letermovir eingeleitet, sollte die nächste Dosis von Letermovir auf 240 mg einmal täglich reduziert werden.
Wird Ciclosporin nach dem Beginn der Behandlung mit Letermovir abgesetzt, sollte die nächste Dosis von Letermovir auf 480 mg einmal täglich erhöht werden.
Wird die Ciclosporin-Dosierung aufgrund von zu hohen Ciclosporin-Spiegeln vorübergehend unterbrochen, ist keine Dosisanpassung von Letermovir erforderlich.
Vergessene Dosis
Wenn eine Dosis vergessen wird, sollte sie dem Patienten so schnell wie möglich gegeben werden. Wenn es Zeit für die nächste Dosis ist, sollte die vergessene Dosis ausgelassen und mit dem gewohnten Dosierungsschema fortgefahren werden. Verdoppeln Sie nicht die nächste Dosis oder geben Sie nicht mehr als die vorgeschriebene Dosis.
Spezielle Patientengruppen
Ältere Patienten
Eine altersgemäße Dosisanpassung von Letermovir ist nicht erforderlich (siehe Abschnitte 5.1 und 5.2).
Leberfunktionsstörung
Bei Patienten mit leichter (Child-Pugh-Klasse A) oder mäßiger (Child-Pugh-Klasse B) Leberfunktionsstörung ist keine Dosisanpassung von Letermovir erforderlich. Für Patienten mit schwerer (Child-Pugh‑Klasse C) Leberfunktionsstörung wird Letermovir nicht empfohlen (siehe Abschnitt 5.2).
Gleichzeitig bestehende Leber- und Nierenfunktionsstörung
Für Patienten mit mäßiger Leberfunktionsstörung und gleichzeitig bestehender mäßiger oder schwerer Nierenfunktionsstörung wird Letermovir nicht empfohlen (siehe Abschnitt 5.2).
Nierenfunktionsstörung
Bei Patienten mit leichter, mäßiger oder schwerer Nierenfunktionsstörung wird keine Dosisanpassung von Letermovir empfohlen. Für Patienten mit terminaler Niereninsuffizienz (ESRD [end stage renal disease]) mit oder ohne Dialyse ist eine Dosierungsempfehlung nicht möglich. Die Wirksamkeit und Sicherheit bei Patienten mit terminaler Niereninsuffizienz wurden nicht nachgewiesen.
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung enthält Hydroxypropylbetadex (siehe Abschnitte 4.4 und 5.3). Bei Patienten mit mäßiger oder schwerer Nierenfunktionsstörung (Kreatinin-Clearance unter 50 ml/min) oder bei kleinen Kindern (unter 2 Jahren), die PREVYMIS erhalten, könnte eine Kumulation von Hydroxypropylbetadex auftreten. Die Serum-Kreatinin-Spiegel sollten bei diesen Patienten engmaschig überwacht werden.
Kinder und Jugendliche
Wenn möglich sollte eine intravenöse Anwendung nicht länger als 4 Wochen dauern.
Die Sicherheit und Wirksamkeit von Letermovir bei HSCT-Patienten mit einem Gewicht unter 5 kg sowie von Patienten mit einer Nierentransplantation mit einem Gewicht unter 40 kg wurde nicht untersucht. Es liegen keine Daten vor. Auf Basis einer pharmakokinetischen/pharmakodynamischen Extrapolation konnte keine Empfehlung zur Dosierung bei Patienten mit Nierentransplantation mit einem Gewicht unter 40 kg gegeben werden.
Art der Anwendung
Nur zum intravenösen Gebrauch.
Letermovir Konzentrat zur Herstellung einer Infusionslösung muss vor der Anwendung verdünnt werden (siehe Abschnitt 6.6).
Letermovir verdünnte Lösung muss über einen sterilen 0,2 µm oder 0,22 µm Polyethersulfon(PES)‑Inline-Filter angewendet werden. Wenden Sie die verdünnte Lösung nicht unter Verwendung eines anderen Filters als eines sterilen 0,2 µm oder 0,22 µm PES-Inline-Filters an.
Letermovir darf nur als intravenöse Infusion angewendet werden.
Nach der Verdünnung sollte Letermovir als intravenöse Infusion über einen peripheren oder zentralen Venenkatheter über einen Zeitraum von insgesamt etwa 60 Minuten gegeben werden. Wenden Sie den gesamten Inhalt des Infusionsbeutels an.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Die gemeinsame Anwendung mit Pimozid (siehe Abschnitte 4.4 und 4.5).
Die gemeinsame Anwendung mit Mutterkornalkaloiden (siehe Abschnitte 4.4 und 4.5).
Die gemeinsame Anwendung mit Johanniskraut (Hypericum perforatum) (siehe Abschnitt 4.5).
Bei Kombination von Letermovir mit Ciclosporin:
Die gemeinsame Anwendung mit Dabigatran, Atorvastatin, Simvastatin, Rosuvastatin oder Pitavastatin ist kontraindiziert (siehe Abschnitt 4.5).
Überwachung der CMV-DNA bei HSCT-Empfängern
Die Sicherheit und Wirksamkeit von Letermovir wurden in einer Phase-III-Studie (P001) bei HSCT-Empfängern mit einem negativen CMV-DNA-Testergebnis vor Einleitung der Prophylaxe nachgewiesen. Die CMV-DNA wurde wöchentlich bis Woche 14 nach Transplantation kontrolliert und anschließend alle 2 Wochen bis Woche 24. Im Falle einer klinisch signifikanten CMV-DNA-ämie oder einer CMV-Erkrankung wurde die Prophylaxe mit Letermovir beendet und eine Standardversorgung mit einer präemptiven Therapie (PET) oder eine Behandlung eingeleitet. Bei den Studienteilnehmern, bei denen eine Letermovir-Prophylaxe eingeleitet wurde und deren CMV-DNA-Test anschließend positiv war, konnte die Prophylaxe fortgesetzt werden, wenn die Kriterien für eine PET nicht erfüllt waren (siehe Abschnitt 5.1).
Risiko von Nebenwirkungen oder verminderter therapeutischer Wirkung durch Arzneimittelwechselwirkungen
Die gemeinsame Anwendung von Letermovir und bestimmten anderen Arzneimitteln kann zu bekannten oder potenziell signifikanten Arzneimittelwechselwirkungen führen. In einigen Fällen kann es zu folgenden Auswirkungen kommen:
möglichen klinisch signifikanten Nebenwirkungen infolge stärkerer Exposition gegenüber gemeinsam angewendeten anderen Arzneimitteln oder Letermovir,
signifikante Abnahme der Plasmakonzentrationen von gemeinsam angewendeten Arzneimitteln und damit verminderte therapeutische Wirkung des gemeinsam angewendeten Arzneimittels.
(siehe Abschnitt 4.5),
In Tabelle 2 sind Maßnahmen zur Vorbeugung oder zur Handhabung von diesen bekannten oder potenziell signifikanten Wechselwirkungen sowie Dosierungsempfehlungen angegeben (siehe Abschnitte 4.3 und 4.5).
Wechselwirkungen
Letermovir sollte zusammen mit Arzneimitteln, die CYP3A‑Substrate mit einer geringen therapeutischen Breite sind (z. B. Alfentanil, Fentanyl und Chinidin), mit Vorsicht angewendet werden, da eine gemeinsame Anwendung zu erhöhten Plasmakonzentrationen von CYP3A-Substraten führen kann. Eine engmaschige Überwachung und/oder Dosisanpassung von gemeinsam angewendeten CYP3A-Substraten wird empfohlen (siehe Abschnitt 4.5).
Generell wird eine engmaschigere Überwachung der Konzentrationen von Ciclosporin, Tacrolimus und Sirolimus in den ersten beiden Wochen nach Beginn und nach Beendigung der Anwendung von Letermovir sowie auch nach Änderung der Anwendungsart von Letermovir empfohlen.
Letermovir ist ein moderater Induktor von Enzymen und Transportern. Diese Induktion kann die Plasmakonzentrationen von einigen metabolisierten und transportierten Arzneimitteln senken (siehe Abschnitt 4.5). Ein therapeutisches Monitoring (therapeutic drug monitoring, TDM) wird daher für Voriconazol empfohlen. Die gemeinsame Anwendung von Dabigatran ist wegen des Risikos einer verminderten Wirksamkeit von Dabigatran zu vermeiden.
Letermovir kann die Plasmakonzentrationen von Arzneimitteln erhöhen, die von OATP1B1/3 transportiert werden, wie beispielsweise von vielen Statinen (siehe Abschnitt 4.5 und Tabelle 2).
Anwendung unter Verwendung eines sterilen 0,2 µm oder 0,22 µm Polyethersulfon(PES)-Inline-Filters
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung kann einige wenige produktbezogene kleine durchscheinende oder weiße Partikel enthalten. Die Anwendung der verdünnten Lösung von PREVYMIS muss immer mit einem sterilen 0,2 µm oder 0,22 µm PES-Inline-Filter erfolgen, unabhängig davon, ob diese produktbezogenen Partikel in der Durchstechflasche oder in der verdünnten Lösung sichtbar sind (siehe Abschnitte 4.2 und 6.6).
Sonstige Bestandteile
Natrium
Dieses Arzneimittel enthält 23 mg (1 mmol) Natrium pro 240-mg-Durchstechflasche, entsprechend 1,15 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/-kochsalzarmer) Diät.
Dieses Arzneimittel enthält 46 mg (2 mmol) Natrium pro 480-mg-Durchstechflasche, entsprechend 2,30 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/-kochsalzarmer) Diät.
Cyclodextrin
Dieses Arzneimittel enthält 300 mg Hydroxypropylbetadex (Cyclodextrin) pro 40-mg-Dosis.
Dieses Arzneimittel enthält 450 mg Hydroxypropylbetadex (Cyclodextrin) pro 60-mg-Dosis.
Dieses Arzneimittel enthält 900 mg Hydroxypropylbetadex (Cyclodextrin) pro 120-mg-Dosis.
Dieses Arzneimittel enthält 1 800 mg Hydroxypropylbetadex (Cyclodextrin) pro 240-mg-Dosis.
Dieses Arzneimittel enthält 3 600 mg Hydroxypropylbetadex (Cyclodextrin) pro 480-mg-Dosis.
Allgemeine Informationen über Unterschiede in der Exposition zwischen den verschiedenen Therapieregimen mit Letermovir
Die geschätzte Letermovir-Plasmaexposition ist unterschiedlich, abhängig vom gewählten Dosierungsregime (siehe Tabelle in Abschnitt 5.2). Daher sind die klinischen Auswirkungen der Letermovir-Wechselwirkungen abhängig vom gewählten Letermovir-Therapieregime und davon, ob Letermovir mit Ciclosporin kombiniert wird oder nicht.
Die Kombination von Ciclosporin und Letermovir kann zu stärker ausgeprägten oder zusätzlichen Wirkungen auf gleichzeitig angewendete Arzneimittel führen im Vergleich zur alleinigen Gabe von Letermovir (siehe Tabelle 2).
Wirkung anderer Arzneimittel auf Letermovir
Die Elimination von Letermovir erfolgt in vivo über biliäre Ausscheidung und Glucuronidierung. Die relative Bedeutung dieser Eliminationswege ist nicht bekannt. Bei beiden Eliminationswegen erfolgt die aktive Aufnahme in Hepatozyten über den hepatischen Aufnahmetransporter OATP1B1/3. Nach der Aufnahme wird die Glucuronidierung von Letermovir über UGT1A1 und 3 vermittelt. Außerdem scheint Letermovir dem P‑gp‑ und BCRP-vermittelten Efflux in Leber und Darm zu unterliegen (siehe Abschnitt 5.2).
Induktoren von metabolisierenden Enzymen oder Transportern
Die gemeinsame Anwendung von Letermovir (mit oder ohne Ciclosporin) mit starken oder moderaten Induktoren von Transportern (z. B. P-gp) und/oder Enzymen (z. B. UGTs) wird nicht empfohlen, da dies zu einem subtherapeutischen Plasmaspiegel von Letermovir führen kann (siehe Tabelle 2).
Beispiele für starke Induktoren sind Rifampicin, Phenytoin, Carbamazepin, Rifabutin und Phenobarbital.
Beispiele für moderate Induktoren sind Thioridazin, Modafinil, Ritonavir, Lopinavir, Efavirenz und Etravirin.
Die gemeinsame Anwendung mit Rifampicin führte zu einem initialen, klinisch nicht relevanten Anstieg der Plasmakonzentration von Letermovir (aufgrund von OATP1B1/3- und/oder P‑gp‑Inhibition), gefolgt von einer klinisch relevanten Abnahme der Plasmakonzentrationen von Letermovir (aufgrund der Induktion von P-gp/UGT) bei kontinuierlicher Anwendung von Rifampicin (siehe Tabelle 2).
Zusätzliche Wirkungen anderer Arzneimittel auf Letermovir, die bei einer Kombination mit Ciclosporin relevant sind
Inhibitoren von OATP1B1 oder 3
Die gemeinsame Anwendung von Letermovir mit Inhibitoren der OATP1B1/3-Transporter kann zu erhöhten Plasmakonzentrationen von Letermovir führen. Bei gemeinsamer Anwendung von Letermovir und Ciclosporin (einem potenten OATP1B1/3-Inhibitor) wird bei erwachsenen und pädiatrischen Patienten mit einem Gewicht von mindestens 30 kg eine einmal tägliche Dosis von 240 mg Letermovir empfohlen (siehe Tabelle 2 sowie Abschnitte 4.2 und 5.2). Wenn intravenöses Letermovir bei pädiatrischen Patienten mit einem Gewicht unter 30 kg gleichzeitig mit Ciclosporin angewendet wird, ist keine Dosisanpassung erforderlich (siehe Tabelle 2 und Abschnitte 4.2 und 5.2). Vorsicht ist geboten bei der gemeinsamen Anwendung von anderen OATP1B1/3-Inhibitoren mit Letermovir und Ciclosporin.
Beispiele für OATP1B1-Inhibitoren sind Gemfibrozil, Erythromycin, Clarithromycin sowie einige Proteaseinhibitoren (Atazanavir, Simeprevir).
Inhibitoren von P-gp/BCRP (Brustkrebs‑Resistenz‑Protein, breast cancer resistance protein, BCRP)
In-vitro-Ergebnisse zeigen, dass Letermovir ein P-gp-/BCRP-Substrat ist. Änderungen der Letermovir‑Plasmakonzentrationen aufgrund einer Inhibition von P-gp/BCRP durch Itraconazol sind klinisch nicht relevant.
Wirkung von Letermovir auf andere Arzneimittel
Arzneimittel, die hauptsächlich über den Stoffwechsel ausgeschieden oder durch aktiven Transport beeinflusst werden
Letermovir ist in aller Regel in vivo ein Induktor von Enzymen und Transportern. Im Allgemeinen kann eine Induktion erwartet werden, außer es wird gleichzeitig ein bestimmtes Enzym oder Transporter inhibiert (siehe unten). Daher kann Letermovir potenziell zu niedrigeren Plasmakonzentrationen und möglicherweise verminderter Wirksamkeit von gemeinsam angewendeten Arzneimitteln führen, die hauptsächlich über den Metabolismus oder durch aktiven Transport eliminiert werden.
Das Ausmaß des induzierenden Effekts hängt von der Art der Anwendung von Letermovir ab und davon, ob Letermovir gemeinsam mit Ciclosporin angewendet wird.
Der volle induzierende Effekt kann 10 bis 14 Tage nach Beginn der Anwendung von Letermovir erwartet werden. Die Zeit, die ein spezifisch betroffenes Arzneimittel jeweils braucht, den Steady State zu erreichen, wird ebenfalls die Zeit beeinflussen, bis die volle Wirkung auf die Plasmakonzentrationen erreicht ist.
In vitro ist Letermovir ein Inhibitor von CYP3A, CYP2C8, CYP2B6, BCRP, UGT1A1, OATP2B1 und OAT3 bei in vivo relevanten Konzentrationen. In-vivo-Studien zur Untersuchung des Nettoeffektes auf CYP3A4, P-gp, OATP1B1/3 sowie auf CYP2C19 stehen zur Verfügung. Der Nettoeffekt in vivo auf die anderen genannten Enzyme und Transporter ist nicht bekannt. Detaillierte Informationen werden nachfolgend aufgeführt.
Es ist nicht bekannt, ob Letermovir die Exposition von Piperacillin/Tazobactam, Amphotericin B und Micafungin beeinflusst. Mögliche Wechselwirkungen zwischen Letermovir und diesen Arzneimitteln wurden nicht untersucht. Aufgrund der Induktion besteht ein theoretisches Risiko für eine Senkung der Plasmaspiegel, deren Ausmaß und klinische Bedeutung jedoch gegenwärtig nicht bekannt sind.
Über CYP3A metabolisierte Arzneimittel
In vivo ist Letermovir ein moderater Inhibitor von CYP3A. Die gemeinsame Anwendung von Letermovir mit oralem Midazolam (ein CYP3A-Substrat) führt zu 2- bis 3‑fach erhöhten Plasmakonzentrationen von Midazolam. Die Anwendung von Letermovir kann zu klinisch relevanten Erhöhungen der Plasmakonzentrationen von gemeinsam angewendeten Substraten von CYP3A führen (siehe Abschnitte 4.3, 4.4 und 5.2).
Beispiele für solche Arzneimittel umfassen bestimmte Immunsuppressiva (z. B. Ciclosporin, Tacrolimus, Sirolimus), HMG-CoA-Reduktase‑Hemmer und Amiodaron (siehe Tabelle 2). Pimozid und Mutterkornalkaloide sind kontraindiziert (siehe Abschnitt 4.3).
Das Ausmaß des durch CYP3A verursachten inhibitorischen Effekts hängt von der Art der Anwendung von Letermovir ab und davon, ob Letermovir gemeinsam mit Ciclosporin angewendet wird.
Aufgrund der zeitabhängigen Inhibition und der gleichzeitigen Induktion wird der Nettoeffekt der Enzymhemmung möglicherweise erst nach 10 bis 14 Tagen erreicht. Die Zeitdauer, die ein spezifisch betroffenes Arzneimittel braucht, den Steady State zu erreichen, wird ebenfalls die Zeit beeinflussen, bis die volle Wirkung auf die Plasmakonzentrationen erreicht ist. Nach dem Behandlungsende dauert es 10 bis 14 Tage, bis der inhibitorische Effekt verschwunden ist. Bei einer Überwachung wird empfohlen, diese in den ersten beiden Wochen nach Beginn und Absetzen der Anwendung von Letermovir durchzuführen (siehe Abschnitt 4.4) sowie bei Änderung der Anwendungsart von Letermovir.
Von OATP1B1/3 transportierte Arzneimittel
Letermovir ist ein Inhibitor von OATP1B1/3-Transportern. Die Anwendung von Letermovir kann zu einem klinisch relevanten Anstieg der Plasmakonzentrationen von gemeinsam angewendeten Arzneimitteln, die Substrate von OATP1B1/3 sind, führen.
Beispiele für solche Arzneimittel umfassen HMG-CoA-Reduktase‑Hemmer, Fexofenadin, Repaglinid und Glibenclamid (siehe Tabelle 2). Bei Vergleich der Letermovir-Regime ohne Ciclosporin ist die Wirkung nach intravenöser Gabe ausgeprägter als nach oraler Gabe von Letermovir.
Das Ausmaß der durch OATP1B1/3 vermittelten Inhibition auf andere gemeinsam angewendete Arzneimittel ist vermutlich größer, wenn Letermovir zusammen mit Ciclosporin (einem potenten OATP1B1/3-Inhibitor) angewendet wird. Dies ist zu beachten, wenn das Letermovir-Regime während der Behandlung mit einem OATP1B1/3-Substrat geändert wird.
Über CYP2C9 und/oder CYP2C19 metabolisierte Arzneimittel
Die gemeinsame Anwendung von Letermovir mit Voriconazol (ein CYP2C19-Substrat) führt zu signifikant verminderten Voriconazol-Plasmakonzentrationen, was darauf hindeutet, dass Letermovir ein Induktor von CYP2C19 ist. Auch CYP2C9 wird vermutlich induziert. Letermovir kann die Exposition von CYP2C9- und/oder CYP2C19-Substraten verringern, so dass möglicherweise subtherapeutische Konzentrationen erreicht werden.
Zu diesen Arzneimitteln zählen u. a. Warfarin, Voriconazol, Diazepam, Lansoprazol, Omeprazol, Esomeprazol, Pantoprazol, Tilidin und Tolbutamid (siehe Tabelle 2).
Es wird davon ausgegangen, dass die Wirkung bei oraler Anwendung von Letermovir ohne Ciclosporin nicht so ausgeprägt ist, wie unter intravenöser Anwendung von Letermovir mit oder ohne Ciclosporin oder oraler Anwendung von Letermovir mit Ciclosporin. Dies ist zu beachten, wenn das Letermovir-Regime während der Behandlung mit einem CYP2C9- oder CYP2C19-Substrat geändert wird. Bitte beachten Sie bezüglich des zeitlichen Verlaufs der Interaktion auch die obenstehenden allgemeinen Hinweise zur Induktion.
Über CYP2C8 metabolisierte Arzneimittel
In vitro hemmt Letermovir CYP2C8, kann aber aufgrund seines Induktionspotenzials CYP2C8 auch induzieren. Der Nettoeffekt in vivo ist nicht bekannt.
Zu den Arzneimitteln, die hauptsächlich über CYP2C8 eliminiert werden, zählt Repaglinid (siehe Tabelle 2). Die gemeinsame Anwendung von Repaglinid und Letermovir mit oder ohne Ciclosporin wird nicht empfohlen.
Arzneimittel, die intestinal über P-gp transportiert werden
Letermovir ist ein Induktor intestinalen P-gps. Die Anwendung von Letermovir kann die Plasmakonzentrationen gemeinsam angewendeter Arzneimittel, für die der intestinale P-gp-Transport eine wichtige Rolle spielt, wie z. B. bei Dabigatran und Sofosbuvir, in klinisch bedeutsamem Ausmaß verringern.
Arzneimittel, die über CYP2B6 oder UGT1A1 metabolisiert oder von BCRP oder OATP2B1 transportiert werden
Letermovir ist in vivo allgemein ein Induktor von CYP2B6 und UGT1A1, aber es wurde auch beobachtet, dass es in vitro CYP2B6, UGT1A1, BCRP und OATP2B1 inhibiert. Der Nettoeffekt in vivo ist nicht bekannt. Daher können die Plasmakonzentrationen von Arzneimitteln, die Substrate dieser Enzyme oder Transporter sind, bei Kombination mit Letermovir ansteigen oder sinken. Eine zusätzliche Überwachung kann notwendig sein; beachten Sie dazu die Fachinformationen solcher Arzneimittel.
Ein Beispiel für CYP2B6-metabolisierte Arzneimittel ist Bupropion.
Beispiele für UGT1A1-metabolisierte Arzneimittel sind Raltegravir und Dolutegravir.
Beispiele für BCRP-transportierte Arzneimittel sind Rosuvastatin und Sulfasalazin.
Ein Beispiel für OATP2B1-transportierte Arzneimittel ist Celiprolol.
Arzneimittel, die über den renalen Transporter OAT3 transportiert werden
In-vitro-Daten legen nahe, dass Letermovir ein Inhibitor von OAT3 ist; daher kann Letermovir auch in vivo ein OAT3-Inhibitor sein. Die Plasmakonzentrationen von Arzneimitteln, die über OAT3 transportiert werden, können ansteigen.
Beispiele für OAT3-transportierte Arzneimittel sind Ciprofloxacin, Tenofovir, Imipenem und Cilastatin.
Allgemeine Informationen
Falls aufgrund einer Anwendung von Letermovir Dosisanpassungen von gleichzeitig angewendeten Arzneimitteln durchgeführt werden, sollten nach Beendigung der Anwendung von Letermovir die Dosen wieder neu angepasst werden. Eine Dosisanpassung kann auch bei einem Wechsel der Art der Anwendung oder des Immunsuppressivums erforderlich sein.
Tabelle 2 enthält eine Liste von bekannten oder potenziell klinisch signifikanten Wechselwirkungen. Die aufgeführten Wechselwirkungen basieren auf Studien mit Erwachsenen, die mit Letermovir durchgeführt wurden, oder sind zu erwartende Wechselwirkungen, die unter Letermovir auftreten können (siehe Abschnitte 4.3, 4.4, 5.1 und 5.2).
Tabelle 2: Wechselwirkungen und Dosierungsempfehlungen für die gemeinsame Anwendung mit anderen Arzneimitteln. Beachten Sie, dass die Tabelle nicht vollständig ist, aber Beispiele für klinisch relevante Wechselwirkungen aufführt. Beachten Sie auch die obenstehenden allgemeinen Informationen zu Wechselwirkungen.
Soweit nicht anders angegeben, wurden die Studien zu Wechselwirkungen mit oral gegebenem Letermovir ohne Ciclosporin bei Erwachsenen durchgeführt. Bitte berücksichtigen Sie, dass das Interaktionspotenzial und die klinischen Auswirkungen unterschiedlich sein können, je nachdem, ob Letermovir oral oder intravenös angewendet wird oder ob es gemeinsam mit Ciclosporin angewendet wird. Bei Änderung der Anwendungsart oder Wechsel des Immunsuppressivums sind die Empfehlungen zu Kombinationen erneut zu beachten. |
Gleichzeitig angewendete Arzneimittel | Wirkung auf Konzentration† | Empfehlungen bei gemeinsamer Anwendung mit Letermovir |
Antibiotika | ||
Nafcillin | Interaktion nicht untersucht. | Nafcillin kann die Plasmakonzentration von Letermovir verringern. |
Antimykotika | ||
Fluconazol | ↔ Fluconazol | Keine Dosisanpassung erforderlich. |
Itraconazol | ↔ Itraconazol | Keine Dosisanpassung erforderlich. |
Posaconazol‡ | ↔ Posaconazol | Keine Dosisanpassung erforderlich. |
Voriconazol‡ | ↓ Voriconazol | Falls eine gemeinsame Anwendung erforderlich ist, wird ein TDM für Voriconazol in den ersten beiden Wochen nach Beginn oder Beendigung der Anwendung von Letermovir sowie bei Änderung der Anwendungsart von Letermovir oder des Immunsuppressivums empfohlen. |
Antimykobakterielle Wirkstoffe | ||
Rifabutin | Interaktion nicht untersucht. | Rifabutin kann die Plasmakonzentration von Letermovir reduzieren. |
Rifampicin | Mehrfachdosen von Rifampicin reduzieren die Plasmakonzentration von Letermovir. | |
(600 mg Einzeldosis oral)/Letermovir (480 mg Einzeldosis oral) | ↔ Letermovir | |
(600 mg Einzeldosis intravenös)/Letermovir (480 mg Einzeldosis oral) | ↔ Letermovir | |
(600 mg einmal täglich oral)/Letermovir (480 mg einmal täglich oral) | ↓ Letermovir | |
(600 mg einmal täglich oral [24 Stunden nach der Anwendung von Rifampicin])§/Letermovir (480 mg einmal täglich oral) | ↓ Letermovir | |
Antipsychotika | ||
Thioridazin | Interaktion nicht untersucht. | Thioridazin kann die Plasmakonzentration von Letermovir reduzieren. |
Endothelinantagonisten | ||
Bosentan | Interaktion nicht untersucht. | Bosentan kann die Plasmakonzentration von Letermovir reduzieren. |
Virostatika | ||
Aciclovir‡ | ↔ Aciclovir | Keine Dosisanpassung erforderlich. |
Valaciclovir | Interaktion nicht untersucht. | Keine Dosisanpassung erforderlich. |
Pflanzliche Präparate | ||
Johanniskraut (Hypericum perforatum) | Interaktion nicht untersucht. | Johanniskraut kann die Plasmakonzentration von Letermovir reduzieren. |
HIV-Medikamente | ||
Efavirenz | Interaktion nicht untersucht. | Efavirenz kann die Plasmakonzentration von Letermovir reduzieren. |
Etravirin, Nevirapin, Ritonavir, Lopinavir | Interaktion nicht untersucht. | Diese antiretroviralen Arzneimittel können die Plasmakonzentration von Letermovir reduzieren. |
HMG-CoA‑Reduktase‑Hemmer | ||
Atorvastatin‡ | ↑ Atorvastatin | Statin-bedingte Nebenwirkungen wie Myopathien sollten engmaschig überwacht werden. Bei gemeinsamer Anwendung von Letermovir sollte die Atorvastatin-Dosis 20 mg täglich nicht überschreiten#. Obwohl nicht untersucht, wird erwartet, dass bei gemeinsamer Anwendung von Letermovir mit Ciclosporin das Ausmaß des Anstiegs der Plasmakonzentrationen von Atorvastatin größer ist als bei alleiniger Gabe von Letermovir. |
Simvastatin, | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentrationen dieser Statine erheblich erhöhen. Daher wird eine gleichzeitige Anwendung mit Letermovir allein nicht empfohlen. |
Fluvastatin, Pravastatin | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentrationen von Statinen erhöhen. Bei gemeinsamer Anwendung von Letermovir mit Ciclosporin wird Pravastatin nicht empfohlen, während für Fluvastatin unter Umständen eine Dosisreduktion erforderlich ist#. Statin-bedingte Nebenwirkungen wie z. B. Myopathie sollten engmaschig überwacht werden. |
Immunsuppressiva | ||
Ciclosporin | ↑ Ciclosporin | Falls Letermovir gemeinsam mit Ciclosporin angewendet wird, sollte die Dosis von Letermovir bei Erwachsenen auf 240 mg einmal täglich reduziert werden (siehe Abschnitte 4.2 und 5.1), ebenso bei pädiatrischen Patienten mit einem Gewicht über 30 kg (siehe Abschnitt 4.2). Wenn intravenöses Letermovir bei pädiatrischen Patienten mit einem Gewicht unter 30 kg gleichzeitig mit Ciclosporin angewendet wird, ist keine Dosisanpassung erforderlich (siehe Abschnitt 4.2). |
Ciclosporin | ↑ Letermovir | |
Mycophenolatmofetil | ↔ Mycophenolsäure | Keine Dosisanpassung erforderlich. |
Sirolimus‡ | ↑ Sirolimus | Die Vollblutkonzentration von Sirolimus sollte engmaschig überwacht werden, während Letermovir angewendet, wenn die Anwendungsart geändert und wenn es abgesetzt wird. Die Dosis von Sirolimus sollte entsprechend angepasst werden#. |
Tacrolimus | ↑ Tacrolimus | Die Vollblutkonzentration von Tacrolimus sollte engmaschig überwacht werden, während Letermovir angewendet, wenn die Anwendungsart geändert und wenn es abgesetzt wird. Die Dosis von Tacrolimus sollte entsprechend angepasst werden#. |
Tacrolimus | ↔ Letermovir | |
Orale Kontrazeptiva | ||
Ethinylestradiol (EE) (0,03 mg)/Levonorgestrel (LNG)‡ | ↔ EE | Keine Dosisanpassung erforderlich. |
Andere Kontrazeptiva mit systemischer Wirkung | Risiko für ↓ kontrazeptiver Steroide | Letermovir kann die Plasmakonzentrationen anderer oraler kontrazeptiver Steroide reduzieren und dadurch deren Wirksamkeit beeinträchtigen. Um einen angemessenen kontrazeptiven Schutz mit einem oralen Kontrazeptivum zu gewährleisten, sollten solche Kontrazeptiva gewählt werden, die Ethinylestradiol und Levonorgestrel enthalten. |
Antidiabetika | ||
Repaglinid | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Repaglinid erhöhen oder reduzieren (der Nettoeffekt ist nicht bekannt). |
Glibenclamid | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Glibenclamid erhöhen. |
Antiepileptika (siehe auch allgemeiner Teil) | ||
Carbamazepin, | Interaktion nicht untersucht. | Carbamazepin oder Phenobarbital können die Plasmakonzentration von Letermovir reduzieren. |
Phenytoin | Interaktion nicht untersucht. | Phenytoin kann die Plasmakonzentration von Letermovir reduzieren. |
Orale Antikoagulanzien | ||
Warfarin | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Warfarin reduzieren. |
Dabigatran | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Dabigatran reduzieren und seine Wirksamkeit vermindern. Aufgrund des Risikos einer verminderten Wirksamkeit von Dabigatran ist die gemeinsame Anwendung zu vermeiden. |
Sedativa | ||
Midazolam Midazolam (2 mg Einzeldosis oral)/Letermovir (240 mg einmal täglich oral) | ↑ Midazolam | Bei gemeinsamer Anwendung von Letermovir mit Midazolam sollte eine engmaschige klinische Überwachung hinsichtlich einer Atemdepression und/oder einer verlängerten Sedierung vorgenommen werden. Eine Dosisanpassung von Midazolam sollte in Betracht gezogen werden#. Der Anstieg der Plasmakonzentrationen von Midazolam kann größer sein, wenn Midazolam oral gemeinsam mit Letermovir in klinischer Dosis gegeben wird, als bei der untersuchten Dosis. |
Opioidagonisten | ||
Beispiele: Alfentanil, Fentanyl | Interaktion nicht untersucht. | Eine engmaschige Überwachung hinsichtlich mit diesen Arzneimitteln assoziierten Nebenwirkungen wird während einer gemeinsamen Anwendung empfohlen. Eine Dosisanpassung der über CYP3A metabolisierten Opioide kann erforderlich sein# (siehe Abschnitt 4.4). |
Antiarrhythmika | ||
Amiodaron | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Amiodaron erhöhen. |
Chinidin | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentration von Chinidin erhöhen. |
Kardiovaskuläre Arzneimittel | ||
Digoxin‡ | ↔ Digoxin | Keine Dosisanpassung erforderlich. |
Protonenpumpen-Hemmer | ||
Omeprazol | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentrationen von CYP2C19‑Substraten reduzieren. |
Pantoprazol | Interaktion nicht untersucht. | Letermovir kann die Plasmakonzentrationen von CYP2C19‑Substraten reduzieren. |
Psychostimulanzien | ||
Modafinil | Interaktion nicht untersucht. | Modafinil kann die Plasmakonzentration von Letermovir reduzieren. |
* Diese Tabelle ist nicht vollständig. | ||
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
Schwangerschaft
Es liegen keine Daten über die Anwendung von Letermovir bei Schwangeren vor. Studien an Tieren haben Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Letermovir wird während einer Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Empfängnisverhütung verwenden, nicht empfohlen.
Stillzeit
Es ist nicht bekannt, ob Letermovir in die Muttermilch übertritt. Verfügbare pharmakodynamische/toxikologische Daten von Tieren zeigten, dass Letermovir in die Muttermilch übertritt (siehe Abschnitt 5.3). Ein Risiko für Neugeborene/Kleinkinder kann nicht ausgeschlossen werden. Unter Berücksichtigung des Vorteils des Stillens für das Kind und des Vorteils der Therapie für die stillende Frau ist zu entscheiden, ob abzustillen ist oder die Anwendung von Letermovir zu beenden ist bzw. auf die Anwendung verzichtet wird.
Fertilität
Bei Ratten zeigten sich keine Auswirkungen auf die weibliche Fertilität. Eine irreversible testikuläre Toxizität und eine Beeinträchtigung der Fertilität wurden bei männlichen Ratten beobachtet, jedoch nicht bei männlichen Mäusen oder männlichen Affen (siehe Abschnitt 5.3).
Letermovir kann einen geringfügigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Bei einigen Studienteilnehmern wurden während der Behandlung mit Letermovir Ermüdung (Fatigue) und Schwindel (Vertigo) berichtet, welche die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen können (siehe Abschnitt 4.8).
Zusammenfassung des Sicherheitsprofils
Die Bewertung der Sicherheit von Letermovir beruht auf drei klinischen Phase-III-Studien.
HSCT
In der Studie P001 erhielten 565 erwachsene HSCT-Empfänger Letermovir oder Placebo über 14 Wochen nach Transplantation und wurden hinsichtlich der Sicherheit bis Woche 24 nach Transplantation nachbeobachtet (siehe Abschnitt 5.1). Die am häufigsten berichteten Nebenwirkungen, die bei mindestens 1 % der Studienteilnehmer in der Letermovir-Gruppe und häufiger als unter Placebo auftraten, waren: Übelkeit (7,2 %), Diarrhö (2,4 %) und Erbrechen (1,9 %). Die am häufigsten berichteten Nebenwirkungen, die zum Absetzen von Letermovir führten, waren Übelkeit (1,6 %), Erbrechen (0,8 %) und abdominaler Schmerz (0,5 %).
In der Studie P040 erhielten 218 erwachsene HSCT-Empfänger Letermovir oder Placebo von Woche 14 (~ 100 Tage) bis Woche 28 (~ 200 Tage) nach der HSCT und wurden hinsichtlich der Sicherheit bis Woche 48 nach der HSCT nachbeobachtet (siehe Abschnitt 5.1). Die gemeldeten Nebenwirkungen stimmten mit dem in Studie P001 beschriebenen Sicherheitsprofil von Letermovir überein.
Nierentransplantation
In der Studie P002 erhielten 292 erwachsene Nierentransplantatempfänger Letermovir bis Woche 28 (~ 200 Tage) nach der Transplantation (siehe Abschnitt 5.1).
Tabellarische Zusammenfassung der Nebenwirkungen
Die folgenden Nebenwirkungen wurden bei erwachsenen Studienteilnehmern beschrieben, die Letermovir in klinischen Studien erhielten. Die Nebenwirkungen sind im Folgenden nach Systemorganklasse und Häufigkeit aufgelistet. Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥ 1/10); häufig (≥ 1/100 bis < 1/10); gelegentlich (≥ 1/1 000 bis < 1/100); selten (≥ 1/10 000 bis < 1/1 000) oder sehr selten (< 1/10 000).
Tabelle 3: Unter Letermovir beschriebene Nebenwirkungen
Häufigkeit | Nebenwirkungen |
Erkrankungen des Immunsystems | |
Gelegentlich | Überempfindlichkeit |
Stoffwechsel- und Ernährungsstörungen | |
Gelegentlich | verminderter Appetit |
Erkrankungen des Nervensystems | |
Gelegentlich | Veränderung der Geschmackswahrnehmung, Kopfschmerz |
Erkrankungen des Ohrs und des Labyrinths | |
Gelegentlich | Schwindel (Vertigo) |
Erkrankungen des Gastrointestinaltrakts | |
Häufig | Übelkeit, Diarrhö, Erbrechen |
Gelegentlich | abdominaler Schmerz |
Leber- und Gallenerkrankungen | |
Gelegentlich | erhöhte Alaninaminotransferase, erhöhte Aspartataminotransferase |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
Gelegentlich | Muskelspasmen |
Erkrankungen der Nieren und Harnwege | |
Gelegentlich | Kreatinin im Blut erhöht |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
Gelegentlich | Ermüdung (Fatigue), peripheres Ödem |
Kinder und Jugendliche
Die Sicherheitsbewertung von Letermovir bei pädiatrischen Patienten von der Geburt bis zu Patienten unter 18 Jahren basierte auf einer klinischen Phase-2b-Studie (P030). In P030 wurden 63 HSCT-Empfänger bis Woche 14 nach der HSCT mit Letermovir behandelt. Die Altersverteilung war wie folgt: 28 Jugendliche, 14 Kinder im Alter von 7 bis unter 12 Jahren, 13 im Alter von 2 bis unter 7 Jahren und 8 unter 2 Jahren (davon 5 unter 1 Jahr). Die Nebenwirkungen stimmten mit denen überein, die in klinischen Studien mit Letermovir bei Erwachsenen beobachtet wurden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
Es liegen keine Erfahrungen zu Überdosierungen mit Letermovir beim Menschen vor. In klinischen Phase-I-Studien erhielten 86 gesunde erwachsene Studienteilnehmer über einen Zeitraum von bis zu 14 Tagen Letermovir in Dosen von 720 mg/Tag bis 1 440 mg/Tag. Das Nebenwirkungsprofil war vergleichbar mit dem unter der klinischen Dosis von 480 mg/Tag. Es gibt kein spezifisches Antidot bei Überdosierungen mit Letermovir. Im Falle einer Überdosierung wird empfohlen, den Patienten auf Nebenwirkungen hin zu überwachen und eine geeignete symptomatische Behandlung einzuleiten.
Es ist unbekannt, ob eine Dialyse zu einer nennenswerten Eliminierung von Letermovir aus der systemischen Zirkulation führen wird.
Pharmakotherapeutische Gruppe: Antivirale Mittel zur systemischen Anwendung, direkt wirkende Antiinfektiva, ATC-Code: J05AX18
Wirkmechanismus
Letermovir hemmt den CMV-DNA-Terminase-Komplex, welcher für die Spaltung und Verpackung viraler Nachkommen-DNA erforderlich ist. Letermovir beeinflusst die Bildung von Genomen einheitlicher Länge und beeinträchtigt die Virion‑Reifung.
Antivirale Aktivität
Der mediane EC50-Wert (mittlere effektive Konzentration) von Letermovir betrug gegenüber einer Sammlung von klinischen CMV-Isolaten in einem Infektions-Zellkulturmodell 2,1 nM (Bereich 0,7 nM bis 6,1 nM; n = 74).
Virale Resistenz
In Zellkulturen
Die CMV-Gene UL51, UL56 und UL89 kodieren für die Untereinheiten der CMV-DNA-Terminase. CMV‑Mutanten mit verminderter Empfindlichkeit gegenüber Letermovir wurden in Zellkulturen bestätigt. EC50-Werte für rekombinante CMV-Mutationen, welche die Substitutionen in pUL51 (P91S), pUL56 (C25F, S229F, V231A, V231L, V236A, T244K, T244R, L254F, L257F, L257I, F261C, F261L, F261S, Y321C, L328V, M329T, A365S, N368D) und pUL89 (N320H, D344E) exprimieren, waren 1,6- bis < 10‑fach höher als die für das Wildtyp-Referenzvirus; diese Substitutionen sind wahrscheinlich klinisch nicht relevant. Die EC50-Werte für rekombinante CMV‑Mutationen, welche die pUL51-Substitution A95V oder die pUL56-Substitutionen N232Y, V236L, V236M, E237D, E237G, L241P, K258E, C325F, C325R, C325W, C325Y, R369G, R369M, R369S und R369T exprimieren, waren 10- bis 9 300‑fach höher als die für das Wildtyp-Referenzvirus; einige dieser Substitutionen wurden in Patienten beobachtet, bei denen in klinischen Studien die Prophylaxe versagt hatte (siehe unten).
In klinischen Studien
In einer Phase-IIb-Studie, in der Letermovir-Dosen von 60, 120 oder 240 mg/Tag oder Placebo bis zu 84 Tage bei 131 erwachsenen HSCT-Empfängern untersucht wurden, wurde eine DNA-Sequenzanalyse einer ausgewählten Region von UL56 (Aminosäuren 231 bis 369) an Proben von 12 mit Letermovir-behandelten Studienteilnehmern durchgeführt, bei denen die Prophylaxe versagt hatte und für die Proben zur Analyse zur Verfügung standen. Ein Studienteilnehmer (der 60 mg/Tag erhielt) wies eine Letermovir-resistente genotypische Variante (GV) (V236M) auf.
In einer Phase-III-Studie (P001) wurde eine DNA-Sequenzanalyse der gesamten kodierenden Regionen von UL56 und UL89 mit 40 Proben von Letermovir-behandelten erwachsenen Studienteilnehmern in der FAS‑Population durchgeführt, bei denen die Prophylaxe versagt hatte und für die Proben zur Analyse zur Verfügung standen. Bei zwei Studienteilnehmern wurden Letermovir-resistente genotypische Varianten (GVs) nachgewiesen, beide mit Substitutionen in pUL56. Ein Studienteilnehmer wies die Substitution V236M und der andere Studienteilnehmer die Substitution E237G auf. Bei einem weiteren Studienteilnehmer, der detektierbare CMV-DNA zu Studienbeginn aufwies (und dadurch nicht zur FAS-Population gehörte), wurden nach dem Absetzen der Letermovir-Anwendung die pUL56 Substitutionen C325W und R369T nachgewiesen.
In einer Phase-III-Studie (P040) wurde eine DNA-Sequenzanalyse der gesamten kodierenden Regionen von UL51, UL56 und UL89 an Proben von 32 erwachsenen Studienteilnehmern (unabhängig von der Behandlungsgruppe) durchgeführt, bei denen ein Versagen der Prophylaxe auftrat oder welche die Behandlung aufgrund einer CMV-Virämie vorzeitig abbrachen. Es wurden keine Letermovir-Resistenz-assoziierten Substitutionen über dem validierten Testgrenzwert von 5% festgestellt.
In einer Phase-III-Studie (P002) wurde eine DNA-Sequenzanalyse der gesamten kodierenden Regionen von UL51, UL56 und UL89 an Proben von 52 mit Letermovir behandelten erwachsenen Studienteilnehmern durchgeführt, bei denen eine CMV-Erkrankung auftrat oder welche die Behandlung aufgrund einer CMV-Virämie vorzeitig abbrachen. Es wurden keine Letermovir-Resistenz-assoziierten Substitutionen über dem validierten Testgrenzwert von 5 % festgestellt.
In einer Phase-2b-Studie (P030) wurde eine DNA-Sequenzanalyse der gesamten kodierenden Regionen von UL51, UL56 und UL89 an Proben durchgeführt, die von 10 mit Letermovir behandelten pädiatrischen Studienteilnehmern bei einem Besuch zur Beurteilung einer CMV-Infektion entnommen wurden. Bei zwei Studienteilnehmern wurden insgesamt zwei Letermovir-Resistenz-assoziierte Substitutionen festgestellt, die beide auf pUL56 abgebildet sind. Ein Studienteilnehmer hatte die Substitution R369S und der andere hatte die Substitution C325W.
Kreuzresistenz
Eine Kreuzresistenz mit Arzneimitteln mit einem anderen Wirkmechanismus ist unwahrscheinlich. Letermovir ist vollständig wirksam gegenüber Viruspopulationen mit Substitutionen, die eine Resistenz gegenüber CMV-DNA-Polymerase-Hemmern (Ganciclovir, Cidofovir und Foscarnet) vermitteln. Eine Gruppe rekombinanter CMV-Stämme mit Substitutionen, die eine Resistenz gegenüber Letermovir vermitteln, war vollständig empfindlich gegen Cidofovir, Foscarnet und Ganciclovir, mit Ausnahme eines rekombinanten Stammes mit der pUL56 E237G-Substitution, die eine 2,1‑fache Verringerung der Ganciclovir-Empfindlichkeit im Vergleich zum Wildtyp vermittelt.
Kardiale Elektrophysiologie
Der Einfluss von Letermovir in Dosen von bis zu 960 mg intravenös auf das QTc-Intervall wurde in einer randomisierten, mit Einzeldosen durchgeführten, Placebo- und Verum-kontrollierten (Moxifloxacin 400 mg, oral) 4-phasischen Crossover‑Thorough-QT-Studie an 38 gesunden erwachsenen Studienteilnehmern untersucht. Bei intravenöser Gabe von 960 mg führte Letermovir zu keiner klinisch relevanten Verlängerung des QTc-Intervalls, wobei die Plasmakonzentrationen ca. 2‑fach höher waren als bei einer 480 mg intravenösen Dosis.
Klinische Wirksamkeit und Sicherheit
Erwachsene CMV-seropositive Empfänger [R+] einer allogenen hämatopoetischen Stammzelltransplantation (HSCT)
P001: Prophylaxe bis Woche 14 (~ 100 Tage) nach HSCT
Zur Beurteilung der Letermovir-Prophylaxe als präventive Strategie gegen CMV-Reaktivierungen oder -Erkrankungen wurde die Wirksamkeit von Letermovir in einer multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studie (P001) bei erwachsenen CMV-seropositiven Empfängern [R+] einer allogenen HSCT untersucht. Die Studienteilnehmer erhielten randomisiert (2:1) entweder Letermovir in einer Dosis von 480 mg einmal täglich angepasst auf 240 mg bei gemeinsamer Gabe mit Ciclosporin oder Placebo. Die Randomisierung erfolgte stratifiziert nach Studienzentrum und anhand des Risikos (hoch vs. niedrig) für eine CMV-Reaktivierung zum Zeitpunkt des Einschlusses der Studienteilnehmer. Die Behandlung mit Letermovir wurde nach HSCT (Tag 0 – 28 nach HSCT) begonnen und bis Woche 14 nach der HSCT fortgesetzt. Letermovir wurde entweder oral oder intravenös angewendet; die Dosierung von Letermovir war gleich und unabhängig von der Art der Anwendung. Die Studienteilnehmer wurden bis einschließlich Woche 24 nach der HSCT und anschließend kontinuierlich bis Woche 48 nach HSCT bezüglich des primären Wirksamkeitsendpunkts nachbeobachtet.
Die Studienteilnehmer wurden bis Woche 14 nach der HSCT wöchentlich und bis Woche 24 nach der HSCT alle 2 Wochen auf CMV-DNA untersucht, wobei eine präemptive Standardversorgung eingeleitet wurde, wenn die CMV-DNA-ämie als klinisch signifikant angesehen wurde. Die Studienteilnehmer wurden dann bis Woche 48 nach HSCT nachbeobachtet.
Von den 565 behandelten Studienteilnehmern erhielten 373 Studienteilnehmer Letermovir (darunter 99 Studienteilnehmer, die mindestens eine intravenöse Dosis erhielten) und 192 Placebo (darunter 48 Studienteilnehmer, die mindestens eine intravenöse Dosis erhielten). Die mediane Dauer bis zum Beginn der Letermovir-Anwendung betrug 9 Tage nach Transplantation. Bei 37 % der Studienteilnehmer war das Engraftment zu Studienbeginn erfolgt. Das mediane Alter betrug 54 Jahre (Bereich: 18 bis 78 Jahre); 56 Studienteilnehmer (15,0 %) waren mindestens 65 Jahre alt: 58 % waren männlich; 82 % waren weiß; 10 % waren asiatischer Herkunft; 2 % waren schwarz oder afrikanischer Herkunft und 7 % waren hispanischer oder lateinamerikanischer Herkunft. Zu Studienbeginn erhielten 50 % der Studienteilnehmer ein myeloablatives Regime, 52 % erhielten Ciclosporin und 42 % erhielten Tacrolimus. Die häufigsten primären Gründe für die Transplantation waren akute myeloische Leukämie (38 %), myeloblastisches Syndrom (15 %) und Lymphom (13 %). 12 % der Studienteilnehmer waren zu Studienbeginn CMV-DNA-positiv.
Zu Studienbeginn hatten 31 % der Studienteilnehmer ein hohes Risiko für eine Reaktivierung, definiert durch eines oder mehrere der folgenden Kriterien: Bezüglich des humanen Leukozyten‑Antigens (HLA) verwandte (Geschwister-) Spender mit mindestens einer Diskrepanz an einem der folgenden drei HLA-Gen-Loci: HLA-A, -B oder -DR, haplo-identischer Spender; nicht verwandter Spender mit mindestens einer Diskrepanz an einem der folgenden vier HLA‑Gen-Loci: HLA‑A, ‑B, ‑C und ‑DRB1; Verwendung von Nabelschnurblut als Stammzellquelle; Verwendung von ex vivo T-Zell‑depletierten Transplantaten; Graft-Versus-Host-Disease (GVHD) Grad 2 oder höher, die systemische Kortikosteroide erfordert.
Primärer Wirksamkeitsendpunkt
Der primäre Wirksamkeitsendpunkt der klinisch signifikanten CMV-Infektion wurde in P001 definiert durch die Häufigkeit einer CMV-DNA-ämie mit erforderlicher präemptiver Anti‑CMV‑Therapie (PET) oder durch das Auftreten einer CMV‑Endorganerkrankung. Es wurde nach dem Non-Completer = Failure (NC = F)-Ansatz vorgegangen, wonach jeder Studienteilnehmer als Prophylaxeversager galt, der die Studie vor Woche 24 nach HSCT abbrach oder bei dem in Woche 24 nach HSCT kein Ergebnis vorlag.
Letermovir zeigte in der Analyse des primären Endpunkts eine überlegene Wirksamkeit gegenüber Placebo, wie in Tabelle 4 dargestellt. Der geschätzte Anwendungsunterschied von −23,5 % war statistisch signifikant (einseitiger p-Wert < 0,0001).
Tabelle 4: P001: Ergebnisse zur Wirksamkeit bei HSCT-Empfängern ([NC = F]-Ansatz, FAS‑Population)
Letermovir | Placebo | |
(N = 325) | (N = 170) | |
Parameter | n (%) | n (%) |
Primärer Wirksamkeitsendpunkt (Anteil der Studienteilnehmer mit Prophylaxe-Versagen bis Woche 24) | 122 (37,5) | 103 (60,6) |
| ||
Klinisch signifikante CMV-Infektion | 57 (17,5) | 71 (41,8) |
CMV-DNA-ämie mit erforderlicher Anti-CMV-PET | 52 (16,0) | 68 (40,0) |
CMV-Endorganerkrankung | 5 (1,5) | 3 (1,8) |
Studienabbruch | 56 (17,2) | 27 (15,9) |
Fehlendes Ergebnis | 9 (2,8) | 5 (2,9) |
Stratum-adjustierter Anwendungsunterschied (Letermovir‑Placebo)§ | ||
Unterschied (95% KI) | −23,5 (−32,5, −14,6) | |
p-Wert | < 0,0001 | |
† Die Kategorien für ein Prophylaxeversagen schließen sich gegenseitig aus und basieren auf der Hierarchie der Kategorien in der aufgeführten Reihenfolge. | ||
Zu den Faktoren, die mit einer CMV-DNA-ämie nach Woche 14 nach HSCT bei Letermovir-behandelten Studienteilnehmern assoziiert waren, zählten ein hohes Risiko für eine CMV‑Reaktivierung zu Studienbeginn, GVHD und Anwendung von Kortikosteroiden sowie ein CMV-seronegativer Spenderstatus.
Abbildung 1: P001: Kaplan-Meier‑Kurve über die Zeit bis zur Einleitung einer Anti-CMV-PET oder dem Ausbruch einer CMV-Endorganerkrankung bis Woche 24 nach Transplantation bei HSCT‑Empfängern (FAS‑Population)
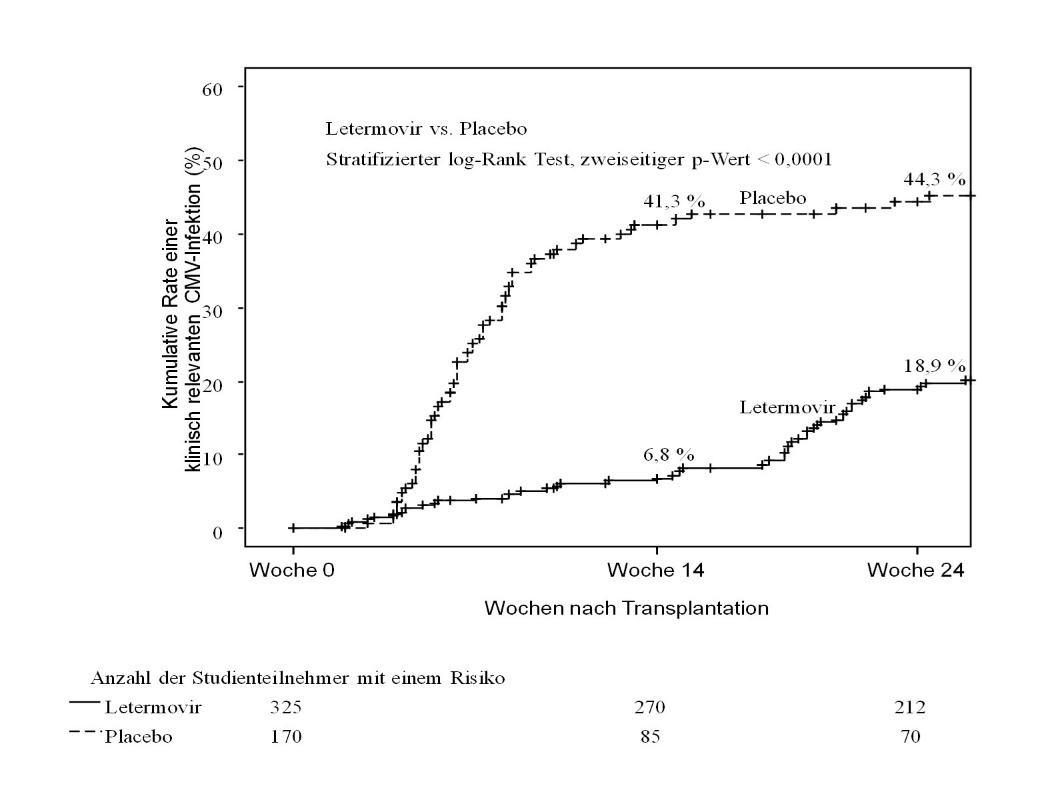
Zwischen den Letermovir- und Placebogruppen zeigte sich kein Unterschied hinsichtlich der Häufigkeit von Engraftments oder der Zeit bis zu deren Auftreten.
In Bezug auf geringes und hohes Risiko einer CMV-Reaktivierung, konditionierende Regime und begleitende immunsuppressive Regime erwies sich Letermovir in allen Subgruppen durchweg als wirksamer (siehe Abbildung 2).
Abbildung 2: P001: Forest-Diagramm des Anteils an Studienteilnehmern mit Einleitung einer Anti-CMV-PET oder einer CMV-Endorganerkrankung bis Woche 24 nach HSCT nach ausgewählten Subgruppen ([NC = F]-Ansatz, FAS‑Population)

Non-Completer = Failure (NC = F). Unter Verwendung des (NC = F)-Ansatzes: Alle Studienteilnehmer, die die Studie vor Woche 24 nach Transplantation abbrachen oder für die keine Ergebnisse in Woche 24 nach Transplantation vorlagen, wurden als Therapieversager gezählt.
Studie P040: Prophylaxe von Woche 14 (~ 100 Tage) bis Woche 28 (~ 200 Tage) nach HSCT
Die Wirksamkeit der Verlängerung der Letermovir-Prophylaxe ab Woche 14 (~ 100 Tage) bis Woche 28 (~ 200 Tage) nach HSCT bei Patienten mit einem Risiko für eine späte CMV-Infektion und -Erkrankung wurde in einer multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studie (P040) an erwachsenen CMV-seropositiven Empfängern [R+] einer allogenen HSCT untersucht. Geeignete Studienteilnehmer, welche die Letermovir-Prophylaxe ~ 100 Tage nach der HSCT abgeschlossen hatten, wurden randomisiert (2:1) und erhielten ab Woche 14 bis Woche 28 nach der HSCT Letermovir oder Placebo. Die Studienteilnehmer wurden bis Woche 28 nach der HSCT auf den primären Wirksamkeitsendpunkt hin überwacht und die Nachbeobachtung außerhalb der Behandlung wurde bis Woche 48 nach der HSCT fortgesetzt.
Von den 218 behandelten Studienteilnehmern erhielten 144 Studienteilnehmer Letermovir und 74 Studienteilnehmer erhielten Placebo. Das mediane Alter betrug 55 Jahre (Bereich: 20 bis 74 Jahre); 62 % waren männlich; 79 % hatten weiße Hautfarbe; 11 % waren Asiaten; 2 % hatten schwarze Hautfarbe; und 10 % waren Hispanoamerikaner oder Latinos. Die häufigsten Gründe für eine Transplantation waren akute myeloische Leukämie (42 %), akute lymphatische Leukämie (15 %) und myelodysplastisches Syndrom (11 %).
Bei Studienbeginn hatten alle Studienteilnehmer Risikofaktoren für eine späte CMV-Infektion und -Erkrankung, wobei 64 % zwei oder mehr Risikofaktoren hatten. Zu den Risikofaktoren gehörten: HLA-verwandter (Geschwister-)Spender mit mindestens einer Fehlpaarung an einem der folgenden drei HLA-Genorte: HLA-A, -B oder -DR; haploidentischer Spender; nicht verwandter Spender mit mindestens einer Fehlpaarung an einem der folgenden vier HLA-Genorte: HLA-A, -B, -C und -DRB1; Verwendung von Nabelschnurblut als Stammzellquelle; Verwendung von ex vivo T-Zell-depletierten Transplantaten; Erhalt von Anti-Thymozyten-Globulin; Erhalt von Alemtuzumab; Anwendung von systemischem Prednison (oder einem Äquivalent) in einer Dosis von ≥ 1 mg/kg Körpergewicht pro Tag.
Primärer Wirksamkeitsendpunkt
Der primäre Wirksamkeitsendpunkt der Studie P040 war die Inzidenz einer klinisch signifikanten CMV-Infektion bis Woche 28 nach der HSCT. Eine klinisch signifikante CMV-Infektion wurde entweder als das Auftreten einer CMV-Endorganerkrankung oder die Einleitung einer Anti-CMV-PET basierend auf einer dokumentierten CMV-Virämie und dem klinischen Zustand des Studienteilnehmers definiert. Es wurde der Observed Failure (OF)-Ansatz verwendet, bei dem Studienteilnehmer, die eine klinisch signifikante CMV-Infektion entwickelten oder die Studie wegen Virämie vorzeitig abbrachen, als „Therapieversager“ gewertet wurden.
Letermovir zeigte in der Analyse des primären Endpunkts eine überlegene Wirksamkeit gegenüber Placebo, wie in Tabelle 5 dargestellt. Der geschätzte Behandlungsunterschied von −16,1 % war statistisch signifikant (einseitiger p-Wert = 0,0005). Die Wirksamkeit begünstigte Letermovir in allen Subgruppen durchweg, basierend auf den Merkmalen der Studienteilnehmer (Alter, Geschlecht, ethnische Herkunft) und Risikofaktoren für eine späte CMV-Infektion und -Erkrankung.
Tabelle 5: Studie P040: Ergebnisse zur Wirksamkeit bei HSCT-Empfängern mit einem Risiko für eine späte CMV-Infektion und -Erkrankung (OF-Ansatz, FAS-Population)
Parameter | Letermovir | Placebo |
Therapieversagen* | 4 (2,8) | 14 (18,9) |
Klinisch signifikante CMV-Infektion bis Woche 28† | 2 (1,4) | 13 (17,6) |
Beginn einer PET basierend auf dokumentierter CMV-Virämie | 1 (0,7) | 11 (14,9) |
CMV-Endorganerkrankung | 1 (0,7) | 2 (2,7) |
Studienabbruch mit CMV-Virämie vor Woche 28 | 2 (1,4) | 1 (1,4) |
Stratum-angepasster Behandlungsunterschied (Letermovir (~ 200 Tage Letermovir)-Placebo (~ 100 Tage Letermovir))‡ | ||
Unterschied (95% KI) | −16,1 (−25,8; −6,5) | |
p-Wert | ||
* Die Kategorien für „Therapieversagen“ schließen sich gegenseitig aus und basieren auf der Hierarchie der Kategorien in der aufgeführten Reihenfolge. | ||
Studie P002: Erwachsene CMV-seronegative Empfänger eines Nierentransplantats von einem CMV-seropositiven Spender [D+/R−]
Um die Letermovir-Prophylaxe als präventive Strategie für CMV-Erkrankungen bei Nierentransplantatempfängern zu bewerten, wurde die Wirksamkeit von Letermovir in einer multizentrischen, doppelblinden, aktiv Komparator-kontrollierten Nichtunterlegenheitsstudie der Phase-III (P002) bei erwachsenen Nierentransplantatempfängern mit hohem Risiko [D+/R−] untersucht. Die Studienteilnehmer wurden randomisiert (1:1) und erhielten entweder Letermovir oder Valganciclovir. Letermovir wurde gleichzeitig mit Aciclovir gegeben. Valganciclovir wurde gleichzeitig mit einem Placebo zu Aciclovir gegeben. Die Randomisierung wurde nach der Verwendung oder Nichtverwendung einer hochzytolytischen Anti-Lymphozyten-Immuntherapie während der Induktion stratifiziert. Die Behandlung mit Letermovir oder Valganciclovir wurde zwischen Tag 0 und Tag 7 nach der Nierentransplantation begonnen und bis Woche 28 (~ 200 Tage) nach der Transplantation fortgesetzt. Die Studienteilnehmer wurden bis Woche 52 nach der Transplantation überwacht.
Von den 589 behandelten Studienteilnehmern erhielten 292 Studienteilnehmer Letermovir und 297 Studienteilnehmer Valganciclovir. Das mediane Alter betrug 51 Jahre (Bereich: 18 bis 82 Jahre); 72 % waren männlich; 84 % hatten weiße Hautfarbe; 2 % waren Asiaten; 9 % hatten schwarze Hautfarbe; 17 % waren Hispanoamerikaner oder Latinos; und 60 % erhielten eine Niere von einem verstorbenen Spender. Die häufigsten Hauptgründe für eine Transplantation waren angeborene zystische Nierenerkrankung (17 %), Hypertonie (16 %) und Diabetes/diabetische Nephropathie (14 %).
Primärer Wirksamkeitsendpunkt
Der primäre Wirksamkeitsendpunkt der Studie P002 war die Inzidenz einer CMV-Erkrankung (CMV-Endorganerkrankung oder CMV-Syndrom, bestätigt durch ein unabhängiges Beurteilungsgremium) bis Woche 52 nach der Transplantation. Es wurde der OF-Ansatz verwendet, bei dem Studienteilnehmer, welche die Studie aus irgendeinem Grund vorzeitig abbrachen oder bei denen zu diesem Zeitpunkt Daten fehlten, nicht als „Therapieversager“ gewertet wurden.
Letermovir zeigte in der Analyse des primären Endpunkts eine Nichtunterlegenheit gegenüber Valganciclovir, wie in Tabelle 6 dargestellt.
Tabelle 6: Studie P002: Ergebnisse zur Wirksamkeit bei Nierentransplantatempfängern (OF-Ansatz, FAS-Population)
Parameter | Letermovir | Valganciclovir |
CMV-Erkrankung* bis Woche 52 | 30 (10,4) | 35 (11,8) |
Stratum-adjustierter Behandlungsunterschied | ||
Unterschied (95% KI) | −1,4 (−6,5; 3,8)‡ | |
* CMV-Erkrankungsfälle wurden von einem unabhängigen Beurteilungsausschuss bestätigt. | ||
Die Wirksamkeit war in allen Subgruppen vergleichbar, einschließlich Geschlecht, Alter, ethnische Herkunft, Region und der Verwendung/Nichtverwendung einer hochzytolytischen Anti-Lymphozyten-Immuntherapie während der Induktion.
Kinder und Jugendliche
Studie P030: Pädiatrische Empfänger einer allogenen hämatopoetischen Stammzelltransplantation
Um die Letermovir Prophylaxe als präventive Strategie gegen CMV-Infektionen oder -Erkrankungen bei pädiatrischen Transplantatempfängern zu bewerten, wurde die Wirksamkeit von Letermovir in einer multizentrischen, offenen, einarmigen Phase-2b-Studie (P030) bei pädiatrischen Empfängern einer allogenen HSCT untersucht. Das Studienmedikament wurde nach der HSCT (Tag 0 – 28 nach der HSCT) begonnen und bis Woche 14 nach der HSCT fortgesetzt. Das Studienmedikament wurde entweder oral oder intravenös gegeben; die Dosis von Letermovir richtete sich nach Alter, Körpergewicht und Darreichungsform.
Von den 63 behandelten Studienteilnehmern waren 8 Teilnehmer 0 bis unter 2 Jahre alt, 27 waren 2 bis unter 12 Jahre alt und 28 waren 12 bis unter 18 Jahre alt. Zu Studienbeginn erhielten 87 % der Studienteilnehmer eine myeloablative Therapie, 67 % erhielten Ciclosporin und 27 % erhielten Tacrolimus. Die häufigsten primären Gründe für eine Transplantation in der gesamten Studienpopulation waren akute myeloische Leukämie (18 %) und aplastische Anämie (10 %), sowie eine kombinierte Immunschwäche (37,5 %) und familiäre hämophagozytische Lymphohistiozytose (25,0 %) bei Kindern unter 2 Jahren.
Sekundärer Wirksamkeitsendpunkt
Die Wirksamkeitsendpunkte von P030 waren sekundär und umfassten die Inzidenz klinisch signifikanter CMV-Infektionen bis Woche 14 nach HSCT und bis Woche 24 nach HSCT. Eine klinisch signifikante CMV-Infektion wurde als das Auftreten entweder einer CMV-Endorganerkrankung oder die Einleitung einer Anti-CMV-PET basierend auf einer dokumentierten CMV-Virämie und dem klinischen Zustand des Studienteilnehmers definiert. Die Inzidenz klinisch signifikanter CMV-Infektionen betrug bis Woche 14 nach HSCT 7,1 % bzw. bis Woche 24 nach HSCT 10,7 %.
Die Pharmakokinetik von Letermovir wurde nach oraler und intravenöser Gabe bei gesunden erwachsenen Studienteilnehmern untersucht. Die Letermovir-Exposition erhöhte sich stärker als dosisproportional sowohl bei oraler als auch bei intravenöser Gabe. Der Mechanismus ist wahrscheinlich eine Sättigung/Autoinhibition von OATP1B1/3. Die Pharmakokinetik von Letermovir wurde auch nach oraler und intravenöser Anwendung bei erwachsenen HSCT-Empfängern (siehe Tabelle 7) und bei pädiatrischen HSCT-Empfängern (siehe Tabellen 9 und 10) sowie nach oraler Anwendung bei Nierentransplantatempfängern (siehe Tabelle 8) charakterisiert.
Gesunde erwachsene Studienteilnehmer
Die geometrischen mittleren Steady-State-AUC- und Cmax‑Werte lagen bei 71 500 ng·h/ml bzw. 13 000 ng/ml bei oraler Gabe von 480 mg Letermovir einmal täglich.
Letermovir erreichte einen Steady State innerhalb von 9 bis 10 Tagen mit einem Kumulationsverhältnis von 1,2 für AUC und 1 für Cmax.
Erwachsene HSCT-Empfänger
Die AUC von Letermovir wurde unter Verwendung von populationsbasierten pharmakokinetischen (PK)-Analysen mittels Phase-III-Daten der Studie P001 geschätzt (siehe Tabelle 7). Die Unterschiede bezüglich der Exposition sind für alle Behandlungsregime klinisch nicht relevant; die Wirksamkeit war über den Bereich der in der Studie P001 beobachteten Expositionen hinweg konsistent.
Tabelle 7: Letermovir AUC (ng·h/ml)-Werte bei erwachsenen HSCT-Empfängern
Behandlungsregime | Median (90% Vorhersageintervall)* |
480 mg oral, ohne Ciclosporin | 34 400 (16 900, 73 700) |
480 mg intravenös, ohne Ciclosporin | 100 000 (65 300, 148 000) |
240 mg oral, mit Ciclosporin | 60 800 (28 700, 122 000) |
240 mg intravenös, mit Ciclosporin | 70 300 (46 200, 106 000) |
* Populationsbasierte Post-hoc-Vorhersagen aus der populationsbasierten PK‑Analyse mittels Phase-III-Daten | |
Erwachsene Empfänger von Nierentransplantaten
Die AUC von Letermovir wurde unter Verwendung von populationsbasierten pharmakokinetischen (PK)-Analysen mittels Phase-III-Daten der Studie P002 geschätzt (siehe Tabelle 8). Die Wirksamkeit war über den Bereich der in der Studie P002 beobachteten Expositionen hinweg konsistent.
Tabelle 8: Letermovir-AUC-Werte (ng·h/ml) bei erwachsenen Nierentransplantatempfängern
Behandlungsregime | Median (90% Vorhersageintervall)* |
480 mg oral, ohne Ciclosporin | 62 200 (28 900, 145 000) |
240 mg oral, mit Ciclosporin | 57 700 (26 900, 135 000) |
* Mediane und 90% Vorhersageintervalle basieren auf Simulationen unter Verwendung des Phase-III-Populations-PK-Modells mit interindividueller Variabilität. | |
Resorption
Letermovir wurde bei gesunden erwachsenen Studienteilnehmern rasch resorbiert mit einer medianen Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) von 1,5 bis 3,0 Stunden und nahm biphasisch ab. Bei erwachsenen HSCT‑Empfängern wurde die Bioverfügbarkeit von Letermovir bei oraler Gabe von 480 mg Letermovir einmal täglich ohne Ciclosporin auf etwa 35 % geschätzt. Die interindividuelle Variabilität der Bioverfügbarkeit wurde auf etwa 37 % geschätzt. Bei erwachsenen Nierentransplantatempfängern wurde die Bioverfügbarkeit von Letermovir bei einmal täglicher oraler Gabe von 480 mg Letermovir ohne Ciclosporin auf etwa 60 % geschätzt.
Wirkung von Ciclosporin
Bei erwachsenen HSCT-Empfängern erhöhte die gemeinsame Anwendung mit Ciclosporin die Plasmakonzentrationen von Letermovir durch eine Inhibition von OATP1B. Bei oraler Gabe von 240 mg Letermovir einmal täglich und gemeinsamer Anwendung mit Ciclosporin wurde die Bioverfügbarkeit von Letermovir bei Patienten auf etwa 85 % geschätzt.
Wenn Letermovir gemeinsam mit Ciclosporin gegeben wird, beträgt die empfohlene Letermovir‑Dosis bei Erwachsenen und pädiatrischen Patienten mit einem Gewicht von mindestens 30 kg 240 mg einmal täglich (siehe Abschnitt 4.2). Wenn intravenöses Letermovir bei pädiatrischen Patienten mit einem Gewicht unter 30 kg gleichzeitig mit Ciclosporin angewendet wird, ist keine Dosisanpassung erforderlich (siehe Abschnitt 4.2).
Einfluss von Nahrung
Bei gesunden erwachsenen Studienteilnehmern hatte die orale Einnahme einer 480 mg Letermovir Tablette als Einzeldosis mit einer Standardmahlzeit mit hohem Fett- und hohem Kaloriengehalt keine Auswirkung auf die Gesamtexposition (AUC) und führte zu einer etwa 30%‑igen Erhöhung der Spitzenplasmakonzentrationen (Cmax) von Letermovir. Letermovir-Tabletten können oral mit oder ohne Nahrung eingenommen werden, wie es in den klinischen Studien gehandhabt wurde (siehe Abschnitt 4.2).
Bei gesunden erwachsenen Studienteilnehmern führte die orale Einnahme einer 240-mg-Einzeldosis von Letermovir Granulat mit weicher Nahrung (Pudding oder Apfelmus) zu einer Erhöhung von etwa 13 % und 20 % der Gesamtexposition (AUC) und von etwa 25 % und 33 % der Spitzenkonzentration (Cmax) von Letermovir. Letermovir Granulat kann mit weicher Nahrung gegeben werden, so wie es in der pädiatrischen Studie gehandhabt wurde (siehe Abschnitt 4.2).
Verteilung
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen wird das mittlere Steady-State-Verteilungsvolumen bei erwachsenen HSCT-Empfängern nach intravenöser Anwendung auf 45,5 l geschätzt.
In vitro ist Letermovir, unabhängig vom untersuchten Konzentrationsbereich (3 bis 100 mg/l), größtenteils (98,2 %) an menschliche Plasmaproteine gebunden. Bei niedrigeren Konzentrationen wurde eine Sättigung beobachtet. Die Blut-Plasma-Verteilung von Letermovir beträgt 0,56 und ist unabhängig von dem in vitro untersuchten Konzentrationsbereich (0,1 bis 10 mg/l).
In präklinischen Verteilungsstudien wird Letermovir auf Organe und Gewebe verteilt, wobei die höchsten Konzentrationen im Magen-Darm-Trakt, im Gallengang und in der Leber und in niedrigen Konzentrationen im Gehirn beobachtet wurden.
Biotransformation
Der Hauptanteil der mit Letermovir verwandten Komponenten liegt im Plasma in unveränderter Form vor (96,6 %). Es werden keine wesentlichen Metaboliten im Plasma nachgewiesen. Letermovir wird teilweise durch Glucuronidierung, die durch UGT1A1/1A3 vermittelt wird, eliminiert.
Elimination
Bei gesunden erwachsenen Studienteilnehmern beträgt die mittlere scheinbare terminale Halbwertszeit von Letermovir etwa 12 Stunden bei intravenöser Gabe von 480 mg Letermovir. Die Haupteliminationswege von Letermovir sind die biliäre Exkretion sowie die direkte Glucuronidierung. Dieser Vorgang umfasst die hepatischen Aufnahmetransporter OATP1B1 und 3, gefolgt von einer durch UGT1A1/3 katalysierten Glucuronidierung.
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen wird die scheinbare Steady‑State‑CL von Letermovir nach intravenöser Anwendung von 480 mg bei erwachsenen HSCT‑Empfängern auf 4,84 l/h geschätzt. Die interindividuelle Variabilität für CL wird auf 24,6 % geschätzt.
Exkretion
Nach oraler Gabe von radioaktiv markiertem Letermovir wurden 93,3 % der Radioaktivität in den Faeces wiedergefunden. Letermovir wurde hauptsächlich als unveränderte Ausgangssubstanz, in geringerer Menge (6 % der Dosis) als Acylglucuronid-Metabolit, biliär in den Faeces ausgeschieden. Das Acylglucuronid ist in den Faeces instabil. Die Urinausscheidung von Letermovir war vernachlässigbar (< 2 % der Dosis).
Pharmakokinetik bei speziellen Patientengruppen
Leberfunktionsstörung
Die AUC von ungebundenem Letermovir war bei erwachsenen Studienteilnehmern mit moderater (Child-Pugh-Klasse B [CP-B], Score von 7 – 9) Leberfunktionsstörung etwa 81 % und schwerer (Child-Pugh-Klasse C [CP-C], Score von 10 – 15) Leberfunktionsstörung etwa 4‑fach höher als bei gesunden erwachsenen Studienteilnehmern. Die Veränderungen der Letermovir-Exposition bei erwachsenen Studienteilnehmern mit mäßiger Leberfunktionsstörung sind klinisch nicht relevant.
Bei Patienten mit moderater Leberfunktionsstörung in Kombination mit mäßiger oder schwerer Nierenfunktionsstörung ist mit ausgeprägten Erhöhungen der Exposition von ungebundenem Letermovir zu rechnen (siehe Abschnitt 4.2).
Nierenfunktionsstörung
Klinische Studie bei einer Population mit Nierenfunktionsstörung
Die AUC von ungebundenem Letermovir war bei erwachsenen Studienteilnehmern mit moderater (eGFR von 31,0 bis 56,8 ml/min/1,73 m2) Nierenfunktionsstörung etwa 115 % und mit schwerer (eGFR von 11,9 bis 28,1 ml/min/1,73 m2) Nierenfunktionsstörung etwa 81 % höher als bei gesunden erwachsenen Studienteilnehmern. Die Veränderungen der Letermovir-Exposition aufgrund von moderaten oder schweren Nierenfunktionsstörungen gelten als klinisch nicht relevant. Es wurden keine Studienteilnehmer mit terminaler Niereninsuffizienz untersucht.
Nach einer Nierentransplantation (Studie P002)
Unter Verwendung einer populationsbasierten pharmakokinetischen Analyse war die AUC von Letermovir bei erwachsenen Studienteilnehmern mit leichter (CrCl größer oder gleich 60 bis weniger als 90 ml/min), moderater (CrCl größer oder gleich 30 bis weniger als 60 ml/min) oder schwerer (CrCl größer oder gleich 15 bis weniger als 30 ml/min) Nierenfunktionsstörung etwa 12 %, 27 % bzw. 35 % höher im Vergleich zu erwachsenen Studienteilnehmern mit einer CrCl größer oder gleich 90 ml/min. Diese Unterschiede gelten als klinisch nicht relevant.
Gewicht
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen wird die AUC von Letermovir bei gesunden erwachsenen Studienteilnehmern mit einem Gewicht von 80 – 100 kg um 18,7 % niedriger geschätzt als bei Studienteilnehmern mit einem Gewicht von 67 kg. Basierend auf einer populationsbasierten pharmakokinetischen Analyse bei erwachsenen Empfängern von Nierentransplantaten (Studie P002) wird geschätzt, dass die AUC von Letermovir bei Personen mit einem Gewicht von mehr als 80 kg im Vergleich zu Personen mit einem Gewicht von weniger als oder gleich 80 kg um 26 % niedriger ist. Diese Unterschiede sind klinisch nicht relevant.
Ethnische Zugehörigkeit
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen bei gesunden erwachsenen Studienteilnehmern wird die AUC von Letermovir bei Asiaten im Vergleich zu Weißen um 33,2 % höher geschätzt. Dieser Unterschied ist klinisch nicht relevant.
Geschlecht
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen bestehen zwischen erwachsenen Frauen und Männern bezüglich Letermovir keine pharmakokinetischen Unterschiede.
Ältere Patienten
Unter Verwendung von populationsbasierten pharmakokinetischen Analysen hat das Alter keinen Einfluss auf die Pharmakokinetik von Letermovir. Eine altersabhängige Dosisanpassung ist nicht erforderlich.
Kinder und Jugendliche
Die AUC von Letermovir bei pädiatrischen HSCT-Empfängern wurde mithilfe einer populationspharmakokinetischen Analyse unter Verwendung der beobachteten PK-Daten aus Studie P030 geschätzt (siehe Tabelle 9 und Tabelle 10). Die Expositionen für pädiatrische HSCT-Empfänger in allen Körpergewichtsbereichen liegen im Bereich der Expositionen, die bei den HSCT-Referenzexpositionen für Erwachsene erreicht werden (siehe Tabelle 7).
Tabelle 9: Letermovir-AUC-Werte (ng·h/ml) nach oraler Einnahme bei pädiatrischen HSCT-Empfängern
Körpergewicht | Orale Dosis, ohne Ciclosporin | Median (90% Vorhersageintervall)* | Orale Dosis, mit Ciclosporin | Median (90% Vorhersageintervall)* |
Ab 30 kg | 480 mg | 39 100 | 240 mg | 49 100 |
15 kg bis unter 30 kg | 240 mg | 38 900 | 120 mg | 51 000 |
7,5 kg bis unter 15 kg | 120 mg | 32 000 | 60 mg | 41 600 |
5 kg bis unter 7,5 kg | 80 mg | 30 600 | 40 mg | 39 000 |
* Mediane und 90% Vorhersageintervalle basieren auf Simulationen unter Verwendung des pädiatrischen HSCT-Populations-PK-Modells mit interindividueller Variabilität. | ||||
Tabelle 10: Letermovir-AUC-Werte (ng·h/ml) nach intravenöser Gabe bei pädiatrischen HSCT-Empfängern
Körpergewicht | i.v. Dosis, ohne Ciclosporin | Median (90% Vorhersageintervall)* | i.v. Dosis, mit Ciclosporin | Median (90% Vorhersageintervall)* |
Ab 30 kg | 480 mg | 111 000 | 240 mg | 59 800 |
15 kg bis unter 30 kg | 120 mg | 57 200 | 120 mg | 61 100 |
7,5 kg bis unter 15 kg | 60 mg | 46 000 | 60 mg | 49 200 |
5 kg bis unter 7,5 kg | 40 mg | 43 400 | 40 mg | 45 900 |
* Mediane und 90% Vorhersageintervalle basieren auf Simulationen unter Verwendung des pädiatrischen HSCT-Populations-PK-Modells mit interindividueller Variabilität. | ||||
Allgemeine Toxizität
Eine irreversible testikuläre Toxizität wurde nur bei Ratten bei systemischer Exposition (AUC) beobachtet, die einer ≥ 3‑fachen Exposition der beim Menschen empfohlenen Dosis (recommended human dose = RHD) entspricht. Charakteristisch für diese Toxizität waren eine Degeneration der Samenleiter und Oligospermie sowie Zellüberreste in den Nebenhoden einhergehend mit vermindertem Hoden- und Nebenhodengewicht. Es gab keine testikuläre Toxizität bei Ratten bei Expositionen (AUC), die den Expositionen beim Menschen unter RHD ähnlich waren. Bei Gabe höchster getesteter Dosen, die dem bis zu 4-Fachen bzw. 2-Fachen der RHD entsprechen, wurde bei Mäusen und Affen keine testikuläre Toxizität beobachtet. Die Relevanz für den Menschen ist nicht bekannt.
Es ist bekannt, dass Hydroxypropylbetadex bei Ratten eine Vakuolisierung in den Nieren verursachen kann, wenn es intravenös in Dosen von mehr als 50 mg/kg/Tag verabreicht wird. Eine Vakuolisierung wurde in den Nieren von Ratten beobachtet, die Letermovir intravenös erhielten, das mit 1 500 mg/kg/Tag Hydroxypropylbetadex, einem Cyclodextrin, zubereitet war.
Die parenterale Gabe von Hydroxypropylbetadex mit ≥ 2 000 mg/kg war bei zahlreichen Tierarten mit einem Hörverlust aufgrund einer Schädigung des Innenohrs verbunden. Im Vergleich dazu war die maximale Dosis von Hydroxypropylbetadex (120 mg/kg) bei intravenöser Gabe von PREVYMIS mit der beim Menschen maximal empfohlenen Dosis (MRHD) (von 120 mg/kg) in keiner Tierstudie mit Hörverlust verbunden. Der Wirkstoff Letermovir ist nicht dafür bekannt, mit Ototoxizität verbunden zu sein.
Karzinogenese
Eine 6-monatige orale Karzinogenitätsstudie an transgenen RasH2-Mäusen (Tg.RasH2) zeigte bis zu den höchsten getesteten Dosen von 150 mg/kg/Tag bei männlichen bzw. 300 mg/kg/Tag bei weiblichen Mäusen keine Hinweise auf eine für den Menschen relevante Tumorentstehung.
Mutagenese
Letermovir zeigte in einer Reihe von in-vitro- oder in-vivo-Assays, einschließlich mikrobieller Mutagenese-Assays, Chromosomenaberrationstests in chinesischen Hamsterovarialzellen und in einer in-vivo-Maus-Mikronukleus-Studie, keine Genotoxizität.
Reproduktion
Fertilität
In Studien zur Fertilität und zur frühembryonalen Entwicklung an der Ratte zeigte Letermovir keinen Einfluss auf die weibliche Fertilität. Bei männlichen Ratten wurden bei systemischen Expositionen ≥ 3‑fach der AUC beim Menschen unter RHD reduzierte Spermienkonzentration, reduzierte Spermienmotilität und verminderte Fertilität beobachtet (siehe Allgemeine Toxizität).
Bei Affen, die Letermovir erhielten, gab es bei systemischen Expositionen von etwa dem 2-Fachen der AUC beim Menschen unter RHD anhand der histopathologischen Beurteilung, der Messung der Hodengröße, der Blut-Hormon-Analyse (follikelstimulierendes Hormon, Inhibin B und Testosteron) und der Spermienuntersuchung (Spermienzahl, -motilität und -morphologie) keinen Hinweis auf testikuläre Toxizität.
Entwicklung
Bei Ratten wurde eine Toxizität bei den Muttertieren (einschließlich Verringerung der Körpergewichtszunahme) bei 250 mg/kg/Tag beobachtet (entsprechend etwa das 11-Fache der AUC unter RHD); bei den Nachkommen wurden ein vermindertes Fetalgewicht mit verzögerter Verknöcherung, leicht ödematösen Feten und eine erhöhte Inzidenz verkürzter Nabelschnüre sowie Veränderungen und Fehlbildungen an Wirbeln, Rippen und Becken beobachtet. Bei Dosen von 50 mg/kg/Tag (etwa das 2,5-Fache der AUC unter RHD) wurden keine Effekte auf die Muttertiere oder auf die Entwicklung der Nachkommen beobachtet.
Bei Kaninchen wurde eine Toxizität bei den Muttertieren (einschließlich Mortalität und Aborte) bei 225 mg/kg/Tag beobachtet (etwa das 2-Fache der AUC unter RHD); bei den Nachkommen wurde eine erhöhte Inzidenz von Fehlbildungen und Veränderungen der Wirbel und Rippen beobachtet.
In der prä- und postnatalen Entwicklungsstudie wurde Letermovir trächtigen Ratten oral verabreicht. Es wurde keine Entwicklungstoxizität bis zur höchsten getesteten Exposition beobachtet (2-Faches der AUC unter RHD).
Hydroxypropylbetadex (Cyclodextrin)
Natriumchlorid
Natriumhydroxid (E 524)
Wasser für Injektionszwecke
Inkompatible Arzneimittel
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung ist physikalisch inkompatibel mit Amiodaronhydrochlorid, Amphotericin B (liposomal), Aztreonam, Cefepimhydrochlorid, Ciprofloxacin, Ciclosporin, Diltiazemhydrochlorid, Filgrastim, Gentamicinsulfat, Levofloxacin, Linezolid, Lorazepam, Midazolam HCl, Mycophenolatmofetilhydrochlorid, Ondansetron, Palonosetron.
Dieses Arzneimittel darf außer mit den unter Abschnitt 6.6 aufgeführten nicht mit anderen Arzneimitteln gemischt werden.
Inkompatible intravenöse Infusionsbeutel- und Infusionsset-Materialien
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung ist inkompatibel mit Diethylhexylphthalat(DEHP)‑Weichmacher- und Polyurethan-haltigen intravenösen Infusionssetschläuchen.
Dieses Arzneimittel darf nur mit den in Abschnitt 6.6 genannten intravenösen Infusionsbeutel- und Infusionsset-Materialien angewendet werden.
Ungeöffnete Durchstechflasche: 3 Jahre
Nach Anbruch: Unmittelbar zu verwenden
Lagerung der verdünnten Lösung
Chemische und physikalische Stabilität während des Gebrauchs wurde für 48 Stunden bei 25 °C und für 48 Stunden bei 2 °C bis 8 °C nachgewiesen. Aus mikrobiologischer Sicht ist das Produkt unmittelbar zu verwenden. Wird es nicht sofort verwendet, liegen die Lagerungszeiten und ‑bedingungen vor der Anwendung in der Verantwortung des Anwenders und sollten normalerweise 24 Stunden bei 2 °C bis 8 °C nicht überschreiten, es sei denn, die Verdünnung erfolgte unter kontrollierten und validierten aseptischen Bedingungen.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen für die Temperatur einzuhalten.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Für die Lagerungsbedingungen nach Verdünnung des Arzneimittels siehe Abschnitt 6.3.
Durchstechflasche aus Klarglas Typ I (30 ml) mit einem 20 mm fluorummantelten Chlorbutylstopfen mit Aluminium flip-off Verschluss mit 12 ml (mittelgrüner Verschluss) oder 24 ml (dunkelblauer Verschluss) Lösung.
Packungsgröße: 1 Durchstechflasche
PREVYMIS Durchstechflaschen sind nur zur einmaligen Anwendung vorgesehen.
Zubereitung
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung muss vor der intravenösen Anwendung verdünnt werden.
Den Inhalt der Durchstechflasche vor der Verdünnung auf Verfärbungen und Partikel überprüfen. PREVYMIS Konzentrat zur Herstellung einer Infusionslösung ist eine klare, farblose Lösung und kann einige wenige produktbezogene kleine durchscheinende oder weiße Partikel enthalten. Die Durchstechflasche darf nicht verwendet werden, wenn die Lösung trüb oder verfärbt ist oder andere Bestandteile als ein paar kleine durchscheinende oder weiße Partikel enthält.
Das PREVYMIS Konzentrat zur Herstellung einer Infusionslösung darf nicht mit Infusionsbeutel- und Infusionsset-Materialien verwendet werden, die Polyurethan oder den Weichmacher Diethylhexylphthalat (DEHP) enthalten. Materialien, die phthalatfrei sind, sind auch DEHP-frei.
Die Durchstechflasche von PREVYMIS nicht schütteln.
Für die 480-mg- oder die 240-mg-Dosis, den Inhalt einer Einzeldosis-Durchstechflasche (entweder 12 ml für eine 240-mg-Dosis oder 24 ml für eine 480-mg-Dosis) von PREVYMIS Konzentrat zur Herstellung einer Infusionslösung in einen mit 250 ml Natriumchlorid 9 mg/ml (0,9%)-Injektionslösung oder Glucose 50 mg/ml (5%)-Injektionslösung vorgefüllten Infusionsbeutel geben und die verdünnte Lösung durch vorsichtiges Umdrehen mischen. Nicht schütteln. Wenn eine Durchstechflasche in einen 250-ml-Beutel mit intravenösem Verdünnungsmittel gegeben wird, liegen die endgültigen Konzentrationsbereiche von Letermovir bei 0,9 mg/ml (für eine 240-mg-Dosis) und 1,8 mg/ml (für eine 480-mg-Dosis).
Für die 120-mg- oder 60-mg-Dosis bereiten Sie PREVYMIS Konzentrat zur Herstellung einer Infusionslösung gemäß Tabelle 11 unten in 9 mg/ml (0,9 %) Natriumchlorid-Injektionslösung oder 5 % Glucose zu und mischen Sie die verdünnte Lösung durch sanftes Schwenken. Nicht schütteln.
Für die 40-mg-Dosis bereiten Sie PREVYMIS Konzentrat zur Herstellung einer Infusionslösung gemäß Tabelle 12 unten entweder in Natriumchlorid 9 mg/ml (0,9 %) Lösung zur Injektion oder 5 % Glucose vor und mischen Sie die verdünnte Lösung durch sanftes Schwenken. Nicht schütteln.
Tabelle 11: Zubereitung der intravenösen PREVYMIS Lösung für Dosen von 120 mg oder 60 mg
Intravenöse Dosis | Volumen von 20 mg/ml PREVYMIS Konzentrat zur Herstellung einer Infusionslösung | Finales Infusionsvolumen | Finale Konzentration von Letermovir |
120 mg | 6 ml von 20 mg/ml | 75 ml | 1,6 mg/ml |
60 mg | 3 ml von 20 mg/ml | 50 ml | 1,2 mg/ml |
Tabelle 12: Zubereitung der intravenösen PREVYMIS Lösung für Dosen von 40 mg
Intravenöse Dosis | Volumen von 2 mg/ml PREVYMIS Lösung (1:10)* | Finales Infusionsvolumen | Finale Konzentration von Letermovir |
40 mg | 20 ml von 2 mg/ml | 20 ml | 2 mg/ml |
* Um eine 2 mg/ml PREVYMIS Lösung herzustellen, fügen Sie 5 ml 20 mg/ml PREVYMIS Konzentrat zur Herstellung einer Infusionslösung aus der Durchstechflasche zu 45 ml Verdünnungsmittel (Natriumchlorid 9 mg/ml (0,9 %) Injektionslösung oder 5 % Glucose) hinzu und mischen vorsichtig. | |||
Einmal verdünnt, ist die Lösung von PREVYMIS klar und farblos bis gelb. Farbvarianten in diesem Bereich beeinträchtigen die Qualität des Arzneimittels nicht. Die verdünnte Lösung sollte vor der Anwendung visuell auf Partikel und Verfärbungen geprüft werden. Die verdünnte Lösung ist zu verwerfen, wenn sie trüb oder verfärbt ist oder andere Bestandteile als ein paar kleine durchscheinende oder weiße Partikel enthält.
Anwendung
Siehe Abschnitt 4.2.
PREVYMIS verdünnte Lösung muss unter Verwendung eines sterilen 0,2 µm oder 0,22 µm Polyethersulfon(PES)‑Inline-Filters angewendet werden.
Kompatible intravenöse Lösungen und andere Arzneimittel
PREVYMIS Konzentrat zur Herstellung einer Infusionslösung ist mit Natriumchlorid 9 mg/ml (0,9%)- und Glucose 50 mg/ml (5%)-Injektionslösungen kompatibel.
PREVYMIS darf nicht gleichzeitig mit anderen Arzneimitteln und Lösungsmittelkombinationen mit Ausnahme der nachstehend aufgeführten über denselben intravenösen Zugang (oder dieselbe Kanüle) angewendet werden.
Liste der kompatiblen Arzneimittel für die Zubereitung von PREVYMIS und Arzneimittel* in Natriumchlorid 9 mg/ml (0,9%)-Injektionslösung
• Ampicillin-Natrium | • Fluconazol |
• Ampicillin-Natrium/Sulbactam-Natrium | • Humanes Insulin |
• Antithymocytenglobulin | • Magnesiumsulfat |
• Caspofungin | • Methotrexat |
• Daptomycin | • Micafungin |
• Fentanylcitrat | |
| |
Liste der kompatiblen Arzneimittel für die Zubereitung von PREVYMIS und Arzneimittel* in Glucose 50 mg/ml (5%)-Injektionslösung
• Amphotericin B (Lipidkomplex)† | • Hydrocortison-Natriumsuccinat |
• Anidulafungin | • Morphinsulfat |
• Cefazolin-Natrium | • Norepinephrin-Bitartrat |
• Ceftarolin | • Pantoprazol-Natrium |
• Ceftriaxon-Natrium | • Kaliumchlorid |
• Doripenem | • Kaliumphosphat |
• Famotidin | • Tacrolimus |
• Folsäure | • Telavancin |
• Ganciclovir-Natrium | • Tigecyclin |
| |
Kompatible intravenöse Infusionsbeutel- und Infusionsset-Materialien
PREVYMIS ist kompatibel mit den folgenden intravenösen Infusionsbeutel- und Infusionsset-Materialien. Alle nachstehend nicht aufgeführten intravenösen Infusionsbeutel- oder Infusionsset-Materialien dürfen nicht verwendet werden.
Intravenöse Infusionsbeutel-Materialien
Polyvinylchlorid (PVC), Ethylenvinylacetat (EVA) und Polyolefin (Polypropylen und Polyethylen)
Infusionsset-Materialien
PVC, Polyethylen (PE), Polybutadien (PBD), Silikonkautschuk (SR), Styrol-Butadien-Copolymer (SBC), Styrol-Butadien-Styrol-Copolymer (SBS), Polystyrol (PS)
Weichmacher
Tris(2-ethylhexyl)trimellitat (TOTM), Butylbenzylphthalat (BBP)
Katheter
Strahlenundurchlässiges Polyurethan
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Merck Sharp & Dohme B.V.
Waarderweg 39
2031 BN Haarlem
Niederlande
EU/1/17/1245/003
EU/1/17/1245/004
Datum der Erteilung der Zulassung: 8. Januar 2018
Datum der letzten Verlängerung der Zulassung: 24. August 2022
April 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Für weitere Informationen zu diesem Präparat wenden Sie sich bitte an die deutsche Vertretung des Zulassungsinhabers:
MSD Sharp & Dohme GmbH
Levelingstr. 4a
81673 München
Tel.: +49 (0) 89 20 300 4500
E-Mail: medinfo@msd.de
RCN: 000026329-DE
FACH-9000275-0013