Jivi® 250 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi® 500 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi® 1000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi® 2000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi® 3000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi® 4000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Jivi 250 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 100 I.E. (250 I.E./2,5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Jivi 500 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 200 I.E. (500 I.E./2,5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Jivi 1000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 400 I.E. (1 000 I.E./2,5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Jivi 2000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 800 I.E. (2 000 I.E./2,5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Jivi 3000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 1 200 I.E. (3 000 I.E./2,5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Jivi 4000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Nach Rekonstitution mit dem beigefügten Lösungsmittel enthält ein ml Lösung etwa 800 I.E. (4 000 I.E./5 ml) des humanen Blutgerinnungsfaktors VIII, Damoctocog alfa pegol.
Zur Bestimmung der Aktivität in Internationalen Einheiten (I.E.) wird der chromogene Test gemäß Europäischem Arzneibuch verwendet.
Die spezifische Aktivität von Jivi beträgt etwa 10 000 I.E./mg Protein.
Der Wirkstoff Damoctocog alfa pegol ist ein spezifisch PEGylierter rekombinanter humaner Blutgerinnungsfaktor VIII mit deletierter B‑Domäne. Er wird in einer Baby‑Hamster‑Nierenzelllinie (BHK) hergestellt und weist einen 60 kDa großen, verzweigten Polyethylenglykol (PEG)‑Anteil, bestehend aus zwei 30 kDa großen PEG‑Anteilen, auf. Die Molekülmasse des Proteins beträgt ca. 234 kDa.
Jivi wird ohne Zugabe von Proteinen menschlichen oder tierischen Ursprungs während des Zellkulturprozesses, der Aufreinigung, PEGylierung oder endgültigen Formulierung hergestellt.
Sonstiger Bestandteil mit bekannter Wirkung
Jeder ml Injektionslösung enthält 0,08 mg Polysorbat 80 (E 433).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Pulver: fest, weiß bis leicht gelblich.
Lösungsmittel: klare Lösung.
Behandlung und Prophylaxe von Blutungen bei vorbehandelten Patienten ab 7 Jahren mit Hämophilie A (angeborener Faktor VIII‑Mangel).
Die Behandlung sollte unter der Überwachung eines Arztes erfolgen, der mit der Behandlung von Hämophilie vertraut ist.
Überwachung der Therapie
Während der Behandlung wird eine geeignete Bestimmung der Faktor VIII‑Spiegel empfohlen, um das Erreichen adäquater Faktor VIII‑Spiegel zu bestätigen. Das Ansprechen einzelner Patienten auf Faktor VIII kann unterschiedlich sein und zu verschiedenen Halbwertszeiten und Recovery‑Werten führen. Die nach Körpergewicht berechnete Dosis muss möglicherweise bei übergewichtigen Patienten angepasst werden. Insbesondere bei größeren chirurgischen Eingriffen ist eine genaue Überwachung der Substitutionstherapie durch Gerinnungstests (Faktor VIII‑Aktivität im Plasma) unerlässlich.
Wenn zur Bestimmung der Faktor VIII‑Aktivität in Blutproben der Patienten ein In‑vitro‑Assay basierend auf der aktivierten Thromboplastinzeit (aPTT) im Einstufen‑Gerinnungstest verwendet wird, kann die resultierende Faktor VIII‑Aktivität im Plasma signifikant von dem verwendeten aPTT‑Reagenz und dem verwendeten Referenzstandard beeinflusst werden, was eine Über- oder Unterschätzung der Faktor VIII‑Aktivität zur Folge haben kann. Es können zudem signifikante Abweichungen zwischen den Ergebnissen eines mit spezifischen Reagenzien durchgeführten aPTT‑basierten Einstufen‑Gerinnungstests und dem chromogenen Test auftreten. Dies ist bei der Überwachung der Faktor VIII‑Aktivität von Jivi bei einem Wechsel des Labors und/oder verwendeter Testreagenzien von großer Wichtigkeit. Dies gilt auch für modifizierte, lang wirksame Faktor VIII‑Produkte.
Labore sollten ihre Methoden einer Genauigkeitsprüfung unterziehen, bevor sie die Aktivität von Jivi bestimmen. Eine Feldstudie deutet darauf hin, dass die Faktor VIII‑Aktivität von Jivi im Plasma entweder mit Hilfe eines validierten chromogenen Tests oder eines Einstufen‑Gerinnungstests mit spezifischen Reagenzien bestimmt werden kann. Bei Jivi können mit einigen Silica‑basierten Einstufen‑Gerinnungstests (z. B. APTT‑SP, STA‑PTT) zu geringe Werte für die Faktor VIII‑Aktivität von Jivi in Plasmaproben bestimmt werden, während einige Reagenzien wie z. B. solche mit Kaolin‑basierten Aktivatoren möglicherweise zu hohe Werte ergeben.
Die klinische Wirkung von Faktor VIII ist der wichtigste Aspekt bei der Beurteilung der Wirksamkeit der Behandlung. Möglicherweise ist eine Anpassung der individuellen Dosierung beim Patienten erforderlich, um zufriedenstellende klinische Ergebnisse zu erzielen. Falls die berechnete Dosis nicht zu den erwarteten Faktor VIII‑Spiegeln führt oder Blutungen nicht durch die Verabreichung der berechneten Dosis gestillt werden können, sollten Inhibitoren von Faktor VIII im Blutkreislauf oder Anti‑PEG‑Antikörper in Betracht gezogen werden (siehe Abschnitt 4.4).
Dosierung
Die Dosis und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor VIII‑Mangels, Ort und Ausmaß der Blutung und nach dem klinischen Zustand des Patienten.
Die Anzahl der verabreichten Faktor VIII‑Einheiten wird in I.E. angegeben, basierend auf dem aktuellen WHO‑Standard für Faktor VIII‑Produkte. Die Faktor VIII‑Aktivität im Plasma wird entweder als Prozentsatz (bezogen auf normales menschliches Plasma) oder vorzugsweise in I.E. (bezogen auf einen internationalen Standard für Faktor VIII im Plasma) angegeben.
Eine I.E. der Faktor VIII‑Aktivität entspricht der Menge an Faktor VIII in einem Milliliter normalem menschlichem Plasma.
Bedarfsbehandlung
Die Berechnung der erforderlichen Faktor VIII‑Dosis basiert auf dem empirischen Befund, dass die Gabe von 1 I.E. Faktor VIII pro kg Körpergewicht die Faktor VIII‑Aktivität im Plasma um 1,5‑2,5 %, bezogen auf den Normalwert, anhebt.
Die erforderliche Dosis von Jivi wird mit folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht (kg) x erwünschter Faktor VIII‑Anstieg (% oder I.E./dl) x Kehrwert der beobachteten Recovery (d. h. 0,5 bei einer Recovery von 2,0 %).
Die Dosis und die Häufigkeit der Anwendung sollten sich stets an der erforderlichen klinischen Wirksamkeit im Einzelfall orientieren.
Im Falle der folgenden Blutungsereignisse sollte die Faktor VIII‑Aktivität im entsprechenden Zeitraum nicht unter die angegebenen Werte für die Aktivität im Plasma (in % der Norm) fallen. Die folgende Tabelle enthält Richtwerte für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen:
Tabelle 1: Richtwerte für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen
Schwere der Blutung/Art des chirurgischen Eingriffs | Benötigter | Häufigkeit der Dosierung (Stunden)/Behandlungsdauer (Tage) |
Blutungen Gelenkblutungen im Frühstadium, Muskelblutungen, Blutungen im Mundbereich | 20‑40 | Injektion alle 24 bis 48 Stunden wiederholen, |
Ausgeprägtere Gelenkblutungen, Muskelblutungen oder Hämatome | 30‑60 | Injektion alle 24 bis 48 Stunden für 3 bis 4 Tage oder länger wiederholen, bis die Schmerzen und akute Behinderungen beseitigt sind. |
Lebensbedrohliche | 60‑100 | Injektion alle 8 bis 24 Stunden wiederholen, bis der Patienten außer Gefahr ist. |
Chirurgische Eingriffe Kleinere Eingriffe einschließlich Zahnextraktionen | 30‑60 | Injektion alle 24 Stunden; mindestens 1 Tag, bis die Wundheilung erreicht ist. |
Größere Eingriffe | 80‑100 (prä- und postoperativ) | Injektion alle 12 bis 24 Stunden wiederholen, bis ausreichende Wundheilung erreicht ist; dann für mindestens weitere 7 Tage einen Faktor VIII‑Spiegel von 30‑60 % (I.E./dl) aufrechterhalten. |
Prophylaxe
Alle Behandlungsentscheidungen zur Bestimmung geeigneter prophylaktischer Behandlungsschemata sollten sich nach der klinischen Situation des jeweiligen Patienten und dem Ansprechen auf die Behandlung richten. Auf Grundlage der erreichten Faktor VIII-Spiegel und der individuellen Blutungsneigung kann eine Anpassung der Dosis und der Dosierungsintervalle erwogen werden. Für weitere Einzelheiten, siehe Abschnitte 4.4. und 5.1.
Erwachsene und Jugendliche ab 12 Jahren
Die Dosis beträgt 45‑60 I.E./kg alle 5 Tage.
In Abhängigkeit von den klinischen Merkmalen des Patienten kann die Dosis auch 60 I.E./kg alle 7 Tage oder 30‑40 I.E./kg zweimal wöchentlich betragen (siehe Abschnitte 5.1 und 5.2).
Kinder im Alter von 7 bis < 12 Jahren
Die Dosis beträgt 40‑60 I.E./kg zweimal wöchentlich (siehe Abschnitte 5.1 und 5.2).
Die empfohlene Anfangsdosis beträgt 60 I.E./kg zweimal wöchentlich.
Bei übergewichtigen Patienten sollte die maximale Dosis zur Prophylaxe pro Injektion ca. 6000 I.E. nicht überschreiten.
Spezielle Patientengruppen
Kinder und Jugendliche
Jivi darf bei zuvor unbehandelten Patienten und bei Patienten in einem Alter unter 7 Jahren nicht angewendet werden.
Jugendliche
Die Dosierung bei der Bedarfsbehandlung und Prophylaxe von jugendlichen Patienten entspricht der bei erwachsenen Patienten.
Ältere Patienten
Die Erfahrungen bei Patienten ab 65 Jahren sind begrenzt.
Art der Anwendung
Jivi ist zur intravenösen Anwendung bestimmt.
Jivi sollte über einen Zeitraum von 2 bis 5 Minuten, je nach Gesamtvolumen, intravenös injiziert werden. Die Verabreichungsgeschwindigkeit sollte sich nach dem Befinden des Patienten richten (maximale Injektionsrate: 2,5 ml/Minute).
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6 und Packungsbeilage.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bekannte Überempfindlichkeit gegen Maus- oder Hamsterproteine.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Überempfindlichkeit
Allergische Überempfindlichkeitsreaktionen können bei Anwendung von Jivi auftreten. Das Arzneimittel kann Spuren von Maus- und Hamsterproteinen enthalten. Überempfindlichkeitsreaktionen können auch durch Antikörper gegen PEG bedingt sein (siehe Absatz Immunantwort auf PEG). Wenn Symptome einer Überempfindlichkeit auftreten, sollten die Patienten angewiesen werden, die Anwendung des Arzneimittels sofort abzubrechen und ihren Arzt zu kontaktieren. Die Patienten sollten entsprechend unterwiesen werden, um die ersten Anzeichen einer Überempfindlichkeitsreaktion wie Nesselsucht, generalisierte Urtikaria, Brustenge, pfeifende Atmung, Hypotonie und Anaphylaxie zu erkennen. Gegebenenfalls ist eine symptomatische Behandlung der Überempfindlichkeit einzuleiten. Bei Anaphylaxie oder Schock sind die aktuellen medizinischen Behandlungsstandards zu befolgen.
Inhibitoren
Die Bildung neutralisierender Antikörper (Inhibitoren) gegen Faktor VIII ist eine bekannte Komplikation bei der Behandlung von Patienten mit Hämophilie A. Diese Inhibitoren sind stets gegen die prokoagulatorische Aktivität von Faktor VIII gerichtete IgG‑Immunglobuline, die in Bethesda‑Einheiten (B.E.) pro ml Plasma mittels modifizierten Bethesda‑Assays quantifiziert werden. Das Risiko, Inhibitoren zu entwickeln, korreliert mit dem Schweregrad der Erkrankung sowie der Exposition gegenüber dem Faktor VIII. Dieses Risiko ist innerhalb der ersten 50 Expositionstage am größten, besteht allerdings lebenslang fort, wobei dies aber selten ist. In seltenen Fällen können sich Inhibitoren nach den ersten 50 Expositionstagen bilden.
Die klinische Relevanz der Inhibitorentwicklung ist abhängig vom Titer des Inhibitors, wobei niedrigtitrige Inhibitoren ein geringeres Risiko eines ungenügenden klinischen Ansprechens aufweisen als solche mit hohem Titer.
Ganz allgemein sollten alle Patienten, die mit Faktor VIII‑Produkten behandelt wurden, sorgfältig mittels klinischer Befunde und mit geeigneten Labortests hinsichtlich der Entwicklung von Inhibitoren überwacht werden.
Wenn der erwartete Faktor VIII‑Spiegel nicht erreicht wird oder die Blutung nicht durch die Verabreichung einer geeigneten Dosis gestillt werden kann, sollte der Patient auf Faktor VIII‑Inhibitoren hin untersucht werden. Bei Patienten mit hohen Inhibitorspiegeln kann die Faktor VIII‑Therapie unwirksam sein und es müssen andere Therapiemöglichkeiten in Betracht gezogen werden. Die Behandlung solcher Patienten sollte durch Ärzte erfolgen, die Erfahrung mit Hämophilie und mit Inhibitoren gegen Faktor VIII haben.
Immunantwort auf PEG
Eine klinische Immunantwort in Verbindung mit Antikörpern gegen PEG, die sich in Symptomen einer akuten Überempfindlichkeitsreaktion und/oder einem Verlust der Arzneimittelwirksamkeit zeigte, wurde überwiegend in den ersten 4 Expositionstagen beobachtet. Niedrige Faktor VIII‑Spiegel nach der Injektion ohne nachweisbare Faktor VIII‑Inhibitoren deuten darauf hin, dass der Verlust der Arzneimittelwirksamkeit wahrscheinlich durch Anti‑PEG‑Antikörper verursacht wurde. In diesen Fällen sollte Jivi abgesetzt und die Patienten auf ein zuvor wirksames Faktor VIII‑Produkt umgestellt werden.
Bei klinischem Verdacht auf einen Verlust der therapeutischen Wirkung wird ein Test auf Faktor VIII-Inhibitoren und Faktor VIII-Recovery empfohlen.
Mit zunehmendem Alter wurde eine signifikante Abnahme des Risikos einer Immunantwort auf PEG beobachtet. Diese Wirkung könnte mit einer entwicklungsbedingten Veränderung des Immunsystems zusammenhängen, und auch wenn das Festlegen einer eindeutigen Altersgrenze für die Risikoänderung schwierig ist, tritt dieses Phänomen hauptsächlich bei jungen Kindern mit Hämophilie auf.
Die Bedeutung eines möglichen Risikos für betroffene Patienten mit Überempfindlichkeitsreaktion gegen PEGylierte Proteine ist nicht bekannt. Aus den vorliegenden Daten geht hervor, dass der Titer der IgM‑Antikörper gegen PEG bei den betroffenen Patienten nach dem Absetzen von Jivi abnahm und die Antikörper nach einiger Zeit nicht mehr nachweisbar waren. Eine Kreuzreaktivität der IgM‑Antikörper gegen PEG mit anderen, nicht modifizierten Faktor VIII‑Produkten wurde nicht beobachtet. Alle Patienten konnten mit ihren früher verwendeten Faktor VIII‑Produkten erfolgreich behandelt werden.
Da diese Immunantwort vorübergehend ist und die IgM‑Antikörper gegen PEG innerhalb von 4‑6 Wochen verschwinden, kann eine Wiederaufnahme der Behandlung mit Jivi erwogen werden, wenn sich die Recovery normalisiert hat (siehe Abschnitt 4.2). Bei Wiederaufnahme der Behandlung soll die Recovery der Patienten überwacht werden.
Verminderte inkrementelle Faktor VIII-Recovery
Eine geringfügige Verringerung der Recovery (Recovery um 1 I.E./dl pro I.E./kg) nach Beginn der Behandlung kann auf einen vorübergehenden niedrigen Titer von IgM‑Antikörpern gegen PEG, hauptsächlich bei Kindern, zurückzuführen sein. Eine geringe inkrementelle Recovery könnte möglicherweise mit einer verminderten Wirksamkeit während dieses Zeitraums verbunden sein. Eine Überwachung von pädiatrischen Patienten, einschließlich Überwachung der Faktor VIII-Aktivität nach Dosisgabe, wird empfohlen. Wenn eine Blutung mit der empfohlenen Dosis nicht kontrolliert werden kann und/oder die erwarteten Faktor VIII-Aktivitätswerte ohne FVIII-Inhibitoren nicht erreicht werden, sollte eine Anpassung der Dosis, der Dosierungsintervalle oder ein Absetzen des Arzneimittels in Betracht gezogen werden.
Kardiovaskuläre Ereignisse
Bei Patienten mit bestehenden kardiovaskulären Risikofaktoren kann eine Substitutionstherapie mit Faktor VIII das kardiovaskuläre Risiko erhöhen.
Katheter-assoziierte Komplikationen
Wenn ein zentralvenöser Katheter (ZVK) erforderlich ist, sollte das Risiko von ZVK‑assoziierten Komplikationen einschließlich lokaler Infektionen, Bakteriämie und ZVK‑assoziierten Thrombosen berücksichtigt werden.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmaßnahmen gelten für Erwachsene, Jugendliche und Kinder im Alter von 7 bis unter 12 Jahren.
Jivi darf bei Patienten unter 7 Jahren und bei zuvor unbehandelten Patienten nicht angewendet werden.
Informationen über sonstige Bestandteile
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. es ist nahezu „natriumfrei‟.
Polysorbat 80 (E 433)
Dieses Arzneimittel enthält 0,2 mg Polysorbat 80 pro Durchstechflasche mit 250/500/1 000/2 000/3 000 I.E. und 0,4 mg Polysorbat 80 pro Durchstechflasche mit 4 000 I.E., entsprechend 0,08 mg/ml Injektionslösung. Polysorbate können allergische Reaktionen hervorrufen.
Es wurden keine Wechselwirkungen von Produkten mit humanem Gerinnungsfaktor VIII (rDNS) und anderen Arzneimitteln berichtet.
Schwangerschaft und Stillzeit
Mit Faktor VIII wurden keine tierexperimentellen Reproduktionsstudien durchgeführt. Aufgrund des seltenen Auftretens von Hämophilie A bei Frauen liegen keine Erfahrungen zur Anwendung von Faktor VIII während der Schwangerschaft und Stillzeit vor. Daher sollte Faktor VIII während der Schwangerschaft und Stillzeit nur nach eindeutiger Indikationsstellung angewendet werden.
Fertilität
Nach wiederholter Gabe von Jivi an Ratten und Kaninchen in Studien zur systemischen Toxizität wurden keine behandlungsbedingten Wirkungen auf die männlichen Fortpflanzungsorgane beobachtet (siehe Abschnitt 5.3). Die Wirkung auf die Fertilität beim Menschen ist nicht bekannt.
Jivi hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Es wurden Überempfindlichkeit oder allergische Reaktionen (die Angioödem, Brennen und Stechen an der Injektionsstelle, Schüttelfrost, Hitzegefühl, generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, Hypotonie, Lethargie, Übelkeit, Unruhe, Tachykardie, Brustenge, Kribbelgefühl, Erbrechen, pfeifende Atmung einschließen können) beobachtet, die sich in einigen Fällen zu einer schweren Anaphylaxie (einschließlich Schock) entwickeln können.
Bei Patienten mit Hämophilie A, die mit Faktor VIII, einschließlich Jivi, behandelt werden, können sich neutralisierende Antikörper (Inhibitoren) entwickeln (siehe Abschnitt 5.1). Beim Auftreten solcher Inhibitoren wird sich dieser Zustand in einer unzureichenden klinischen Wirksamkeit manifestieren. In diesem Fall wird empfohlen, Kontakt mit einem auf Hämophilie spezialisierten Zentrum aufzunehmen.
Die häufigsten Nebenwirkungen in klinischen Studien mit vorbehandelten Patienten waren Kopfschmerzen, Husten und Fieber.
Tabellarische Auflistung der Nebenwirkungen
Die Sicherheit von Jivi wurde in 4 zulassungsrelevanten Studien der Phasen I und III (einer Phase-I-Studie und 3 Phase-III-Studien) mit insgesamt 256 Patienten, 148 Jugendlichen/Erwachsenen und 108 pädiatrischen Patienten unter 12 Jahren, untersucht.
Die mediane Anzahl der Expositionstage gegenüber Jivi pro Patient betrug 195 (min-max: 1 - 698) über alle Patienten in den klinischen Studien.
Insgesamt wurden in allen Studien 75 Patienten, davon 39 im Alter von unter 12 Jahren, über eine Behandlungsdauer von mehr als 5 Jahren beobachtet. Für weitere Einzelheiten zu den klinischen Studien siehe Abschnitt 5.1.
Die unten aufgeführte Tabelle entspricht der MedDRA‑Systemorganklassifizierung (SOC und Preferred Term Level). Die Häufigkeiten wurden gemäß folgender Konvention beurteilt: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000); sehr selten (< 1/10 000).
Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 2: Häufigkeit von unerwünschten Arzneimittelwirkungen in klinischen Studien
MedDRA Standard | Nebenwirkung | Häufigkeit |
Erkrankungen des Blutes und des Lymphsystems | Faktor VIII‑Inhibition | Gelegentlich (vorbehandelte Patienten)a |
Erkrankungen des Immunsystems | Überempfindlichkeit | Häufig |
Psychiatrische Erkrankungen | Insomnie | Häufig |
Erkrankungen des Nervensystems | Kopfschmerzen | Sehr häufig |
Schwindel | Häufig | |
Dysgeusie | Gelegentlich | |
Gefäßerkrankungen | Hitzegefühl | Gelegentlich |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | Husten | Häufig |
Erkrankungen des Gastrointestinaltrakts | Bauchschmerzen, Übelkeit, Erbrechen | Häufig |
Erkrankungen der Haut und des Unterhautgewebes | Erythemc, Ausschlagd | Häufig |
Pruritus | Gelegentlich | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Reaktionen an der Injektionsstelleb, Fieber | Häufig |
a Die Häufigkeit basiert auf Studien mit allen Faktor VIII‑Produkten, inkl. Patienten mit schwerer Hämophilie A.
b Einschließlich Pruritus an der Injektionsstelle, Ausschlag an der Injektionsstelle, Schmerzen an der Infusionsstelle und Pruritus an der Gefäßpunktionsstelle
c Einschließlich Erythem und Erythema multiforme
d Einschließlich Ausschlag und papulöser Ausschlag
Es kam zu keiner Änderung des Sicherheitsprofils während der PROTECT VIII und der pädiatrischen Verlängerungsstudien PROTECT Kids.
Beschreibung ausgewählter Nebenwirkungen
Immunogenität
Die Immunogenität wurde in klinischen Studien mit Jivi bei 159 (einschließlich chirurgischer Patienten) vorbehandelten Jugendlichen (ab 12 bis unter 18 Jahren, n = 14) und Erwachsenen (n = 145) mit schwerer Hämophilie A (FVIII:C < 1 %) und zuvor mindestens 150 Expositionstagen sowie bei 108 vorbehandelten pädiatrischen Patienten unter 12 Jahren (n = 60 im Alter von 7 bis unter 12 Jahren) mit zuvor mindestens 50 Expositionstagen untersucht.
Faktor VIII‑Inhibitoren
Es traten keine neuen oder bestätigten Fälle von Inhibitoren gegen Faktor VIII auf. Von einem erwachsenen Patienten wurde während einer Operation ein einziges unbestätigtes positives Ergebnis eines niedrigtitrigen Faktor VIII‑Inhibitors (1,7 B.E./ml) berichtet.
Anti‑PEG‑Antikörper
Bei 2 Patienten wurde eine immunogene Aktivität gegen PEG beobachtet, die sich in der Bildung spezifischer IgM‑Antikörper gegen PEG zeigte. Bei einem Patienten über 12 Jahren ging die Immunantwort mit einer klinischen Überempfindlichkeitsreaktion nach 4 Injektionen von Jivi einher. Die Antikörper gegen PEG waren nach Absetzen von Jivi nicht mehr nachweisbar.
Bei einem Kind im Alter von über 7 Jahren traten innerhalb der ersten 4 Expositionstage hohe Titer neutralisierender IgM-Antikörper gegen PEG auf, die mit einem Verlust der Arzneimittelwirkung einhergingen. Die Antikörper waren nach Absetzen der Behandlung nicht mehr nachweisbar und der Patient konnte 2 Monate später die Behandlung mit Jivi sicher wiederaufnehmen.
Bei einigen Patienten wurden innerhalb der ersten 4 Expositionstage vorübergehende niedrige Titer von PEG-Antikörpern des IgM-Isotyps beobachtet, was zu einer geringfügigen Verminderung der Recovery führte.
Von dem 5. Expositionstag bis zum Ende der Verlängerungsstudien wurde keine klinische Immunreaktion auf PEG beobachtet, die zu einem Verlust der Medikamentenwirksamkeit oder einer Überempfindlichkeit führte.
Kinder und Jugendliche in der Studie PROTECT Kids
In der abgeschlossenen klinischen Studie mit 73 vorbehandelten pädiatrischen Patienten unter 12 Jahren (44 vorbehandelte Patienten unter 6 Jahren, 29 vorbehandelte Patienten im Alter von 6 bis unter 12 Jahren) wurden bei Kindern unter 6 Jahren Nebenwirkungen aufgrund einer Immunantwort gegen PEG beobachtet. Bei 10 der 44 Patienten (23 %) in der Altersgruppe unter 6 Jahren wurde ein Verlust der Arzneimittelwirksamkeit aufgrund neutralisierender Antikörper gegen PEG in den ersten 4 Expositionstagen beobachtet. Bei 3 der 44 Patienten (7 %) war der Verlust der Arzneimittelwirksamkeit mit Überempfindlichkeitsreaktionen verbunden (siehe Abschnitt 4.4). Auslöser oder Prädiktoren einer Immunantwort gegen PEG konnten nicht identifiziert werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem nationalen Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de
In den klinischen Studien gab es einen Fall einer Überdosierung. Es wurden keine unerwünschten Ereignisse gemeldet.
Pharmakotherapeutische Gruppe: Antihämorrhagika; Blutgerinnungsfaktor VIII, ATC‑Code: B02BD02.
Wirkmechanismus
Der Faktor VIII/von‑Willebrand‑Faktor‑Komplex besteht aus zwei Molekülen (Faktor VIII und von‑Willebrand‑Faktor) mit unterschiedlichen physiologischen Funktionen. Wird einem Hämophilie-Patienten Faktor VIII infundiert, so bindet dieser an den im Patienten vorhandenen von‑Willebrand‑Faktor. Aktivierter Faktor VIII wirkt als Co‑Faktor für den aktivierten Faktor IX, der die Umwandlung von Faktor X in aktivierten Faktor X beschleunigt.
Aktivierter Faktor X wandelt Prothrombin in Thrombin um. Thrombin wandelt dann Fibrinogen in Fibrin um und führt so zur Bildung eines Gerinnsels. Hämophilie A ist eine geschlechtsgebundene, erbliche Störung der Blutgerinnung, aufgrund erniedrigter oder fehlender Faktor VIII:C‑Spiegel. Als Folge treten entweder spontan oder in Folge unfallbedingter oder chirurgischer Traumata Blutungen in Gelenken, Muskeln oder inneren Organen auf. Durch die Substitutionstherapie werden die Faktor VIII‑Plasmaspiegel erhöht, wodurch eine vorübergehende Korrektur des Faktor VIII‑Mangels und der Blutungsneigung ermöglicht wird.
Damoctocog alfa pegol ist eine PEGylierte Form von rFVIII. Die spezifische PEGylierung vermindert die Clearance von Faktor VIII, was zu einer verlängerten Halbwertszeit führt, während die normalen Funktionen des rFVIII‑Moleküls ohne B‑Domäne beibehalten werden (siehe Abschnitt 5.2). Damoctocog alfa pegol enthält keinen von‑Willebrand‑Faktor.
Klinische Wirksamkeit und Sicherheit
Klinische Studien
Insgesamt wurden 267 vorbehandelte Patienten mit schwerer Hämophilie A im klinischen Studienprogramm, das aus 1 Phase‑I‑Studie und 3 Phase‑II/III‑Studien bestand, behandelt. 219 Patienten waren mindestens 7 Jahre alt.
Phase II/III
PROTECT VIII: Die Pharmakokinetik, Sicherheit und Wirksamkeit von Jivi bei der Bedarfsbehandlung, Prophylaxe mit drei Behandlungsschemata (zweimal pro Woche 30‑40 I.E./kg, alle 5 Tage 45‑60 I.E./kg und alle 7 Tage 60 I.E./kg) und Hämostase bei größeren chirurgischen Eingriffen wurden in einer multinationalen, offenen, nicht kontrollierten, teilrandomisierten Studie untersucht, die gemäß dem vereinbarten pädiatrischen Prüfplan durchgeführt wurde. In einer Verlängerungsstudie wurden Patienten eingeschlossen, die die Hauptstudie abgeschlossen hatten. Primärer Wirksamkeitsparameter war die annualisierte Blutungsrate (ABR).
134 männliche vorbehandelte Patienten (einschließlich 13 Patienten im Alter von 12 bis 17 Jahren) erhielten über einen Zeitraum von 36 Wochen mindestens eine Injektion von Jivi zur Prophylaxe (n = 114) oder als Bedarfsbehandlung (n = 20). Insgesamt 121 Patienten wurden während der Verlängerung der Studie behandelt, wobei 107 Patienten Prophylaxe und 14 Patienten Bedarfsbehandlung erhielten. 36 Patienten erhielten eine prophylaktische Behandlung für >5 Jahren bis zu 7 Jahren. Der Median (Bereich) der Gesamtstudiendauer betrug 3,9 Jahre (0,8 – 7,0 Jahre) bei allen 121 Patienten. Im chirurgischen Teil wurde die Hämostase bei 20 größeren chirurgischen Eingriffen an 17 Patienten untersucht.
Phase III
PROTECT Kids: Die Pharmakokinetik, Sicherheit und Wirksamkeit von Jivi bei drei prophylaktischen Behandlungsschemata (zweimal wöchentlich, alle 5 und alle 7 Tage) sowie die Behandlung von Durchbruchblutungen wurden in einer multinationalen, nicht kontrollierten, offenen Studie mit 73 pädiatrischen Patienten (unter 12 Jahren) über einen Zeitraum von 50 Expositionstagen und mindestens 6 Monaten untersucht. Diese Studie wurde gemäß dem vereinbarten pädiatrischen Prüfplan durchgeführt. 61 (83,6 %) Patienten schlossen die Hauptstudie ab, und 59 Patienten nahmen an der optionalen Verlängerungsstudie teil, wobei die mediane Gesamtzeit in den Studien 5,8 Jahre betrug (Bereich 1,0 – 6,6 Jahre).
Alfa PROTECT: In einer unverblindeten einarmigen Studie zur Bewertung der Sicherheit von Jivi-Infusionen zur Prophylaxe und Behandlung von Blutungen bei vorbehandelten Kindern im Alter von 7 bis unter 12 Jahren mit schwerer Hämophilie A wurde das potenzielle Risiko einer Überempfindlichkeit und eines Verlusts der Arzneimittelwirkung im Zusammenhang mit einer Immunantwort auf Polyethylenglykol (PEG) innerhalb der ersten 4 Expositionen gegenüber Jivi untersucht. Die Patienten wurden 6 Monate lang prophylaktisch behandelt und konnten anschließend an einer 18‑monatigen Verlängerungsstudie teilnehmen.
Prophylaktische Behandlung von Patienten ab 12 Jahren
Während der Hauptstudie erhielten Patienten Jivi entweder prophylaktisch zweimal wöchentlich (n = 24) oder nach Randomisierung alle 5 Tage (n = 43) oder alle 7 Tage (n = 43) oder im Rahmen einer Bedarfsbehandlung (n = 20). 99 von 110 Patienten (90 %) verblieben in dem ihnen zugewiesenen Behandlungsschema. Elf Patienten in dem Arm mit einer Jivi‑Gabe alle 7 Tage, steigerten die Injektionshäufigkeit. Die bei allen prophylaktischen Behandlungsschemata verabreichte mediane Dosis betrug 46,9 I.E./kg/Injektion. Die mediane (Q1; Q3) annualisierte Blutungsrate im Prophylaxe‑Arm betrug 2,09 (0,0; 6,1) für alle Blutungen und 0,0 (0,0; 4,2) für spontane Blutungen im Vergleich zu 23,4 (18; 37) für die Gesamtzahl an Blutungen in der Bedarfsbehandlungsgruppe. Bei 42 der 110 Patienten im Arm mit prophylaktischer Behandlung (38,2 %) kam es zu keiner Blutungsepisode.
Während der Verlängerungsstudie (mediane Dauer von 3,2 Jahren, Bereich 0,1 – 6,3 Jahren) wurden 23 Patienten zweimal wöchentlich, 33 Patienten alle 5 Tage und 23 Patienten alle 7 Tage während der gesamten Zeit in der Verlängerungsstudie behandelt, 28 Patienten wechselten das Behandlungsschema. Die mediane Dosis im Prophylaxe‑Arm betrug 47,8 I.E./kg. Insgesamt betrug die mediane (Q1; Q3) annualisierte Gesamtblutungsrate 1,49 (0,4; 4,8) bzw. 0,75 (0,0; 2,9) für spontane Blutungen in den kombinierten Prophylaxe‑Gruppen, während die annualisierte Gesamtblutungsrate in der Bedarfsbehandlungsgruppe 34,1 betrug.
Es ist zu beachten, dass die annualisierte Blutungsrate zwischen verschiedenen Faktor‑Konzentraten und verschiedenen klinischen Studien nicht vergleichbar ist.
Behandlung von Blutungen
Von den während der Hauptstudie mit Jivi behandelten 702 Blutungsereignissen wurden 636 (90,6 %) mit 1 oder 2 Injektionen behandelt, wobei bei 81,1 % 1 Injektion benötigt wurde. Die mediane (Bereich) Dosis pro Injektion betrug 31,7 (14; 62) I.E./kg. Von den während der Verlängerungsstudie mit Jivi behandelten 1902 Blutungen konnten 94,0 % mit 1 oder 2 Injektionen kontrolliert werden, wobei bei 84,9 % 1 Injektion benötigt wurde. Die mediane (Bereich) Dosis pro Injektion betrug 37,9 (15; 64) I.E./kg.
Perioperative Behandlung
Insgesamt 20 größere chirurgische Eingriffe wurden an 17 Patienten durchgeführt und beurteilt. Die mediane Gesamtdosis bei den größeren Eingriffen betrug 219 I.E./kg (Bereich: 50‑1.500 I.E./kg, einschließlich der postoperativen Phase von bis zu 3 Wochen). Die perioperative hämostatische Wirksamkeit wurde bei allen größeren Eingriffen als gut oder ausgezeichnet beurteilt.
Außerdem wurden bei 19 Patienten 34 kleinere Eingriffe vorgenommen. Die Hämostase wurde in allen vorliegenden Fällen als gut oder ausgezeichnet beurteilt.
Kinder und Jugendliche unter 12 Jahren
Jivi darf bei Kindern unter 7 Jahren nicht angewendet werden (für Informationen zur Anwendung bei Kindern und Jugendlichen siehe Abschnitt 4.2).
PROTECT Kids: In der Phase‑III‑Studie erhielten insgesamt 73 vorbehandelte pädiatrische Patienten (44 Patienten unter 6 Jahren und 29 Patienten 6 bis unter 12 Jahren) zweimal wöchentlich, alle 5 Tage oder alle 7 Tage eine prophylaktische Behandlung. Bei 53 Patienten, die die Hauptstudie abschlossen, betrug die mediane (Q1; Q3) annualisierte Blutungsrate 2,87 (1,1; 6,1) und die spontane annualisierte Blutungsrate 0,0 (0,0; 2,6). Bei der Behandlung von Blutungen konnten 84,4 % der Blutungen mit 1 Injektion und 91,9 % der Blutungen mit 1 oder 2 Injektionen gestoppt werden.
11 Patienten in der Altersgruppe unter 6 Jahren beendeten aufgrund einer Immunantwort gegen PEG in Verbindung mit einem Verlust der Wirksamkeit und/oder einer Überempfindlichkeitsreaktion in den ersten vier Expositionstagen die Studie.
Für 59 Patienten, die an der Verlängerungsstudie teilnahmen, betrug die gesamte mediane (Q1 ; Q3) annualisierte Blutungsrate während der Verlängerungsperiode 1,64 (0,5 ; 3,1). Für 30 Patienten ≥ 12 Jahren betrug die mediane (Q1 ; Q3) annualisierte Blutungsrate am Ende der Verlängerungsstudie 1,76 (0,5 ; 3,3).
Alfa PROTECT: Insgesamt erhielten 35 vorbehandelte Patienten (7 bis unter 12 Jahren) zweimal wöchentlich eine prophylaktische Behandlung (40‑60 I.E./kg) mit einer medianen Dosis von 55 I.E./kg. Die mediane (Q1; Q3) annualisierte Blutungsrate in der Wirksamkeitspopulation (32 Patienten) betrug 0,0 (0,0; 1,9). Die Blutungen konnten in 95,2 % der Fälle mit 1 oder 2 Injektionen gestoppt werden. Bei einem Patienten kam es innerhalb der ersten 4 Expositionstage zu einer Immunantwort gegen PEG, die mit einem Verlust der Arzneimittelwirkung einherging. Die Behandlung wurde für einen Zeitraum von 2 Monaten unterbrochen, woraufhin keine Antikörper mehr nachweisbar waren und der Patient die Behandlung wiederaufnehmen konnte.
Die Pharmakokinetik (PK) von Jivi wurde in einer Phase‑I‑Crossover‑Studie mit der von Faktor VIII verglichen. Die Pharmakokinetik wurde auch bei 12 Patienten im Alter von 7 bis unter 12 Jahren [PROTECT Kids] und bei 22 Patienten im Alter von mindestens 12 Jahren [PROTECT VIII] sowie bei 16 dieser Patienten nach einer 6‑monatigen prophylaktischen Behandlung in der Phase‑II/III‑Studie bewertet.
Die pharmakokinetischen Daten (gemäß chromogenem Test) deuteten darauf hin, dass Jivi eine verminderte Clearance (CL) aufweist, was zu einer 1,4‑fach längeren terminalen Halbwertszeit führt und in einer dosisnormalisierten AUC resultiert, die um das 1,4‑Fache größer ist als beim Faktor VIII‑Vergleichsprodukt. Zwischen den Dosen von 25 und 60 I.E./kg wurden dosisproportionale Anstiege beobachtet, was auf eine Dosislinearität zwischen 25 I.E./kg und 60 I.E./kg hindeutet.
In Tabelle 3 sind die pharmakokinetischen Parameter nach einer Einzeldosis von 60 I.E./kg bei 12 Patienten im Alter von 7 bis unter 12 Jahren und bei 22 Patienten im Alter von mindestens 12 Jahren zusammengefasst. Wiederholte Pharmakokinetik‑Messungen bei Patienten im Alter von mindestens 12 Jahren zeigten keine relevanten Änderungen der pharmakokinetischen Eigenschaften nach einer Langzeitbehandlung.
Tabelle 3: Pharmakokinetische Parameter (geometrischer Mittelwert [%CV] und arithmetischer Mittelwert [± SD]) von Jivi nach einer Einzeldosis von 60 I.E./kg gemäß chromogenem Test
Parameter (Einheiten) | Jivi | Jivi |
AUC (I.E.*h/dl) | 3 710 (33,8) | 2 842 (20,3) |
AUC, norm (h*kg/dl) | 62,5 (33,7) | 47,5 (19,6) |
Cmax (I.E./dl) | 163 (14,7) | 128 (19,9) |
t½ (h) | 17,1 (27,1) | 15,6 (23,5) |
MRTIV (h) | 24,4 (27,5) | 23,5 (24,4) |
Vss (dl/kg) | 0,391 (16,3) | 0,496 (20,2) |
CL (dl/h/kg) | 0,0160 (33,7) | 0,0211 (19,6) |
AUC: Fläche unter der Kurve (Area under the curve); AUC norm: Dosis‑normalisierte AUC; Cmax: maximale Wirkstoffkonzentration
t½: terminale Halbwertszeit; MRTIV: mittlere Verweildauer (mean residence time) nach einer i.v.‑Verabreichung
VSS: scheinbares Verteilungsvolumen im Steady‑State
CL: Clearance
Bei 131 Patienten im Alter von mindestens 12 Jahren wurde zu verschiedenen Zeitpunkten die inkrementelle Recovery bestimmt. Die mediane (Q1; Q3) Recovery im chromogenen Test betrug 2,6 (2,3; 3,0). Die mediane (Bereich) inkrementelle Recovery im chromogenen Test betrug bei 57 Patienten im Alter von 7 bis unter 12 Jahren 1,9 (1,1 bis 3,8).
Auf der Grundlage aller verfügbaren Faktor VIII‑Messungen (von eng beieinander liegenden Pharmakokinetik‑Proben und allen Recovery‑Proben) der 3 klinischen Studien wurde ein populationsbasiertes, pharmakokinetisches Modell erstellt, das die Berechnung pharmakokinetischer Parameter der Patienten in den verschiedenen Studien ermöglichte. Die nachfolgende Tabelle 4 fasst die gemäß dem populationsbasierten pharmakokinetischen Modell bestimmten pharmakokinetischen Parameter zusammen.
Tabelle 4: Pharmakokinetische Parameter (geometrischer Mittelwert [%CV]) gemäß eines populationsbasierten pharmakokinetischen Modells, bestimmt mithilfe des chromogenen Tests
PK‑Parameter (Einheit) | 7 bis < 12 Jahre | 12 bis < 18 Jahre | ≥ 18 Jahre | Gesamt (≥ 12 Jahre) |
AUC (I.E. x h/dl)* | 2 694 (23) | 3 341 (34,2) | 4 052 (31,1) | 3 997 (31,6) |
AUCnorm (kg x h/dl) | 44,9 (23) | 57,4 (32,6) | 67,5 (30,6) | 66,6 (31,0) |
t1/2 (h) | 15,0 (19,3) | 16,8 (25,2) | 17,4 (28,8) | 17,4 (28,4) |
Vss (dl/kg) | 0,481 (15,3) | 0,423 (15,5) | 0,373 (15,6) | 0,376 (15,9) |
CL (dl/h/kg) | 0,0223 (22,9) | 0,0174 (34,2) | 0,0148 (31,1) | 0,0150 (31,6) |
*AUC berechnet für eine Dosis von 60 I.E./kg
Jivi wurde in Studien zur Pharmakologie, zur Toxizität bei einmaliger und wiederholter Gabe sowie zur Toxizität bei juvenilen Tieren in Ratten und Kaninchen untersucht. In einer 6‑monatigen Langzeitstudie zur chronischen Toxizität gab es keine Hinweise auf eine PEG‑Akkumulation oder andere Wirkungen, die mit der Anwendung von Jivi in Zusammenhang standen. Zusätzlich wurden in zwei Tierarten 4‑wöchige Studien zur Toxizität des PEG‑Anteils von Jivi durchgeführt. Der PEG‑Linker‑Anteil wurde auch in einer Standardreihe von In‑vivo- und In‑vitro‑Genotoxizitätsstudien untersucht, ohne dass ein genotoxisches Potenzial aufgezeigt wurde. Diese Studien ergaben keine Sicherheitsbedenken für den Menschen.
Einzeldosis‑Studien bei Ratten mit radioaktiv markiertem PEG‑Anteil ergaben keinen Hinweis auf eine Retention oder irreversible Bindung der Radioaktivität im Tierkörper. Insbesondere wurde keine Restradioaktivität im Gehirn nachgewiesen, was darauf hinweist, dass die radioaktiv markierte Verbindung die Blut‑Hirn‑Schranke nicht passierte. In Studien zur Verteilung und Ausscheidung bei Ratten wurden für den 60 kDa großen PEG‑Anteil von Jivi eine weitreichende Verteilung und Elimination aus Organen und Geweben sowie eine Ausscheidung mit dem Urin (68,4 % bis Tag 231 nach der Verabreichung) und den Fäzes (13,8 % bis Tag 168 nach der Verabreichung) gezeigt.
Es wurden keine tierexperimentellen Langzeitstudien zur Untersuchung des kanzerogenen Potenzials von Jivi oder Studien zu den Auswirkungen von Jivi auf die Reproduktion durchgeführt.
Pulver
Saccharose
Histidin
Glycin (E 640)
Natriumchlorid
Calciumchlorid‑Dihydrat (E 509)
Polysorbat 80 (E 433)
Eisessig (zur Einstellung des pH‑Werts) (E 260)
Lösungsmittel
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Es sollten ausschließlich die in der Packung mitgelieferten Komponenten zur Rekonstitution und Injektion benutzt werden, da die Therapie als Folge einer Adsorption von Faktor VIII an inneren Oberflächen mancher Injektionssets versagen kann.
Ungeöffnete Durchstechflasche
2 Jahre.
Rekonstituierte Lösung
Nach Rekonstitution konnte die chemische und physikalische Stabilität der Lösung bei Raumtemperatur für 3 Stunden gezeigt werden. Nach der Rekonstitution nicht im Kühlschrank lagern.
Die rekonstituierte Lösung sollte aus mikrobiologischer Sicht umgehend verwendet werden. Wird die Lösung nicht umgehend verwendet, liegen die Aufbewahrungszeiten und -bedingungen in der Verantwortung des Anwenders.
Im Kühlschrank lagern (2 °C ‑ 8 °C).
Nicht einfrieren.
Die Durchstechflasche und die Fertigspritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Innerhalb der Dauer der Haltbarkeit von insgesamt 2 Jahren kann das Produkt (im Umkarton) über einen begrenzten Zeitraum von 6 Monaten bei bis zu 25 °C aufbewahrt werden. Das Enddatum der 6‑monatigen Aufbewahrungszeit bei einer Temperatur von bis zu 25 °C sollte auf dem Umkarton vermerkt werden. Dieses Datum darf nicht nach dem auf dem Umkarton aufgedruckten Verfalldatum liegen. Nach Ablauf dieser Frist darf das Arzneimittel nicht erneut im Kühlschrank gelagert werden, sondern muss verwendet oder entsorgt werden.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
Jede Einzelpackung Jivi enthält:
eine Durchstechflasche mit Pulver (10‑ml‑Durchstechflasche aus Typ 1 Klarglas mit grauem Brombutylstopfen und Bördelkappe aus Aluminium)
eine Fertigspritze mit 2,5 ml (für 250 I.E., 500 I.E., 1 000 I.E., 2 000 I.E. und 3 000 I.E.) oder 5 ml (für 4 000 I.E.) Lösungsmittel (Spritze mit Zylinder aus Typ 1 Klarglas mit grauem Brombutylstopfen)
einen Spritzenstempel
einen Adapter für die Durchstechflasche (mit integriertem Filter)
ein Venenpunktionsbesteck
Packungsgrößen
Eine Einzelpackung.
Eine Sammelpackung mit 30 Einzelpackungen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Die Rekonstitution des Jivi‑Pulvers sollte ausschließlich mit der mitgelieferten Fertigspritze mit Lösungsmittel (2,5 ml oder 5 ml Wasser für Injektionszwecke) und dem Adapter für die Durchstechflasche erfolgen. Das Arzneimittel muss unter aseptischen Bedingungen für die Injektion zubereitet werden. Wenn eine der Komponenten der Packung geöffnet oder beschädigt ist, darf diese Komponente nicht verwendet werden.
Nach der Rekonstitution ist die Lösung klar und farblos und wird dann in die Spritze aufgezogen.
Parenterale Arzneimittel sind vor der Anwendung visuell auf Partikel und Verfärbung zu prüfen.
Vor der Anwendung muss das rekonstituierte Arzneimittel filtriert werden, um mögliche Partikel in der Lösung zu entfernen. Die Filtration erfolgt mithilfe des Adapters für die Durchstechflasche.
Detaillierte Anleitung zur Zubereitung und Verabreichung von Jivi
Sie benötigen Alkoholtupfer, Trockentupfer, Pflaster und einen Stauschlauch. Dieses Zubehör ist nicht in der Jivi‑Packung enthalten.
1. Waschen Sie Ihre Hände gründlich mit warmem Wasser und Seife. | |
2. Erwärmen Sie eine ungeöffnete Durchstechflasche und eine Spritze in Ihren Händen, bis sie eine angenehme Temperatur erreicht haben (nicht mehr als 37 °C). | |
3. Entfernen Sie die Schutzkappe von der Durchstechflasche (A). Wischen Sie dann den Gummistopfen der Durchstechflasche mit einem Alkoholtupfer ab. Lassen Sie den Stopfen vor Gebrauch der Durchstechflasche an der Luft trocknen. | 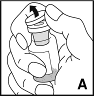 |
4. Stellen Sie die Durchstechflasche mit dem Pulver auf eine feste, rutschfeste Unterlage. Ziehen Sie die Papierfolie von der Kunststoffverpackung des Adapters ab. Nehmen Sie den Adapter nicht aus der Kunststoffverpackung. Halten Sie die Adapterverpackung fest, setzen Sie sie auf die Durchstechflasche mit dem Pulver und drücken Sie sie dann fest nach unten (B). Der Adapter rastet auf der Kappe der Durchstechflasche ein. Die Adapterverpackung jetzt noch nicht entfernen. | 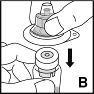 |
5. Halten Sie die Fertigspritze mit dem Lösungsmittel aufrecht. Greifen Sie den Spritzenstempel wie in der Abbildung gezeigt und drehen Sie den Stempel im Uhrzeigersinn in den Gewindestopfen (C). | 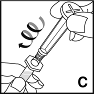 |
6. Halten Sie die Spritze am Zylinder fest und brechen Sie die Spritzenkappe von der Spitze ab (D). Berühren Sie die Spritzenspitze nicht mit Ihren Händen oder anderen Gegenständen. Legen Sie die Spritze zur späteren Verwendung beiseite. | 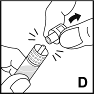 |
7. Entfernen Sie nun die Adapterverpackung und entsorgen Sie sie (E). | 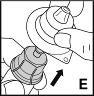 |
8. Verbinden Sie die Fertigspritze durch eine Drehung im Uhrzeigersinn mit dem Adapter für die Durchstechflasche (F). | 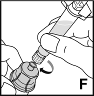 |
9. Überführen Sie langsam das Lösungsmittel durch Druck auf den Spritzenstempel (G). | 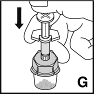 |
10. Schwenken Sie die Durchstechflasche vorsichtig, bis das gesamte Pulver gelöst ist (H). Nicht schütteln! Stellen Sie sicher, dass das Pulver vollständig gelöst ist. Achten Sie darauf, dass die Lösung keine Partikel enthält und nicht verfärbt ist, bevor Sie die Lösung anwenden. Verwenden Sie keine Lösungen mit sichtbaren Partikeln oder Trübungen. | 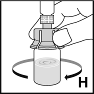 |
11. Halten Sie die Durchstechflasche über den Adapter mit der Spritze (I). Füllen Sie die Spritze durch langsamen, gleichmäßigen Zug des Kolbens. Stellen Sie sicher, dass der gesamte Inhalt der Durchstechflasche in die Spritze überführt wurde. Den Stempel bei aufrecht gehaltener Spritze so weit hineindrücken, bis keine Luft mehr in der Spritze ist. | 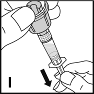 |
12. Legen Sie einen Stauschlauch an Ihren Arm an. | |
13. Lokalisieren Sie die Injektionsstelle und reinigen Sie diese. | |
14. Punktieren Sie die Vene und fixieren Sie das Venenpunktionsbesteck mit einem Pflaster. | |
15. Halten Sie den Adapter der Durchstechflasche fest und nehmen Sie die Spritze vom Adapter ab (der Adapter sollte an der Durchstechflasche bleiben). Verbinden Sie das Venenpunktionsbesteck mit der Spritze (J). Vermeiden Sie Bluteintritt in die Spritze. | 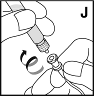 |
16. Lösen Sie den Stauschlauch. | |
17. Die Lösung über 2 bis 5 Minuten in eine Vene injizieren, dabei Nadelposition kontrollieren! Die Injektionsgeschwindigkeit sollte sich nach Ihrem Befinden richten, darf aber eine Geschwindigkeit von 2,5 ml pro Minute nicht überschreiten. | |
18. Wenn eine weitere Dosis benötigt wird, verwenden Sie eine neue Spritze mit Arzneimittel, das wie oben beschrieben rekonstituiert wurde. | |
19. Wenn keine weitere Dosis erforderlich ist, entfernen Sie das Venenpunktionsbesteck und die Spritze. Drücken Sie einen Tupfer ca. 2 Minuten fest auf die Injektionsstelle und halten Sie dabei den Arm gestreckt. Versorgen Sie abschließend die Injektionsstelle mit einem kleinen Druckverband und eventuell einem Pflaster. | |
20. Es wird empfohlen, bei jeder Anwendung von Jivi den Arzneimittelnamen und die Chargennummer des Arzneimittels aufzuschreiben. | |
21. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Arzt oder Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. | |
Jivi ist nur zum einmaligen Gebrauch bestimmt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Bayer AG
51368 Leverkusen
Deutschland
EU/1/18/1324/001 – 1 x (Jivi 250 I.E.)
EU/1/18/1324/002 – 1 x (Jivi 500 I.E.)
EU/1/18/1324/003 – 1 x (Jivi 1000 I.E.)
EU/1/18/1324/004 – 1 x (Jivi 2000 I.E.)
EU/1/18/1324/005 – 1 x (Jivi 3000 I.E.)
EU/1/18/1324/006 – 30 x (Jivi 250 I.E.)
EU/1/18/1324/007 – 30 x (Jivi 500 I.E.)
EU/1/18/1324/008 – 30 x (Jivi 1000 I.E.)
EU/1/18/1324/009 – 30 x (Jivi 2000 I.E.)
EU/1/18/1324/010 – 30 x (Jivi 3000 I.E.)
EU/1/18/1324/011 – 1 x (Jivi 4000 I.E.)
EU/1/18/1324/012 – 30 x (Jivi 4000 I.E.)
Datum der Erteilung der Zulassung: 22. November 2018
Datum der letzten Verlängerung der Zulassung: 23. Juni 2023
Juni 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
__________________________________________________________________________________
Verschreibungspflichtig
Bayer Vital GmbH
51368 Leverkusen
Tel.: +49 (0)214-30 513 48
Fax: +49 (0)214-2605 516 03
E-Mail: medical-information@bayer.com
DE/6