Pregabalin Viatris 25 mg Hartkapseln
Pregabalin Viatris 50 mg Hartkapseln
Pregabalin Viatris 75 mg Hartkapseln
Pregabalin Viatris 100 mg Hartkapseln
Pregabalin Viatris 150 mg Hartkapseln
Pregabalin Viatris 200 mg Hartkapseln
Pregabalin Viatris 225 mg Hartkapseln
Pregabalin Viatris 300 mg Hartkapseln
Pregabalin Viatris 25 mg Hartkapseln
Jede Hartkapsel enthält 25 mg Pregabalin.
Pregabalin Viatris 50 mg Hartkapseln
Jede Hartkapsel enthält 50 mg Pregabalin.
Pregabalin Viatris 75 mg Hartkapseln
Jede Hartkapsel enthält 75 mg Pregabalin.
Pregabalin Viatris 100 mg Hartkapseln
Jede Hartkapsel enthält 100 mg Pregabalin.
Pregabalin Viatris 150 mg Hartkapseln
Jede Hartkapsel enthält 150 mg Pregabalin.
Pregabalin Viatris 200 mg Hartkapseln
Jede Hartkapsel enthält 200 mg Pregabalin.
Pregabalin Viatris 225 mg Hartkapseln
Jede Hartkapsel enthält 225 mg Pregabalin.
Pregabalin Viatris 300 mg Hartkapseln
Jede Hartkapsel enthält 300 mg Pregabalin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Hartkapsel.
Pregabalin Viatris 25 mg Hartkapseln
Hartgelatinekapsel der Größe 4 mit hell-pfirsichfarbenem, opaken Oberteil und weißem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB25“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 50 mg Hartkapseln
Hartgelatinekapsel der Größe 3 mit dunkel-pfirsichfarbenem, opaken Oberteil und weißem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB50“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 75 mg Hartkapseln
Hartgelatinekapsel der Größe 4 mit hell-pfirsichfarbenem, opaken Oberteil und hell-pfirsichfarbenem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB75“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 100 mg Hartkapseln
Hartgelatinekapsel der Größe 3 mit dunkel-pfirsichfarbenem, opaken Oberteil und dunkel-pfirsichfarbenem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB100“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 150 mg Hartkapseln
Hartgelatinekapsel der Größe 2 mit hell-pfirsichfarbenem, opaken Oberteil und weißem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB150“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 200 mg Hartkapseln
Hartgelatinekapsel der Größe 1 mit hell-pfirsichfarbenem, opaken Oberteil und hell-pfirsichfarbenem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB200“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 225 mg Hartkapseln
Hartgelatinekapsel der Größe 1 mit dunkel-pfirsichfarbenem, opaken Oberteil und dunkel-pfirsichfarbenem, opaken Oberteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB225“ in schwarzer Tinte auf Ober- und Unterteil.
Pregabalin Viatris 300 mg Hartkapseln
Hartgelatinekapsel der Größe 0 mit hell-pfirsichfarbenem, opaken Oberteil und weißem, opaken Unterteil, gefüllt mit weißem bis cremefarbenen Pulver. Die Kapsel trägt axial den Aufdruck „MYLAN“ über „PB300“ in schwarzer Tinte auf Ober- und Unterteil.
Neuropathische Schmerzen
Pregabalin Viatris wird angewendet zur Behandlung von peripheren und zentralen neuropathischen Schmerzen im Erwachsenenalter.
Epilepsie
Pregabalin Viatris wird angewendet zur Zusatztherapie von partiellen Anfällen mit und ohne sekundäre Generalisierung im Erwachsenenalter.
Generalisierte Angststörungen
Pregabalin Viatris wird angewendet zur Behandlung von generalisierten Angststörungen bei Erwachsenen.
Dosierung
Die Dosis liegt zwischen 150 und 600 mg täglich, verabreicht in 2 oder 3 Einzeldosen.
Neuropathische Schmerzen
Die Pregabalin-Behandlung kann mit einer Tagesdosis von 150 mg, verabreicht in 2 oder 3 Einzeldosen, begonnen werden.
Abhängig vom Ansprechen und der individuellen Verträglichkeit kann die Dosis nach 3 bis 7 Tagen auf 300 mg täglich erhöht werden. Bei Bedarf kann die Dosis nach weiteren 7 Tagen auf eine Höchstdosis von 600 mg täglich gesteigert werden.
Epilepsie
Die Pregabalin-Behandlung kann mit einer Tagesdosis von 150 mg, verabreicht in 2 oder 3 Einzeldosen, begonnen werden. Abhängig vom Ansprechen und der individuellen Verträglichkeit kann die Dosis nach 1 Woche auf 300 mg täglich erhöht werden. Die Höchstdosis von 600 mg täglich kann nach einer weiteren Woche erreicht werden.
Generalisierte Angststörungen
Die Dosis liegt zwischen 150 und 600 mg pro Tag, verabreicht in 2 oder 3 Einzeldosen. Die Therapienotwendigkeit sollte regelmäßig überprüft werden.
Die Pregabalin-Behandlung kann mit einer Tagesdosis von 150 mg begonnen werden. Abhängig vom klinischen Ansprechen und der individuellen Verträglichkeit kann die Dosis nach 1 Woche auf 300 mg täglich erhöht werden. Nach 1 weiteren Woche kann die Dosis auf 450 mg täglich gesteigert werden. Die Höchstdosis von 600 mg täglich kann nach 1 weiteren Woche erreicht werden.
Absetzen von Pregabalin
In Übereinstimmung mit der gängigen klinischen Praxis wird empfohlen, beim Absetzen von Pregabalin unabhängig von der Indikation die Dosis ausschleichend über einen Zeitraum von mindestens 1 Woche zu verringern (siehe Abschnitte 4.4 und 4.8).
Besondere Patientengruppen
Eingeschränkte Nierenfunktion
Pregabalin wird aus dem Blutkreislauf hauptsächlich unverändert über die Nieren ausgeschieden. Da die Pregabalin-Clearance direkt proportional zur Kreatinin-Clearance ist (siehe Abschnitt 5.2), muss die Dosisreduzierung bei Patienten mit eingeschränkter Nierenfunktion individuell an die Kreatinin-Clearance (CLcr) angepasst werden. Die in Tabelle 1 angegebenen Werte für die Kreatinin-Clearance errechnen sich nach der folgenden Formel:
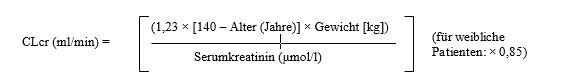
Pregabalin wird durch Hämodialyse wirksam aus dem Plasma eliminiert (50 % des Wirkstoffs in 4 Stunden). Bei Patienten, die sich einer Hämodialyse unterziehen, sollte die tägliche Pregabalin-Dosis entsprechend der Nierenfunktion angepasst werden. Neben der Tagesdosis sollte eine Zusatzdosis sofort nach jeder 4‑stündigen Hämodialysebehandlung verabreicht werden (siehe Tabelle 1).
Tabelle 1: Anpassung der Pregabalin-Dosis in Abhängigkeit von der Nierenfunktion
Kreatinin-Clearance (CLcr) | Gesamttagesdosis von Pregabalin* | Dosisaufteilung | |
Anfangsdosis | Höchstdosis | ||
≥ 60 | 150 | 600 | zwei- oder dreimal täglich |
≥ 30 bis < 60 | 75 | 300 | zwei- oder dreimal täglich |
≥ 15 bis < 30 | 25 bis 50 | 150 | ein- oder zweimal täglich |
< 15 | 25 | 75 | einmal täglich |
Zusatzdosis nach Hämodialyse (mg) | |||
25 | 100 | als Einzeldosis+ | |
* Die Gesamttagesdosis (mg/Tag) muss je nach der angegebenen Dosisaufteilung geteilt werden, um mg/Dosis zu erhalten.
+ Zusatzdosis ist eine einzelne zusätzliche Dosis
Eingeschränkte Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2).
Kinder und Jugendliche
Sicherheit und Wirksamkeit von Pregabalin Viatris bei Kindern unter 12 Jahren und bei Jugendlichen (12 bis 17 Jahre) wurden nicht nachgewiesen. Zurzeit vorliegende Daten werden in Abschnitt 4.8, 5.1 und 5.2 beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Ältere Patienten
Bei älteren Patienten kann aufgrund einer verringerten Nierenfunktion die Reduzierung der Pregabalin-Dosis notwendig werden (siehe Patienten mit eingeschränkter Nierenfunktion).
Art der Anwendung
Pregabalin Viatris kann mit oder ohne Nahrung eingenommen werden.
Pregabalin Viatris ist nur zur oralen Einnahme vorgesehen.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Hautreaktionen
Es wurde über seltene Fälle von schweren arzneimittelinduzierten Hautreaktionen (SCARs), einschließlich Stevens-Johnson-Syndrom (SJS) und toxisch epidermaler Nekrolyse (TEN), die lebensbedrohlich oder tödlich sein können, im Zusammenhang mit Pregabalin-Behandlungen berichtet. Die Patienten sollten zum Zeitpunkt der Verschreibung auf die Anzeichen und Symptome der Hautreaktionen hingewiesen und engmaschig auf diese überwacht werden. Wenn Anzeichen und Symptome, die auf diese Reaktionen hinweisen, auftreten, sollte die Behandlung mit Pregabalin unverzüglich beendet und eine alternative Behandlung in Betracht gezogen werden.
Diabetes-Patienten
In Übereinstimmung mit der gängigen klinischen Praxis kann es bei einigen Diabetes-Patienten, bei denen es unter einer Pregabalin-Therapie zu einer Gewichtszunahme kommt, notwendig werden, die Hypoglykämie-Medikation entsprechend anzupassen.
Überempfindlichkeitsreaktionen
Aus den Erfahrungen nach Markteinführung liegen Berichte über Überempfindlichkeitsreaktionen vor, die auch in Einzelfällen ein Angioödem einschließen. Beim Auftreten von Symptomen eines Angioödems, wie z. B. Schwellungen im Gesicht, im Mundbereich oder der oberen Atemwege, muss Pregabalin sofort abgesetzt werden.
Benommenheit, Schläfrigkeit, Verlust des Bewusstseins, Verwirrtheit und geistige Beeinträchtigung
Die Behandlung mit Pregabalin wurde mit dem Auftreten von Benommenheit und Schläfrigkeit in Verbindung gebracht, was bei älteren Patienten zu häufigeren sturzbedingten Verletzungen führen könnte. Nach Markteinführung wurden auch Fälle von Verlust des Bewusstseins, Verwirrtheit und geistigen Beeinträchtigungen berichtet. Die Patienten sollten daher angehalten werden, sich vorsichtig zu verhalten, bis sie mit den möglichen Auswirkungen des Arzneimittels vertraut sind.
Sehbeeinträchtigungen
In kontrollierten Studien haben mehr Patienten unter Pregabalin über verschwommenes Sehen berichtet als Patienten, die Placebo erhielten. In der Mehrzahl der Fälle verschwand diese Nebenwirkung wieder mit fortgesetzter Behandlung. In den klinischen Studien, in denen eine augenärztliche Untersuchung durchgeführt wurde, war bei den mit Pregabalin behandelten Patienten die Häufigkeit von verringerter Sehschärfe und einer Veränderung des Gesichtsfelds höher als bei den mit Placebo behandelten Patienten. Bei den mit Placebo behandelten Patienten traten häufiger fundoskopische Veränderungen auf (siehe Abschnitt 5.1).
In den Erfahrungen nach Markteinführung wurde auch über Nebenwirkungen am Auge berichtet, einschließlich Verlust des Sehvermögens, verschwommenes Sehen oder andere Veränderungen der Sehschärfe, von denen viele vorübergehend waren. Absetzen von Pregabalin kann hier zu einem Verschwinden oder einer Verbesserung dieser visuellen Symptome führen.
Nierenversagen
Es wurden Fälle von Nierenversagen berichtet. Diese Nebenwirkung war jedoch in einigen Fällen bei Absetzen von Pregabalin reversibel.
Absetzen antiepileptischer Begleitbehandlung
Es liegen keine hinreichenden Daten über das Absetzen der antiepileptischen Begleitbehandlung zur Erreichung einer Monotherapie mit Pregabalin vor, wenn unter Pregabalin als Zusatztherapie eine Anfallskontrolle erreicht wurde.
Herzinsuffizienz
Nach Markteinführung gab es Berichte über Herzinsuffizienz bei einigen Patienten, die Pregabalin erhielten. Diese Reaktionen sind hauptsächlich bei älteren, kardiovaskulär beeinträchtigten Patienten während der Behandlung mit Pregabalin bei einer neuropathischen Indikation zu beobachten. Bei diesen Patienten ist Pregabalin mit Vorsicht anzuwenden. Nach Absetzen von Pregabalin ist diese Reaktion möglicherweise reversibel.
Behandlung von zentralen neuropathischen Schmerzen aufgrund einer Rückenmarkverletzung
Bei der Behandlung von zentralen neuropathischen Schmerzen aufgrund einer Rückenmarkverletzung war die Häufigkeit von Nebenwirkungen im Allgemeinen, von zentralnervösen Nebenwirkungen und hier insbesondere der Schläfrigkeit, erhöht. Das beruht möglicherweise auf einem additiven Effekt aufgrund der benötigten Komedikation (z. B. Spasmolytika). Dies muss berücksichtigt werden, wenn bei dieser Erkrankung Pregabalin verschrieben wird.
Atemdepression
Über schwere Atemdepression wurde in Verbindung mit der Anwendung von Pregabalin berichtet. Patienten mit beeinträchtigter Atemfunktion, Atemwegs- oder neurologischen Erkrankungen, Niereninsuffizienz sowie Patienten, die gleichzeitig ZNS-dämpfende Arzneimittel anwenden, und 7 ältere Patienten könnten ein höheres Risiko für diese schwere Nebenwirkung haben. Für diese Patienten muss die Dosis gegebenenfalls angepasst werden (siehe Abschnitt 4.2).
Suizidale Gedanken und suizidales Verhalten
Über suizidale Gedanken und suizidales Verhalten wurde bei Patienten, die mit Antiepileptika in verschiedenen Indikationen behandelt wurden, berichtet. Eine Metaanalyse randomisierter, placebokontrollierter Studien mit Antiepileptika zeigte auch ein leicht erhöhtes Risiko für das Auftreten von Suizidgedanken und suizidalem Verhalten. Der Mechanismus für die Auslösung dieser Nebenwirkung ist nicht bekannt. Es wurden Fälle von suizidalen Gedanken und suizidalem Verhalten bei Patienten, die mit Pregabalin behandelt wurden, nach Markteinführung beobachtet (siehe Abschnitt 4.8). In einer epidemiologischen Studie mit einem selbstkontrollierten Studiendesign (Vergleich von Behandlungszeiträumen mit Nicht-Behandlungszeiträumen bei individuellen Personen) zeigten sich Hinweise auf ein erhöhtes Risiko für das erneute Auftreten von suizidalem Verhalten und Tod durch Suizid bei Patienten, die mit Pregabalin behandelt wurden.
Patienten (und deren betreuenden Personen) sollte geraten werden, medizinische Hilfe einzuholen, wenn Anzeichen für Suizidgedanken oder suizidales Verhalten auftreten. Patienten sollten hinsichtlich Anzeichen von Suizidgedanken und suizidalem Verhalten überwacht und eine geeignete Behandlung in Erwägung gezogen werden. Das Beenden der Therapie mit Pregabalin sollte beim Auftreten von Suizidgedanken und suizidalem Verhalten in Betracht gezogen werden.
Verringerte Funktionalität des unteren Gastrointestinaltrakts
Nach Markteinführung wurden Fälle von verringerter Funktionalität des unteren Gastrointestinaltrakts berichtet (z. B. Darmobstruktion, paralytischer Ileus, Obstipation), wenn Pregabalin zusammen mit Medikamenten gegeben wurde, die wie Opioidanalgetika Obstipationen verursachen können. Wenn Pregabalin und Opioide in Kombination angewendet werden, sollten Maßnahmen zur Vermeidung der Verstopfung erwogen werden (insbesondere bei weiblichen und älteren Patienten).
Gleichzeitige Anwendung mit Opioiden
Bei einer gleichzeitigen Verordnung von Pregabalin zusammen mit Opioiden ist aufgrund des Risikos einer ZNS-Depression Vorsicht geboten (siehe Abschnitt 4.5). In einer Fall-Kontroll-Studie mit Opioidanwendern bestand bei Patienten, die Pregabalin gleichzeitig mit einem Opioid einnahmen, ein erhöhtes Risiko für opioidbedingte Todesfälle im Vergleich zu einer alleinigen Anwendung von Opioiden (angepasstes Quotenverhältnis [adjusted odds ratio, aOR] 1,68 [95%-KI, 1,19 bis 2,36]). Dieses erhöhte Risiko wurde bei niedrigen Dosen von Pregabalin beobachtet (≤ 300 mg, aOR 1,52 [95%-KI, 1,04 bis 2,22]) und es gab ein tendenziell höheres Risiko bei hohen Dosen von Pregabalin (> 300 mg, aOR 2,51 [95%-KI, 1,24 bis 5,06]).
Nicht bestimmungsgemäßer Gebrauch, Missbrauchspotenzial oder Abhängigkeit
Pregabalin kann eine Arzneimittelabhängigkeit verursachen, die bei therapeutischen Dosen auftreten kann. Es wurde über Fälle von Missbrauch und nicht bestimmungsgemäßem Gebrauch berichtet. Bei Patienten mit Drogenmissbrauch in der Vorgeschichte kann ein erhöhtes Risiko für nicht bestimmungsgemäßen Gebrauch, Missbrauch und Abhängigkeit von Pregabalin bestehen. Daher sollte Pregabalin bei diesen Patienten mit Vorsicht angewendet werden. Vor der Verschreibung von Pregabalin sollte das Risiko des Patienten für einen nicht bestimmungsgemäßen Gebrauch, einen Missbrauch oder eine Abhängigkeit sorgfältig geprüft werden.
Patienten, die mit Pregabalin behandelt werden, sollten auf Anzeichen und Symptome eines nicht bestimmungsgemäßen Gebrauchs, eines Missbrauchs oder einer Abhängigkeit von Pregabalin, wie z. B. Toleranzentwicklung, Dosissteigerung und wirkstoffsuchendes Verhalten, überwacht werden.
Entzugssymptome
Nach Absetzen einer Kurzzeit- oder Langzeittherapie von Pregabalin wurden Entzugssymptome beobachtet. Die folgenden Symptome wurden berichtet: Schlafstörungen, Kopfschmerzen, Übelkeit, Angst, Durchfall, Grippesymptome, Nervosität, Depressionen, suizidale Gedanken, Schmerzen, Konvulsionen, Hyperhidrose und Benommenheit. Das Auftreten von Entzugssymptomen nach dem Absetzen von Pregabalin kann auf eine Arzneimittelabhängigkeit hinweisen (siehe Abschnitt 4.8). Der Patient sollte zu Beginn der Behandlung hierüber informiert werden. Im Falle des Absetzens von Pregabalin wird empfohlen, dies schrittweise über einen Zeitraum von mindestens 1 Woche zu tun, unabhängig von der Indikation (siehe Abschnitt 4.2).
Konvulsionen, einschließlich Status epilepticus und Grand-Mal-Konvulsionen, können während der Anwendung von Pregabalin oder kurz nach dem Absetzen auftreten.
In Bezug auf das Absetzen einer Langzeitbehandlung mit Pregabalin deuten die Daten darauf hin, dass das Auftreten und der Schweregrad der Entzugssymptome dosisabhängig sein können.
Enzephalopathie
Fälle von Enzephalopathie wurden berichtet, meistens bei Patienten mit zugrunde liegenden Bedingungen, die eine Enzephalopathie herbeiführen können.
Frauen im gebärfähigen Alter/Verhütung
Die Anwendung von Pregabalin im ersten Schwangerschaftstrimester kann zu schweren Fehlbildungen beim ungeborenen Kind führen. Pregabalin Viatris sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der Nutzen für die Mutter überwiegt eindeutig das potenzielle Risiko für den Fötus. Frauen im gebärfähigen Alter müssen während der Behandlung eine zuverlässige Verhütungsmethode anwenden (siehe Abschnitt 4.6).
Natrium-Gehalt
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) Natrium pro Tablette, d.h., es ist nahezu „natriumfrei“.
Pregabalin wird hauptsächlich unverändert über die Nieren ausgeschieden und beim Menschen praktisch nicht metabolisiert (< 2 % einer Dosis finden sich als Metaboliten im Urin wieder). Pregabalin behindert in‑vitro nicht den Metabolismus von anderen Arzneimitteln und wird nicht an Plasmaproteine gebunden. Daher ist es unwahrscheinlich, dass es pharmakokinetische Wechselwirkungen hervorruft oder diesen unterliegt.
In‑vivo-Studien und pharmakokinetische Populationsanalysen
Dementsprechend wurden in in‑vivo-Studien keine klinisch relevanten pharmakokinetischen Wechselwirkungen zwischen Pregabalin und Phenytoin, Carbamazepin, Valproinsäure, Lamotrigin, Gabapentin, Lorazepam, Oxycodon oder Ethanol beobachtet. Pharmakokinetische Populationsanalysen haben gezeigt, dass orale Antidiabetika, Diuretika, Insulin, Phenobarbital, Tiagabin und Topiramat keinen klinisch signifikanten Einfluss auf die Clearance von Pregabalin hatten.
Orale Kontrazeptiva, Norethisteron und/oder Ethinylestradiol
Die gleichzeitige Anwendung von Pregabalin und oralen Norethisteron- und/oder Ethinylestradiol-haltigen Kontrazeptiva hat keinen Einfluss auf den Steady State dieser Substanzen.
Arzneimittel, die das Zentralnervensystem beeinflussen
Pregabalin kann die Wirkung von Ethanol und Lorazepam verstärken. Nach Markteinführung wurden Fälle von respiratorischer Insuffizienz, Koma und Tod bei Patienten berichtet, die Pregabalin und Opiode und/oder andere das Zentralnervensystem (ZNS) dämpfende Arzneimittel einnahmen.. Eine durch Oxycodon hervorgerufene Beeinträchtigung der kognitiven und grobmotorischen Funktionen scheint durch Pregabalin noch verstärkt zu werden.
Interaktionen und ältere Personen
Bei älteren Probanden wurden keine spezifischen Interaktionsstudien zur Pharmakodynamik durchgeführt. Interaktionsstudien wurden nur bei Erwachsenen durchgeführt.
Frauen im gebärfähigen Alter/Verhütung
Frauen im gebärfähigen Alter müssen während der Behandlung eine zuverlässige Verhütungsmethode anwenden (siehe Abschnitt 4.4).
Schwangerschaft
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Es wurde gezeigt, dass Pregabalin bei Ratten plazentagängig ist (siehe Abschnitt 5.2). Pregabalin kann beim Menschen die Plazenta überwinden.
Schwere angeborene Fehlbildungen
Daten aus einer nordeuropäischen Beobachtungsstudie mit mehr als 2.700 Schwangerschaften, bei denen Pregabalin im ersten Schwangerschaftstrimester angewendet wurde, zeigten eine höhere Prävalenz schwerer angeborener Fehlbildungen in der gegenüber Pregabalin exponierten pädiatrischen Population (lebend- oder totgeboren) als in der nicht exponierten Population (5,9 % gegenüber 4,1 %).
Das Risiko für schwere angeborene Fehlbildungen in der pädiatrischen Population mit Exposition gegenüber Pregabalin im ersten Schwangerschaftstrimester war im Vergleich zur nicht exponierten Population (adjustierte Prävalenzrate und 95%-Konfidenzintervall: 1,14 [0,96–1,35]) und im Vergleich zu den gegenüber Lamotrigin (1,29 [1,01–1,65]) oder Duloxetin (1,39 [1,07–1,82]) exponierten Populationen geringfügig erhöht.
Die Analysen zu spezifischen Fehlbildungen zeigten höhere Risiken für Fehlbildungen des Nervensystems, der Augen, der Harnwege, der Genitalien sowie orofaziale Spaltenbildungen, wobei die Zahlen jedoch klein und die Schätzungen ungenau waren.
Pregabalin Viatris darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich (wenn der Nutzen für die Mutter deutlich größer ist als ein mögliches Risiko für den Fötus).
Stillzeit
Pregabalin wird in die Muttermilch ausgeschieden (siehe Abschnitt 5.2). Es ist nicht bekannt, ob Pregabalin Auswirkungen auf Neugeborene/Säuglinge hat. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen oder die Behandlung mit Pregabalin zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens für den Säugling als auch der Nutzen der Therapie für die Mutter berücksichtigt werden.
Fertilität
Es liegen keine klinischen Daten zu den Wirkungen von Pregabalin auf die weibliche Fruchtbarkeit vor.
In einer klinischen Studie zur Bewertung des Effekts von Pregabalin auf die Spermienbeweglichkeit wurden männlichen Probanden Pregabalin-Dosen von 600 mg/Tag verabreicht. Nach einer Behandlung von 3 Monaten gab es keine Wirkungen auf die Spermienbeweglichkeit.
Eine Fertilitätsstudie bei weiblichen Ratten zeigte unerwünschte Reproduktionseffekte. Fertilitätsstudien bei männlichen Ratten zeigten unerwünschte Reproduktions- und Entwicklungseffekte. Die klinische Relevanz dieser Befunde ist nicht bekannt (siehe Abschnitt 5.3).
Pregabalin Viatris hat einen geringen oder mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Pregabalin Viatris kann Benommenheit und Schläfrigkeit hervorrufen und dadurch die Fähigkeit beeinflussen, Auto zu fahren oder Maschinen zu bedienen. Deshalb wird Patienten empfohlen, weder Auto zu fahren noch komplexe Maschinen zu bedienen oder andere potenziell gefährliche Tätigkeiten auszuführen, so lange nicht bekannt ist, ob ihre Fähigkeit zur Ausübung solcher Tätigkeiten durch dieses Arzneimittel beeinträchtigt wird.
Zusammenfassung des Sicherheitsprofils
An dem klinischen Studienprogramm nahmen mehr als 8.900 Patienten teil, die Pregabalin erhielten. Von diesen wurden mehr als 5.600 in doppelblinde, placebokontrollierte Studien aufgenommen. Die am häufigsten berichteten Nebenwirkungen waren Benommenheit und Schläfrigkeit. Der Schweregrad der Nebenwirkungen war in der Regel leicht bis mäßig. Bei allen kontrollierten Studien lag die Abbruchrate aufgrund von Nebenwirkungen bei 12 % bei Patienten unter Pregabalin und bei 5 % bei Patienten unter Placebo. Die häufigsten Nebenwirkungen, die unter Pregabalin zu einem Abbruch der Therapie führten, waren Benommenheit und Schläfrigkeit.
Tabellarische Liste der Nebenwirkungen
Die unten stehende Tabelle 2 zeigt alle Nebenwirkungen, die mit größerer Häufigkeit als unter Placebo und bei mehr als einem Patienten auftraten, geordnet nach Organsystem und Häufigkeit (sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1.000, < 1/100), selten (≥ 1/10.000, < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Die angeführten Nebenwirkungen können auch mit der Grunderkrankung und/oder gleichzeitig verabreichten Arzneimitteln zusammenhängen.
Bei der Behandlung von zentralen neuropathischen Schmerzen aufgrund einer Rückenmarkverletzung war die Häufigkeit von Nebenwirkungen im Allgemeinen, von zentralnervösen Nebenwirkungen und hier insbesondere der Schläfrigkeit, erhöht (siehe Abschnitt 4.4).
Weitere Nebenwirkungen, die nach Markteinführung berichtet wurden, sind in der unten stehenden Liste kursiv angegeben.
Tabelle 2: Unerwünschte Arzneimittelwirkungen von Pregabalin
Systemorganklasse | Unerwünschte Arzneimittelwirkung |
Infektionen und parasitäre Erkrankungen | |
Häufig | Nasopharyngitis |
Erkrankungen des Blutes und des Lymphsystems | |
Gelegentlich | Neutropenie |
Erkrankungen des Immunsystems | |
Gelegentlich | Überempfindlichkeit |
Selten | Angioödem, allergische Reaktion |
Stoffwechsel- und Ernährungsstörungen | |
Häufig | gesteigerter Appetit |
Gelegentlich | Anorexie, Hypoglykämie |
Psychiatrische Erkrankungen | |
Häufig | Euphorie, Verwirrung, Reizbarkeit, Desorientierung, Schlaflosigkeit, verringerte Libido |
Gelegentlich | Halluzinationen, Panikattacken, Ruhelosigkeit, Agitiertheit, Depression, Niedergeschlagenheit, gehobene Stimmungslage, Aggression, Stimmungsschwankungen, Depersonalisation, Wortfindungsstörungen, abnorme Träume, gesteigerte Libido, Anorgasmie, Apathie |
Selten Nicht bekannt | Enthemmung, suizidales Verhalten, Suizidgedanken Arzneimittelabhängigkeit |
Erkrankungen des Nervensystems | |
Sehr häufig | Benommenheit, Schläfrigkeit, Kopfschmerzen |
Häufig | Ataxie, Koordinationsstörungen, Tremor, Dysarthrie, Amnesie, Gedächtnisstörungen, Aufmerksamkeitsstörungen, Parästhesie, Hypästhesie, Sedierung, Gleichgewichtsstörung, Lethargie |
Gelegentlich | Synkopen, Stupor, Myoklonus, Verlust des Bewusstseins, psychomotorische Hyperaktivität, Dyskinesie, posturaler Schwindel, Intentionstremor, Nystagmus, kognitive Störungen, geistige Beeinträchtigungen, Sprachstörungen, verringerte Reflexe, Hyperästhesie, brennendes Gefühl, Geschmacksverlust, Unwohlsein |
Selten | Konvulsionen, Parosmie, Hypokinesie, Schreibstörungen, Parkinsonismus |
Augenerkrankungen | |
Häufig | verschwommenes Sehen, Diplopie |
Gelegentlich | „Tunnelblick“, Sehstörungen, geschwollene Augen, Gesichtsfeldeinengung, verringerte Sehschärfe, Augenschmerzen, Schwachsichtigkeit, Photopsie, Augentrockenheit, verstärkter Tränenfluss, Augenreizung |
Selten | Verlust des Sehvermögens, Keratitis, Oszillopsie, verändertes räumliches Sehen, Mydriasis, Schielen, Lichtempfindlichkeit |
Erkrankungen des Ohrs und des Labyrinths | |
Häufig | Vertigo |
Gelegentlich | Hyperakusis |
Herzerkrankungen | |
Gelegentlich | Tachykardie, AV‑Block 1. Grades, Sinusbradykardie, Herzinsuffizienz |
Selten | QT‑Verlängerung, Sinustachykardie, Sinusarrhythmie |
Gefäßerkrankungen | |
Gelegentlich | Hypotonie, Hypertonie, Hautrötung mit Wärmegefühl, Gesichtsrötung, kalte Extremitäten |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
Gelegentlich | Dyspnoe, Nasenbluten, Husten, verstopfte Nase, Rhinitis, Schnarchen, trockene Nase |
Selten Nicht bekannt | Lungenödem, Engegefühl im Hals Atemwegsdepression |
Erkrankungen des Gastrointestinaltrakts | |
Häufig | Erbrechen, Übelkeit, Verstopfung, Diarrhoe, Flatulenz, aufgeblähter Bauch, Mundtrockenheit |
Gelegentlich | gastroösophagealer Reflux, vermehrter Speichelfluss, orale Hypästhesie |
Selten | Aszites, Pankreatitis, geschwollene Zunge, Dysphagie |
Leber- und Gallenerkrankungen | |
Gelegentlich | erhöhte Leberenzymwerte* |
Selten | Gelbsucht |
Sehr selten | Leberversagen, Hepatitis |
Erkrankungen der Haut und des Unterhautzellgewebes | |
Gelegentlich | papulöser Ausschlag, Urtikaria, Hyperhidrose, Pruritus |
Selten | Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, kalter Schweiß |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
Häufig | Muskelkrämpfe, Arthralgie, Rückenschmerzen, Schmerzen in den Extremitäten, zervikale Spasmen |
Gelegentlich | Gelenkschwellungen, Myalgie, Muskelzuckungen, Nackenschmerzen, Steifigkeit der Muskulatur |
Selten | Rhabdomyolyse |
Erkrankungen der Nieren und Harnwege | |
Gelegentlich | Harninkontinenz, Dysurie |
Selten | Nierenversagen, Oligurie, Harnretention |
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |
Häufig | erektile Dysfunktion |
Gelegentlich | Störungen der Sexualfunktion, verzögerte Ejakulation, Dysmenorrhoe, Brustschmerzen |
Selten | Amenorrhoe, Absonderungen aus der Brust, Brustvergrößerung, Gynäkomastie |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
Häufig | periphere Ödeme, Ödeme, Gangstörungen, Stürze, Trunkenheitsgefühl, Krankheitsgefühl, Abgeschlagenheit |
Gelegentlich | generalisierte Ödeme, Gesichtsödem, Engegefühl in der Brust, Schmerzen, Fieber, Durst, Frösteln, Asthenie |
Untersuchungen | |
Häufig | Gewichtszunahme |
Gelegentlich | Erhöhung der Kreatinphosphokinase, Hyperglykämie, Thrombozytenzahl erniedrigt, erhöhte Kreatininwerte, Hypokaliämie, Gewichtsverlust |
Selten | Leukozytenzahl erniedrigt |
* Alanin-Aminotransferase (ALT) und Aspartat-Aminotransferase (AST) erhöht
Nach Absetzen einer Kurzzeit- oder Langzeittherapie von Pregabalin wurden Entzugssymptome beobachtet. Die folgenden Symptome wurden berichtet: Schlafstörungen, Kopfschmerzen, Übelkeit, Angst, Durchfall, Grippesymptome, Konvulsionen, Nervosität, Depressionen, suizidale Gedanken, Schmerzen, Hyperhidrose und Benommenheit. Diese Symptome können auf eine Arzneimittelabhängigkeit hinweisen. Der Patient sollte zu Beginn der Behandlung hierüber informiert werden. Nach Absetzen einer Langzeitbehandlung mit Pregabalin deuten die Daten darauf hin, dass das Auftreten und der Schweregrad der Entzugssymptome dosisabhängig sein können (siehe Abschnitte 4.2 und 4.4).
Kinder und Jugendliche
Das Sicherheitsprofil von Pregabalin, das in fünf pädiatrischen Studien an Patienten mit partiellen Anfällen mit und ohne sekundäre Generalisierung (12-wöchige Studie zur Wirksamkeit und Sicherheit an Patienten im Alter von 4 bis 16 Jahren, n = 295; 14-tägige Studie zur Wirksamkeit und Sicherheit an Patienten im Alter von 1 Monat bis unter 4 Jahren, n = 175; Studie zur Pharmakokinetik und Verträglichkeit, n = 65; und 2-jährige unverblindete Folgestudien zur Sicherheit, n = 54 und n = 431) beobachtet wurde, war jenem, das in den Studien bei erwachsenen Patienten mit Epilepsie beobachtet wurde, ähnlich. Die häufigsten unerwünschten Ereignisse, die in der 12-wöchigen Studie unter der Behandlung mit Pregabalin beobachtet wurden, waren Somnolenz, Fieber, Infektionen der oberen Atemwege, gesteigerter Appetit, Gewichtszunahme und Nasopharyngitis. Die häufigsten unerwünschten Ereignisse, die in der 14-tägigen Studie unter der Behandlung mit Pregabalin beobachtet wurden, waren Somnolenz, Infektionen der oberen Atemwege und Fieber (siehe Abschnitte 4.2, 5.1 und 5.2).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
Symptome
Zu den nach Markteinführung am häufigsten beobachteten Nebenwirkungen bei Überdosierung von Pregabalin gehörten Somnolenz, Verwirrtheitszustand, Agitiertheit und Unruhe. Über Krampfanfälle wurde ebenfalls berichtet.
Selten wurden Fälle von Koma berichtet.
Behandlung
Die Behandlung von Pregabalin-Überdosierungen sollte generelle unterstützende Maßnahmen, einschließlich bei Bedarf auch Hämodialyse, beinhalten (siehe Abschnitt 4.2, Tabelle 1).
Pharmakotherapeutische Gruppe: Analgetika, andere Analgetika und Antipyretika ATC-Code: N02BF02.
Der Wirkstoff Pregabalin ist ein Gamma-Aminobuttersäure-Analogon mit der chemischen Bezeichnung [(S)‑3‑(aminomethyl)‑5‑methylhexan-Säure].
Wirkmechanismus
Pregabalin bindet an eine auxiliare Untereinheit (α2‑δ‑Protein) von spannungsabhängigen Calciumkanälen im ZNS.
Klinische Wirksamkeit und Sicherheit
Neuropathische Schmerzen
Die Wirksamkeit konnte in Studien bei diabetischer Neuropathie, postherpetischer Neuralgie und nach Rückenmarkverletzung gezeigt werden. In anderen Modellen zum neuropathischen Schmerz wurde die Wirksamkeit nicht untersucht.
Pregabalin wurde in 10 kontrollierten klinischen Studien untersucht, bei zweimal täglicher Gabe bis zu 13 Wochen und bei dreimal täglicher Gabe bis zu 8 Wochen. Insgesamt waren die Sicherheits- und Wirksamkeitsprofile bei zweimaliger und bei dreimaliger Gabe ähnlich.
In klinischen Studien über bis zu 12 Wochen wurde sowohl bei peripheren als auch zentralen neuropathischen Schmerzen eine Schmerzverringerung innerhalb der 1. Woche festgestellt und blieb während der gesamten Behandlungsperiode erhalten.
In kontrollierten klinischen Studien bei peripheren neuropathischen Schmerzen kam es bei 35 % der mit Pregabalin behandelten Patienten und bei 18 % der Patienten unter Placebo zu einer 50 %igen Verbesserung des Schmerzscores. Unter den Patienten, bei denen es nicht zu Schläfrigkeit kam, kam es bei 33 % der mit Pregabalin behandelten Patienten zu einer derartigen Verbesserung und bei 18 % der Patienten unter Placebo. Bei den Patienten, bei denen es zu Schläfrigkeit kam, betrugen die Responder-Raten unter Pregabalin 48 % und 16 % unter Placebo.
In der kontrollierten klinischen Studie bei zentralen neuropathischen Schmerzen kam es bei 22 % der mit Pregabalin behandelten Patienten und 7 % der Patienten unter Placebo zu einer 50 %igen Verbesserung des Schmerzscores.
Epilepsie
Zusatztherapie
Pregabalin wurde in 3 kontrollierten klinischen Studien sowohl bei zweimal täglicher als auch bei dreimal täglicher Gabe über jeweils 12 Wochen untersucht. Insgesamt war das Verträglichkeits- und Wirksamkeitsprofil bei zweimal und bei dreimal täglicher Gabe ähnlich.
Eine Reduktion der Anfallshäufigkeit wurde innerhalb der 1. Woche beobachtet.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Pregabalin als Zusatztherapie von Epilepsie wurden bei pädiatrischen Patienten unter 12 Jahren und Jugendlichen nicht nachgewiesen. Die Nebenwirkungen, die in einer Studie zur Pharmakokinetik und Verträglichkeit unter Beteiligung von Patienten ab einem Alter von 3 Monaten bis 16 Jahren (n = 65) mit partiellen Anfällen beobachtet wurden, waren jenen, die bei Erwachsenen beobachtet wurden, ähnlich. Die Ergebnisse einer 12-wöchigen, placebokontrollierten Studie an 295 pädiatrischen Patienten im Alter von 4 bis 16 Jahren und einer 14-tägigen placebokontrollierten Studie an 175 pädiatrischen Patienten im Alter von 1 Monat bis unter 4 Jahren zur Bewertung der Wirksamkeit und Sicherheit von Pregabalin als Zusatztherapie zur Behandlung von partiellen Anfällen sowie zwei 1-jährigen unverblindeten Sicherheitsstudien unter Beteiligung von 54 und 431 pädiatrischen Epilepsie-Patienten ab einem Alter von 3 Monaten bis 16 Jahren zeigen, dass die Nebenwirkungen Fieber und Infektionen der oberen Atemwege häufiger als in Studien bei erwachsenen Patienten mit Epilepsie beobachtet wurden (siehe Abschnitte 4.2, 4.8 und 5.2).
In der 12-wöchigen placebokontrollierten Studie wurden pädiatrische Patienten (4 bis 16 Jahre) einer Behandlung mit Pregabalin 2,5 mg/kg/Tag (Höchstdosis 150 mg/Tag), Pregabalin 10 mg/kg/Tag (Höchstdosis 600 mg/Tag) oder Placebo zugeordnet. Eine Verringerung der partiellen Anfälle um mindestens 50 % gegenüber dem Ausgangswert wurde bei 40,6 % der Patienten, die mit Pregabalin 10 mg/kg/Tag behandelt wurden (p = 0,0068 gegenüber Placebo), bei 29,1 % der Patienten, die mit Pregabalin 2,5 mg/kg/Tag behandelt wurden (p = 0,2600 gegenüber Placebo), und bei 22,6 % der Patienten, die Placebo erhielten, nachgewiesen.
In der 14-tägigen placebokontrollierten Studie wurden pädiatrische Patienten (1 Monat bis unter 4 Jahre) einer Behandlung mit Pregabalin 7 mg/kg/Tag, Pregabalin 14 mg/kg/Tag oder Placebo zugeordnet. Die medianen Anfallshäufigkeiten innerhalb von 24 Stunden zu Studienbeginn bzw. beim letzten Besuchstermin betrugen 4,7 bzw. 3,8 bei Pregabalin 7 mg/kg/Tag, 5,4 bzw. 1,4 bei Pregabalin 14 mg/kg/Tag und 2,9 bzw. 2,3 bei Placebo. Bei Pregabalin 14 mg/kg/Tag war eine signifikante Verringerung der logarithmisch transformierten, partiellen Anfallshäufigkeit im Vergleich zu Placebo (p = 0,0223) zu beobachten; bei Pregabalin 7 mg/kg/Tag zeigte sich keine Besserung gegenüber Placebo.
In einer 12-wöchigen placebokontrollierten Studie an Patienten mit primären generalisierten tonisch-klonischen (primary generalized tonic-clonic, PGTC) Anfällen wurden 219 Patienten (Alter 5 bis 65 Jahre, davon 66 im Alter von 5 bis 16 Jahren) mit Pregabalin 5 mg/kg/Tag (Höchstdosis 300 mg/Tag), 10 mg/kg/Tag (Höchstdosis 600 mg/Tag) oder Placebo als Zusatztherapie behandelt. Der Prozentsatz der Patienten mit einer Verringerung der PGTC-Anfallsrate um mindestens 50 % betrug jeweils 41,3 %, 38,9 % bzw. 41,7 % für Pregabalin 5 mg/kg/Tag, Pregabalin 10 mg/kg/Tag und Placebo.
Monotherapie (neu diagnostizierte Patienten)
In einer kontrollierten klinischen Studie über 56 Wochen wurde Pregabalin bei zweimal täglicher Gabe untersucht. Bezogen auf den Endpunkt einer 6‑monatigen Anfallsfreiheit zeigte Pregabalin im Vergleich zu Lamotrigin keine Nicht-Unterlegenheit. Pregabalin und Lamotrigin waren gleichermaßen sicher und gut verträglich.
Generalisierte Angststörungen
Pregabalin wurde in 6 kontrollierten Studien über einen Zeitraum von 4 bis 6 Wochen sowie in einer 8‑wöchigen Studie mit älteren Patienten und in einer Langzeitstudie zur Rückfallprävention mit einer doppelblinden Rückfallpräventionsphase von 6 Monaten untersucht.
Eine Besserung der Symptome von generalisierten Angststörungen gemäß der Hamilton-Anxiety-Rating-Skala (HAM‑A) wurde innerhalb der 1. Woche beobachtet.
In kontrollierten klinischen Studien über 4 bis 8 Wochen zeigten 52 % der mit Pregabalin behandelten Patienten und 38 % der Patienten unter Placebo eine im Vergleich zu den Ausgangswerten mindestens 50 %ige Verbesserung des HAM‑A‑Gesamt-Scores.
Bei kontrollierten Studien haben mehr Patienten unter Pregabalin über verschwommenes Sehen berichtet als Patienten, die Placebo erhielten. In der Mehrzahl der Fälle verschwand diese Nebenwirkung mit fortgesetzter Behandlung wieder.
In kontrollierten klinischen Studien wurden bei mehr als 3.600 Patienten augenärztliche Untersuchungen durchgeführt (einschließlich Untersuchungen der Sehschärfe und des Gesichtsfelds sowie ausführliche Fundoskopie). Unter diesen Patienten war die Sehschärfe bei 6,5 % der mit Pregabalin behandelten Patienten verringert, im Vergleich zu 4,8 % bei den mit Placebo behandelten Patienten. Bei den mit Pregabalin behandelten Patienten wurde eine Veränderung des Gesichtsfelds in 12,4 % und bei den mit Placebo behandelten Patienten in 11,7 % festgestellt. Zu fundoskopischen Veränderungen kam es bei 1,7 % der mit Pregabalin behandelten Patienten und bei 2,1 % der mit Placebo behandelten Patienten.
Bei gesunden Probanden, Epilepsie-Patienten unter Antiepileptika und bei Patienten mit chronischen Schmerzen ist die Pharmakokinetik von Pregabalin im Steady State vergleichbar.
Resorption
Bei Verabreichung an nüchterne Patienten wird Pregabalin rasch resorbiert. Sowohl nach Einmal- als auch nach Mehrfachanwendung werden maximale Plasmakonzentrationen innerhalb von 1 Stunde erreicht. Die orale Bioverfügbarkeit von Pregabalin wird auf ≥ 90 % geschätzt und ist dosisunabhängig. Nach wiederholter Anwendung wird der Steady State innerhalb von 24 bis 48 Stunden erreicht. Bei Einnahme während der Mahlzeiten wird die Resorptionsrate von Pregabalin verringert, was zu einer Verringerung der Cmax um ca. 25 bis 30 % sowie zu einer Verzögerung der tmax auf ca. 2,5 Stunden führt. Die Verabreichung von Pregabalin mit den Mahlzeiten hat jedoch keine klinisch signifikante Auswirkung auf die Resorptionsrate von Pregabalin.
Verteilung
Präklinische Studien haben gezeigt, dass Pregabalin die Blut-Hirn-Schranke bei Mäusen, Ratten und Affen überwindet. Pregabalin geht bei Ratten in die Plazenta über und ist in der Milch von säugenden Ratten nachweisbar. Beim Menschen beträgt das Verteilungsvolumen nach oraler Anwendung ca. 0,56 l/kg. Pregabalin wird nicht an Plasmaproteine gebunden.
Biotransformation
Pregabalin wird beim Menschen nicht nennenswert metabolisiert. Nach einer Gabe von radioaktiv markiertem Pregabalin wurden ca. 98 % unverändertes Pregabalin im Urin wiedergefunden. Das N‑Methyl-Derivat, der Hauptmetabolit von Pregabalin, macht 0,9 % der Dosis im Urin aus. In präklinischen Studien ergaben sich keine Hinweise auf eine Racemisierung des S‑Enantiomers in das R‑Enantiomer von Pregabalin.
Elimination
Pregabalin wird unverändert hauptsächlich renal ausgeschieden. Die mittlere Eliminationshalbwertszeit von Pregabalin beträgt 6,3 Stunden. Die Plasmaclearance und renale Clearance von Pregabalin sind direkt proportional zur Kreatininclearance (siehe Abschnitt 5.2 „Eingeschränkte Nierenfunktion“).
Bei Patienten mit eingeschränkter Nierenfunktion oder bei Patienten, die sich einer Hämodialyse unterziehen, ist eine Anpassung der Pregabalin-Dosis notwendig (siehe Abschnitt 4.2, Tabelle 1).
Linearität/Nicht-Linearität
Im empfohlenen täglichen Dosisbereich ist die Pharmakokinetik von Pregabalin linear. Die interindividuelle pharmakokinetische Variabilität von Pregabalin ist gering (< 20 %). Die Pharmakokinetik nach Mehrfachanwendung lässt sich von den Einzeldosis-Daten ableiten. Es besteht deshalb keine Notwendigkeit für eine routinemäßige Kontrolle der Pregabalin-Plasmaspiegel.
Geschlecht
Klinische Studien haben gezeigt, dass das Geschlecht keinen klinisch signifikanten Einfluss auf die Plasmakonzentration von Pregabalin hat.
Eingeschränkte Nierenfunktion
Die Pregabalin-Clearance verhält sich zur Kreatinin-Clearance direkt proportional. Weiterhin kann Pregabalin effektiv (nach einer 4‑stündigen Hämodialyse reduzieren sich die Plasmakonzentrationen von Pregabalin um ca. 50 %) hämodialysiert werden. Da die renale Elimination den hauptsächlichen Ausscheidungsweg darstellt, ist bei Patienten mit eingeschränkter Nierenfunktion eine Dosisreduktion – und nach einer Hämodialyse eine Dosisergänzung notwendig (siehe Abschnitt 4.2, Tabelle 1).
Eingeschränkte Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion wurden keine speziellen Pharmakokinetikstudien durchgeführt. Nachdem Pregabalin jedoch keiner ausgeprägten Metabolisierung unterliegt und hauptsächlich als unveränderte Substanz im Urin ausgeschieden wird, erscheint es unwahrscheinlich, dass sich die Plasmakonzentrationen von Pregabalin bei eingeschränkter Leberfunktion signifikant verändern.
Kinder und Jugendliche
Die Pharmakokinetik von Pregabalin wurde in einer Studie zur Pharmakokinetik und Verträglichkeit bei pädiatrischen Patienten mit Epilepsie (Altersgruppen 1 bis 23 Monate, 2 bis 6 Jahre, 7 bis 11 Jahre und 12 bis 16 Jahre) in Dosierungen von 2,5, 5, 10 und 15 mg/kg/Tag bewertet.
Nach oraler Verabreichung von Pregabalin bei pädiatrischen Patienten im Nüchternzustand war die Zeit bis zur Erreichung maximaler Plasmakonzentrationen im Allgemeinen in allen Altersgruppen ähnlich und betrug ab Dosisgabe 0,5 bis 2 Stunden.
Die Parameter für Cmax und AUC von Pregabalin stiegen in allen Altersgruppen linear zur Erhöhung der Dosis an. Die AUC war bei Patienten mit einem Gewicht von unter 30 kg aufgrund einer bei diesen Patienten um 43 % erhöhten körpergewichtsbezogenen Clearance im Vergleich zu Patienten mit einem Gewicht von ≥30 kg insgesamt 30 % niedriger.
Die terminale Halbwertszeit von Pregabalin betrug bei pädiatrischen Patienten im Alter von bis zu 6 Jahren durchschnittlich 3 bis 4 Stunden und bei Patienten im Alter ab 7 Jahren durchschnittlich 4 bis 6 Stunden.
Analysen der Populationspharmakokinetik ergaben, dass die Kreatinin-Clearance eine signifikante Kovariate der oralen Clearance von Pregabalin und das Körpergewicht eine signifikante Kovariate des scheinbaren Verteilungsvolumens bei oraler Gabe von Pregabalin war und diese Zusammenhänge in pädiatrischen und erwachsenen Patienten ähnlich waren.
Die Pharmakokinetik von Pregabalin wurde bei Patienten im Alter von unter 3 Monaten nicht untersucht (siehe Abschnitte 4.2, 4.8 und 5.1).
Ältere Patienten
Die Pregabalin-Clearance hat die Tendenz, mit zunehmendem Alter des Patienten abzunehmen. Diese Abnahme der oralen Pregabalin-Clearance entspricht der Abnahme der Kreatinin-Clearance mit zunehmendem Alter. Bei Patienten mit altersbedingter Einschränkung der Nierenfunktion kann eine Reduktion der Pregabalin-Dosis notwendig sein (siehe Abschnitt 4.2, Tabelle 1).
Stillende Mütter
Die Pharmakokinetik von Pregabalin bei einer Gabe von 150 mg alle 12 Stunden (Tagesdosis 300 mg) wurde bei 10 laktierenden Frauen zu einem Zeitpunkt von mindestens 12 Wochen nach der Entbindung untersucht. Die Laktation hatte nur einen geringen bis keinen Einfluss auf die Pharmakokinetik von Pregabalin. Pregabalin wurde in die Muttermilch ausgeschieden mit einer durchschnittlichen Steady-State-Konzentration von etwa 76 % der mütterlichen Plasmakonzentration. Bei Frauen, welche 300 mg/Tag bzw. die Maximaldosis von 600 mg/Tag erhalten, würde die durch die Muttermilch aufgenommene Pregabalindosis eines Säuglings (bei einer durchschnittlichen Milchaufnahme von 150 ml/kg/Tag) geschätzt 0,31 bzw. 0,62 mg/kg/Tag betragen. Diese geschätzten Dosen entsprechen auf mg/kg-Basis etwa 7 % der täglichen Gesamtdosis der Mutter.
In den konventionellen Tierstudien zur Sicherheitspharmakologie wurde Pregabalin in klinisch relevanten Dosen gut vertragen. Bei Toxizitätsstudien an Ratten und Affen wurden bei wiederholter Gabe Auswirkungen auf das ZNS einschließlich Hypoaktivität, Hyperaktivität und Ataxie beobachtet. Bei Anwendung von mehr als dem 5‑Fachen der beim Menschen empfohlenen Maximaldosis kam es in Langzeitversuchen an Albinoratten zu einer erhöhten Inzidenz von Retinaatrophien, die bei älteren Tieren häufig beobachtet wurden.
Pregabalin war nicht teratogen bei Mäusen, Ratten oder Kaninchen. Nur bei Dosen, die deutlich über der Humandosis lagen, kam es bei Ratten und Kaninchen zu Fetotoxizität. In Studien zur prä-/postnatalen Toxizität an Ratten verursachte Pregabalin ab der 2‑fachen maximal empfohlenen Humandosis entwicklungstoxische Störungen bei den Nachkommen.
Unerwünschte Effekte auf die Fertilität bei männlichen und weiblichen Ratten wurden nur bei Expositionen beobachtet, die deutlich höher lagen als die therapeutisch notwendige Exposition. Unerwünschte Effekte auf die männlichen Reproduktionsorgane und Spermienparameter waren reversibel und traten nur bei Expositionen auf, die ausreichend über der therapeutischen Exposition lagen, oder sie waren mit spontanen Degenerationsprozessen in den männlichen Reproduktionsorganen in der Ratte assoziiert. Daher wurden die Effekte als gering bis klinisch nicht relevant erachtet.
Wie sich in einer Vielzahl von in‑vitro- und in‑vivo-Tests zeigte, ist Pregabalin nicht genotoxisch.
Mit Pregabalin wurden an Ratten und Mäusen Karzinogenitätsstudien über 2 Jahre durchgeführt. Bei Expositionen, die dem 24‑fachen der beim Menschen empfohlenen klinischen Maximaldosis von 600 mg/Tag entsprechen, wurden bei den Ratten keine Tumoren beobachtet. Bei Mäusen wurde bei Expositionen, die denen unter durchschnittlicher Dosierung beim Menschen entsprachen, keine erhöhte Tumorhäufigkeit beobachtet. Bei höheren Expositionen kam es jedoch zu einem häufigeren Auftreten von Hämangiosarkomen. Der nicht genotoxische Mechanismus der Tumorbildung bei Mäusen schließt Veränderungen der Thrombozyten und, im Zusammenhang damit, eine endotheliale Zellproliferation ein. Derartige Veränderungen der Thrombozyten wurden bei Ratten oder anhand klinischer Daten zur Kurzzeittherapie und, in begrenztem Umfang, zur Langzeittherapie beim Menschen nicht beobachtet. Es gibt keine Hinweise auf ein derartiges Risiko für den Menschen.
Bei Ratten unterscheidet sich die Toxizität bei Jungtieren qualitativ nicht von der bei den adulten Tieren. Die Jungtiere weisen jedoch eine erhöhte Empfindlichkeit auf. Bei therapeutischen Dosen gab es Hinweise auf die ZNS‑Effekte Hyperaktivität und Bruxismus sowie Wachstumsstörungen (vorübergehende Hemmung der Gewichtszunahme). Auswirkungen auf die weibliche Fertilität wurden beim 5‑fachen der therapeutischen Humandosis beobachtet. Eine reduzierte Schreckreaktion auf akustische Reize wurde bei Überschreiten der 2‑fachen therapeutischen Humandosis bei jungen Ratten nach 1 bis 2 Wochen beobachtet. Nach 9 Wochen war dieser Effekt nicht mehr zu beobachten.
Kapselinhalt
Hyprolose
Maisstärke
Talkum
Kapselhülle
Eisen(III)-hydroxid-oxid x H2O (E172)
Titandioxid (E171)
Erythrosin (E127)
Gelatine
Natriumdodecylsulfat
Gereinigtes Wasser
Drucktinte
Schellack
Propylenglycol
Eisen(II,III)-oxid (E172)
Konzentrierte Ammoniak-Lösung
Kaliumhydroxid
Gereinigtes Wasser
Nicht zutreffend.
3 Jahre.
Blisterpackung: In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Flasche: Die Flasche fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
Pregabalin Viatris 25 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 21, 56, 84 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 56 x 1, 84 x 1 und 100 x 1 Hartkapsel.
Pregabalin Viatris 50 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 21, 56, 84 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 84 x 1 und 100 x 1 Hartkapsel.
Pregabalin Viatris 75 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 56 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 14 x 1, 56 x 1 und 100 x 1 Hartkapsel.
HDPE‑Flasche mit 200 Hartkapseln.
Pregabalin Viatris 100 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 21, 84 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 84 x 1 und 100 x 1 Hartkapsel.
Pregabalin Viatris 150 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 56 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 14 x 1, 56 x 1 und 100 x 1 Hartkapsel.
HDPE‑Flasche mit 200 Hartkapseln.
Pregabalin Viatris 200 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 21, 84 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 84 x 1 und 100 x 1 Hartkapsel.
Pregabalin Viatris 225 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 56 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 56 x 1 und 100 x 1 Hartkapsel.
Pregabalin Viatris 300 mg Hartkapseln
PVC/PVDC-Al-Blisterpackung mit 14, 56 und 100 Hartkapseln.
PVC/PVDC-Al-perforierte Blisterpackung zur Abgabe von Einzeldosen mit 56 x 1 und 100 x 1 Hartkapsel.
HDPE‑Flasche mit 200 Hartkapseln.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Keine besonderen Anforderungen.
Viatris Limited
Damastown Industrial Park,
Mulhuddart, Dublin 15,
DUBLIN
Irland
Pregabalin Viatris 25 mg Hartkapseln
EU/1/15/997/001
EU/1/15/997/002
EU/1/15/997/003
EU/1/15/997/004
EU/1/15/997/005
EU/1/15/997/006
EU/1/15/997/007
EU/1/15/997/008
Pregabalin Viatris 50 mg Hartkapseln
EU/1/15/997/009
EU/1/15/997/010
EU/1/15/997/011
EU/1/15/997/012
EU/1/15/997/013
EU/1/15/997/014
EU/1/15/997/015
Pregabalin Viatris 75 mg Hartkapseln
EU/1/15/997/016
EU/1/15/997/017
EU/1/15/997/018
EU/1/15/997/019
EU/1/15/997/020
EU/1/15/997/021
EU/1/15/997/022
Pregabalin Viatris 100 mg Hartkapseln
EU/1/15/997/023
EU/1/15/997/024
EU/1/15/997/025
EU/1/15/997/026
EU/1/15/997/027
Pregabalin Viatris 150 mg Hartkapseln
EU/1/15/997/028
EU/1/15/997/029
EU/1/15/997/030
EU/1/15/997/031
EU/1/15/997/032
EU/1/15/997/033
EU/1/15/997/034
Pregabalin Viatris 200 mg Hartkapseln
EU/1/15/997/035
EU/1/15/997/036
EU/1/15/997/037
EU/1/15/997/038
EU/1/15/998/039
Pregabalin Viatris 225 mg Hartkapseln
EU/1/15/998/040
EU/1/15/998/041
EU/1/15/998/042
EU/1/15/998/043
EU/1/15/998/044
Pregabalin Viatris 300 mg Hartkapseln
EU/1/15/998/045
EU/1/15/998/046
EU/1/15/998/047
EU/1/15/998/048
EU/1/15/998/049
EU/1/15/998/050
Datum der Erteilung der Zulassung: 25 Juni 2015
Datum der letzten Verlängerung: 3 April 2020
Dezember 2024
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar.
Verschreibungspflichtig
25 mg Hartkapseln:
PVC/ Aluminiumblisterpackungen mit 14 Hartkapseln N 1 und 100 Hartkapseln N 3
50 mg Hartkapseln:
PVC/ Aluminiumblisterpackungen mit 21 Hartkapseln N 1 und 100 Hartkapseln N 3
75 mgHartkapseln:
PVC/ Aluminiumblisterpackungen mit 14 Hartkapseln N 1 , 56 Hartkapseln N 2 und 100 Hartkapseln N 3
100 mg Hartkapseln:
PVC/ Aluminiumblisterpackungen mit 21 Hartkapseln N 1 und 100 Hartkapseln N 3
150 mg Hartkapseln: PVC/ Aluminiumblisterpackungen mit 56 Hartkapseln N 2 und 100 Hartkapseln N 3 200 mg Hartkapseln: PVC/ Aluminiumblisterpackungen mit 21 Hartkapseln N 1
225 mg Hartkapseln: PVC/ Aluminiumblisterpackungen mit 56 Hartkapseln N 2 und 100 Hartkapseln N 3
300 mg Hartkapseln: PVC/ Aluminiumblisterpackungen mit 56 Hartkapseln N 2 und 100 Hartkapseln N 3
Viatris Healthcare GmbH
Lütticher Straße 5
53842 Troisdorf
Tel.: +49 (0) 800 0700 800