Nyvepria® 6 mg Injektionslösung
Jede Fertigspritze enthält 6 mg Pegfilgrastim* in 0,6 ml Injektionslösung. Basierend auf dem Proteinanteil, beträgt die Konzentration 10 mg/ml**.
*Pegfilgrastim wird mittels rekombinanter DNA-Technologie aus Escherichia coli und nachfolgender Konjugation mit Polyethylenglykol (PEG) hergestellt.
**Die Konzentration beträgt 20 mg/ml, wenn der PEG-Anteil eingerechnet wird.
Die Stärke dieses Arzneimittels sollte nicht mit der Stärke anderer pegylierter oder nicht-pegylierter Proteine der gleichen therapeutischen Klasse verglichen werden. Siehe Abschnitt 5.1 für weitere Informationen.
Sonstige(r) Bestandteil(e) mit bekannter Wirkung
Jede Fertigspritze enthält 30 mg Sorbitol (E 420) (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Injektionslösung (Injektion).
Klare, farblose Injektionslösung ohne sichtbare Partikel.
Zur Verkürzung der Dauer von Neutropenien sowie zur Verminderung der Häufigkeit neutropenischen Fiebers bei erwachsenen Patienten, die wegen einer malignen Erkrankung mit zytotoxischer Chemotherapie behandelt werden (mit Ausnahme von chronisch-myeloischer Leukämie und Myelodysplastischem Syndrom).
Eine Behandlung mit Nyvepria sollte durch Ärzte, die in der Onkologie und/ oder Hämatologie erfahren sind, eingeleitet und überwacht werden.
Dosierung
Pro Chemotherapiezyklus wird eine 6 mg-Dosis (eine einzelne Fertigspritze) Nyvepria empfohlen, die frühestens 24 Stunden nach einer zytotoxischen Chemotherapie angewendet wird.
Besondere Patientengruppen
Nierenfunktionsstörung
Eine Dosisänderung für Patienten mit eingeschränkter Nierenfunktion, einschließlich terminaler Niereninsuffizienz, wird nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Pegfilgrastim bei Kindern und Jugendlichen sind bisher noch nicht erwiesen. Zurzeit vorliegende Daten werden in Abschnitten 4.8, 5.1 und 5.2 beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Art der Anwendung
Nyvepria wird subkutan injiziert.
Die Injektionen sollten in den Oberschenkel, die Bauchregion oder in den Oberarm erfolgen.
Hinweise zur Handhabung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Bei Patienten mit de novo akuter myeloischer Leukämie (AML) sprechen begrenzte klinische Daten für eine vergleichbare Wirkung von Pegfilgrastim und Filgrastim auf die Zeit bis zur Erholung von der schweren Neutropenie (siehe Abschnitt 5.1). Die Langzeitwirkungen von Pegfilgrastim sind jedoch bei AML noch nicht ausreichend untersucht; daher sollte es bei dieser Patientengruppe mit Vorsicht angewendet werden.
Granulozyten-koloniestimulierende Faktoren (G-CSF) können das Wachstum myeloischer Zellen in vitro fördern, ähnliche Effekte können bei einigen nicht-myeloischen Zellen in vitro beobachtet werden.
Die Sicherheit und Wirksamkeit von Pegfilgrastim wurden bei Patienten mit Myelodysplastischem Syndrom, chronisch-myeloischer Leukämie und bei Patienten mit sekundärer AML nicht untersucht; daher sollte es bei solchen Patienten nicht angewendet werden. Besondere Vorsicht ist hinsichtlich der Differentialdiagnose einer Blastentransformation einer chronisch-myeloischen Leukämie und einer AML geboten.
Die Sicherheit und Wirksamkeit von Pegfilgrastim wurden bei de-novo-AML-Patienten im Alter von < 55 Jahren mit einer t(15;17) als zytogenetischem Befund nicht gezeigt.
Die Sicherheit und Wirksamkeit von Pegfilgrastim wurden bei Patienten, die eine Hochdosischemotherapie erhalten, nicht untersucht. Dieses Arzneimittel darf nicht angewendet werden, um die Dosierung der zytotoxischen Chemotherapie über etablierte Dosierungsregime hinaus zu erhöhen.
Pulmonale unerwünschte Ereignisse
Über pulmonale Nebenwirkungen, insbesondere interstitielle Pneumonie, wurde nach der Anwendung von G-CSFs berichtet. Das Risiko kann für Patienten mit einer kurz zurückliegenden Vorgeschichte von pulmonalen Infiltraten oder Pneumonie höher sein (siehe Abschnitt 4.8).
Das Auftreten pulmonaler Beschwerden wie Husten, Fieber und Atemnot in Verbindung mit radiologischen Hinweisen auf pulmonale Infiltrate sowie eine mit einer erhöhten Anzahl neutrophiler Granulozyten einhergehende Verschlechterung der Lungenfunktion können erste Anzeichen für ein akutes Atemnotsyndrom (Acute Respiratory Distress Syndrome - ARDS) sein. In solchen Fällen sollte Pegfilgrastim nach Ermessen des Arztes abgesetzt und eine angemessene Therapie eingeleitet werden (siehe Abschnitt 4.8).
Glomerulonephritis
Bei Patienten, die Filgrastim und Pegfilgrastim erhalten hatten, wurde über Glomerulonephritis berichtet. Im Allgemeinen klangen Ereignisse von Glomerulonephritis nach Dosisreduktion oder nach Absetzen von Filgrastim bzw. Pegfilgrastim ab. Die Überwachung des Urinstatus wird empfohlen.
Kapillarlecksyndrom
Nach Anwendung von G-CSF wurde über Kapillarlecksyndrom (capillary leak syndrome) berichtet, das durch Hypotonie, Hypoalbuminämie, Ödem und Hämokonzentration charakterisiert ist. Patienten, die Symptome des Kapillarlecksyndroms entwickeln, sollten engmaschig überwacht werden und eine symptomatische Standardbehandlung erhalten, die die Notwendigkeit einer Behandlung auf der Intensivstation einschließen kann (siehe Abschnitt 4.8).
Splenomegalie und Milzruptur
Nach der Anwendung von Pegfilgrastim wurde über Fälle von Splenomegalien, die im Allgemeinen asymptomatisch verliefen, und über Fälle von Milzrupturen, die in einigen Fällen tödlich verliefen, berichtet (siehe Abschnitt 4.8). Daher sollte die Milzgröße sorgfältig überwacht werden (z. B. klinische Untersuchung, Ultraschall). Die Diagnose einer Milzruptur sollte für Patienten in Betracht gezogen werden, die über linksseitige Oberbauchschmerzen oder Schmerzen in der Schulterregion berichten.
Thrombozytopenie und Anämie
Die Behandlung mit Pegfilgrastim allein schließt das Auftreten von Thrombozytopenie und Anämie nicht aus, da die volle Dosis der myelosuppressiven Chemotherapie gemäß vorgesehenem Dosierungsschema beibehalten wird. Die regelmäßige Überwachung der Thrombozytenzahl und des Hämatokrits wird empfohlen. Besondere Vorsicht muss bei der Anwendung von einzelnen oder kombinierten Chemotherapeutika bestehen, welche dafür bekannt sind, schwere Thrombozytopenie auszulösen.
Myelodysplastisches Syndrom und akute myeloische Leukämie bei Patienten mit Brust- und Lungenkrebs
In der Beobachtungsstudie nach der Markteinführung wurde Pegfilgrastim in Zusammenhang mit Chemotherapie und/ oder Strahlentherapie mit der Entwicklung eines Myelodysplastischen Syndroms (MDS) und akuter myeloischer Leukämie (AML) bei Brust- und Lungenkrebspatienten in Verbindung gebracht (siehe Abschnitt 4.8). Patienten mit Brust- oder Lungenkrebs sind auf Anzeichen und Symptome von MDS/ AML zu überwachen.
Sichelzellanämie
Bei Patienten mit Sichelzellanlage oder Sichelzellkrankheit wurden Sichelzellkrisen mit der Anwendung von Pegfilgrastim in Verbindung gebracht (siehe Abschnitt 4.8). Ärzte sollten daher Pegfilgrastim bei Patienten mit Sichelzellanlage oder Sichelzellkrankheit mit Vorsicht verschreiben, geeignete klinische Parameter und Laborwerte überwachen und einen möglichen Zusammenhang zwischen diesem Arzneimittel und Milzvergrößerung sowie vaso-okklusiven Krisen beachten.
Leukozytose
Während der Behandlung mit Pegfilgrastim wurde bei weniger als 1 % der Patienten eine Anzahl weißer Blutzellen von 100 × 109/l oder mehr beobachtet. Direkt mit einem solchen Grad der Leukozytose in Verbindung zu bringende unerwünschte Wirkungen sind nicht berichtet worden. Eine solche Erhöhung der Anzahl weißer Blutzellen ist vorübergehend, tritt typischerweise innerhalb von 24 bis 48 Stunden nach der Anwendung auf und entspricht den pharmakodynamischen Wirkungen dieses Arzneimittels. Entsprechend den klinischen Effekten und dem Potenzial zur Leukozytose muss die Anzahl weißer Blutzellen während der Therapie in regelmäßigen Abständen bestimmt werden. Wenn die Anzahl der Leukozyten nach dem erwarteten Nadir 50 × 109/l übersteigt, muss dieses Arzneimittel umgehend abgesetzt werden.
Überempfindlichkeit
Überempfindlichkeit, einschließlich anaphylaktischer Reaktionen, die während der initialen oder einer nachfolgenden Behandlung auftritt, wurde bei Patienten beobachtet, die mit Pegfilgrastim behandelt wurden. Bei Patienten mit klinisch signifikanter Überempfindlichkeit muss Pegfilgrastim dauerhaft abgesetzt werden. Wenden Sie Pegfilgrastim nicht bei Patienten mit einer Vorgeschichte einer Überempfindlichkeit gegenüber Pegfilgrastim oder Filgrastim an. Wenn eine schwerwiegende allergische Reaktion auftritt, muss eine entsprechende Therapie mit einer genauen Beobachtung des Patienten über mehrere Tage hinweg angewendet werden.
Stevens-Johnson-Syndrom
In Verbindung mit einer Behandlung mit Pegfilgrastim wurde in seltenen Fällen über ein Stevens- Johnson-Syndrom (SJS) berichtet, das lebensbedrohlich oder tödlich verlaufen kann. Wenn bei einem Patienten unter der Anwendung von Pegfilgrastim ein SJS aufgetreten ist, darf bei diesem Patienten zu keinem Zeitpunkt eine erneute Behandlung mit Pegfilgrastim begonnen werden (siehe auch Abschnitt 4.8).
Immunogenität
Wie bei allen therapeutischen Proteinen besteht die Möglichkeit einer Immunogenität. Die Entstehungsraten von Antikörpern gegen Pegfilgrastim sind generell niedrig. Es treten, wie bei allen Biologika erwartet, bindende Antikörper auf. Allerdings sind diese bisher nicht mit einer neutralisierenden Aktivität assoziiert.
Aortitis
Nach der Anwendung von G-CSF wurde bei gesunden Probanden und bei Krebspatienten Aortitis berichtet. Zu den Symptomen, die auftraten, zählten Fieber, abdominale Schmerzen, Unwohlsein, Rückenschmerzen und erhöhte Entzündungsmarker (z. B. C-reaktives Protein und Anzahl weißer Blutkörperchen). In den meisten Fällen wurde die Aortitis durch einen Computertomografie(CT)-Scan diagnostiziert und klang nach Absetzen von G-CSF im Allgemeinen wieder ab (siehe auch Abschnitt 4.8).
Andere Warnhinweise
Die Sicherheit und Wirksamkeit von Pegfilgrastim zur Mobilisierung von hämatopoetischen Progenitorzellen bei Patienten oder gesunden Spendern wurden nicht ausreichend untersucht.
Eine erhöhte hämatopoetische Aktivität des Knochenmarks als Antwort auf eine Therapie mit Wachstumsfaktoren wurde mit vorübergehend positiven Befunden in den Darstellungen der Knochen mittels bildgebender Verfahren in Verbindung gebracht. Dies sollte bei der Interpretation der Ergebnisse von Darstellungen der Knochen mittels bildgebender Verfahren berücksichtigt werden.
Sorbitol
Nyvepria enthält pro Fertigspritze 30 mg Sorbitol, entsprechend 50 mg/ml. Die additive Wirkung gleichzeitig angewendeter Sorbitol (oder Fructose) -haltiger Arzneimittel und die Einnahme von Sorbitol (oder Fructose) über die Nahrung ist zu berücksichtigen.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro 6 mg-Dosis, d. h. es ist nahezu „natriumfrei“.
Aufgrund der potenziellen Empfindlichkeit von sich schnell teilenden myeloischen Zellen gegenüber einer zytotoxischen Chemotherapie sollte Pegfilgrastim mindestens 24 Stunden nach Gabe einer zytotoxischen Chemotherapie angewendet werden. In klinischen Studien konnte Pegfilgrastim14 Tage vor einer Chemotherapie sicher angewendet werden. Die gleichzeitige Anwendung von Pegfilgrastim mit einem Chemotherapeutikum wurde bei Patienten nicht untersucht. In Tiermodellen konnte bei gleichzeitiger Anwendung von Pegfilgrastim mit 5-Fluorouracil (5-FU) oder anderen Antimetaboliten eine gesteigerte Myelosuppression gezeigt werden.
Mögliche Wechselwirkungen mit anderen hämatopoetischen Wachstumsfaktoren und Zytokinen wurden in klinischen Studien nicht gezielt untersucht.
Die Möglichkeit einer Wechselwirkung mit Lithium, welches ebenfalls die Freisetzung von neutrophilen Granulozyten fördert, wurde nicht gezielt untersucht. Es gibt keine Hinweise, dass eine solche Wechselwirkung eine Gefährdung bedeuten würde.
Die Sicherheit und Wirksamkeit von Pegfilgrastim bei Patienten, die eine Chemotherapie erhalten, die mit einer verzögerten Myelosuppression einhergeht, z. B. mit Nitrosoharnstoffverbindungen, wurden nicht untersucht.
Spezifische Interaktions- oder Metabolisierungsstudien wurden nicht durchgeführt, jedoch ergaben klinische Studien keine Hinweise auf eine Wechselwirkung von Pegfilgrastim mit anderen Arzneimitteln.
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Pegfilgrastim bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Die Anwendung von Pegfilgrastim während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.
Stillzeit
Es gibt nur ungenügende Informationen darüber, ob Pegfilgrastim/ Metabolite in die Muttermilch übergehen, ein Risiko für das Neugeborene/ Kind kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Pegfilgrastim verzichtet werden soll/ die Behandlung mit Pegfilgrastim zu unterbrechen ist. Dabei sollten sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Fertilität
Pegfilgrastim zeigte keinen Einfluss auf die Reproduktionsfähigkeit oder Fertilität männlicher und weiblicher Ratten, die circa das 6- bis 9-Fache der empfohlenen humantherapeutischen Dosis (basierend auf Körperoberfläche) als kumulierte wöchentliche Dosis erhielten (siehe Abschnitt 5.3).
Nyvepria hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die am häufigsten berichteten Nebenwirkungen waren Knochenschmerzen (sehr häufig [≥ 1/10]) und muskuloskelettale Schmerzen (häufig [≥ 1/100, < 1/10]). Die Knochenschmerzen waren im Allgemeinen leicht bis mäßig im Schweregrad, vorübergehend und konnten bei den meisten Patienten mit einem Standardanalgetikum beherrscht werden.
Überempfindlichkeitsreaktionen, einschließlich Hautausschlag, Urtikaria, Angioödem, Dyspnoe, Erytheme, Hautrötung und Hypotonie, traten bei der erstmaligen oder nachfolgenden Behandlung mit Pegfilgrastim (gelegentlich [≥ 1/1 000, < 1/100]) auf. Schwerwiegende allergische Reaktionen, einschließlich Anaphylaxie, können bei Patienten auftreten, die Pegfilgrastim erhalten (gelegentlich) (siehe Abschnitt 4.4).
Kapillarlecksyndrom, das lebensbedrohlich sein kann, wenn die Behandlung nicht unverzüglich erfolgt, wurde bei Krebspatienten, die sich einer Chemotherapie und nachfolgender Behandlung mit G-CSFs unterzogen haben, gelegentlich (≥ 1/1 000, < 1/100) berichtet; siehe Abschnitt 4.4 und unten stehenden Abschnitt „Beschreibung ausgewählter Nebenwirkungen“.
Splenomegalie, im Allgemeinen asymptomatisch, tritt gelegentlich auf.
Milzrupturen, die in einigen Fällen tödlich verliefen, werden gelegentlich nach der Behandlung mit Pegfilgrastim berichtet (siehe Abschnitt 4.4).
Gelegentliche pulmonale Nebenwirkungen einschließlich interstitieller Pneumonie, Lungenödem, Lungeninfiltrate und Lungenfibrose wurden berichtet. Gelegentlich resultierten einige der berichteten Fälle in respiratorischem Versagen oder ARDS, welche tödlich enden können (siehe Abschnitt 4.4).
Vereinzelt wurde bei Patienten mit Sichelzellanlage oder Sichelzellkrankheit (gelegentlich bei Sichelzellpatienten) über Fälle von Sichelzellkrisen berichtet (siehe Abschnitt 4.4).
Tabellarische Liste der Nebenwirkungen
Die Daten in der untenstehenden Tabelle beschreiben die Nebenwirkungen, die in klinischen Prüfungen und bei Spontanmeldungen berichtet wurden. Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen in absteigendem Schweregrad dargestellt.
Systemorganklassen gemäß MedDRA |
Nebenwirkungen |
|||
Sehr häufig (≥ 1/10) |
Häufig (≥ 1/100, < 1/10) |
Gelegentlich (≥ 1/1 000, < 1/100) |
Selten (≥ 1/10 000, < 1/1 000) |
|
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) |
Myelodysplastisches Syndrom1 |
|||
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie1; Leukozytose1 |
Sichelzellanämie mit Krise2; Splenomegalie2; Milzruptur2 |
||
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen; Anaphylaxie |
|||
Stoffwechsel- und Ernährungsstörungen |
Erhöhung des Harnsäurewertes |
|||
Erkrankungen des Nervensystems |
Kopfschmerzen1 |
|||
Gefäßerkrankungen |
Kapillarlecksyndrom1 |
Aortitis |
||
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Akutes Atemnotsyndrom2; Pulmonale Nebenwirkungen (interstitielle Pneumonie, Lungenödem, Lungeninfiltrate und Lungenfibrose) Hämoptyse |
Lungenhämorrhagie |
||
Erkrankungen des Gastrointestinaltrakts |
Übelkeit1 |
|||
Erkrankungen der Haut und des Unterhautzellgewebes |
Sweet-Syndrom (akute febrile neutrophile Dermatose)1, 2; Kutane Vaskulitis1, 2 |
Stevens-Johnson-Syndrom |
||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Knochenschmerzen |
Muskuloskelettale Schmerzen (Myalgie, Arthralgie, Schmerzen in den Extremitäten, Rückenschmerzen, muskuloskelettale Schmerzen, Nackenschmerzen) |
||
Erkrankungen der Nieren und Harnwege |
Glomerulonephritis2 |
|||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schmerzen an der Injektionsstelle1, Nicht vom Herzen ausgehende Schmerzen im Brustkorb |
Reaktionen an der Injektionsstelle2 |
||
Untersuchungen |
Erhöhung der Werte von Laktatdehydrogenase und alkalischer Phosphatase1; Vorübergehende Erhöhung der Werte von ALAT (Alanin-Aminotransferase) und ASAT (Aspartat-Aminotransferase) bei der Kontrolle der Leberfunktionswerte1 |
|||
1 Siehe unten stehenden Abschnitt „Beschreibung ausgewählter Nebenwirkungen“. | ||||
Beschreibung ausgewählter Nebenwirkungen
Gelegentliche Fälle von Sweet-Syndrom wurden berichtet, wobei in einigen Fällen die zugrunde liegenden hämatologischen Malignitäten eine Rolle spielen können.
Gelegentliche Fälle von kutaner Vaskulitis wurden bei Patienten berichtet, die mit Pegfilgrastim behandelt wurden. Der Mechanismus der Vaskulitis bei Patienten, die mit Pegfilgrastim behandelt wurden, ist unbekannt.
Reaktionen an der Injektionsstelle, einschließlich Rötungen im Bereich der Injektionsstelle (gelegentlich) sowie Schmerzen an der Injektionsstelle (häufig), sind bei erstmaliger und wiederholter Behandlung mit Pegfilgrastim aufgetreten.
Häufige Fälle von Leukozytose (Anzahl der weißen Blutzellen > 100 × 109/l) wurden berichtet (siehe Abschnitt 4.4).
Reversible, leichte bis mäßige Erhöhungen der Werte von Harnsäure und alkalischer Phosphatase, ohne damit verbundene klinische Wirkungen, traten gelegentlich auf; reversible, leichte bis mäßige Erhöhungen der Werte von Laktatdehydrogenase, ohne damit verbundene klinische Wirkungen, traten gelegentlich bei Patienten auf, die Pegfilgrastim nach einer zytotoxischen Chemotherapie erhielten.
Übelkeit und Kopfschmerzen wurden sehr häufig bei Patienten beobachtet, die Chemotherapie erhielten.
Gelegentliche Erhöhungen der Werte von Alanin-Aminotransferase (ALAT) oder Aspartat-Aminotransferase (ASAT) wurden bei Untersuchungen der Leberfunktionswerte von Patienten beobachtet, die Pegfilgrastim nach einer zytotoxischen Chemotherapie erhalten hatten. Diese Erhöhungen sind vorübergehend und gehen auf das Ausgangsniveau zurück.
Ein erhöhtes Risiko von MDS/ AML nach einer Behandlung mit Pegfilgrastim in Zusammenhang mit Chemotherapie und/ oder Strahlentherapie wurde in einer epidemiologischen Studie mit Brust- und Lungenkrebspatienten beobachtet (siehe Abschnitt 4.4).
Häufig wurde über Fälle von Thrombozytopenie berichtet.
Nach der Markteinführung wurde nach Anwendung von G-CSF über Fälle von Kapillarlecksyndrom berichtet. Diese sind im Allgemeinen aufgetreten bei Patienten mit fortgeschrittenen malignen Erkrankungen, bei Sepsis, bei Patienten, die mehrere chemotherapeutische Behandlungen erhalten oder sich einer Apharese unterzogen haben (siehe Abschnitt 4.4).
Kinder und Jugendliche
Die Erfahrung bei Kindern ist begrenzt. Im Vergleich zu älteren Kindern im Alter von 6-11 Jahren (80 %), 12-21 Jahren (67 %) und Erwachsenen wurde bei jüngeren Kindern im Alter von 0-5 Jahren (92 %) eine größere Häufigkeit an schwerwiegenden Nebenwirkungen beobachtet. Die am häufigsten berichtete Nebenwirkung waren Knochenschmerzen (siehe Abschnitte 5.1 und 5.2).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Deutschland |
Einzeldosen von 300 µg/kg konnten ohne schwerwiegende unerwünschte Wirkungen bei einer begrenzten Anzahl von gesunden Probanden und Patienten mit nicht-kleinzelligem Lungenkrebs subkutan angewendet werden. Die Nebenwirkungen waren den Nebenwirkungen ähnlich, die bei Patienten auftraten, die niedrigere Dosierungen Pegfilgrastim erhielten.
Pharmakotherapeutische Gruppe: Immunstimulanzien, koloniestimulierende Faktoren; ATC-Code: L03AA13.
Nyvepria ist ein biologisch/ biotechnologisch hergestelltes Arzneimittel, das im Wesentlichen einem bereits zugelassenen Arzneimittel gleicht. Ausführliche Informationen sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Der humane G-CSF ist ein Glykoprotein, das die Entstehung neutrophiler Granulozyten und deren Freisetzung aus dem Knochenmark reguliert. Pegfilgrastim ist ein kovalentes Konjugat des rekombinanten humanen Methionyl-G-CSF (r-metHuG-CSF) mit einem einzelnen 20 kDa PEG-Molekül. Pegfilgrastim ist eine Form von Filgrastim mit verlängerter Verweildauer, die auf einer verminderten renalen Clearance beruht. Pegfilgrastim und Filgrastim, für die identische Wirkmechanismen gezeigt werden konnten, führen innerhalb von 24 Stunden zu einem deutlichen Anstieg der Anzahl neutrophiler Granulozyten im peripheren Blut bei geringem Anstieg der Monozyten und/oder Lymphozyten. Ähnlich wie bei Filgrastim verfügen die als Reaktion auf eine Behandlung mit Pegfilgrastim gebildeten neutrophilen Granulozyten über eine normale oder erhöhte Funktionsfähigkeit, wie in Versuchen zur chemotaktischen und phagozytischen Funktion gezeigt werden konnte. Wie andere hämatopoetische Wachstumsfaktoren hat G-CSF in vitro stimulierende Eigenschaften auf menschliche Endothelzellen gezeigt. G-CSF kann das Wachstum myeloider Zellen, einschließlich maligner Zellen, in vitro fördern, ähnliche Effekte können bei einigen nicht-myeloischen Zellen in vitro beobachtet werden.
In zwei randomisierten, doppelblinden Zulassungsstudien mit Hochrisiko-Brustkrebspatienten in den Stadien II-IV, welche eine myelosuppressive Chemotherapie mit Doxorubicin und Docetaxel erhielten, bewirkte die einmalige Gabe von Pegfilgrastim pro Zyklus eine ähnliche Reduktion der Neutropeniedauer und der Inzidenz des neutropenischen Fiebers wie die tägliche Anwendung von Filgrastim (im Median 11 Anwendungen einmal täglich). Es wurde berichtet, dass dieses Behandlungsschema ohne Wachstumsfaktorgabe zu einer durchschnittlichen Dauer einer Neutropenie 4. Grades von 5-7 Tagen und zu einer 30-40%igen Inzidenz von neutropenischem Fieber führte. In einer Studie (n = 157), in welcher eine feste Dosis von 6 mg Pegfilgrastim eingesetzt wurde, lag die durchschnittliche Dauer der Neutropenie 4. Grades in der Pegfilgrastim-Gruppe bei 1,8 Tagen im Vergleich zu 1,6 Tagen in der Filgrastim-Gruppe (Unterschied: 0,23 Tage, 95 % KI –0,15; 0,63). Über die gesamte Studie gesehen lag die Rate für neutropenisches Fieber bei 13 % bei mit Pegfilgrastim behandelten Patienten, hingegen bei 20 % bei mit Filgrastim behandelten Patienten (Unterschied: 7 %, 95 % KI –19 %; 5 %). In einer zweiten Studie (n = 310), in welcher eine gewichtsabhängige Dosis (100 µg/kg) eingesetzt wurde, lag die durchschnittliche Dauer für Neutropenie 4. Grades bei 1,7 Tagen in der Pegfilgrastim-Gruppe im Vergleich zu 1,8 Tagen in der Filgrastim-Gruppe (Unterschied: 0,03 Tage, 95 % KI –0,36; 0,30). Die Gesamtrate für das Auftreten neutropenischen Fiebers lag bei 9 % bei den mit Pegfilgrastim behandelten Patienten und bei 18 % bei den mit Filgrastim behandelten Patienten (Unterschied: 9 %, 95 % KI –16,8 %; –1,1 %).
In einer Placebo-kontrollierten, doppelblinden Studie bei Brustkrebspatienten wurde die Wirkung von Pegfilgrastim auf die Inzidenz neutropenischen Fiebers nach Anwendung eines Chemotherapieregimes (Docetaxel 100 mg/m2 alle 3 Wochen für 4 Zyklen) untersucht, das mit einer Rate febriler Neutropenie von 10-20 % in Verbindung gebracht wurde. 928 Patienten wurden randomisiert und erhielten ca. 24 Stunden (Tag 2) nach Chemotherapie in jedem Zyklus entweder eine Einzeldosis Pegfilgrastim oder Placebo. Bei randomisierten Patienten, welche Pegfilgrastim erhielten, war die Inzidenz neutropenischen Fiebers niedriger als bei Patienten, welche Placebo erhielten (1 % versus 17 %, p < 0,001). Die Inzidenz von Krankenhausaufenthalten und der Gabe von intravenös angewendeten Antiinfektiva, verbunden mit einer klinischen Diagnose neutropenischen Fiebers, war bei Patienten in der Pegfilgrastim-Gruppe niedriger als bei Patienten in der Placebo-Gruppe (1 % versus 14 %, p < 0,001; und 2 % versus 10 %, p < 0,001).
In einer kleinen (n = 83), randomisierten, doppelblinden Studie der Phase II wurde bei Patienten mit de novo AML, die Chemotherapie erhielten, die Anwendung von Pegfilgrastim (Einzeldosis von 6 mg) mit derjenigen von Filgrastim während der Induktions-Chemotherapie verglichen. Die mediane Zeit bis zur Erholung von der schweren Neutropenie wurde in beiden Behandlungsgruppen auf 22 Tage geschätzt. Die Langzeit-Behandlungsergebnisse wurden nicht untersucht (siehe Abschnitt 4.4).
In einer multizentrischen, randomisierten, offenen Phase II-Studie (n = 37) bei pädiatrischen Sarkom- Patienten, die 100 µg/kg Pegfilgrastim nach dem ersten Zyklus einer Chemotherapie mit Vincristin, Doxorubicin und Cyclophosphamid (VAdriaC/IE) erhielten, wurde bei jüngeren Kindern im Alter von 0-5 Jahren eine längere Dauer von schwerer Neutropenie (Neutrophile < 0,5 × 109/l) beobachtet (8,9 Tage) als bei älteren Kindern im Alter von 6-11 Jahren (6 Tage), 12-21 Jahren (3,7 Tage) und Erwachsenen. Zusätzlich wurde eine höhere Inzidenz an febriler Neutropenie bei jüngeren Kindern im Alter von 0-5 Jahren beobachtet (75 %) im Vergleich zu älteren Kindern im Alter von 6-11 und 12-21 Jahren (70 % bzw. 33 %) sowie Erwachsenen (siehe Abschnitte 4.8 und 5.2).
Nach Anwendung einer subkutanen Einzeldosis von Pegfilgrastim wird die maximale Serumkonzentration von Pegfilgrastim nach 16 bis 120 Stunden erreicht, und die Serumkonzentration von Pegfilgrastim bleibt nach einer myelosuppressiven Chemotherapie während der Dauer der Neutropenie erhalten. Die Elimination von Pegfilgrastim ist bezogen auf die Dosis nicht-linear; die Serum-Clearance von Pegfilgrastim nimmt mit steigender Dosis ab. Pegfilgrastim scheint hauptsächlich über eine Neutrophilen-vermittelte Clearance eliminiert zu werden, welche bei höheren Dosierungen eine Sättigung erreicht. Einem selbstregulierenden Clearance-Mechanismus entsprechend sinkt die Serumkonzentration von Pegfilgrastim rasch, sobald sich die neutrophilen Granulozyten zu erholen beginnen (siehe Abbildung 1).
Abbildung 1: Profil der medianen Pegfilgrastim-Serumkonzentration und der absoluten Zahl neutrophiler Granulozyten (ANZ) nach Injektion einer 6 mg-Einzeldosis bei chemotherapeutisch behandelten Patienten
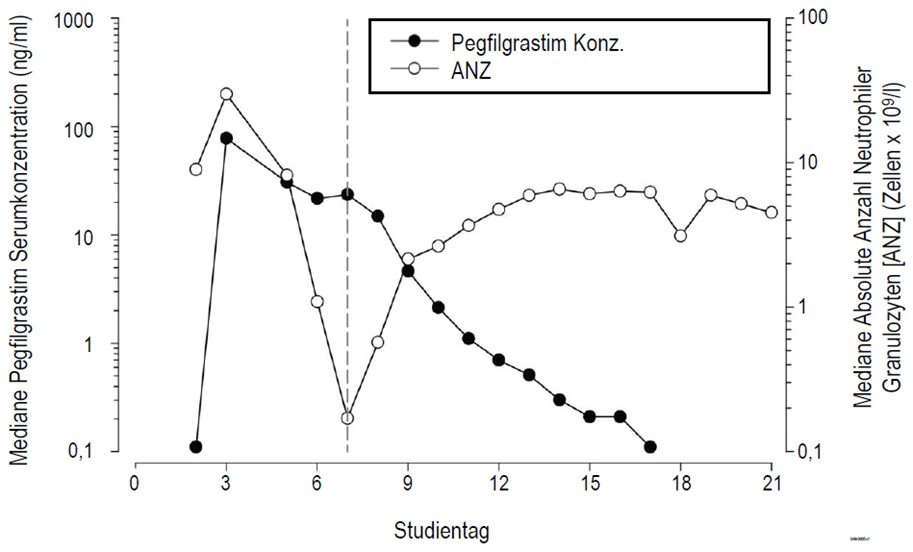
Aufgrund des durch neutrophile Granulozyten vermittelten Clearance-Mechanismus ist nicht zu erwarten, dass die Pharmakokinetik von Pegfilgrastim durch Funktionsstörungen der Niere oder der Leber beeinflusst wird. In einer offenen Studie mit Einmalgabe (n = 31) hatten Nierenfunktionsstörungen unterschiedlichen Grades, einschließlich terminaler Niereninsuffizienz, keinen Einfluss auf die Pharmakokinetik von Pegfilgrastim.
Ältere Personen
Begrenzte Daten weisen darauf hin, dass die Pharmakokinetik von Pegfilgrastim bei älteren Patienten (> 65 Jahre) der bei erwachsenen Patienten ähnlich ist.
Kinder und Jugendliche
Die Pharmakokinetik von Pegfilgrastim wurde bei 37 pädiatrischen Patienten mit Sarkomen untersucht, die 100 µg/kg Pegfilgrastim nach Abschluss einer Chemotherapie mit VAdriaC/IE erhalten hatten. Die jüngste Altersgruppe (0-5 Jahre) hatte eine höhere durchschnittliche Exposition mit Pegfilgrastim (AUC) (± Standardabweichung) (47,9 ± 22,5 µg h/ml) als ältere Kinder im Alter von 6-11 und 12-21 Jahren (22,0 ± 13,1 µg h/ml bzw. 29,3 ± 23,2 µg h/ml) (siehe Abschnitt 5.1). Mit Ausnahme der jüngsten Altersgruppe (0-5 Jahre) schien die durchschnittliche AUC bei pädiatrischen Patienten ähnlich zu sein wie bei erwachsenen Patienten mit Mammakarzinom im Hochrisikostadium II-IV, die 100 µg/kg Pegfilgrastim nach Doxorubicin/Docetaxel erhalten hatten (siehe Abschnitte 4.8 und 5.1).
Präklinische Daten aus konventionellen Studien zur chronischen Toxizität zeigten die erwarteten pharmakologischen Wirkungen. Diese schließen Erhöhungen der Leukozytenzahl, myeloische Hyperplasie im Knochenmark, extramedulläre Hämatopoese und Milzvergrößerung ein.
Bei den Nachkommen trächtiger Ratten, die Pegfilgrastim subkutan erhielten, wurden keine unerwünschten Wirkungen beobachtet. Jedoch wurde bei Kaninchen gezeigt, dass Pegfilgrastim bei kumulierten Dosen, die ca. dem 4-Fachen der empfohlenen humantherapeutischen Dosis entsprachen, eine embryonale/fetale Toxizität (Embryoletalität) verursacht. Dies wurde bei trächtigen Kaninchen, die die empfohlene humantherapeutische Dosis erhielten, nicht beobachtet. In Studien an Ratten wurde gezeigt, dass Pegfilgrastim die Plazenta passieren kann. Studien an Ratten zeigten, dass eine subkutane Anwendung von Pegfilgrastim keine Auswirkungen auf Reproduktionsleistung, Fertilität, Sexualzyklus, Zeitraum zwischen Paarung und Koitus und intrauterines Überleben hatte. Die Bedeutung dieser Ergebnisse für den Menschen ist nicht bekannt.
Natriumacetat-Trihydrat
Essigsäure 99 %
Sorbitol (Ph. Eur.) (E 420)
Polysorbat 20
Wasser für Injektionszwecke
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden, insbesondere nicht mit Natriumchloridlösungen.
3 Jahre.
Im Kühlschrank lagern (2 °C – 8 °C).
Nyvepria kann einmalig über einen Zeitraum von bis zu 15 Tagen bei Raumtemperatur (nicht über 25 °C) gelagert werden. Nyvepria, das länger als 15 Tage bei Raumtemperatur gelagert wurde, muss verworfen werden.
Nicht einfrieren. Sollte Nyvepria versehentlich einmalig über einen Zeitraum von weniger als 24 Stunden Temperaturen unterhalb des Gefrierpunktes ausgesetzt werden, hat dies keine nachteilige Auswirkung auf die Stabilität von Nyvepria.
Das Behältnis im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Fertigspritze (Glas Typ I) mit einem Gummistopfen, einer Injektionsnadel aus rostfreiem Stahl und einer Nadelkappe mit automatischem Nadelschutz. Der Kolbenstopfen der Nyvepria-Spritze und die Nadelkappe sind nicht mit Naturkautschuklatex hergestellt.
Jede Fertigspritze enthält 0,6 ml Injektionslösung.
Packungsgröße mit einer Fertigspritze in einem Umkarton.
Vor Verwendung muss die Nyvepria-Lösung optisch auf sichtbare Schwebeteilchen untersucht werden. Es dürfen nur klare und farblose Lösungen injiziert werden.
Starkes Schütteln kann zur Aggregation von Pegfilgrastim führen, sodass es biologisch inaktiv wird.
Die Fertigspritze sollte vor der Injektion für 30 Minuten Raumtemperatur erreichen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brüssel
Belgien
EU/1/20/1486/001
Datum der Erteilung der Zulassung: 18. November 2020
August 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.euverfügbar.
Verschreibungspflichtig
Nyvepria 6 mg Injektionslösung: 1 Fertigspritze mit 6 mg/0,6 ml
PFIZER PHARMA GmbH
Friedrichstr. 110
10117 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000