▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Enspryng® 120 mg Injektionslösung in einer Fertigspritze.
Jede Fertigspritze enthält 120 mg Satralizumab in 1 ml.
Satralizumab wird in Ovarialzellen des Chinesischen Hamsters mittels rekombinanter DNA-Technologie hergestellt.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Injektionslösung (Injektion)
Farblose bis leicht gelbliche Flüssigkeit. Die Lösung hat einen pH-Wert von ca. 6,0 und eine Osmolalität von ca. 310 mosm/kg.
Enspryng wird als Monotherapie oder in Kombination mit einer immunsuppressiven Therapie (IST) zur Behandlung von Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) bei Erwachsenen und Jugendlichen ab 12 Jahren angewendet, die anti-Aquaporin-4-IgG-(AQP4-IgG-)seropositiv sind (siehe Abschnitt 5.1).
Die Behandlung darf nur unter Aufsicht eines in der Behandlung von Neuromyelitis optica (NMO) oder NMOSD erfahrenen Arztes eingeleitet werden.
Dosierung
Enspryng kann als Monotherapie oder in Kombination mit oralen Corticosteroiden (OC), Azathioprin (AZA) oder Mycophenolatmofetil (MMF) angewendet werden (siehe Abschnitt 5.1). Die Dosierung bei jugendlichen Patienten ≥ 12 Jahre mit einem Körpergewicht ≥ 40 kg und bei erwachsenen Patienten ist identisch.
Initialdosis
Die empfohlene Initialdosis für die ersten drei Anwendungen beträgt 120 mg als subkutane (s.c.) Injektion alle zwei Wochen (erste Dosis in Woche 0, zweite Dosis in Woche 2 und dritte Dosis in Woche 4).
Erhaltungsdosis
Die empfohlene Erhaltungsdosis beträgt 120 mg als s.c. Injektion alle vier Wochen.
Dauer der Behandlung
Enspryng ist zur Langzeitbehandlung vorgesehen.
Verspätete oder versäumte Injektionen
Wenn eine Injektion versäumt wurde und der Grund dafür kein Anstieg der Leberenzyme war, ist diese, wie in Tabelle 1 beschrieben, nachzuholen.
Tabelle 1: Empfohlene Dosierung bei verspäteten oder versäumten Dosen
Letzte angewendete Dosis |
Empfohlene Dosierung bei verspäteten oder versäumten Dosen |
Versäumte Initialdosis oder weniger als 8 Wochen während des Erhaltungszeitraums |
Die empfohlene Dosis ist sobald wie möglich anzuwenden, ohne bis zur nächsten planmäßigen Dosis zu warten. Wenn die zweite Initialdosis versäumt oder verspätet angewendet wurde, ist diese Dosis sobald wie möglich und die dritte und letzte Initialdosis 2 Wochen danach anzuwenden. Wenn die dritte Initialdosis versäumt oder verspätet angewendet wurde, ist diese Dosis sobald wie möglich und die erste Erhaltungsdosis 4 Wochen danach anzuwenden. Erhaltungszeitraum Nachdem die verspätete oder versäumte Dosis appliziert wurde, ist das Dosierungsschema wieder auf alle 4 Wochen zurücksetzen. |
8 Wochen bis weniger als 12 Wochen |
Die empfohlene Dosis ist nach 0*, 2 Wochen und danach alle 4 Wochen anzuwenden. |
12 Wochen oder länger |
Die empfohlene Dosis ist nach 0*, 2, 4 Wochen und danach alle 4 Wochen anzuwenden. |
* “0 Wochen” bezieht sich auf den Zeitpunkt der ersten Anwendung nach der versäumten Dosis.
Anleitung zur Dosisanpassung bei abweichenden Leberenzymwerten
Wenn die Alaninaminotransferase (ALT) oder die Aspartattransaminase (AST) um mehr als das Fünffache der oberen Normgrenze (> 5 x upper limit of normal, ULN) erhöht und mit einem Anstieg des Bilirubins assoziiert ist, muss die Behandlung abgesetzt werden und ein erneuter Behandlungsbeginn wird nicht empfohlen.
Wenn die ALT- oder AST-Erhöhung um > 5 x ULN nicht mit einem Anstieg des Bilirubins assoziiert ist, ist die Behandlung zu unterbrechen. Die Behandlung kann, auf Basis einer Nutzen-Risiko-Beurteilung für den Patienten, in einer Dosierung von 120 mg als s.c. Injektion alle vier Wochen wieder aufgenommen werden, sobald die ALT- und AST-Werte wieder im Normbereich liegen. Wenn entschieden wurde, die Behandlung wieder aufzunehmen, sind die Leberparameter engmaschig zu überwachen. Falls in der Folge ein Anstieg der ALT/AST und/oder des Bilirubins beobachtet wird, muss die Behandlung abgesetzt werden und ein erneuter Behandlungsbeginn wird nicht empfohlen (siehe Abschnitte 4.4 und 4.8).
Tabelle 2: Empfohlene Dosis bei erneutem Behandlungsbeginn nach erhöhten Lebertransaminasen
Letzte angewendete Dosis |
Empfohlene Dosis bei erneutem Behandlungsbeginn |
Weniger als 12 Wochen |
Erneuter Behandlungsbeginn mit der empfohlenen Dosis, die alle 4 Wochen gegeben wird. |
12 Wochen oder länger |
Erneuter Behandlungsbeginn mit der empfohlenen Dosis, die nach 0*, 2, 4 und danach alle 4 Wochen gegeben wird. |
* “0 Wochen” bezieht sich auf den Zeitpunkt der ersten Anwendung nach der Wiederaufnahme der Behandlung.
Anleitung zur Dosisanpassung bei Neutropenie
Wenn die Neutrophilenzahl unter 1,0 x 109/l liegt und dies durch wiederholtes Testen bestätigt wurde, muss die Behandlung ausgesetzt werden, bis die Neutrophilenzahl > 1,0 x 109/l ist.
Empfehlung zur Dosisanpassung bei verringerter Thrombozytenzahl
Wenn die Thrombozytenzahl unter 75 x 109/l liegt und dies durch wiederholtes Testen bestätigt wurde, muss die Behandlung ausgesetzt werden, bis die Thrombozytenzahl ≥ 75 x 109/l ist.
Besondere Patientengruppen
Kinder und Jugendliche
Die Dosierung für jugendliche Patienten ≥ 12 Jahre mit einem Körpergewicht ≥ 40 kg und erwachsene Patienten ist identisch (siehe Abschnitte 5.1 und 5.2). Die Sicherheit und Wirksamkeit von Satralizumab bei Kindern mit einem Körpergewicht < 40 kg ist nicht erwiesen. Es liegen keine Daten vor.
Ältere Patienten
Bei Patienten ≥ 65 Jahre ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2).
Patienten mit Nierenfunktionsstörungen
Die Sicherheit und Wirksamkeit von Satralizumab wurde bei Patienten mit Nierenfunktionsstörung nicht eigens untersucht. Für Patienten mit leichter Nierenfunktionsstörung wird keine Dosisanpassung empfohlen (siehe Abschnitt 5.2).
Patienten mit Leberfunktionsstörungen
Die Sicherheit und Wirksamkeit von Satralizumab wurde bei Patienten mit Leberfunktionsstörung nicht untersucht. Es liegen keine Daten vor (siehe Abschnitt 5.2).
Erhöhte Leberenzymwerte wurden während der Behandlung mit Satralizumab beobachtet (siehe Abschnitte 4.4 und 4.8). Für Dosisanpassungen siehe oben, Abschnitt „Anleitung zur Dosisanpassung bei abweichenden Leberenzymwerten“.
Art der Anwendung
Satralizumab 120 mg wird mit einer Einzeldosis-Fertigspritze s.c. injiziert. Der gesamte Inhalt (1 ml) der Fertigspritze ist zu verabreichen.
Empfohlene Injektionsstellen sind Bauchdecke und Oberschenkel. Die Injektionsstelle ist zu wechseln und es darf niemals in Muttermale, Narben, Hämatome oder Bereiche mit empfindlicher, geröteter, verhärteter oder verletzter Haut injiziert werden.
Umfassende Informationen zur Anwendung von Satralizumab werden am Ende der Packungsbeilage gegeben.
Anwendung durch den Patienten und/oder Betreuer
Die erste Injektion muss unter Aufsicht eines Arztes oder qualifiziertem medizinischem Fachpersonal erfolgen.
Nach angemessener Schulung zur Injektionsvorbereitung und -anwendung, kann ein erwachsener Patient/Betreuer alle weiteren Dosen zu Hause injizieren, wenn der behandelnde Arzt dies für angemessen erachtet und der erwachsene Patient/Betreuer die Injektionstechnik beherrscht.
Die Patienten/Betreuer müssen sofort medizinische Hilfe holen, wenn der Patient Symptome einer schwerwiegenden allergischen Reaktion zeigt, und mit dem behandelnden Arzt abklären, ob die Behandlung fortgesetzt werden darf oder nicht.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Infektionen
Bei Patienten mit aktiver Infektion ist die Anwendung von Satralizumab auszusetzen, bis die Infektion unter Kontrolle ist (siehe Abschnitt 4.2).
Bei Patienten, die eine Behandlung mit Satralizumab erhalten, wird empfohlen, sorgfältig auf Anzeichen von Infektionen zu achten, um diese rechtzeitig erkennen und diagnostizieren zu können. Wenn der Patient eine schwerwiegende oder opportunistische Infektion entwickelt, ist die Behandlung aufzuschieben und eine angemessene Therapie mit weiterer Überwachung einzuleiten. Die Patienten sind anzuweisen, bei Anzeichen und Symptomen von Infektionen frühzeitig einen Arzt aufzusuchen, um eine rechtzeitige Diagnose von Infektionen zu ermöglichen. Den Patienten ist ein Patientenpass auszuhändigen.
Impfungen
Lebendimpfstoffe und abgeschwächte Lebendimpfstoffe dürfen nicht zusammen mit Satralizumab angewendet werden, da die klinische Sicherheit hier nicht erwiesen ist. Das Intervall zwischen einer Lebendimpfung und der Einleitung der Behandlung mit Satralizumab sollte den aktuellen Impfempfehlungen für immunmodulierende oder immunsuppressive Substanzen entsprechen.
Es liegen keine Daten zur Wirkung von Impfungen bei Patienten unter Satralizumab vor. Es wird empfohlen, bei allen Patienten vor Einleitung der Behandlung mit Satralizumab sämtliche Impfungen nach den geltenden Immunisierungsrichtlinien durchzuführen bzw. aufzufrischen.
Leberenzyme
Unter Behandlung mit Satralizumab wurden leichte bis mäßige Erhöhungen der Lebertransaminasen beobachtet, wobei die meisten Werte unter 5 x ULN lagen (siehe Abschnitt 4.8).
Die ALT- und AST-Werte sind in den ersten drei Behandlungsmonaten alle vier Wochen, anschließend alle drei Monate für die Dauer eines Jahres und danach entsprechend klinischer Indikation zu überwachen.
Bei Patienten mit ALT oder AST > 5 x ULN ist Satralizumab abzusetzen (siehe Abschnitt 4.2).
Neutrophilenzahl
Unter der Behandlung mit Satralizumab wurden erniedrigte Neutrophilenzahlen beobachtet (siehe Abschnitt 4.8).
Die Neutrophilenzahlen sind über einen Zeitraum von 4 bis 8 Wochen nach Behandlungsbeginn und danach entsprechend klinischer Indikation zu überwachen. Für empfohlene Dosisunterbrechungen siehe Abschnitt 4.2.
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
In pharmakokinetischen Populationsanalysen wurde keine Wirkung von Azathioprin (AZA), oralen Corticosteroiden (OC) oder Mycophenolatmofetil (MMF) auf die Clearance von Satralizumab festgestellt.
Sowohl In-vitro- als auch In-vivo-Studien haben gezeigt, dass die Expression spezifischer hepatischer CYP450-Enzyme (CYP1A2, CYP2C9, CYP2C19 und CYP3A4) durch Zytokine wie Interleukin-6 (IL-6) supprimiert wird.
Deshalb ist bei Beginn oder Absetzen der Behandlung mit Satralizumab bei Patienten Vorsicht geboten, wenn Patienten auch CYP450 3A4-, -1A2-, -2C9- oder -2C19-Substrate erhalten, insbesondere Substrate mit engem therapeutischem Fenster (wie Warfarin, Carbamazepin, Phenytoin und Theophyllin). Dosisanpassungen sind bei Bedarf vorzunehmen.
Aufgrund der verlängerten terminalen Halbwertszeit von Satralizumab kann die Wirkung von Satralizumab mehrere Wochen nach Behandlungsende anhalten.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Satralizumab bei Schwangeren vor. Aus Studien an Affen ergaben sich keine Hinweise auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
Als Vorsichtsmaßnahme wird empfohlen, Enspryng während der Schwangerschaft nicht anzuwenden.
Stillzeit
Es ist nicht bekannt, ob Satralizumab in die Muttermilch übergeht. Humanes Immunglobulin G (IgG) geht bekanntermaßen während der ersten Tage nach der Geburt in die Muttermilch über und sinkt kurz danach auf geringe Konzentrationen ab. Daher kann ein Risiko für gestillte Säuglinge während dieser kurzen Zeitspanne nicht ausgeschlossen werden. Nach dieser Zeitspanne sollte die Anwendung von Enspryng während der Stillzeit nur bei klinischer Notwendigkeit in Betracht gezogen werden.
Fertilität
Es liegen keine klinischen Daten zur Wirkung von Satralizumab auf die Fertilität beim Menschen vor. In tierexperimentellen Studien wurde keine Beeinträchtigung der männlichen oder weiblichen Fertilität beobachtet (siehe Abschnitt 5.3).
Enspryng hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die häufigsten beobachteten gemeldeten Nebenwirkungen waren Kopfschmerzen (19,2 %), Arthralgie (13,5 %), verringerte Leukozytenzahl (13,5 %), Hyperlipidämie (13,5 %) und injektionsbedingte Reaktionen (12,5 %).
Tabellarische Auflistung der Nebenwirkungen
Tabelle 3 fasst die Nebenwirkungen zusammen, die in klinischen Studien in Zusammenhang mit der Anwendung von Satralizumab, als Monotherapie oder in Kombination mit IST, gemeldet wurden.
Die in klinischen Studien aufgetretenen Nebenwirkungen (Tabelle 3) sind gemäß MedDRA nach Systemorganklasse aufgelistet. Die Nebenwirkungen sind nach Anzahl der Ereignisse pro 100 Patientenjahre und Häufigkeiten angegeben. Die entsprechende Häufigkeitskategorie für die jeweilige Nebenwirkung basiert auf folgenden Häufigkeiten und Konventionen: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1.000, < 1/100), selten (≥ 1/10.000, < 1/1.000), sehr selten (< 1/10.000).
Tabelle 3: Nebenwirkungen
Systemorganklasse |
Häufigkeit |
|
Sehr häufig |
Häufig |
|
Erkrankungen des Blutes und des Lymphsystems |
Hypofibrinogenämie |
|
Stoffwechsel- und Ernährungsstörungen |
Hyperlipidämie |
|
Psychiatrische Erkrankungen |
Schlaflosigkeit |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Migräne |
Herzerkrankungen |
Bradykardie |
|
Gefäßerkrankungen |
Hypertonie |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Allergische Rhinitis |
|
Erkrankungen des Gastrointestinaltrakts |
Gastritis |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Ausschlag, Pruritus |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Arthralgie |
Muskuloskelettale Steifigkeit |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Injektionsbedingte Reaktionen |
Peripheres Ödem |
Untersuchungen |
Leukozytenzahl erniedrigt |
Neutrophilenzahl erniedrigt, Thrombozytenzahl erniedrigt, Transaminasen erhöht, Bilirubin im Blut erhöht, Gewichtszunahme |
Beschreibung ausgewählter Nebenwirkungen
Injektionsbedingte Reaktionen (injection-related reactions, IRR)
Die unter Satralizumab beschriebenen IRR waren vorwiegend leicht bis mäßig und traten zumeist innerhalb von 24 Stunden nach einer Injektion auf. Die am häufigsten gemeldeten systemischen Symptome waren Diarrhoe und Kopfschmerzen. Die am häufigsten beschriebenen lokalen Reaktionen an der Injektionsstelle waren Flush, Erythem, Pruritus, Ausschlag und Schmerzen.
Körpergewicht
Während der doppelblinden Behandlungsphase wurde bei 3,8 % der mit Satralizumab (als Monotherapie oder in Kombination mit IST) behandelten Patienten, im Vergleich zu 2,7 % der mit Placebo (oder Placebo plus IST) behandelten Patienten, eine Zunahme des Körpergewichts um ≥ 15 % gegenüber dem Ausgangswert beobachtet.
Laborwertveränderungen
Neutrophile
In der doppelblinden Behandlungsphase kam es bei 31,7 % der Patienten, die Satralizumab als Monotherapie oder in Kombination mit IST erhielten, zu einer Verringerung der neutrophilen Granulozyten. Im Vergleich dazu waren von den Patienten, die Placebo oder Placebo plus IST erhielten, 21,6 % betroffen. In den meisten Fällen war die Verringerung der Neutrophilen vorübergehend oder intermittierend.
Bei 9,6 % der Patienten, die Satralizumab erhielten, lagen die neutrophilen Granulozyten unter 1 x 109/l im Vergleich zu 5,4 % der Patienten, die Placebo oder Placebo plus IST erhielten.
Thrombozyten
In der doppelblinden Behandlungsphase kam es bei 24,0 % der Patienten, die Satralizumab als Monotherapie oder in Kombination mit IST erhielten, zu einer Verringerung der Thrombozytenzahl (unter 150 × 109/l). Im Vergleich dazu waren von den Patienten, die Placebo oder Placebo plus IST erhielten, 9,5 % betroffen. Die verringerte Thrombozytenzahl war nicht mit Blutungsereignissen assoziiert.
In den meisten Fällen war die Verringerung der Thrombozytenzahl vorübergehend und die Werte lagen nicht unter 75 × 109/l.
Leberenzyme
In der doppelblinden Behandlungsphase kam es bei 27,9 % bzw. 18,3 % der Patienten, die Satralizumab als Monotherapie bzw. in Kombination mit IST erhielten, zu einem Anstieg der ALT oder AST. Im Vergleich dazu waren von den Patienten, die Placebo bzw. Placebo plus IST erhielten, 12,2 % bzw. 13,5 % betroffen. Der Anstieg lag zumeist unter 3 x ULN, war vorübergehend und die Werte normalisierten sich ohne Unterbrechung der Behandlung mit Satralizumab.
Erhöhte ALT- oder AST-Werte > 3 x ULN traten bei 2,9 % bzw. 1,9 % der Patienten, die Satralizumab als Monotherapie bzw. in Kombination mit IST erhielten, auf. Diese Erhöhungen waren nicht mit einem Anstieg des Gesamtbilirubins assoziiert.
Bei einem Patienten (1 %), der Satralizumab in Kombination mit IST erhielt, wurde 4 Wochen nach Einleitung der Behandlung ein Anstieg der ALT über 5 x ULN beobachtet. Nach Absetzen von Satralizumab normalisierten sich die Werte und Satralizumab wurde bei diesem Patienten nicht erneut angewendet (siehe Abschnitte 4.2 und 4.4).
Lipidparameter
In der doppelblinden Behandlungsphase kam es bei 10,6 % der Patienten, die Satralizumab als Monotherapie oder in Kombination mit IST erhielten, zu einem Anstieg des Gesamtcholesterins über 7,75 mmol/l. Im Vergleich dazu waren von den Patienten, die Placebo oder Placebo plus IST erhielten, 1,4 % betroffen. 20,2 % der Patienten, die Satralizumab als Monotherapie oder in Kombination mit IST erhielten, wiesen einen Anstieg der Triglyzeridwerte über 3,42 mmol/l auf, verglichen mit 10,8 % der Patienten, die Placebo erhielten.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Satralizumab wurde bei 9 Kindern im Alter von ≥ 12 Jahren untersucht. Bezüglich Häufigkeit, Art und Schweregrad der Nebenwirkungen bei Kindern ab 12 Jahren werden keine Unterschiede im Vergleich zu Erwachsenen erwartet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51‑59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
anzuzeigen.
Im Fall einer Überdosierung ist der Patient engmaschig zu überwachen und symptomatisch zu behandeln; bei Bedarf sind unterstützende Maßnahmen einzuleiten.
Pharmakotherapeutische Gruppe: Immunsuppressiva, Interleukin-Inhibitoren, ATC-Code: L04AC19
Wirkmechanismus
Satralizumab ist ein rekombinanter humanisierter monoklonaler Immunglobulin-G2(IgG2)-Antikörper (monoclonal antibody, mAb), der an den löslichen und membrangebundenen humanen IL-6-Rezeptor (IL-6R) bindet und dadurch eine IL-6 nachgeschaltete Signalgebung durch diese Rezeptoren hemmt.
Bei Patienten mit NMO und NMOSD ist in den Phasen der Krankheitsaktivität die IL-6-Konzentration in der Zerebrospinalflüssigkeit und im Serum erhöht. IL-6-Funktionen sind an der Pathogenese von NMO und NMOSD beteiligt, darunter an der B-Zell-Aktivierung, der Differenzierung von B-Lymphozyten zu Plasmablasten, der Produktion von pathologischen Autoantikörpern (z. B. gegen AQP4, einem Wasserkanalprotein, das hauptsächlich durch Astrozyten im zentralen Nervensystem exprimiert wird), der Th17-Zell-Aktivierung und -Differenzierung, der Inhibierung von regulatorischen T-Zellen und an Veränderungen der Permeabilität der Blut-Hirn-Schranke.
Pharmakodynamische Wirkungen
In klinischen Studien zu Satralizumab bei NMO und NMOSD wurde eine Verminderung von C-reaktivem Protein (CRP), Fibrinogen und Komplement (C3, C4 und CH50) beobachtet.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit und Sicherheit von Satralizumab wurde in zwei klinischen Hauptstudien der Phase III bei Patienten mit NMOSD (diagnostiziert als AQP4-IgG-seropositive oder -seronegative NMO [Wingerchuck 2006 Kriterien] oder AQP4-IgG-seropositive NMOSD [Wingerchuck 2007 Kriterien]) beurteilt.
In die Studie BN40898 wurden erwachsene und jugendliche Patienten mit NMOSD im Alter zwischen 12 – 74 Jahren eingeschlossen, die mit einer stabilen IST behandelt wurden und mindestens 2 Schübe in den letzten beiden Jahren vor dem Screening hatten (davon mindestens einen Schub innerhalb der letzten 12 Monate vor dem Screening) und einen Expanded Disability Status Scale(EDSS)-Wert zwischen 0 und 6,5 aufwiesen. Demgegenüber wurden in die Studie BN40900 erwachsene Patienten im Alter zwischen 18 – 74 Jahre ohne Basistherapie mit IST eingeschlossen, die mindestens einen Schub oder ihre erste Krankheitsattacke innerhalb der letzten 12 Monate vor dem Screening hatten und einen EDSS-Wert zwischen 0 und 6,5 aufwiesen.
In beide Studien wurden ca. 30 % AQP4-IgG-seronegative NMO-Patienten eingeschlossen.
In beiden Studien wurde die Wirksamkeit anhand der Zeit bis zum ersten protokolldefinierten Schub bewertet, welcher durch ein unabhängiges Clinical Endpoint Committee (CEC) bestätigt wurde. Ein Schub wurde definiert als eine vorab festgelegte Verschlechterung des EDSS-Wertes und der Functional System Score(FSS)-Kriterien, die innerhalb von 7 Tagen, nachdem der Patient Symptome gemeldet hatte, ausgewertet wurde (bestätigter Schub).
Studie BN40898 (auch SA-307JG oder SAkuraSky)
Die Studie BN40898 war eine randomisierte, multizentrische, doppelblinde, placebokontrollierte klinische Studie zur Beurteilung der Wirkung von Satralizumab in Kombination mit einer stabilen IST (OC bis zu 15 mg/Tag [Prednisolon-Äquivalent], AZA bis zu 3 mg/kg/Tag oder MMF bis zu 3.000 mg/Tag; Jugendliche erhielten eine Kombinationstherapie mit AZA plus OC oder MMF plus OC). In die doppelblinde Phase der Studie wurden 83 AQP4-IgG-seropositive und -seronegative Patienten (76 Erwachsene und 7 Jugendliche) eingeschlossen. Die Patienten erhielten die ersten 3 Einzeldosen von Satralizumab 120 mg bzw. das entsprechende Placebo in den ersten 4 Wochen jede 2. Woche und danach jede 4. Woche als s.c. Injektion in den Bauch- oder Oberschenkelbereich.
Das Studiendesign und die Ausgangswerte der Studienpopulation sind in Tabelle 4 angegeben.
Tabelle 4: Studiendesign und Ausgangswerte bei AQP4-IgG-seropositiven Patienten für Studie BN40898
Studienname |
Studie BN40898 |
|
Studiendesign | ||
Studienpopulation |
Jugendliche und erwachsene Patienten mit NMO oder NMOSD unter stabiler IST |
|
Dauer der Studie für die Beurteilung der Wirksamkeit |
Ereignisgesteuert** (26 bestätigte Schübe) |
|
Behandlungsgruppen, Randomisierung 1:1 |
Gruppe A: Satralizumab 120 mg s.c. |
|
Ausgangswerte der AQP4-IgG-seropositiven Patienten |
Satralizumab + IST (n = 27) |
Placebo + IST (n = 28) |
Diagnose, n (%): |
19 (70,4) |
14 (50,0) |
Mittleres Alter in Jahren (SD) |
44,4 (15,7) |
43,4 (12,9) |
Ältere Patienten (≥ 65 Jahre), n (%) |
3 (11,1) |
1 (3,6) |
Jugendliche (≥ 12 bis < 18 Jahre), n (%) |
1 (3,7) |
2 (7,1) |
Geschlechterverteilung, |
0 / 27 (100) |
0 / 28 (100) |
Immunsuppressive Therapie (IST), n (%): |
14 (51,9) |
13 (46,4) |
* Intention-To-Treat (ITT)
** Patienten, die mit einer Rescue-Therapie ohne bestätigten Schub behandelt wurden, konnten in die offene Verlängerungsphase (OLE) der Studie eingeschlossen werden und wurden für die primäre Wirksamkeitsanalyse zensiert.
*** Kombination für jugendliche Patienten gestattet
Studie BN40900 (auch SA-309JG oder SAkuraStar)
Studie BN40900 war eine randomisierte, multizentrische, doppelblinde, placebokontrollierte klinische Studie zur Beurteilung der Wirkung einer Monotherapie mit Satralizumab im Vergleich zu Placebo. In die Studie wurden 95 AQP4-IgG-seropositive und -seronegative erwachsene Patienten eingeschlossen. Die Patienten erhielten die ersten 3 Einzeldosen von Satralizumab 120 mg bzw. das entsprechende Placebo in den ersten 4 Wochen jede 2. Woche und danach jede 4. Woche als s.c. Injektion in den Bauch- oder Oberschenkelbereich.
Das Studiendesign und die Ausgangswerte der Studienpopulation sind in Tabelle 5 angegeben.
Tabelle 5: Studiendesign und Ausgangswerte bei AQP4-IgG-seropositiven Patienten für Studie BN40900
Studienname |
Studie BN40900 |
|
Studiendesign | ||
Studienpopulation |
Erwachsene Patienten mit NMO oder NMOSD |
|
Dauer der Studie für die Beurteilung der Wirksamkeit |
Ereignisgesteuert (44 bestätigte Schübe oder 1,5 Jahre nach dem Randomisierungsdatum des letzten eingeschlossenen Patienten; je nachdem, welches Ereignis zuerst eintritt) |
|
Behandlungsgruppen, Randomisierung 2:1 |
Monotherapie: |
|
Ausgangswerte der AQP4-IgG-seropositiven Patienten |
Satralizumab (n = 41) |
Placebo (n = 23) |
Diagnose, n (%): |
26 (63,4) |
15 (65,2) |
Mittleres Alter in Jahren (SD) |
46,0 (12,0) |
40,1 (11,5) |
Ältere Patienten (≥ 65 Jahre), n (%) |
1 (2,4) |
0 |
Geschlechterverteilung, |
10 (24,4) / 31 (75,6) |
1 (4,3) / 22 (95,7) |
* Intention-To-Treat (ITT)
Primäre Wirksamkeit
Bei den AQP4-IgG-seropositiven Patienten zeigte sich das relative Risiko eines bestätigten Schubs in Studie BN40898 um 79 % (hazard ratio, HR [95-%-KI]: 0,21 [0,06 - 0,75]) und in Studie BN40900 um 74 % (HR [95-%-KI]: 0,26 [0,11 - 0,63]) reduziert (siehe Abbildungen 1 und 2). Die gepoolten Daten aus den Studien BN40898 und BN40900 zeigten, dass die Behandlung mit Satralizumab mit oder ohne IST bei AQP4-IgG-seropositiven Patienten zu einer Risikoreduktion von insgesamt 75 % (HR [95-%-KI]: 0,25 [0,12 - 0,50]) führte. Nach 48 Wochen waren 85,7 % der mit Satralizumab behandelten AQP4-IgG-seropositiven Patienten (Anwendung mit IST bzw. als Monotherapie) weiterhin frei von bestätigten Schüben, verglichen mit 58,7 % in der Placebogruppe. Nach 96 Wochen waren 81,4 % der mit Enspryng behandelten AQP4-IgG-seropositiven Patienten (Anwendung mit IST bzw. als Monotherapie) weiterhin frei von bestätigten Schüben, verglichen mit 47,2 % in der Placebogruppe. Die Wirksamkeit war bei AQP4-IgG-seronegativen Patienten nicht signifikant.
Abbildung 1: Studie BN40898 – Zeit bis zum ersten bestätigten Schub in der doppelblinden Phase bei AQP4-IgG-seropositiven Patienten
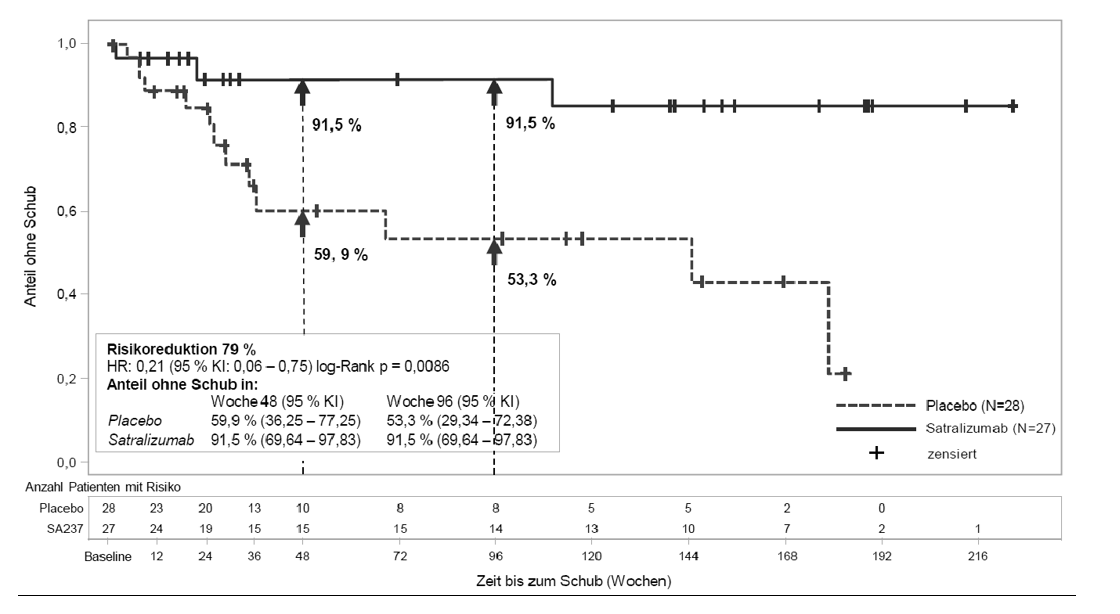
Abbildung 2: Studie BN40900 – Zeit bis zum ersten bestätigten Schub in der doppelblinden Phase bei AQP4-IgG-seropositiven Patienten
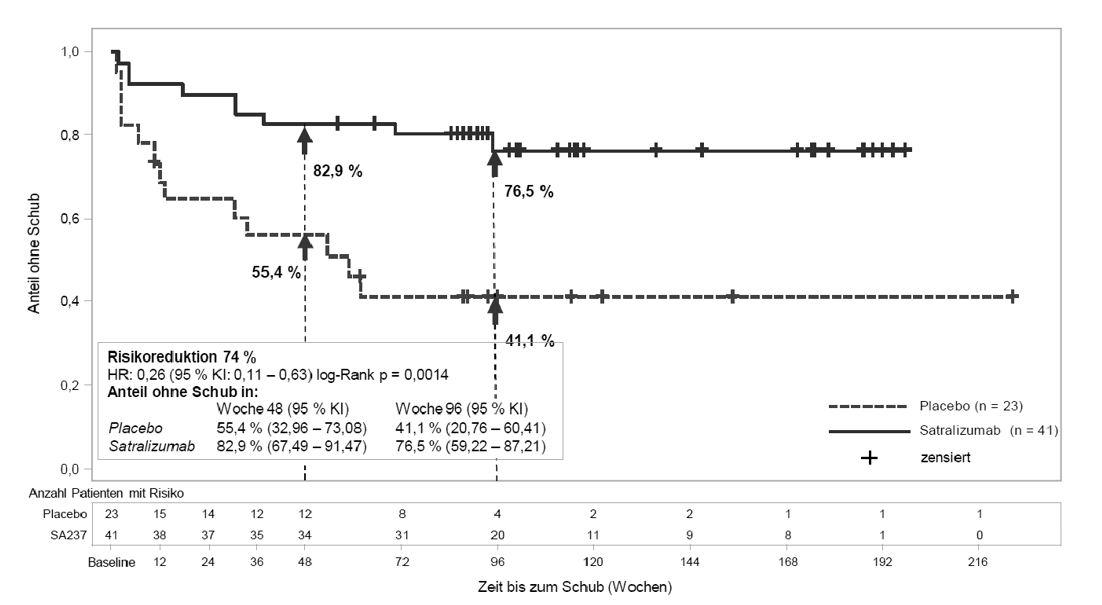
Die Behandlung mit Satralizumab bei AQP4-IgG-seropositiven Patienten verringerte die jährliche Rate bestätigter Schübe (annualized rate of adjudicated relapses, ARR) in der Studie BN40898 um 88 % (rate ratio [RR] = 0,122; 95-%-KI: 0,027 – 0,546; p = 0,0039) und in der Studie BN40900 um 90 % (RR = 0,096; 95-%-KI: 0,020 – 0,473; p = 0,0086), verglichen mit einer Behandlung mit Placebo.
Im Vergleich mit Placebo behandelten Patienten war die Notwendigkeit einer Rescue-Therapie (darunter Corticosteroide, intravenöses Immunglobulin und/oder Apherese [einschließlich Plasmapherese oder Plasmaaustausch]) bei mit Satralizumab behandelten, AQP4-IgG-seropositiven Patienten in Studie BN40898 um 61 % (odds ratio [OR] = 0,3930; 95-%-KI: 0,1343 – 1,1502; p = 0,0883) und in Studie BN40900 um 74 % (OR = 0,2617; 95-%-KI: 0,0862 – 0,7943; p = 0,0180) verringert.
Die Behandlung mit Satralizumab bei AQP4-IgG-seropositiven Patienten verringerte das Risiko für das Auftreten eines schweren Schubs, definiert als EDSS-Anstieg um ≥ 2 Punkte im Vergleich zur vorherigen EDSS-Bewertung, in Studie BN40898 um 85 % (Zeit bis zum bestätigten schweren Schub während der doppelblinden Phase; HR = 0,15; 95-%-KI: 0,02 – 1,25; p = 0,0441) und in Studie BN40900 um 79 % (HR = 0,21; 95-%-KI: 0,05 – 0,91; p = 0,0231) im Vergleich zur Behandlung mit Placebo.
Wesentliche sekundäre Endpunkte
Eine Veränderung von Schmerzen oder Fatigue wurde in den Studien BN40898 und BN40900 bis Woche 24 gegenüber Baseline nicht erreicht.
Offene Verlängerungsphase
Analysen von Langzeitdaten, einschließlich Daten aus der offenen Verlängerungsphase (basierend auf mit Rescue-Therapie behandeltem Schub), zeigten, dass bei Anwendung von Satralizumab als Add-on-Therapie 58 % bzw. bei Anwendung von Satralizumab als Monotherapie 73 % der AQP4-IgG-seropositiven Patienten nach 120 Wochen Behandlung frei von Schüben blieben.
Immunogenität
In den Phase-III-Studien BN40898 (in Kombination mit IST) und BN40900 (als Monotherapie) wurden Anti-Drug-Antikörper (ADA) bei 41 % bzw. 71 % der Patienten festgestellt, die Satralizumab in der doppelblinden Phase erhielten. Es ist nicht bekannt, inwieweit ADA die Bindung von Satralizumab neutralisieren können.
Die Exposition war bei ADA-positiven Patienten geringer, allerdings hatten die ADA keinen Einfluss auf die Sicherheit und keinen eindeutigen Einfluss auf die Wirksamkeit und die pharmakodynamischen Marker, welche die Zielwirkung anzeigen.
Die Behandlung mit Satralizumab führte bei den Patienten in beiden Phase-III-Studien trotz unterschiedlicher ADA-Raten in den Studien zu einer ähnlichen Reduktion des Risikos eines bestätigten Schubs.
Kinder und Jugendliche
An Studie BN40898 nahmen während der doppelblinden Phase 7 jugendliche Patienten teil. Ihr Durchschnittsalter betrug 15,4 Jahre und das mediane Körpergewicht 79,6 kg. Die Mehrzahl der Patienten war weiblich (n = 6). Vier Patienten waren kaukasischer Abstammung, 2 waren schwarz- bzw. afroamerikanischer Abstammung und 1 Patient war asiatischer Abstammung. Drei jugendliche Patienten (42,9 %) waren beim Screening AQP4-IgG-seropositiv (2 in der Placebogruppe und 1 in der Gruppe mit Satralizumab). Während der doppelblinden Phase trat bei einem der 3 Jugendlichen in der Placebogruppe und einem der 4 Jugendlichen in der Gruppe mit Satralizumab ein bestätigter Schub auf. Aufgrund der geringen Fallzahl wurde die Hazard Ratio für den primären Endpunkt Zeit bis zum ersten bestätigten Schub in dieser Subgruppe nicht berechnet. Zwei weitere jugendliche Patienten wurden in die offene Verlängerungsphase der Studie aufgenommen.
Die Europäische Arzneimittel-Agentur hat für Enspryng eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen in der Behandlung der NMOSD gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Pharmakokinetik von Satralizumab wurde an gesunden Probanden japanischer und kaukasischer Abstammung sowie an NMO- und NMOSD-Patienten untersucht. Die Pharmakokinetik bei NMO- und NMOSD-Patienten, welche die empfohlene Dosis erhielten, wurde mittels populationspharmakokinetischer Analysemethoden auf Basis einer Datenbank von 154 Patienten untersucht.
Der Konzentrations-Zeit-Verlauf von Satralizumab bei Patienten mit NMO oder NMOSD wurde anhand eines populationspharmakokinetischen Zwei-Kompartiment-Modells mit paralleler linearer und zielvermittelter (Michaelis-Menten-)Elimination und s.c. Absorption erster Ordnung genau beschrieben. Die Clearance- und Volumen-Parameter von Satralizumab wurden allometrisch nach Körpergewicht skaliert (anhand der Power-Funktion mit fixem Power-Koeffizient von 0,75 bzw. 1 für die Clearance- bzw. Volumen-Parameter). Das Körpergewicht erwies sich als signifikante Kovariate, wobei Clearance bzw. Vc bei einem Patienten mit einem Gewicht von 123 kg (97,5. Perzentile der Gewichtsverteilung) im Vergleich zu einem Patienten mit 60 kg um 71,3 % bzw. 105 % anstiegen.
Die nach der Initialphase (8 Wochen) erreichten Steady-State-Werte für die pharmakokinetischen Parameter Cmin, Cmax und AUC (Mittelwert [±SD]) waren: Cmin: 19,7 (12,2) µg/ml, Cmax: 31,5 (14,9) µg/ml und AUC: 737 (386) µg×ml/Tag.
Resorption
Die Resorptionsratenkonstante von Satralizumab betrug 0,0104/h, entsprechend einer Resorptionshalbwertszeit von rund 3 Tagen (66 Stunden) bei der empfohlenen Dosis (siehe Abschnitt 4.2). Die Bioverfügbarkeit war hoch (85,4 %).
Verteilung
Satralizumab unterliegt einer biphasischen Verteilung. Das zentrale Verteilungsvolumen betrug 3,46 l, das periphere Verteilungsvolumen war 2,07 l. Die interkompartimentelle Clearance betrug 14 ml/h.
Biotransformation
Der Metabolismus von Satralizumab wurde nicht direkt untersucht, da monoklonale Antikörper grundsätzlich durch Katabolismus abgebaut werden.
Elimination
Die Gesamtclearance von Satralizumab ist konzentrationsabhängig. Die lineare Clearance (die etwa die Hälfte der Gesamtclearance im Steady State mit der empfohlenen Dosis bei NMO- und NMOSD-Patienten beträgt) wird auf 2,50 ml/h geschätzt. Die assoziierte terminale t1/2 beträgt etwa 30 Tage (Bereich 22 - 37 Tage) auf Basis der gepoolten Daten aus den Phase-III-Studien.
Spezielle Patientengruppen
Populationspharmakokinetische Analysen bei erwachsenen Patienten mit NMO oder NMOSD haben gezeigt, dass Alter, Geschlecht und ethnische Zugehörigkeit die Pharmakokinetik von Satralizumab nicht wesentlich beeinflussen. Obwohl das Körpergewicht Auswirkungen auf die Pharmakokinetik von Satralizumab hatte, werden für keine dieser demographischen Merkmale Dosisanpassungen empfohlen.
Kinder und Jugendliche
Daten von 8 jugendlichen Patienten (13 - 17 Jahre), die mit dem Dosierungsschema für Erwachsene behandelt wurden, zeigen, dass sich die populationspharmakokinetischen Parameter von Satralizumab nicht signifikant von den Parametern in der Erwachsenenpopulation unterscheiden. Daher ist keine Dosisanpassung erforderlich.
Ältere Patienten
Es wurden keine speziellen Studien zur Untersuchung der Pharmakokinetik von Satralizumab bei Patienten ≥ 65 Jahre durchgeführt, allerdings nahmen Patienten mit NMO oder NMOSD im Alter zwischen 65 und 74 Jahren an den klinischen Studien BN40898 und BN40900 teil.
Nierenfunktionsstörung
Es wurden keine formalen Studien zur Auswirkung von Nierenfunktionsstörungen auf die Pharmakokinetik von Satralizumab durchgeführt. Allerdings nahmen Patienten mit leichter Nierenfunktionsstörung (Kreatinin-Clearance ≥ 50 ml/min und < 80 ml/min) an den klinischen Phase-III-Studien teil. Basierend auf einer populationspharmakokinetischen Analyse hat eine Nierenfunktionsstörung keinen Einfluss auf die Pharmakokinetik von Satralizumab, was mit den bekannten Clearance-Mechanismen für Satralizumab übereinstimmt. Somit ist keine Dosisanpassung erforderlich.
Leberfunktionsstörung
Es wurden keine formalen Studien zur Auswirkung von Leberfunktionsstörungen auf die Pharmakokinetik von Satralizumab durchgeführt (siehe Abschnitt 4.2).
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktions- und Entwicklungstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Karzinogenität
Es wurden keine Karzinogenitätsstudien an Nagern zur Untersuchung des karzinogenen Potenzials von Satralizumab durchgeführt. In einer 6-monatigen Studie zur chronischen Toxizität an Javaneraffen wurden keine proliferierenden Läsionen festgestellt.
Genotoxizität
Es wurden keine Studien zum mutagenen Potenzial von Satralizumab durchgeführt. Es sind keine Auswirkungen von Antikörpern auf die DNA zu erwarten.
Reproduktionstoxizität
Die pränatale Gabe von und die postnatale Exposition mit Satralizumab riefen bei trächtigen Affen und deren Nachkommen keine unerwünschten Wirkungen auf die Muttertiere, die fetale Entwicklung, den Trächtigkeitsverlauf sowie das Überleben und die Entwicklung einschließlich Lernfähigkeit der Jungen hervor.
Die Konzentration von Satralizumab in der Muttermilch war sehr niedrig (< 0,9 % der entsprechenden maternalen Plasmakonzentration).
Fertilität
Bei Affen wurden nach Langzeitgabe von Satralizumab keine Auswirkungen auf die männlichen oder weiblichen Reproduktionsorgane festgestellt.
Zytokin-Freisetzungs-Syndrom
Auf Basis von In-vitro-Studien mit menschlichem Blut wird das Risiko einer Freisetzung proinflammatorischer Zytokine unter Satralizumab bezüglich Inzidenz und Anstieg der Zytokine für gering erachtet.
Histidin
Asparaginsäure
Arginin
Poloxamer 188
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
3 Jahre
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren. Die Spritze darf nicht verwendet werden, wenn sie eingefroren wurde.
Die Spritze immer trocken halten.
Die Fertigspritze im Umkarton aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen.
Wenn ungeöffnet im Umkarton aufbewahrt, kann die Spritze einmalig für eine Zeitspanne von bis zu 8 Tagen außerhalb des Kühlschranks bei unter 30 °C gelagert werden. Nach Lagerung bei Raumtemperatur darf das Produkt nicht in den Kühlschrank zurückgelegt werden und muss entweder verwendet oder entsorgt werden.
1 ml Lösung in einer Fertigspritze (Polymer) mit eingeklebter Nadel aus Edelstahl und steifem Nadelschutz aus chloriertem Butylkautschuk/Polypropylen, verschlossen mit einem Kolbenstopfen aus chloriertem Butylkautschuk. Die Fertigspritze ist etikettiert und verfügt über einen automatischen Nadelschutz, eine Kolbenstange und verlängerte Fingergriffe.
Packungsgröße: Packung mit 1 Fertigspritze und Bündelpackung mit 3 Fertigspritzen (3 Packungen mit jeweils 1 Fertigspritze). Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Den versiegelten Umkarton nach der Entnahme aus dem Kühlschrank öffnen und die Fertigspritze vorsichtig am Spritzenkörper aus der Verpackung heben. Es ist wichtig, vor Beginn des Injektionsvorgangs 30 Minuten zu warten, damit die Fertigspritze Raumtemperatur annehmen kann.
Das Arzneimittel darf nicht verwendet werden, wenn die Lösung trübe oder verfärbt ist, sichtbare Partikel enthält oder Teile der Fertigspritze Beschädigungen aufweisen.
Die Injektion muss direkt nach dem Abnehmen der Schutzkappe und spätestens nach 5 Minuten durchgeführt werden, damit das Arzneimittel nicht eintrocknet und die Nadel verstopft. Wenn die Fertigspritze nicht innerhalb von 5 Minuten nach Entfernen der Schutzkappe verwendet werden kann, ist sie in einem durchstichsicheren Behälter zu entsorgen und eine neue Fertigspritze zu verwenden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Roche Registration GmbH
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Deutschland
EU/1/21/1559/001
EU/1/21/1559/002
Datum der Erteilung der Zulassung: 24. Juni 2021
September 2024
Verschreibungspflichtig
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Telefon (07624) 14-0
Telefax (07624) 1019
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.