▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Upstaza 2,8 x 1011 Vektorgenome (Vg)/0,5 ml Infusionslösung
Eladocagene exuparvovec ist ein Arzneimittel zur Gentherapie, das die humane Aromatische-L-Aminosäure-Decarboxylase (hAADC) exprimiert. Es handelt sich um einen nicht replizierenden rekombinanten Vektor auf Grundlage des Adeno-assoziierten Virus vom Serotyp 2 (AAV2), der die cDNA des humanen Dopa-Decarboxylase(DDC)-Gens enthält und unter der Kontrolle eines Zytomegalievirus(CMV)-Promoters ist.
Eladocagene exuparvovec wird in menschlichen embryonalen Nierenzellen mittels rekombinanter DNA-Technologie hergestellt.
Jede Einzeldosis-Durchstechflasche enthält 2,8 × 1011 Vg von Eladocagene exuparvovec in 0,5 ml extrahierbarer Lösung. Jeder ml der Lösung enthält 5,6 x 1011 Vg Eladocagene exuparvovec.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Infusionslösung.
Nach dem Auftauen, ist die Infusionslösung eine klare bis leicht trübe, farblose bis blassweiße Flüssigkeit.
Upstaza ist indiziert für die Behandlung von Patienten im Alter ab 18 Monaten mit einer klinisch, molekularbiologisch und genetisch bestätigten Diagnose eines Aromatische-L-Aminosäure-Decarboxylase-(AADC)-Mangels mit einem schweren Phänotyp (siehe Abschnitt 5.1).
Die Behandlung sollte in einem Zentrum, das auf stereotaktische Neurochirurgie spezialisiert ist, von einem qualifizierten Neurochirurgen unter kontrollierten aseptischen Bedingungen verabreicht werden.
Dosierung
Die Patienten erhalten eine Gesamtdosis von 1,8 × 1011 Vg als vier (zwei pro Putamen) 0,08-ml-Infusionen (0,45 × 1011 Vg).
Die Dosierung ist dieselbe für die gesamte von dem Anwendungsgebiet erfasste Population.
Besondere Patientengruppen
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Eladocagene exuparvovec bei Kindern im Alter von unter 18 Monaten ist bisher noch nicht erwiesen. Es liegen keine Daten vor.
Bei Patienten ab 12 Jahren liegen nur begrenzte Erfahrungen vor. Die Sicherheit und Wirksamkeit von Eladocagene exuparvovec bei diesen Patienten ist nicht erwiesen. Zurzeit vorliegende Daten werden in Abschnitt 5.1 beschrieben. Dosisanpassungen dürfen nicht in Betracht gezogen werden.
Eingeschränkte Leber- und Nierenfunktion
Die Sicherheit und Wirksamkeit von Eladocagene exuparvovec wurde bei Patienten mit eingeschränkter Leber- und Nierenfunktion nicht untersucht.
Immunogenität
Es gibt keine Sicherheits- oder Wirksamkeitsdaten für Patienten, deren AAV2-Antikörperspiegel vor der Behandlung > 1:50 betrug (siehe Abschnitt 4.4).
Art der Anwendung
Zur intraputaminalen Anwendung.
Vorbereitung
Upstaza ist eine sterile Infusionslösung, die vor der Verabreichung von der Krankenhausapotheke aufgetaut und vorbereitet werden muss.
Genaue Hinweise zur Vorbereitung, Verabreichung, Maßnahmen bei einer versehentlichen Exposition und Entsorgung von Upstaza, siehe Abschnitt 6.6.
Neurochirurgische Verabreichung
Upstaza ist eine Einzeldosis-Durchstechflasche und wird mittels bilateraler intraputaminaler Infusion während einer chirurgischen Sitzung in zwei Bereiche pro Putamen verabreicht. Vier separate Infusionen von gleichen Volumina werden in das rechte anteriore Putamen, rechte posteriore Putamen, linke anteriore Putamen und linke posteriore Putamen verabreicht.
Für Hinweise zur Vorbereitung der Infusion von Upstaza im Operationssaal, siehe Abschnitt 6.6.
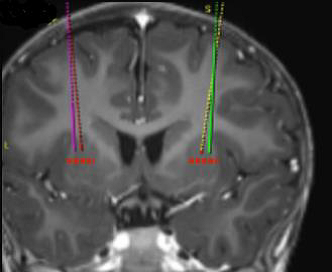
Die angestrebten Infusionsstellen werden gemäß der stereotaktischen neurochirurgischen Standardpraxis definiert. Upstaza wird als eine bilaterale Infusion (2 Infusionen pro Putamen) mit einer intrakraniellen Kanüle verabreicht. Die 4 endgültigen Ziele für jeden Zielkanal sind als 2 mm dorsal zu (über) den vorderen und hinteren Zielpunkten in der mittelhorizontalen Ebene zu definieren (Abbildung 1).
Abbildung 1 Die vier Zielpunkte für die Infusionsstellen
 |
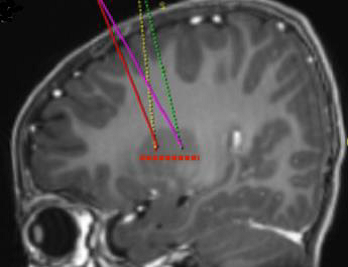 |
Nachdem die stereotaktische Registrierung abgeschlossen ist, wird der Eingangspunkt auf dem Schädel markiert. Es wird der chirurgische Zugang durch den Schädelknochen und die Dura durchgeführt.
Die Infusionskanüle wird mithilfe von stereotaktischen Instrumenten auf der Grundlage der geplanten Zielkanäle an den Zielpunkt im Putamen gesetzt. Es ist wichtig zu beachten, dass die Infusionskanüle für jedes Putamen getrennt gesetzt und die Infusion für jedes Putamen getrennt durchgeführt wird.
Upstaza wird bei einer Rate von 0,003 ml/min in jeden der 2 Zielpunkte jedes Putamens infundiert; pro putaminaler Infusionsstelle wird 0,08 ml Upstaza infundiert, bei insgesamt 4 Infusionen mit einem Gesamtvolumen von 0,320 ml (oder 1,8 × 1011 Vg).
Beginnend mit der ersten Zielstelle, wird die Kanüle durch ein Trepanationsloch in das Putamen eingeführt und dann langsam zurückgezogen. Dabei erfolgt die Verteilung von 0,08 ml Upstaza entlang des festgelegten Zielkanals zur Optimierung der Verteilung im Putamen.
Nach der ersten Infusion wird die Kanüle zurückgezogen und dann an den nächsten Zielpunkt gesetzt. Das gleiche Verfahren wird für die anderen 3 Zielpunkte (anteriorer und posteriorer Bereich jedes Putamens) wiederholt.
Nach den standardmäßigen neurochirurgischen Verschlussverfahren wird der Patient einer postoperativen Hirnbildgebung (Magnetresonanztomografie [MRT] oder Computertomografie [CT]) unterzogen, um sicherzustellen, dass keine Komplikationen (d. h. Blutungen) vorhanden sind.
Der Patient muss für mindestens 48 Stunden nach dem Eingriff in der Nähe des Krankenhauses verbleiben, in dem das Verfahren durchgeführt wurde. Nach dem Eingriff kann der Patient auf der Grundlage der Empfehlung des behandelnden Arztes nach Hause gehen. Die Versorgung nach der Behandlung sollte durch den Neurochirurgen und den überweisenden Neurologen erfolgen. Der Patient sollte für eine Nachbeobachtung 7 Tage nach der Operation erscheinen, um sicherzustellen, dass keine Komplikationen aufgetreten sind. 2 Wochen später (d. h. 3 Wochen nach der Operation) sollte ein zweiter Nachbeobachtungstermin zur Überwachung der postoperativen Erholung und des Auftretens von unerwünschten Ereignissen stattfinden.
Den Patienten wird angeboten, zur weiteren Beurteilung der langfristigen Sicherheit und Wirksamkeit der Behandlung unter normalen Bedingungen der klinischen Praxis in ein Register aufgenommen zu werden.
Überempfindlichkeit gegen den (die) Wirkstoff(e) oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei der Vorbereitung und Infusion von Upstaza müssen stets die angemessenen aseptischen Techniken eingehalten werden.
Überwachung
Patienten, die sich einer Gentherapie unterziehen, sollten im perioperativen Zeitraum engmaschig auf behandlungsbedingte Komplikationen, Komplikationen im Zusammenhang mit ihrer zugrunde liegenden Erkrankung und Risiken in Zusammenhang mit der Vollnarkose überwacht werden. Bei Patienten kann es möglicherweise infolge der Operation und der Narkose zu Verschlimmerungen der Symptome ihres zugrunde liegenden AADC-Mangels kommen (siehe Abschnitt 4.8).
Autonome und serotonerge Symptome von AADC können nach der Behandlung mit Eladocagene exuparvovec fortbestehen.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Immunogenität
Für Patienten mit Anti-AAV2-Antikörperspiegel > 1:50 vor der Behandlung sind keine Erfahrungen mit Eladocagene exuparvovec verfügbar.
Austritt zerebrospinaler Flüssigkeit
Zerebrospinale Flüssigkeit (ZSF) tritt aus, wenn ein Riss oder Loch in den Meningen, die das Gehirn oder Rückenmark umgeben, vorhanden ist, aus dem die ZSF entweichen kann. Upstaza wird mittels bilateraler intraputaminaler Infusion über Trepanationslöcher verabreicht. Daher kann es postoperativ zu einem ZSF-Austritt kommen. Patienten, die sich einer Behandlung mit Eladocagene exuparvovec unterziehen, sollten nach der Verabreichung sorgfältig auf einen ZSF-Austritt überwacht werden, insbesondere im Zusammenhang mit dem Risiko einer Meningitis und Enzephalitis.
Dyskinesie
Patienten mit AADC-Mangel haben möglicherweise aufgrund ihres chronischen Dopamin-Mangels eine erhöhte Empfindlichkeit gegenüber Dopamin. Nach der Behandlung mit Eladocagene exuparvovec wurde bei 26 von 30 Patienten Dyskinesie berichtet (siehe Abschnitt 4.8). Das Auftreten von Dyskinesie ist auf die Dopamin-Empfindlichkeit zurückzuführen, beginnt im Allgemeinen 1 Monat nach der Verabreichung der Gentherapie und klingt über mehrere Monate allmählich ab. Ereignisse von Dyskinesie wurden mit der routinemäßigen medizinischen Versorgung behandelt, etwa mit einer antidopaminergen Behandlung (z. B. Risperidon) (siehe Abschnitt 5.1).
Risiko einer viralen Freisetzung (Shedding)
Das Risiko einer Freisetzung wird als gering angesehen, da die systemische Verteilung von Eladocagene exuparvovec sehr begrenzt ist (siehe Abschnitt 5.2). Als Vorsichtsmaßnahme sollten die Patienten/Pflegepersonen darauf hingewiesen werden, Abfallmaterial, das aufgrund von Bandagen und/oder Sekreten (Tränen, Blut, Nasensekrete und ZSF) anfällt, ordnungsgemäß zu entsorgen. Dazu gehört die Lagerung von Abfallmaterial in versiegelten Beuteln vor der Entsorgung und das Tragen von Handschuhen beim Verbandwechsel und bei der Abfallentsorgung. Diese Vorsichtsmaßnahmen sollten für 14 Tage nach der Verabreichung von Eladocagene exuparvovec befolgt werden. Patienten/Pflegepersonen wird das Tragen von Handschuhen beim Verbandwechsel und bei der Abfallentsorgung empfohlen, besonders falls die Pflegeperson schwanger ist, stillt oder an einer Immundefizienz leidet.
Blut-, Organ-, Gewebe- und Zellspende
Mit Upstaza behandelte Patienten dürfen kein Blut, keine Organe, kein Gewebe und keine Zellen zur Transplantation spenden.
Natrium- und Kaliumgehalt
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h., es ist nahezu „natriumfrei“.
Dieses Arzneimittel enthält weniger als 1 mmol Kalium (39 mg) pro Dosis, d. h., es ist nahezu „kaliumfrei“.
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Aufgrund der sehr begrenzten systemischen Verteilung von Eladocagene exuparvovec werden keine Wechselwirkungen erwartet.
Impfungen
Es wurde von keiner Wechselwirkung zwischen den allgemeinen Impfungen und der Verabreichung einer Gentherapie berichtet. Die medizinische Fachkraft sollte entscheiden, ob Anpassungen des Impfplans des Patienten erforderlich sind.
Aufgrund des Fehlens einer systemischen Exposition und der vernachlässigbaren Biodistribution in den Gonaden, ist das Risiko für eine Keimbahnübertragung gering.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Eladocagene exuparvovec bei schwangeren Frauen vor. Es wurden keine tierexperimentelle Reproduktionsstudien mit Eladocagene exuparvovec durchgeführt (siehe Abschnitt 5.3).
Stillzeit
Es ist nicht bekannt, ob Eladocagene exuparvovec in die Muttermilch übergeht.
Eladocagene exuparvovec wird nach der intraputaminalen Verabreichung nicht systemisch resorbiert und es wird keine Wirkung auf gestillte Neugeborene/Säuglinge erwartet.
Fertilität
Es gibt keine klinischen oder nichtklinischen Daten zur Wirkung von Eladocagene exuparvovec auf die Fertilität.
Nicht zutreffend.
Zusammenfassung des Sicherheitsprofils
Die Sicherheitsinformationen wurden in 3 offenen klinischen Studien beobachtet, in denen Eladocagene exuparvovec 30 Patienten mit AADC-Mangel im Alter von 19 Monaten bis 8,5 Jahren zum Zeitpunkt der Dosierung verabreicht wurde. Die Patienten wurden für eine mediane Dauer von 59,3 Monaten (von einem Minimum von 11,8 Monaten bis zu einem Maximum von 5,7 Jahren) beobachtet. 26 Patienten, die in den klinischen Studien behandelt wurden, wurden in eine Langzeit-Nachbeobachtungsstudie aufgenommen. Die Dauer der Nachbeobachtung ab dem Zeitpunkt der Gentherapie reichte von 27,2 bis zu 126,5 Monaten (ungefähr 2 bis 10,5 Jahre).
Die häufigste Nebenwirkung war Dyskinesie; sie wurde bei 26 Patienten (86,7 %) berichtet und war während der ersten 2 Monate nach der Behandlung ausgeprägter.
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen sind in Tabelle 1 dargestellt. Die Nebenwirkungen werden nach Systemorganklasse und Häufigkeit folgendermaßen klassifiziert: sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gelegentlich (≥ 1/1.000 bis < 1/100), selten (≥ 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1 Nebenwirkungen, die bei ≥ 2 Patienten in 3 offenen klinischen Studien auftraten (n = 30)
Systemorganklasse |
Sehr häufig |
Häufig |
Stoffwechsel- und Ernährungsstörungen |
Ernährungsstörungen |
|
Psychiatrische Erkrankungen |
Einschlafstörungen |
Reizbarkeit |
Erkrankungen des Nervensystems |
Dyskinesie |
|
Erkrankungen des Gastrointestinaltraktes |
Hypersalivation |
Tabelle 2 Mit dem neurochirurgischen Eingriff assoziierte Nebenwirkungen, die bei ≥ 2 Patienten in 3 offenen klinischen Studien auftraten (n = 30)
Kategorie der Nebenwirkung |
Sehr häufig |
Erkrankungen des Blutes und des Lymphsystems |
Anämie |
Erkrankungen des Nervensystems |
Austritt zerebrospinaler Flüssigkeit a |
a Kann auch Pseudomeningozele umfassen
Tabelle 3 Mit der Narkose und postoperative assoziierte Nebenwirkungen, die bei ≥ 2 Patienten in 3 offenen klinischen Studien auftraten (n = 30)
Kategorie der Nebenwirkung |
Sehr häufig |
Häufig |
Infektionen und parasitäre Erkrankungen |
Pneumonie |
Gastroenteritis |
Stoffwechsel- und Ernährungsstörungen |
Hypokaliämie |
|
Psychiatrische Erkrankungen |
Reizbarkeit |
|
Erkrankungen des Nervensystems |
Dyskinesie |
|
Herzerkrankungen |
Zyanose |
|
Gefäßerkrankungen |
Hypotonie |
Hypovolämischer Schock |
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Ateminsuffizienz |
|
Erkrankungen des Gastrointestinaltrakts |
Blutung des oberen Gastrointestinaltrakts, Durchfall |
Mundulzeration |
Erkrankungen der Haut und des Unterhautzellgewebes |
Dekubitalgeschwür |
Windeldermatitis, Ausschlag |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Pyrexie |
Hypothermie |
Chirurgische und medizinische Eingriffe |
Zahnextraktion |
Beschreibung ausgewählter Nebenwirkungen
Dyskinesie
Dyskinesie-Ereignisse wurden bei 26 Patienten (86,7 %) berichtet (siehe Abschnitt 4.4). Von den 37 Dyskinesie-Ereignissen waren 35 Ereignisse leicht bis mittelschwer und 2 Ereignisse waren schwer. Die Mehrzahl der Ereignisse klang in etwa 2 Monaten ab, und innerhalb von 7 Monaten ab Symptombeginn klangen alle ab. Die mittlere Zeit bis zum Auftreten von Dyskinesie-Ereignissen betrug 25 Tage nach Erhalt der Gentherapie. Die Dyskinesie-Ereignisse konnten mit der routinemäßigen medizinischen Versorgung, wie antidopaminerge Therapie, behandelt werden.
Nach der Markteinführung wurden Dyskinesie-Ereignisse beobachtet, die erst nach mehr als 7 Monaten abklangen.
Immunogenität
Patienten mit Anti-AAV2-Antikörpertitern < 1:1200 wurde eine Teilnahme an den klinischen Studien gewährt. Jedoch hatten alle Patienten, die Eladocagene exuparvovec erhielten, vor der Behandlung Anti-AAV2-Antikörpertiter gleich oder kleiner als 1:50. Nach der Behandlung, waren die meisten Studienteilnehmer (n = 20) mindestens einmal innerhalb der ersten 12 Monate positiv für Anti-AAV2-Antikörper. Im Allgemeinen stabilisierte sich der Antikörperspiegel mit der Zeit oder er sank ab. Es gab kein bestimmtes Programm zur Nachbeobachtung, um mögliche Immunogenitätsreaktionen in den klinischen Studien zu erfassen. Das Vorhandensein von Anti‑AAV2-Antikörpern in den klinischen Studien war jedoch Berichten zufolge nicht mit einer Zunahme der Schwere, der Anzahl der Nebenwirkungen oder mit einer verminderten Wirksamkeit verbunden.
Es sind keine Erfahrungen mit Eladocagene exuparvovec bei Patienten mit einem Anti-AAV2-Antikörperspiegel > 1:50 vor der Behandlung verfügbar.
Die Immunantwort auf das Transgen und die zelluläre Immunantwort wurden nicht gemessen.
Austritt von Zerebrospinalflüssigkeit
Bei 3 Patienten, die in klinischen Studien Eladocagene exuparvovec erhielten, kam es zum Austritt von ZSF. Ein Patient meldete zwei getrennte Ereignisse als schwerwiegende unerwünschte Ereignisse, die möglicherweise mit dem chirurgischen Eingriff in Verbindung standen, während alle anderen Ereignisse nicht schwerwiegend waren.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
Belgien
Föderalagentur für Arzneimittel und Gesundheitsprodukte
www.afmps.be
Abteilung Vigilanz:
Website: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Luxemburg
Centre Régional de Pharmacovigilance de Nancy oder Abteilung Pharmazie und Medikamente (Division de la pharmacie et des médicaments) der Gesundheitsbehörde in Luxemburg
Website : www.guichet.lu/pharmakovigilanz
Deutschland
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
Italia
Agenzia Italiana del Farmaco
Sito web:
https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse
anzuzeigen.
Das Risiko einer Überdosierung ist aufgrund einer kontrollierten und neurochirurgischen Verabreichung unwahrscheinlich. Es gibt keine klinischen Erfahrungen mit einer Eladocagene exuparvovec-Überdosierung. Im Falle einer Überdosierung wird eine symptomatische und unterstützende Behandlung nach Ermessen des behandelnden Arztes empfohlen. Eine engmaschige Überwachung klinischer und Laborparameter (einschließlich großes Blutbild mit Differentialblutbild und umfassendes metabolisches Panel) in Bezug auf die systemische Immunantwort wird empfohlen. Für Anweisungen im Falle einer versehentlichen Exposition, siehe Abschnitt 6.6.
Pharmakotherapeutische Gruppe: Andere Mittel für das alimentäre System und den Stoffwechsel, Enzyme; ATC-Code: A16AB26
Wirkmechanismus
AADC-Mangel ist ein angeborener Fehler der Neurotransmitter-Biosynthese am Dopa-Decarboxylase(DDC)-Gen mit autosomal rezessiver Vererbung. Das DDC-Gen kodiert das AADC-Enzym, das L‑3,4‑Dihydroxyphenylalanin (L-DOPA) in Dopamin umwandelt. Mutationen am DDC-Gen führen zu einer Verringerung oder einem Ausbleiben der AADC-Enzymaktivität, was zu einer Verringerung der Konzentrationen von Dopamin führt und dazu, dass die meisten Patienten mit AADC-Mangel, Entwicklungsmeilensteine nicht erreichen.
Eladocagene exuparvovec ist eine Gentherapie auf der Grundlage eines rekombinanten AAV2-Vektors, der die humanen cDNA für das DDC-Gen enthält. Nach Infusion in das Putamen führt das Produkt zu einer Expression des AADC-Enzyms und einer nachfolgenden Dopamin-Produktion. Somit kommt es zu einer Entwicklung der motorischen Funktion bei behandelten Patienten mit AADC-Mangel.
Pharmakodynamische Wirkungen
Aufnahme von L‑6‑[18F] fluoro‑3,4‑Dihydroxyphenylalanin (18F‑DOPA) in das zentrale Nervensystem (ZNS)
Die Messung der Aufnahme von 18F‑DOPA in das Putamen mittels Positronen-Emissionstomografie (PET) nach der Behandlung ist eine objektive Messung der de novo Dopamin-Produktion im Gehirn und bewertet den Erfolg und die Stabilität der Transduktion des DDC-Gens im Laufe der Zeit. Die meisten Patienten zeigten leichte, anhaltende Anstiege der PET‑spezifischen Aufnahme. Ein Anstieg war bereits nach 6 Monaten sichtbar, setzte sich 12 Monate nach der Behandlung fort und konnte für mindestens 5 Jahre aufrecht erhalten werden.
Tabelle 4 Prozentuelle Veränderung der Aufnahme von 18F-DOPA nach der Behandlung mit Eladocagene exuparvovec gegenüber Baseline (Studien AADC-010 und AADC-011)
Zeitpunkt |
Monat 12 (n = 19) |
Monat 24 (n = 17) |
Monat 60 (n = 11) |
PET-spezifische Aufnahme |
220,3 |
261,39 |
287,88 |
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit der Gentherapie Upstaza wurde in 2 klinischen Studien (AADC‑010, AADC‑011) beurteilt. Diese 2 Studien umfassten zusammen 22 Patienten mit schwerem AADC-Mangel, diagnostiziert anhand einer Abnahme der Homovanillinsäure und 5‑Hydroxyindolessigsäure und einer Erhöhung des L-DOPA-ZSF-Spiegels, des Vorhandenseins einer DDC-Genmutation in beiden Allelen und des Vorhandenseins klinischer Symptome von AADC-Mangel (einschließlich Entwicklungsverzögerung, Hypotonie, Dystonie und okulogyre Krise [OGC]). Diese Patienten hatten bei Baseline keine Meilensteine in der motorischen Entwicklung erreicht, einschließlich der Fähigkeit zu sitzen, stehen oder gehen, was einem schweren Phänotyp entspricht. Die Patienten wurden mit einer Gesamtdosis von 1,8 × 1011 Vg (N = 13) oder 2,4 × 1011 Vg (N = 9) während eines einzigen operativen Eingriffes behandelt. Die Ergebnisse zur Wirksamkeit und Sicherheit waren ähnlich zwischen den 2 Dosen.
Die Daten nach den Zeitpunkten von Monat 60 und Monat 12 in Studie AADC‑010 bzw. Studie AADC‑011 wurden in der Langzeit-Nachbeobachtungsstudie AADC‑1602, wie unten angegeben, erhoben. Das Datum des Datenschnitts war der 16. Juni 2023.
Die Studie AADC-CU/1601 wurde mit einer Behandlung basierend auf einem älteren Herstellungsverfahren durchgeführt. In diese Studie wurde 8 Patienten aufgenommen, die ähnliche Ergebnisse mit dem Aufrechterhalten von einem Nutzen für bis zu 126,5 Monate zeigten.
Motorische Funktion
Das Erreichen von motorischen Meilensteinen wurde aus der Peabody Developmental Motor Scale, Version 2 (PDMS‑2) abgeleitet. Die PDMS‑2 ist eine Beurteilung der motorischen Entwicklung des Kindes bis zum Entwicklungsalter von 5 Jahren und bewertet sowohl die Grob- als auch die Feinmotorik, mit speziell auf das Erreichen motorischer Meilensteine bezogenen Aspekten. Die Aspekte der motorischen Fähigkeiten der PDMS‑2 wurden ausgewählt, um die Anzahl der Patienten zu bestimmen, die mindestens die folgenden motorischen Meilensteine erreichten (Beherrschung der Fähigkeit – Score von 2): 1) vollständige Kopfkontrolle (sitzt an der Hüfte gestützt und hält seinen/ihren Kopf in einer Linie, während er/sie den Kopf dreht, um einem Spielzeug 8 Sekunden lang zu folgen), 2) Sitzen ohne Unterstützung (sitzt ohne Unterstützung und hält das Gleichgewicht in der sitzenden Position für 60 Sekunden), 3) Stehen mit Unterstützung (macht mindestens 4 abwechselnde Schritte, entweder am Platz oder in einer Vorwärtsbewegung, wobei die Hand des Beurteilers auf dem Rumpf des Kindes liegt) und 4) Gehen mit Unterstützung (geht mindestens 8 Fuß [2,5 Meter] mit abwechselnden Schritten, wobei der Beurteiler sich seitlich des Patienten befindet und nur eine Hand des Kindes hält).
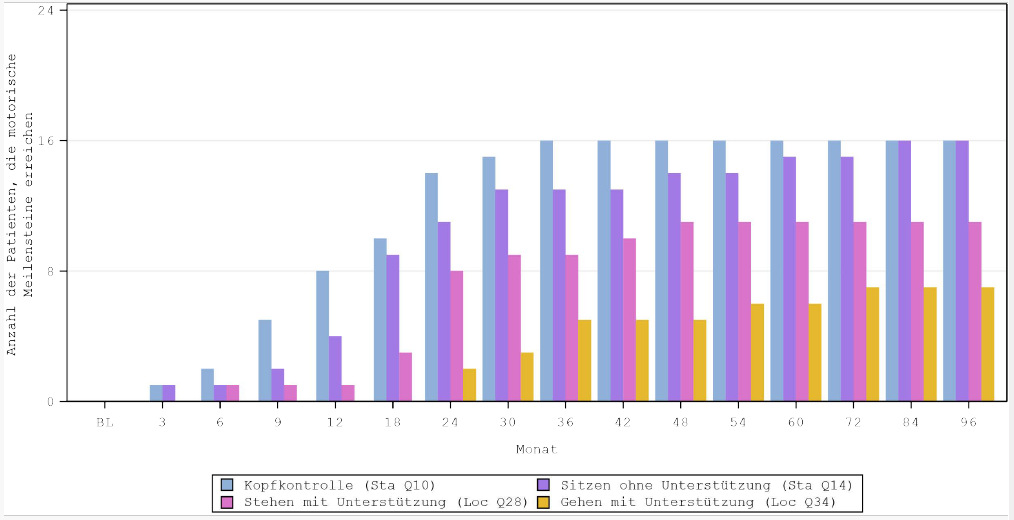
Tabelle 5 fasst die primäre Analyse zusammen, in der die Anzahl der Patienten bewertetwurde, bei denen das Erreichen der wesentlichen motorischen Meilensteine (Beherrschung der Fähigkeit) 24 Monate, 60 Monate und 96 Monate nach der Gentherapie nachgewiesen wurde.
Die Behandlung mit Eladocagene exuparvovec zeigte ein Erreichen motorischer Meilensteine schon 3 Monate nach dem chirurgischen Eingriff. Das Erreichen wesentlicher motorischer Meilensteine wurde über 24 Monate hinweg und bis zu 96 Monate fortgesetzt oder beibehalten, entsprechend einer 8-jährigen Nachbeobachtung (Abbildung 2).
Tabelle 5 Kumulative Anzahl der Patienten, die in Monat 24, Monat 60 und Monat 96 die motorischen Meilensteine von PDMS-2 erreichten (Beherrschung der Fähigkeit) (Studien AADC‑010, AADC‑011 und AADC‑1602; N = 22)
Motorischer Meilenstein / Monat |
Anzahl der Patienten (%) |
||
Monat 24 |
Monat 60 |
Monat 96 |
|
Vollständige Kopfkontrolle |
14 (64) |
16 (73) |
16 (73) |
Sitzen ohne Unterstützung |
11 (50) |
15 (68) |
16 (73) |
Stehen mit Unterstützung |
8 (36) |
11 (50) |
11 (50) |
Gehen mit Unterstützung |
2 (9) |
6 (27) |
7 (32) |
Abbildung 2 Kumulative Anzahl der Patienten mit nachgewiesenen motorischen Meilensteinen (Beherrschung der Fähigkeit) bis Monat 96 (Studien AADC‑010, AADC‑011 und AADC‑1602)
PDMS‑2-Gesamtscore
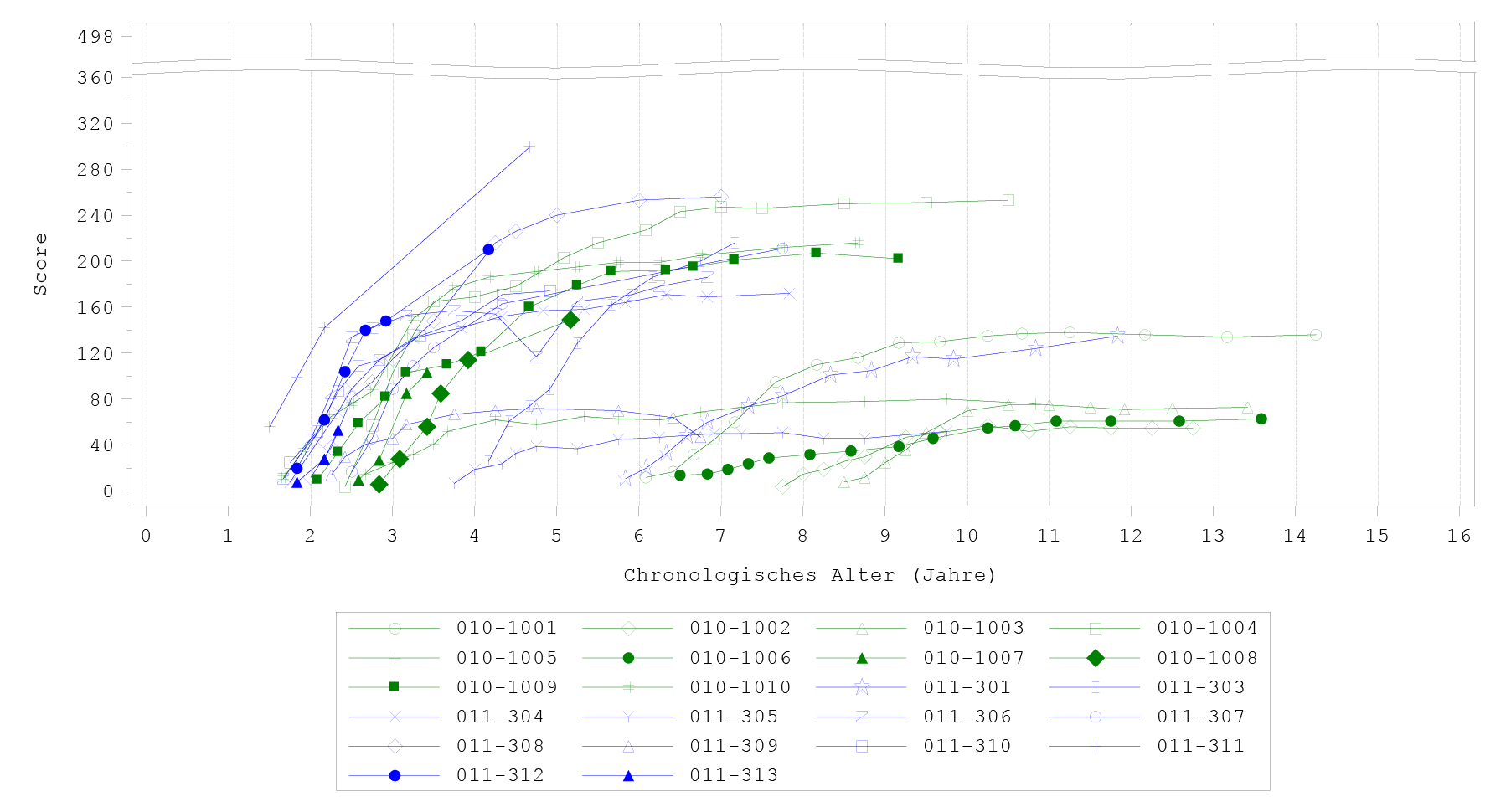
Der PDMS‑2-Gesamtscore wurde während den klinischen Studien als sekundärer Endpunkt gemessen. Die PDMS‑2‑Maximalscores lagen je nach Alter (< 12 Monate oder > 12 Monate) bei 450–482. Alle mit Eladocagene exuparvovec behandelten Patienten zeigten eine Zunahme der mittleren PDMS‑2-Gesamtscores im Laufe der Zeit im Vergleich zur Baseline, wobei bereits nach 3 Monaten ein Nutzen beobachtet werden konnte (Abbildung 3). Nach 24 Monaten betrug die Veränderung des Least-Square(LS)-Mittelwerts des PDMS‑2-Gesamtscores im Vergleich zur Baseline 111,2 Punkte. Die Verbesserung des PDMS‑2-Gesamtscores im Vergleich zur Baseline war bereits 12 Monate nach der Behandlung ersichtlich (77,6 Punkte) und hielt bis zu 60 Monate (139,0 Punkte) und 96 Monate (141,6) an. Patienten, die Eladocagene exuparvovec in jüngerem Alter erhielten, zeigen ein schnelleres Ansprechen auf die Behandlung und scheinen ein höheres Endniveau zu erreichen.
Abbildung 3 PDMS‑2-Gesamtscores nach Besuch – bis Monat 96 (Studien AADC‑010, AADC‑011 und AADC‑1602; N = 22)
Die folgenden Daten wurden in den klinischen Studien als sekundäre Endpunkte erfasst.
Kognitive und Kommunikationsfähigkeiten
Der Bayley-III, ein Standardinstrument zur Beurteilung von Kognition, Sprache und motorischer Entwicklung bei Säuglingen und Kleinkindern (Alter von 1–42 Monaten) wurde in den Studien AADC‑010 und AADC‑011 verwendet, um die kognitive und sprachliche Entwicklung zu untersuchen. Die Subskalen der sprachlichen Beurteilung umfassen die rezeptive und expressive Kommunikation.
Im Laufe der Zeit zeigten alle Patienten eine schrittweise und anhaltende Erhöhung des mittleren kognitiven Scores und des Gesamtscores für die Sprache, der ein kombinierter Score für die rezeptive und expressive Kommunikation ist. Der mittlere Gesamt-Rohscore der kognitiven Subskala bei der Baseline betrug 12,41 (N = 22). Die LS-Mittelwert-Veränderung des kognitiven Scores gegenüber Baseline zeigte eine Erhöhung von 12,3 in Monat 12 16,4 in Monat 24 und 23,6 in Monat 60. Der mittlere Gesamt-Rohscore der Sprache-Subskala bei der Baseline betrug 18,09 (N = 22). Die LS‑Mittelwert-Veränderung des Gesamtscores für die Sprache zeigte eine Erhöhung von 7,6 in Monat 12, 10,1 in Monat 24 und 14,9 in Monat 60.
Körpergewicht
18 von 19 Patienten (95 %) konnten ihr Körpergewicht über einen Zeitraum von 12 Monaten basierend auf der geschlechts- und altersspezifischen Wachstumstabelle entweder aufrechterhalten (47 %, 9 Patienten) oder an Körpergewicht zulegen (47 %, 9 Patienten).
Schlaffheit (Hypotonie), Dystonie der Gliedmaßen, reizinduzierten Dystonie
Nach der Gentherapie nahm der Prozentsatz der Patienten mit Symptomen der Schlaffheit (Hypotonie) von 80,0 % bei Basline (N = 20) auf 41,2 % in Monat 12 (N = 17) ab. Kein Patient hatte 12 Monate nach der Behandlung Dystonie der Gliedmaßen, im Vergleich zu 70,0 % der Patienten bei der Baseline (N = 20).
OGC-Episoden
Nach der Gentherapie nahm die Dauer von OGC-Episoden im Laufe der Zeit ab und blieb bis zu 12 Monate nach der Behandlung auf demselben Niveau. Die durchschnittliche Dauer einer OGC betrug 11,90 Stunden/Woche bei Baseline (N = 21). Diese wurde nach der Behandlung bis Monat 3 um 1,39 Stunden pro Woche (N = 19) und bis Monat 12 um 4,82 Stunden pro Woche (N = 6) verringert.
Das Ausmaß der Wirkung von Eladocagene exuparvovec auf die autonomen Symptome des AADC-Mangels wurde nicht systematisch evaluiert.
Außergewöhnliche Umstände
Dieses Arzneimittel wurde unter „Außergewöhnlichen Umständen“ zugelassen. Das bedeutet, dass es aufgrund der Seltenheit der Erkrankung nicht möglich war, vollständige Informationen zu diesem Arzneimittel zu erhalten. Die Europäische Arzneimittel-Agentur wird alle neuen Informationen, die verfügbar werden, jährlich bewerten, und falls erforderlich, wird die Zusammenfassung der Merkmale des Arzneimittels aktualisiert werden.
Es wurden keine pharmakokinetischen Studien mit Eladocagene exuparvovec durchgeführt. Eladocagene exuparvovec wird als Infusion direkt in das Gehirn verabreicht und es wurde keine Verteilung außerhalb des ZNS nachgewiesen.
Verteilung
Die Biodistribution des viralen AAV2‑hAADC-Vektors im Blut und Urin wurde bei den Teilnehmern mit einem validierten quantitativen Echtzeit-Polymerase-Kettenreaktionstest gemessen. Bei einem Patienten, der mit Eladocagene exuparvovec behandelt wurde, wurden sehr geringe Konzentrationen, weit unter den Behandlungskonzentrationen, in Monat 6 im Urin nachgewiesen.
Es wurden keine Tierstudien durchgeführt, um die Wirkungen von Eladocagene exuparvovec auf die Karzinogenese, Mutagenese oder Beeinträchtigung der Fertilität zu beurteilen. In Tierstudien wurden keine toxikologischen Wirkungen auf die männlichen oder weiblichen Fortpflanzungsorgane beobachtet.
Bei Ratten wurde bis zu 6 Monate nach bilateraler Infusion in das Putamen bei 21 Mal höheren Dosen als die therapeutische Dosis für Menschen auf Vg-pro-Gehirngewicht(g)-Basis keine Toxizität nachgewiesen.
Studien an Ratten zeigten keine Freisetzung von Viren ins Blut oder jegliches systemische Gewebe außerhalb des ZNS, mit Ausnahme der ZSF, für welche sich in der 6-monatigen Toxikologiestudie an Tag 7 ein positives Ergebnis ergab (Kopien/µg DNA). Bei der Untersuchung zu nachfolgenden Zeitpunkten (Tag 30, Tag 90 und Tag 180) waren alle Proben negativ.
Kaliumchlorid
Natriumchlorid
Kaliumdihydrogenphosphat
Dinatriumhydrogenphosphat
Poloxamer 188
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Ungeöffnete tiefgekühlte Durchstechflasche
5 Jahre
Nach dem Auftauen und Öffnen
Nach dem Auftauen darf das Arzneimittel nicht erneut eingefroren werden.
Die gefüllte Spritze, die unter aseptischen Bedingungen für die Abgabe an die Stätte des chirurgischen Eingriffs vorbereitet wurde, sollte sofort verwendet werden; falls sie nicht sofort verwendet wird, kann sie bei Raumtemperatur (unter 25 °C) aufbewahrt und innerhalb von 6 Stunden nach Beginn des Auftauens des Produkts verwendet werden.
Tiefgekühlt lagern und transportieren bei ≤ -65 °C.
Die Durchstechflasche im Umkarton aufbewahren.
Aufbewahrungsbedingungen nach dem Auftauen und Öffnen des Arzneimittels, siehe Abschnitt 6.3.
Durchstechflasche aus Typ I Borsilikatglas mit einem silikonisierten Chlorobutyl-Stopfen mit Beschichtung, versiegelt mit einer Aluminium-Plastikkappe.
Die Packungsgröße umfasst eine Durchstechflasche.
Jede Durchstechflasche ist nur für den einmaligen Gebrauch vorgesehen. Dieses Arzneimittel darf nur mit der ventrikulären SmartFlow-Kanüle infundiert werden.
Vorsichtsmaßnahmen vor/bei der Handhabung bzw. vor/während der Anwendung des Arzneimittels
Dieses Arzneimittel enthält gentechnisch verändertes Virus. Während der Vorbereitung, Verabreichung und Entsorgung sollte bei der Handhabung von Eladocagene exuparvovec und von Material, das in Kontakt mit der Lösung gekommen ist (Fest- und Flüssigabfall), persönliche Schutzausrüstung (einschließlich Labormantel, Sicherheitsbrille, Maske und Handschuhe) getragen werden.
Auftauen in der Krankenhausapotheke
Upstaza wird tiefgekühlt an die Apotheke geliefert und muss bis zur Vorbereitung für die Anwendung im Umkarton bei ≤ ‑65 ºC aufbewahrt werden.
Upstaza soll aseptisch unter sterilen Bedingungen gehandhabt werden.
Lassen Sie die tiefgekühlte Durchstechflasche von Upstaza aufrecht bei Raumtemperatur auftauen, bis der Inhalt vollständig aufgetaut ist. Die Durchstechflasche vorsichtig etwa 3 Mal umkehren, NICHT schütteln.
Überprüfen Sie Upstaza nach dem Mischen. Bei sichtbaren Partikeln, Trübung oder Verfärbung das Produkt nicht verwenden.
Vorbereitung vor der Verabreichung
Die Durchstechflasche, Spritze, Nadel, Spritzenkappe, die sterilen Beutel oder sterile Verpackungen gemäß dem Krankenhausverfahren zur Übertragung und Verwendung der gefüllten Spritze im Operationssaal zur biologischen Sicherheitswerkbank (Biological Safety Cabinet, BSC) bringen und kennzeichnen. Tragen Sie sterile Handschuhe und andere persönliche Schutzausrüstung (einschließlich Labormantel, Sicherheitsbrille und Maske) gemäß dem Standardverfahren für Arbeit an der BSC.
Die 1-ml- oder 5‑ml-Spritze [1 ml oder 5 ml, Polypropylen-Spritzen mit latexfreiem FluroTec-Kolben, geschmiert mit Silikonöl medizinischer Qualität] öffnen und als mit dem Produkt gefüllte Spritze, gemäß dem Apothekenverfahren und den lokalen Vorschriften, kennzeichnen.
Die 18‑ oder 19‑Gauge-Filterkanüle [18 oder 19 Gauge, 2,54 cm, Edelstahl, 5‑µm-Filternadeln] an die Spritze anschließen.
Das gesamte Volumen der Durchstechflasche von Upstaza in die Spritze ziehen. Durchstechflasche und Spritze umkehren und die Nadel etwas herausziehen oder den Winkel nach Bedarf anpassen, um die maximale Menge des Produkts in die Spritze aufzuziehen.
Etwas Luft in die Spritze ziehen, sodass kein Produkt mehr in der Nadel vorhanden ist. Die Nadel vorsichtig von der 1-ml- oder 5‑ml-Spritze mit Upstaza entfernen. Die Luft aus der Spritze entfernen, bis keine Luftblase mehr vorhanden ist, und eine Spritzenkappe aufsetzen.
Die Spritze in einen sterilen Kunststoffbeutel (oder mehrere Beutel, je nach Standardverfahren des Krankenhauses) geben und in einen geeigneten zweiten Transportbehälter (z. B. Hartplastik-Kühlbox) für die Auslieferung in den Operationssaal bei Raumtemperatur legen. Die Verwendung der Spritze (d. h. der Anschluss der Spritze an die Spritzenpumpe und das Vorfüllen der Kanüle) muss innerhalb von 6 Stunden nach Beginn des Auftauens des Produkts stattfinden.
Verabreichung im Operationssaal
Die Spritze mit Upstaza fest an die ventrikuläre SmartFlow-Kanüle anschließen.
Die Spritze mit Upstaza in eine Spritzeninfusionspumpe installieren, die kompatibel mit der 1‑ml- oder 5‑ml-Spritze ist. Upstaza mit der Infusionspumpe bei 0,003 ml/min pumpen, bis der erste Tropfen Upstaza an der Nadelspitze zu sehen ist und dann die Pumpe bis zum Beginn der Infusion anhalten.
Vorsichtsmaßnahmen für die Beseitigung des Arzneimittels oder bei einer versehentlichen Exposition
Eine versehentliche Exposition gegenüber Eladocagene exuparvovec, einschließlich des Kontakts mit der Haut, den Augen und den Schleimhäuten, muss vermieden werden.
Im Falle einer Exposition der Haut, muss der betroffene Bereich gründlich mit Seife und Wasser für mindestens 5 Minuten gewaschen werden. Im Falle einer Exposition der Augen, muss der betroffene Bereich gründlich für mindestens 5 Minuten mit Wasser gespült werden.
Im Falle einer Nadelstichverletzung, muss der betroffene Bereich gründlich mit Seife und Wasser und/oder einem Desinfektionsmittel gesäubert werden.
Sämtliches nicht verwendetes Eladocagene exuparvovec und Abfallmaterial muss in Übereinstimmung mit den lokalen Leitlinien für pharmakologische Abfälle entsorgt werden. Mögliche Verschüttungen müssen mit saugfähiger Gaze aufgewischt und die Flächen mit einem Bleichmittel desinfiziert und anschließend mit Alkoholtüchern abgewischt werden.
Nach der Verabreichung wird das Risiko einer Freisetzung als gering angesehen. Es wird empfohlen, dass Patienten und Pflegepersonen in die Vorsichtsmaßnahmen zur richtigen Handhabung von Körperflüssigkeiten des Patienten und Abfällen geschult werden und diese für 14 Tage nach der Verabreichung von Eladocagene exuparvovec befolgen (siehe Abschnitt 4.4).
PTC Therapeutics International Limited
70 Sir John Rogerson's Quay
Dublin 2
Irland
EU/1/22/1653/001
Datum der Erteilung der Zulassung: 18. Juli 2022
12.2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.