Ilumetri 100 mg Injektionslösung in einer Fertigspritze
Ilumetri 200 mg Injektionslösung in einer Fertigspritze
Ilumetri 100 mg Injektionslösung im Fertigpen
Ilumetri 200 mg Injektionslösung im Fertigpen
Ilumetri 100 mg Injektionslösung in einer Fertigspritze
Jede Fertigspritze enthält 100 mg Tildrakizumab in 1 ml Lösung.
Ilumetri 200 mg Injektionslösung in einer Fertigspritze
Jede Fertigspritze enthält 200 mg Tildrakizumab in 2 ml Lösung.
Ilumetri 100 mg Injektionslösung im Fertigpen
Jeder Fertigpen enthält 100 mg Tildrakizumab in 1 ml Lösung.
Ilumetri 200 mg Injektionslösung im Fertigpen
Jeder Fertigpen enthält 200 mg Tildrakizumab in 2 ml Lösung.
Tildrakizumab ist ein humanisierter, monoklonaler IgG1/κ-Antikörper, hergestellt in Ovarialzellen des chinesischen Hamsters (Chinese Hamster Ovary cells, CHO-Zellen) mittels rekombinanter DNA-Technologie.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Sonstiger Bestandteil mit bekannter Wirkung
Jede Ilumetri 100 mg Injektionslösung in einer Fertigspritze enthält 0,5 mg Polysorbat 80 (E 433).
Jede Ilumetri 200 mg Injektionslösung in einer Fertigspritze enthält 1,0 mg Polysorbat 80 (E 433).
Jede Ilumetri 100 mg Injektionslösung im Fertigpen enthält 0,5 mg Polysorbat 80 (E 433).
Jede Ilumetri 200 mg Injektionslösung im Fertigpen enthält 1 mg Polysorbat 80 (E 433).
Injektionslösung (Injektion)
Die Lösung ist klar bis leicht schillernd und farblos bis leicht gelblich. Die Lösung hat einen pH-Wert von 5,7 - 6,3 und eine Osmolalität zwischen 258 und 311 mOsm/kg.
Ilumetri ist angezeigt für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis, die für eine systemische Therapie in Frage kommen.
Dieses Arzneimittel ist zur Anwendung unter Anleitung und Aufsicht eines Arztes vorgesehen, der über Erfahrung in der Diagnose und Behandlung von Plaque-Psoriasis verfügt.
Dosierung
Die empfohlene Dosis beträgt 100 mg mittels subkutaner Injektion und wird in den Wochen 0 und 4 sowie danach alle 12 Wochen verabreicht.
Nach Ermessen des Arztes könnte bei Patienten mit hoher Krankheitslast oder bei Patienten mit einem Körpergewicht über 90 kg eine Dosis von 200 mg eine höhere Wirksamkeit aufweisen.
Bei Patienten, die nach 28 Behandlungswochen kein Ansprechen zeigen, sollte ein Absetzen der Behandlung in Erwägung gezogen werden. Bei einigen Patienten mit nur partiellem Ansprechen zu Beginn kann es im Verlauf bei Fortführung der Behandlung über 28 Wochen hinaus zu Verbesserungen kommen.
Verpasste Dosis
Wenn eine Dosis verpasst wurde, sollte die Dosis so bald wie möglich verabreicht werden. Anschließend sollte die Dosisverabreichung wieder in den regelmäßigen, geplanten Abständen erfolgen.
Besondere Patientengruppen
Ältere Patienten
Es ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2).
Eingeschränkte Nieren- oder Leberfunktion
Ilumetri wurde in diesen Patientenpopulationen nicht untersucht. Es können daher keine Dosisempfehlungen gegeben werden. Weitere Informationen zur Elimination von Tildrakizumab sind dem Abschnitt 5.2 zu entnehmen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Ilumetri bei Kindern und Jugendlichen unter 18 Jahren ist bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Dieses Arzneimittel wird als subkutane Injektion verabreicht. Die Injektionsstellen sollten variiert werden. Ilumetri sollte nicht in von Plaque-Psoriasis betroffene oder schmerzempfindliche, geprellte, rote, harte, dicke oder schuppige Hautbereiche injiziert werden. Die Spritze oder der Pen darf nicht geschüttelt werden. Jede Spritze beziehungsweise jeder Pen ist nur für den einmaligen Gebrauch vorgesehen.
Nach einer sachgemäßen Schulung zur subkutanen Injektionstechnik können sich Patienten Ilumetri selbst injizieren, wenn ein Arzt dies für angebracht hält. Der Arzt sollte jedoch entsprechende medizinische Nachkontrollen der Patienten sicherstellen. Die Patienten sind anzuweisen, die gesamte Menge an Tildrakizumab gemäß den Anweisungen in der Packungsbeilage zu injizieren. Ausführliche Anweisungen zur Verabreichung sind in der Packungsbeilage enthalten.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Klinisch relevante aktive Infektionen, z. B. aktive Tuberkulose (siehe Abschnitt 4.4).
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Infektionen
Tildrakizumab hat das Potenzial zur Erhöhung des Infektionsrisikos (siehe Abschnitt 4.8).
Bei Patienten mit einer chronischen Infektion, einer rezidivierenden Infektion in der Vorgeschichte oder einer kürzlich aufgetretenen schweren Infektion soll Tildrakizumab mit Vorsicht angewendet werden.
Die Patienten sollten angewiesen werden, ärztlichen Rat einzuholen, wenn Anzeichen oder Symptome auftreten, die auf eine klinisch relevante chronische oder akute Infektion hinweisen. Sollte es bei einem Patienten zu einer schwerwiegenden Infektion kommen, ist der Patient engmaschig zu beobachten und Tildrakizumab sollte bis zum Abklingen der Infektion nicht verabreicht werden (siehe Abschnitt 4.3).
Untersuchung auf Tuberkulose vor der Behandlung
Vor Beginn der Behandlung sollten Patienten auf eine Infektion mit Tuberkulose (TB) untersucht werden. Patienten, die Tildrakizumab erhalten, müssen während und nach der Behandlung auf Anzeichen und Symptome einer aktiven TB engmaschig überwacht werden. Bei Patienten mit einer früheren latenten oder aktiven TB, bei denen nicht bestätigt werden kann, dass sie eine adäquate Behandlung erhalten haben, sollte vor Behandlungsbeginn eine Anti-TB-Therapie in Erwägung gezogen werden.
Überempfindlichkeit
Im Falle des Auftretens einer schwerwiegenden Überempfindlichkeitsreaktion sollte die Anwendung von Tildrakizumab unverzüglich abgebrochen und eine geeignete Behandlung eingeleitet werden (siehe Abschnitt 4.3).
Impfungen
Vor dem Einleiten der Therapie mit Tildrakizumab sollte die Durchführung aller angebrachten Impfungen in Übereinstimmung mit den aktuellen Impfrichtlinien erwogen werden. Nach einer Verabreichung von Lebendimpfstoffen (viral oder bakteriell) wird empfohlen, mindestens 4 Wochen zu warten, bevor die Behandlung mit Tildrakizumab eingeleitet wird. Während und für mindestens 17 Wochen nach der Behandlung mit Tildrakizumab sollten die Patienten keine Lebendimpfstoffe erhalten (siehe Abschnitt 4.5).
Sonstige Bestandteile
Dieses Arzneimittel enthält 0,5 mg Polysorbat 80 (E 433) pro Fertigspritze oder Fertigpen mit 100 mg und 1 mg Polysorbat 80 (E 433) pro Fertigspritze oder Fertigpen mit 200 mg, entsprechend 0,5 mg/ml. Polysorbate können allergische Reaktionen hervorrufen.
Impfstoffe
Es liegen keine Daten bezüglich der Impfantwort auf Lebend- oder Totimpfstoffe vor. Lebendimpfstoffe sollen nicht gleichzeitig mit Tildrakizumab verabreicht werden (siehe Abschnitt 4.4).
Wechselwirkungen mit Cytochrom P450
Es ist nicht zu erwarten, dass Begleitmedikationen die Pharmakokinetik von Tildrakizumab beeinflussen, da Tildrakizumab durch allgemeine Proteinabbauprozesse ohne Beteiligung von Cytochrom-P450-Enzymen (CYP450-Enzymen) aus dem Körper ausgeschieden und nicht über renale oder hepatische Wege eliminiert wird. Darüber hinaus wirkt sich Tildrakizumab auch nicht auf die pharmakokinetischen Eigenschaften von Begleitmedikationen aus, die entweder direkt oder indirekt über CYP450-Enzyme verstoffwechselt werden (siehe Abschnitt 5.2).
Wechselwirkungen mit anderen Immunsuppressiva oder mit Phototherapie
Die Sicherheit und Wirksamkeit von Tildrakizumab in Kombination mit anderen Immunsuppressiva, einschließlich Biologika oder mit Phototherapie wurden nicht untersucht.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während und für mindestens 17 Wochen nach Behandlungsende eine zuverlässige Verhütungsmethode anwenden.
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen (weniger als 300 Schwangerschaftsausgänge) mit der Anwendung von Tildrakizumab bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3). Aus Vorsichtsgründen soll eine Anwendung von Ilumetri während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Tildrakizumab in die Muttermilch übergeht. Die verfügbaren toxikologischen Daten von Javaneraffen am postnatalen Tag 28 haben vernachlässigbare Ilumetri-Spiegel in der Milch gezeigt (siehe Abschnitt 5.3). Beim Menschen können in den ersten Tagen nach der Geburt Antikörper über die Milch auf das Neugeborene übertragen werden. Für diesen kurzen Zeitraum kann ein Risiko für die Neugeborenen/Kinder nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Ilumetri verzichtet werden soll / die Behandlung mit Ilumetri zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Die Wirkung von Ilumetri auf die menschliche Fertilität wurde nicht untersucht. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die Fertilität (siehe Abschnitt 5.3).
Ilumetri hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen sind Infektionen der oberen Atemwege (12,6 %), Kopfschmerzen (4,0 %), Diarrhö (1,6 %), Gastroenteritis (1,5 %), Rückenschmerzen (1,5 %), Übelkeit (1,3 %) und Schmerzen an der Injektionsstelle (1,3 %).
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen aus klinischen Studien (Tabelle 1) sind nach MedDRA-Systemorganklassen (SOC) und gemäß Häufigkeit aufgelistet, wobei die entsprechende Häufigkeitskategorie auf den folgenden Definitionen basiert: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000) sowie nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 1. Liste der Nebenwirkungen
MedDRA Systemorganklasse | Bevorzugter Begriff | Häufigkeitskategorie |
Infektionen und parasitäre Erkrankungen | Infektionen der oberen Atemwegea | Sehr häufig |
Erkrankungen des Nervensystems | Kopfschmerzen | Häufig |
Erkrankungen des Gastrointestinaltrakts | Gastroenteritis | Häufig |
Diarrhö | Häufig | |
Übelkeit | Häufig | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Rückenschmerzen | Häufig |
Schmerzen an der Injektionsstelle |
aEinschließlich Nasopharyngitis
Langzeitsicherheit
Das Sicherheitsprofil von Tildrakizumab, das im Zeitraum der Langzeitverlängerung beobachtet wurde, entsprach dem Sicherheitsprofil in den doppelblinden Zeiträumen von reSURFACE 1 und reSURFACE 2.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: +49 6103 77 0, Fax +49 6103 77 1234, Website: www.pei.de anzuzeigen.
In klinischen Studien wurden Dosen von bis zu 10 mg/kg intravenös sicher verabreicht.
Im Falle einer Überdosierung wird empfohlen, den Patienten auf Anzeichen oder Symptome von Nebenwirkungen hin zu überwachen und gegebenenfalls umgehend eine geeignete symptomatische Behandlung einzuleiten.
Pharmakotherapeutische Gruppe: Immunsuppressiva, Interleukin-Inhibitoren; ATC-Code: L04AC17
Wirkmechanismus
Tildrakizumab ist ein humanisierter, monoklonaler IgG1/κ-Antikörper, der spezifisch an die p19-Protein-Untereinheit des Zytokins Interleukin-23 (IL-23) bindet, ohne an IL-12 zu binden und dessen Interaktion mit dem IL-23-Rezeptor hemmt.
IL-23 ist ein natürlich vorkommendes Zytokin, das an Entzündungs- und Immunreaktionen beteiligt ist. Tildrakizumab hemmt die Freisetzung von proinflammatorischen Zytokinen und Chemokinen.
Klinische Wirksamkeit und Sicherheit
In die multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studien reSURFACE 1 und reSURFACE 2 wurden insgesamt 1.862 Patienten ab 18 Jahren mit Plaque-Psoriasis eingeschlossen; diese wiesen eine betroffene Körperoberfläche (Body Surface Area) von mindestens 10 % auf, einen Wert ≥ 3 bei der Gesamtbeurteilung durch den Arzt (Physician Global Assessment, PGA) im Bereich der allgemeinen Beurteilung der Psoriasis (Plaque-Dicke, Erythem, Schuppung) auf einer Schweregradskala von 0 bis 5 sowie einen Wert ≥ 12 auf dem Index zur Ausbreitung und Schwere der Psoriasis (Psoriasis Area and Severity Index, PASI) und eigneten sich für eine Phototherapie oder eine systemische Therapie.
In diesen Studien wurden die Patienten per Randomisierung für bis zu 52 bzw. 64 Wochen einer Behandlung entweder mit Placebo oder mit Tildrakizumab zugeteilt (200 mg bzw. 100 mg in den Wochen 0 und 4 sowie danach alle 12 Wochen [Q12W]). In der aktiven Vergleichsstudie (reSURFACE 2) erhielten die entsprechend randomisierten Patienten 12 Wochen lang 50 mg Etanercept zweimal wöchentlich und danach einmal wöchentlich bis zu Woche 28. Patienten, die nicht auf die Etanercept -Behandlung ansprachen (< 75 % PASI‑Reduktion gegenüber Baseline), wurden für bis zu 52 Wochen auf 200 mg Tildrakizumab Q12W umgestellt, während Patienten, die auf Etanercept ansprachen, aus der Studie ausgeschlossen wurden.
Geeignete Patienten, die die doppelblinden Zeiträume von reSURFACE 1 bzw. reSURFACE 2 mit einer ≥ 50%igen PASI‑Verbesserung gegenüber Baseline abschlossen, konnten an den offenen Verlängerungszeiträumen dieser Studien zur Beurteilung der langfristigen Sicherheit und Aufrechterhaltung der Wirksamkeit einer fortgesetzten Tildrakizumab-Behandlung teilnehmen. Patienten, die in die Verlängerungszeiträume von reSURFACE 1 und reSURFACE 2 eintraten, setzten die Behandlung mit derselben Dosis von Tildrakizumab, 100 mg bzw. 200 mg, die sie in Woche 64 bzw. Woche 52 erhielten, fort. Es stehen Nachbeobachtungsdaten von bis zu 6 Jahren zur Verfügung.
Die demografischen und Baseline-Merkmale waren zwischen den Studien reSURFACE 1 und reSURFACE 2 konsistent. Die Patienten waren zwischen 18 und 82 Jahre alt, mit einem Durchschnittsalter von 45,9 Jahren. Der mediane Baseline-PASI-Score lag in allen Behandlungsgruppen zwischen 17,7 und 18,4. Der Baseline-PGA-Score wurde bei 33,4 % der Patienten als „schwer“ eingestuft. 35,8 % aller Patienten hatten zur Behandlung der Plaque-Psoriasis zuvor eine Phototherapie erhalten, 41,1 % eine konventionelle systemische Therapie und 16,7 % eine Therapie mit Biologika. Insgesamt hatten 15,4 % der Studienpatienten Psoriasis-Arthritis in der Vorgeschichte. Der mittlere Baseline-DLQI (Dermatology Life Quality Index) lag zwischen 13,0 und 14,8.
Die Studien reSURFACE 1 und reSURFACE 2 untersuchten die Veränderungen von der Baseline bis Woche 12 hinsichtlich zweier ko-primärer Endpunkte: 1) PASI 75 und 2) PGA in der Höhe von „0“ (erscheinungsfrei) oder „1“ (nahezu erscheinungsfrei), mit einer Verbesserung im Vergleich zur Baseline um mindestens 2 Punkte. Weitere Auswertungen umfassten den Anteil der Patienten, die PASI 90 und PASI 100 erreichten, den Anteil der Patienten mit DLQI 0 oder 1 und die Aufrechterhaltung der Wirksamkeit über eine Dauer von bis zu 52/64 Wochen.
Die Ergebnisse in den Wochen 12, 28 und bis zu Woche 64 in reSURFACE 1 und bis zu Woche 52 in reSURFACE 2 sind in Tabelle 2 und 3 dargestellt.
Tabelle 2. Zusammenfassung der Ansprechraten in den Studien reSURFACE 1 und reSURFACE 2
Woche 12 (2 Dosen)* | Woche 28 (3 Dosen)* | |||||||
200 mg | 100 mg | Placebo | Etanercept | 200 mg | 100 mg | Etanercept | ||
reSURFACE1 | ||||||||
Anzahl Patienten | 308 | 309 | 154 | - | 298 | 299 | - | |
PASI 75a (%) | 62,3†b | 63,8†b | 5,8b | - | 81,9c | 80,4c | - | |
PGA-Score „erscheinungsfrei“ oder „fast erscheinungsfrei“ mit einer Verbesserung um ≥ 2 Stufen gegenüber Baselinea (%) | 59,1†b | 57,9†b | 7,1b | - | 69,1c | 66,0c | - | |
PASI 90 (%) | 35,4†b | 34,6†b | 2,6b | - | 59,0c | 51,6c | - | |
PASI 100 (%) | 14,0†b | 13,9†b | 1,3b | - | 31,5c | 23,5c | - | |
DLQI-Score 0 oder 1 (%) | 44,2† | 41,5† | 5,3 | - | 56,7c | 52,4c | - | |
reSURFACE2 | ||||||||
Anzahl Patienten | 314 | 307 | 156 | 313 | 299 | 294 | 289 | |
PASI 75a (%) | 65,6†‡b | 61,2†‡b | 5,8b | 48,2b | 72,6‡b | 73,5‡b | 53,6b | |
PGA-Score „erscheinungsfrei“ oder „fast erscheinungsfrei“ mit einer Verbesserung um ≥ 2 Stufen gegenüber Baselinea (%) | 59,2†¥b | 54,7†b | 4,5b | 47,6b | 69,2‡b | 64,6‡b | 45,3b | |
PASI 90 (%) | 36,6†‡b | 38,8†‡b | 1,3b | 21,4b | 57,7‡c | 55,5‡c | 29,4c | |
PASI 100 (%) | 11,8†‡b | 12,4†‡b | 0 | 4,8b | 27,0‡c | 22,8‡c | 10,7c | |
DLQI-Score 0 oder 1 (%) | 47,4†¥ | 40,2† | 8,0 | 35,5 | 65,0‡c | 54,1‡c | 39,4c | |
a Ko-primärer Wirksamkeitsendpunkt in Woche 12.
b Patienten mit fehlenden Daten wurden als Non-Responder gewertet.
c Keine Imputation für fehlende Daten.
* Die Anzahl der verabreichten Dosen bezieht sich nur auf die Tildrakizumab-Gruppen.
n = Anzahl der Patienten im Full-Analysis-Set, für die Daten nach einer Imputation, sofern zutreffend, vorlagen.
Die Errechnung der p-Werte erfolgte mittels Cochran-Mantel-Haenszel-Test (CMH-Test), stratifiziert nach Körpergewicht (≤ 90 kg, > 90 kg) und erhaltener Biologika-Therapie gegen Psoriasis (ja/nein).
† p ≤ 0,001 vs. Placebo; ‡ p ≤ 0,001 vs. Etanercept; ¥ p ≤ 0,05 vs. Etanercept.
Aufrechterhaltung des Ansprechens
Die Aufrechterhaltung des Ansprechens in den Studien reSURFACE 1 und reSURFACE 2 sind in Tabelle 3 dargestellt. Aufrechterhaltung und Dauerhaftigkeit des PASI-90-Ansprechens im Zeitverlauf sind in Abbildung 1 dargestellt.
Tabelle 3. Aufrechterhaltung des Ansprechens in den Studien reSURFACE 1 und reSURFACE 2
Langzeit-Ansprechena,b | ||||
200 mg | 100 mg | |||
reSURFACE 1 | Woche 28 | Woche 64 | Woche 28 | Woche 64 |
Anzahl Patienten | 116 | 114 | 115 | 112 |
PGA-Score „erscheinungsfrei“ oder „fast erscheinungsfrei“ mit einer Verbesserung um ≥ 2 Stufen gegenüber Baseline (%) | 80,2 | 76,3 | 80,9 | 61,6 |
PASI 90 (%) | 70,7 | 74,6 | 65,2 | 58,0 |
PASI 100 (%) | 38,8 | 40,4 | 25,2 | 32,1 |
reSURFACE 2 | Woche 28 | Woche 52 | Woche 28 | Woche 52 |
Anzahl Patienten | 108 | 105 | 213 | 204 |
PGA-Score „erscheinungsfrei“ oder „fast erscheinungsfrei“ mit einer Verbesserung um ≥ 2 Stufen gegenüber Baseline (%) | 88,0 | 84,8 | 84,0 | 79,4 |
PASI 90 (%) | 75,0 | 81,9 | 74,2 | 78,4 |
PASI 100 (%) | 34,3 | 46,7 | 30,2 | 35,3 |
a Langzeit-Ansprechen bei Patienten, die in Woche 28 auf Tildrakizumab ansprachen (mindestens PASI 75).
b Keine Imputation für fehlende Daten.
Abbildung 1. Aufrechterhaltung und Dauerhaftigkeit des PASI-90-Ansprechens. Anteil der Patienten mit einem PASI-90-Ansprechen im Zeitverlauf bis Woche 64 (Full-Analysis-Set Teil 3*)
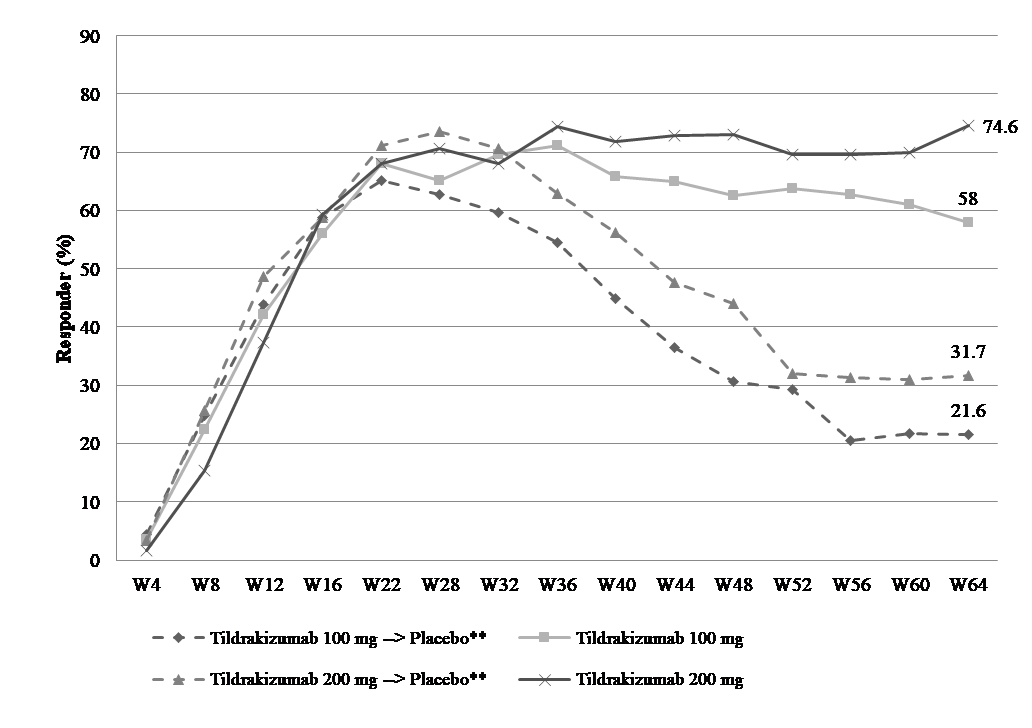
Patienten, die in Teil 1 zu 100 mg Tildrakizumab oder 200 mg Tildrakizumab randomisiert und in Woche 28 PASI-75-Responder waren (reSURFACE 1).
*Keine Imputation für fehlende Daten.
** Diese Patienten wurden in Woche 28 auf Placebo umgestellt.
Von den Patienten, die den doppelblinden Zeitraum abschlossen, traten 506 (79 %) in reSURFACE 1 und 730 (97 %) in reSURFACE 2 in den Verlängerungszeitraum ein. Von den Patienten mit einem PASI‑90‑Ansprechen am Ende des doppelblinden Zeitraums der Studien blieb das PASI‑90‑Ansprechen bei mindestens 76 % der Patienten im Verlängerungszeitraum erhalten, in dem die Behandlung mit Tildrakizumab 100 mg bzw. 200 mg über einen Zeitraum von 192 Wochen fortgesetzt wurde (Abbildung 2 und Abbildung 3).
Abbildung 2. Prozentualer Anteil der Patienten mit Aufrechterhaltung eines PASI‑90-Ansprechens in der offenen Verlängerung von reSURFACE 1 nach Besuch (Full-Analysis-Set, Verlängerungszeitraum*)
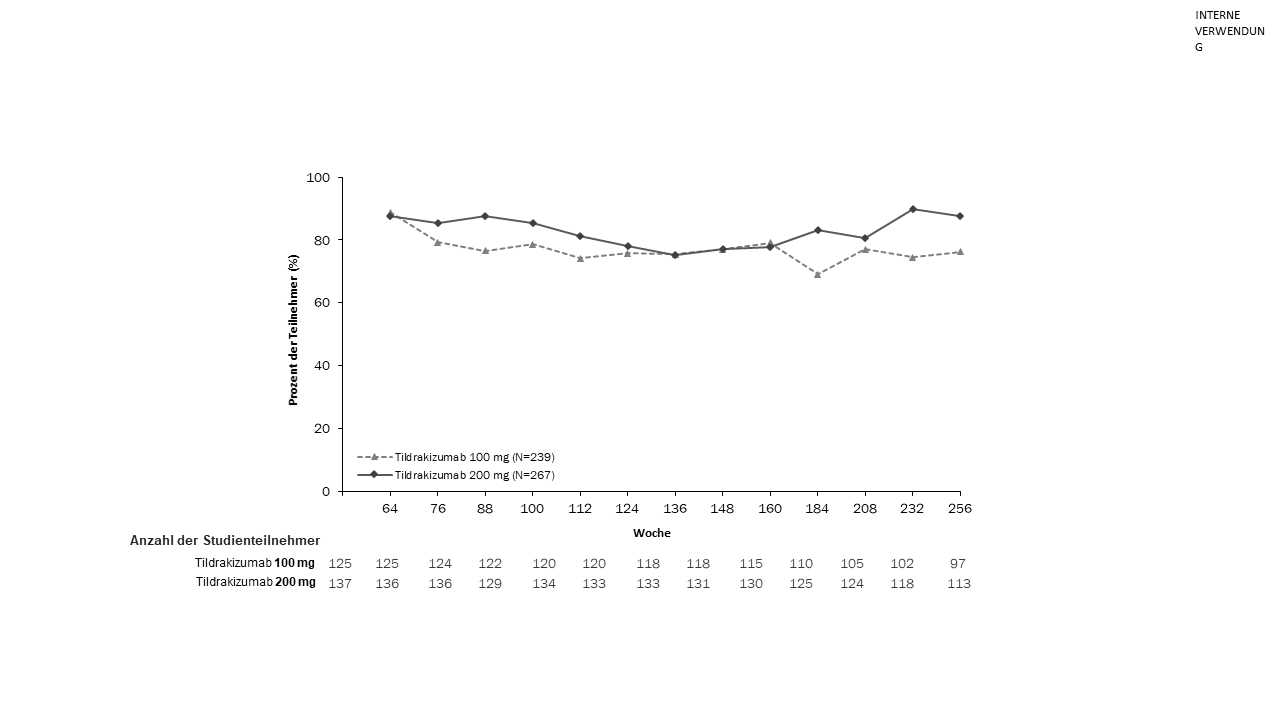
*Von den PASI‑90‑Respondern am Ende des doppelblinden Studienzeitraums. Keine Imputation für fehlende Daten.
Hinweis: Die Besuchswoche ist nominal, da die Studienteilnehmer ab Woche 64 ein Zeitfenster von bis zu etwa 12 Wochen hatten, um mit der Verlängerung zu beginnen.
Abbildung 3. Prozentualer Anteil der Patienten mit Aufrechterhaltung eines PASI‑90-Ansprechens in der offenen Verlängerung von reSURFACE 2 nach Besuch (Full-Analysis-Set, Verlängerungszeitraum*)
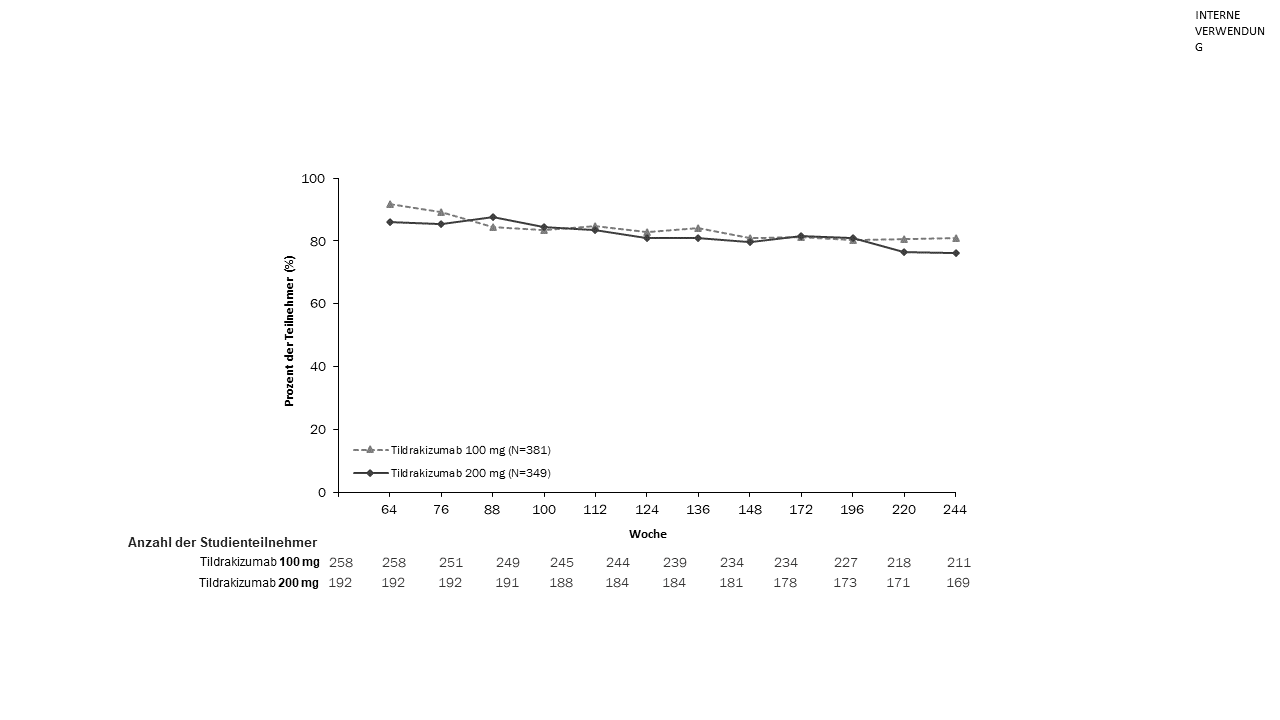
*Von den PASI‑90‑Respondern am Ende des doppelblinden Studienzeitraums. Keine Imputation für fehlende Daten.
Lebensqualität/Ergebnisse nach Patientenangaben
In Woche 12 war Tildrakizumab in allen Studien gemäß DLQI mit einer statistisch signifikanten Verbesserung der gesundheitsbezogenen Lebensqualität assoziiert (Tabelle 2). Diese Verbesserung blieb im Zeitverlauf bis Woche 52 bei 63,7 % (100 mg) und 73,3 % (200 mg) der Patienten in reSURFACE 1 bzw. bei 68,8 % (100 mg) und bei 72,4 % (200 mg) der Patienten in reSURFACE 2 erhalten, die in Woche 28 PASI-75-Responder gewesen waren und einen DLQI-Score in der Höhe von 0 oder 1 aufgewiesen hatten.
Plaque-Psoriasis der Kopfhaut
In einer randomisierten, placebokontrollierten Studie wurden die Wirksamkeit und Sicherheit von Tildrakizumab bei 231 Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis der Kopfhaut, definiert als ein Score in der modifizierten (mod) Gesamtbeurteilung durch den Arzt (Physician Global Assessment, PGA) in Bezug auf die Kopfhaut aus dem Jahr 2011 von ≥ 3, ein Score im Index zur Schwere der Psoriasis der Kopfhaut (Psoriasis Scalp Severity Index, PSSI) von ≥ 12 und ein betroffener Bereich der Kopfhautoberfläche (Scalp Surface Area, SSA) von ≥ 30 % zur Baseline, untersucht. In Woche 16 war die Behandlung mit Tildrakizumab im Vergleich zu Placebo mit einer statistisch signifikanten Verbesserung in Bezug auf die beiden Endpunkte PGA mod 2011 mit 0 oder 1 betroffenem Bereich der Kopfhautoberfläche (49 % versus 7 %) und PSSI 90 (56 % versus 4 %) assoziiert. Diese Effekte blieben bei Patienten erhalten, die die Behandlung mit Tildrakizumab bis Woche 52 fortsetzten.
Immunogenität
Gemäß den gepoolten Phase-IIb- und Phase-III-Analysen bildeten 7,3 % der mit Tildrakizumab behandelten Patienten bis Woche 64 Antikörper gegen Tildrakizumab. Von den Patienten, die Antikörper gegen Tildrakizumab entwickelten, hatten 38 % (22 von 57 Patienten) neutralisierende Antikörper. Dies entspricht 2,8 % aller Patienten, die Tildrakizumab erhielten.
Gemäß den gepoolten Phase-III-Analysen bildeten 8,3 % der mit Tildrakizumab behandelten Patienten bis Behandlungswoche 420 Antikörper gegen Tildrakizumab. Von den mit Tildrakizumab behandelten Patienten, die Antikörper gegen Tildrakizumab entwickelten, hatten 35 % (36 von 102 Patienten) Antikörper, die als neutralisierend eingestuft wurden. Dies entspricht 2,9 % aller Patienten, die mit Tildrakizumab behandelt wurden.
Die Entwicklung von neutralisierenden Antikörpern gegen Tildrakizumab war mit einer geringeren Konzentration von Tildrakizumab im Serum verbunden.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Ilumetri eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen zur Behandlung der Plaque-Psoriasis gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Resorption
Die subkutane Formulierung von Tildrakizumab zeigte eine absolute Bioverfügbarkeit im Bereich von 73 % (90 % KI: 46 % – 115 %, 200 mg subkutan versus 3 mg/kg intravenös) bis 80 % (90 % KI: 62 % – 103 %, 50 mg subkutan versus 0,5 mg/kg intravenös) als Ergebnis einer cross-over Einzeldosis-Vergleichsstudie bei gesunden Erwachsenen. Die maximale Konzentration wurde 6,2 Tage nach der Injektion erreicht. Populationsbezogene pharmakokinetische Analysen zeigten eine 31 % höhere Bioverfügbarkeit bei gesunden Erwachsenen als bei Patienten.
Im Steady-State nach Gabe von 100 mg Tildrakizumab an Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis betrugen die geometrischen Mittel (% Variationskoeffizient [%CV]) der AUC0-τ und Cmax-Werte 305 µg/ml (41 %) bzw. 8.1 μg/ml (34 %) pro Tag, wohingegen sie nach Gabe von 200 mg bei 612 µg/ml (40 %) bzw. bei 16,3 µg/ml (33 %) pro Tag lagen.
Verteilung
Tildrakizumab weist eine begrenzte extravaskuläre Verteilung mit einem Verteilungsvolumen (Vd) von 76,9 bis 106 ml/kg auf.
Biotransformation
Tildrakizumab wird durch katabole Abbauprozesse zu Aminosäurebestandteilen abgebaut. Die Stoffwechselwege kleiner Moleküle (z. B. über CYP450-Enzyme, Glucuronosyltransferasen) tragen nicht zum Abbau bei.
Elimination
Die Clearance-Werte lagen bei Patienten mit Plaque-Psoriasis im Bereich zwischen 2,04 und 2,52 ml/Tag/kg und die Halbwertszeit bei 23,4 Tagen (23 % CV).
Linearität/Nicht-Linearität
Nach subkutaner Verabreichung wies Tildrakizumab bei Patienten mit Plaque-Psoriasis eine dosisproportionale Pharmakokinetik im Dosierungsbereich zwischen 50 mg bis 400 mg auf, wobei die Clearance dosisunabhängig war.
Der Steady-State wird mit dem klinischen Behandlungsschema – Wochen 0 und 4 sowie danach alle 12 Wochen – nach 16 Wochen erreicht, wobei es zwischen Woche 1 und Woche 12 zu einer 1,1‑fachen dosisunabhängigen Akkumulation der Exposition kommt.
Pharmakokinetik bei besonderen Patientengruppen
Ältere Patienten
Die populationsbezogene pharmakokinetische Analyse zeigte, dass das Alter keinen klinisch signifikanten Einfluss auf die Clearance von Tildrakizumab bei erwachsenen Patienten mit Plaque-Psoriasis hat. Nach einer Verabreichung von 100 mg oder 200 mg Tildrakizumab wiesen Patienten ab einem Alter von 65 Jahren (n = 81 bzw. n = 82) eine ähnliche Clearance wie Patienten unter 65 Jahren auf (n = 884).
Eingeschränkte Nieren- und Leberfunktion
Es wurde keine formale Studie über die Auswirkung einer eingeschränkten Nieren- oder Leberfunktion auf die Pharmakokinetik von Tildrakizumab durchgeführt. Tildrakizumab wird über katabole Abbauprozesse in Aminosäurebestandteile zerlegt und nicht über die Nieren oder die Leber eliminiert.
Körpergewicht
Populationsbezogene pharmakokinetische Modelle zeigten, dass mit zunehmendem Körpergewicht die Exposition abnahm. Bei erwachsenen Patienten mit einem Körpergewicht von > 90 kg war das vorausgesagte geometrische Mittel der Exposition (AUC0-τ im Steady-State) nach einer subkutanen Dosis von 100 mg oder 200 mg etwa 30 % niedriger als bei erwachsenen Patienten mit einem Körpergewicht von ≤ 90 kg (siehe Abschnitt 4.2).
Arzneimittelwechselwirkungen
Die Ergebnisse einer Studie zu Arzneimittelwechselwirkungen, die mit Plaque-Psoriasis-Patienten durchgeführt wurde, lassen darauf schließen, dass Tildrakizumab keine klinisch relevante Auswirkung auf CYP1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A4 hat. Daher hat Tildrakizumab keinen Einfluss auf die Pharmakokinetik von Begleitmedikationen, die durch diese CYP-Enzyme verstoffwechselt werden (siehe Abschnitt 4.5).
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und Toxizität bei wiederholter Gabe lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Studien zur Mutagenität und Karzinogenität bei Tieren wurden mit Tildrakizumab nicht durchgeführt. Studien an Maustumormodellen zeigten, dass eine selektive Hemmung von IL-23p19 das karzinogene Risiko nicht erhöht.
Bei Javaneraffen zeigte sich eine zu vernachlässigende Sekretion des Produkts in die Muttermilch. Einen Monat nach der Geburt lag das Milch/Serum-Verhältnis bei ≤ 0,002. Tildrakizumab überwindet nachweislich die Plazentaschranke. Nach einer wiederholten Dosisverabreichung an trächtige Javaneraffen waren Serumkonzentrationen im Fötus nachweisbar, aber Studien zur Reproduktionstoxizität wiesen keine nachteiligen Effekte auf.
Bei männlichen und weiblichen Javaneraffen, die Tildrakizumab in Dosen verabreicht bekamen, die mehr als dem 100‑fachen Wert der humanen Exposition gemäß der empfohlenen klinischen Dosis auf Basis des AUC-Werts entsprachen, wurde keine Auswirkung auf Fertilitätsparameter wie Reproduktionsorgane, Menstruationszykluslänge und/oder Hormone beobachtet.
In einer Studie zur prä- und postnatalen Entwicklungstoxizität bei Affen wurden bei Dosen, die einer bis zu 85‑fachen humanen Exposition gemäß der empfohlenen Dosis entsprachen, keine damit in Zusammenhang stehenden Schwangerschaftsabgänge beobachtet. Bei Neugeborenen, deren Mütter ein bis zu 9-Faches der für Menschen empfohlenen Dosis erhalten hatten, wurden keine schädlichen Wirkungen bemerkt. Zwei Todesfälle bei neugeborenen Affen, deren Mütter die 85‑fache der für Menschen empfohlenen Dosis Tildrakizumab erhalten hatten, wurden auf eine mögliche Virusinfektion zurückgeführt und ihr Zusammenhang mit der Behandlung als unsicher eingestuft. Die klinische Signifikanz dieser Ergebnisse ist nicht bekannt.
Histidin
Histidinhydrochlorid-Monohydrat
Polysorbat 80 (E 433)
Saccharose
Wasser für Injektionszwecke
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
3 Jahre
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
Eine ungeöffnete Spritze beziehungsweise ein ungeöffneter Pen kann nach Entnahme aus dem Kühlschrank einmalig über einen Zeitraum von bis zu 30 Tagen bei bis zu 25 °C aufbewahrt werden. Sobald die Entnahme aus dem Kühlschrank und die Aufbewahrung unter diesen Bedingungen erfolgt ist, muss die Spritze/der Pen nach 30 Tagen oder bei dem auf dem Behältnis angegebenen Verfalldatum entsorgt werden, je nachdem was zuerst eintritt. Ein Feld zur Erfassung des Datums vom Zeitpunkt der Entnahme aus dem Kühlschrank befindet sich auf dem Karton.
Im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht schütteln.
Ilumetri 100 mg Injektionslösung in einer Fertigspritze
1 ml Lösung in einer Fertigspritze aus Glas vom Typ I mit einer Edelstahlnadel der Größe 29G x ½”, mit Nadelhülle und einer starren Nadelschutzkappe aus Polypropylen mit einem Fluorpolymer-beschichteten Stopfen in einer passiven Sicherheitsvorrichtung.
Jede Packung enthält 1 oder 2 Fertigspritze(n).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht
Ilumetri 200 mg Injektionslösung in einer Fertigspritze
2 ml Lösung in einer Fertigspritze aus Glas vom Typ I mit einer Edelstahlnadel der Größe 27G x ½”, mit Nadelhülle und einer starren Nadelschutzkappe aus Polypropylen mit einem Fluorpolymer-beschichteten Stopfen in einer passiven Sicherheitsvorrichtung.
Jede Packung enthält 1 Fertigspritze.
Ilumetri 100 mg Injektionslösung im Fertigpen
1-ml-Fertigspritze, bestehend aus einem Spritzenkörper aus Glas vom Typ I mit einer eingesetzten Nadel und einer starren Nadelschutzkappe sowie einem sterilen, gebrauchsfertigen Kolbenstopfen.
Jede Packung enthält 1 Fertigpen.
Ilumetri 200 mg Injektionslösung im Fertigpen
2-ml-Fertigspritze, bestehend aus einem Spritzenkörper aus Glas vom Typ I mit einer eingesetzten Nadel und einer starren Nadelschutzkappe sowie einem sterilen, gebrauchsfertigen Kolbenstopfen.
Jede Packung enthält 1 Fertigpen.
Ilumetri ist eine sterile Injektionslösung in einer Fertigspritze oder einem Fertigpen. Die Spritzen und Pens sind nur für den einmaligen Gebrauch bestimmt.
Nicht schütteln oder einfrieren. Die 100-mg- und die 200-mg-Spritze beziehungsweise der 100-mg-Pen sollte 30 Minuten vor der Injektion aus dem Kühlschrank genommen werden, damit sie/er Raumtemperatur (bis zu 25 °C) annimmt. Der 200-mg-Pen sollte 45 Minuten vor der Injektion aus dem Kühlschrank genommen werden, damit er Raumtemperatur (bis zu 25 °C) annimmt.
Vor der Anwendung der Spritze/des Pens wird empfohlen, diese(n) visuell zu prüfen. Möglicherweise ist eine kleine Luftblase zu sehen; das ist normal. Nicht verwenden, wenn die Flüssigkeit sichtbare Partikel enthält, trübe erscheint oder bräunlich verfärbt ist.
Die in der Packungsbeilage enthaltene Gebrauchsanleitung ist sorgfältig zu befolgen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Almirall, S.A.
Ronda General Mitre, 151
08022 Barcelona
Spanien
EU/1/18/1323/001
EU/1/18/1323/002
EU/1/18/1323/003
EU/1/18/1323/004
EU/1/18/1323/005
Datum der Erteilung der Zulassung: 17. September 2018
Datum der letzten Verlängerung der Zulassung: 24. Juli 2023
06/2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu/ verfügbar.
Verschreibungspflichtig
Almirall Hermal GmbH
Scholtzstraße 3
D-21465 Reinbek
Tel: (040) 7 27 04-0
Fax: (040) 7 27 04-329
info@almirall.de