Emcitate 350 Mikrogramm Tabletten zur Herstellung einer Suspension zum Einnehmen
Jede Tablette enthält 350 Mikrogramm Tiratricol.
Sonstiger Bestandteil mit bekannter Wirkung
Jede Tablette enthält 19 mg Lactose (entspricht 20 mg Lactose-Monohydrat).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Tablette zur Herstellung einer Suspension zum Einnehmen
Weiße, längliche Tablette (Größe: 10 mm lang, 5 mm breit) mit Bruchkerben auf beiden Seiten.
Die Tablette kann in gleiche Dosen geteilt werden.
Emcitate ist für die Behandlung der peripheren Thyreotoxikose bei Patienten mit Mangel an Monocarboxylat-Transporter 8 (MCT8)(Allan-Herndon-Dudley-Syndrom) ab der Geburt indiziert.
Die Behandlung sollte von Ärzten eingeleitet und überwacht werden, die Erfahrung in der Behandlung von Patienten mit seltenen genetischen Erkrankungen wie MCT8-Mangel haben.
Dosierung
Die Dosierung von Emcitate sollte bei jedem Patienten auf der Grundlage der Schilddrüsenhormonspiegel titriert werden.
Die Dosis sollte während einer Titrationsphase schrittweise etwa alle zwei Wochen erhöht werden, bis eine Erhaltungsdosis erreicht ist. Generell wird empfohlen, die Dosis so lange zu titrieren, bis der T3-Wert im Serum unter dem Mittelwert des Normalbereichs für das jeweilige Alter liegt. Die Dosis kann je nach Ansprechen des Patienten auf die Behandlung (Verbesserung klinischer Parameter)weiter angepasst werden.
Die Notwendigkeit weiterer Dosisanpassungen sollte in Übereinstimmung mit der klinischen Praxis regelmäßig neu bewertet werden (siehe Abschnitt 4.4).
Die TSH- und fT4-Werte können zusätzliche Informationen liefern, um die individuelle Dosierung einzustellen.
Erwachsene, Jugendliche, Kinder und Kleinkinder mit einem Körpergewicht von 10 kg oder mehr
Dosistitration und Dosisanpassung
Die empfohlene Anfangsdosis für Patienten mit einem Körpergewicht von 10 kg oder mehr beträgt 350 Mikrogramm täglich.
Ein empfohlenes Schema zur Dosistitration ist in Tabelle 1 dargestellt. Die tägliche Dosis sollte schrittweise alle zwei Wochen um 350 Mikrogramm erhöht werden, bis eine Erhaltungsdosis erreicht ist. Generell wird empfohlen, die Dosis so lange zu titrieren, bis der T3-Wert im Serum unter dem Mittelwert des Normalbereichs für das jeweilige Alter liegt. Wenn der Patient sich dem angestrebten T3-Wert im Serum nähert, kann die Dosis in kleineren Schritten (Halbtabletten) gesteigert werden. Die Dosis kann je nach Ansprechen des Patienten auf die Behandlung in Bezug auf die klinischen Merkmale des MCT8-Mangels weiter angepasst werden. Die Gesamttagesdosis sollte in 1 bis 3 Dosen über den ganzen Tag verteilt (z. B. morgens, mittags, abends) verabreicht werden.
Tabelle 1. Empfohlenes Schema zur Dosistitration bei Patienten mit einem Körpergewicht von 10 kg oder mehr
Titration | Gesamttagesdosis (Mikrogramm) | Anzahl der Tabletten/Tag |
Anfangsdosis | 350 | 1 |
Woche 2 | 700 | 2 |
Woche 4 | 1 050 | 3 |
Woche 6 | 1 400 | 4 |
Woche 8 | 1 750 | 5 |
Woche 10 | 2 100 | 6 |
Die Dosistitration sollte in Schritten von 350 Mikrogramm fortgesetzt werden, bis eine Erhaltungsdosis erreicht ist. Es wird nicht empfohlen, eine Tagesdosis von 80 Mikrogramm/kg bei Patienten mit einem Körpergewicht zwischen 10 und 40 kg, 60 Mikrogramm/kg bei Patienten mit einem Körpergewicht zwischen 40 und 60 kg und 50 Mikrogramm/kg bei Patienten mit einem Körpergewicht über 60 kg zu überschreiten. | ||
Neugeborene, Säuglinge, Kleinkinder und Kinder mit einem Körpergewicht unter 10 kg
Dosistitration und Dosisanpassung
Die empfohlene Anfangsdosis für Patienten mit einem Körpergewicht unter 10 kg beträgt 175 Mikrogramm (eine halbe Tablette) täglich.
Ein empfohlenes Schema zur Dosistitration ist in Tabelle 2 dargestellt. Die tägliche Dosis sollte schrittweise alle zwei Wochen um 175 Mikrogramm erhöht werden, bis eine Erhaltungsdosis erreicht ist. Generell wird empfohlen, die Dosis so lange zu titrieren, bis der T3-Wert im Serum unter dem Mittelwert des Normalbereichs für das jeweilige Alter liegt. Die Dosis kann je nach Ansprechen des Patienten auf die Behandlung in Bezug auf die klinischen Merkmale des MCT8-Mangels weiter angepasst werden. Die Gesamttagesdosis sollte in 1 bis 3 Dosen über den ganzen Tag verteilt (z. B. morgens, mittags, abends) verabreicht werden.
Tabelle 2. Empfohlenes Schema zur Dosistitration bei Patienten mit einem Körpergewicht unter 10 kg
Titration | Gesamttagesdosis (Mikrogramm) | Anzahl der Tabletten/Tag |
Anfangsdosis | 175 | 0,5 |
Woche 2 | 350 | 1 |
Woche 4 | 525 | 1,5 |
Woche 6 | 700 | 2 |
Woche 8 | 875 | 2,5 |
Woche 10 | 1 050 | 3 |
Die Dosistitration sollte in Schritten von 175 Mikrogramm fortgesetzt werden, bis eine Erhaltungsdosis erreicht ist. Es wird nicht empfohlen, eine tägliche Dosis von 100 Mikrogramm/kg bei Patienten mit einem Körpergewicht unter 10 kg zu überschreiten. | ||
Erhaltungsdosis
Die Dosis von Emcitate wird auf individueller Basis titriert, bis eine Erhaltungsdosis erreicht ist. Generell wird empfohlen, die Dosis so lange zu titrieren, bis der T3-Wert im Serum unter dem Mittelwert des Normalbereichs für das jeweilige Alter liegt. Die Dosis kann je nach Ansprechen des Patienten auf die Behandlung in Bezug auf die klinischen Merkmale des MCT8-Mangels weiter angepasst werden. Die Notwendigkeit weiterer Dosisanpassungen sollte in Übereinstimmung mit der klinischen Praxis regelmäßig neu bewertet werden (siehe Abschnitt 4.4).
Versäumte oder verspätete Dosis
Wenn eine Dosis vergessen wurde und bis zur nächsten geplanten Dosis mehr als 4 Stunden liegen, sollte sie so bald wie möglich eingenommen werden. Wenn eine Dosis vergessen wurde und die nächste Dosis innerhalb von 4 Stunden vorgesehen ist, sollte auf die Dosis verzichtet und die nächste Dosis entsprechend dem Dosierungsschema eingenommen werden.
Laboruntersuchungen (T3-Messungen)
Es wird empfohlen, die T3-Werte jedes Patienten mittels einer Flüssigchromatografie mit Tandem-Massenspektrometrie (LC/MS/MS) zu messen. Bei Immunoassays kreuzreagiert Tiratricol mit T3, was zu unzuverlässigen Testergebnissen führen kann. Bei der Einleitung, Titration und Anpassung der Dosis von Tiratricol unter Anwendung der Immunoassay-Methode sollte fachkundiger Rat zur Interpretation des Testergebnisses eingeholt werden (siehe Abschnitt 4.4).
Hypermetabolische Anzeichen und Symptome
Wenn hypermetabolische Anzeichen und Symptome (wie Hyperhidrose, Reizbarkeit, Angstzustände, Schlaflosigkeit, Albträume, Hyperthermie, Tachykardie, vorübergehende Erhöhungen des systolischen Blutdrucks (SBP) oder Durchfall) entweder zum ersten Mal auftreten oder sich verschlechtern und nicht innerhalb von 2 Wochen abklingen, sollte die Dosis entsprechend den Schritten des Schemas zur Dosistitration reduziert werden, bis die Anzeichen und Symptome abgeklungen sind (siehe Tabelle 1 oder Tabelle 2). Nach Abklingen der hypermetabolischen Anzeichen und Symptome kann die Dosistitration, sofern klinisch angemessen, wieder aufgenommen werden (siehe Abschnitt 4.4).
Besondere Patientengruppen
Leberfunktionsstörung
Es wurden keine spezifischen Studien bei Patienten mit Leberfunktionsstörungen durchgeführt. Bei diesen Patienten werden eine sorgfältige Dosistitration und eine regelmäßige Überwachung des T3-Werts im Serum empfohlen (siehe Abschnitt 4.4).
Nierenfunktionsstörung
Es wurden keine spezifischen Studien bei Patienten mit Nierenfunktionsstörung durchgeführt. Bei diesen Patienten werden eine sorgfältige Dosistitration und eine regelmäßige Überwachung des T3-Werts im Serum empfohlen (siehe Abschnitt 4.4).
Art der Anwendung
Zum Einnehmen oder zur Verabreichung über eine Ernährungssonde.
Zum Einnehmen
Emcitate Tabletten zur Herstellung einer Suspension zum Einnehmen sind dazu bestimmt, vor dem Hinunterschlucken in Wasser aufgelöst zu werden.
Die Suspension sollte in einem dafür vorgesehenen kleinen Glas hergestellt werden, indem die Tablette(n) (maximal 4 Tabletten bei jeder Dosierung) unter Rühren mit einem Teelöffel über einen Zeitraum von 1 Minute in 30 ml Trinkwasser aufgelöst wird bzw. werden. Es dürfen keine anderen Flüssigkeiten verwendet werden. Die Suspension sollte milchig-weiß sein. Die Suspension sollte dann mit einer 40-ml-Applikationsspritze aus dem Glas aufgezogen und dem Patienten unverzüglich mit der Spritze oral verabreicht werden. Der Kolben sollte langsam und sanft heruntergedrückt werden, um die Suspension vorsichtig in die Wangeninnenseite des Patienten zu spritzen.
Weitere 10 ml Trinkwasser sollten dem Glas zugegeben und etwa 5 Sekunden lang mit einem Teelöffel gerührt werden, um sicherzustellen, dass das verbleibende Arzneimittel aufgelöst ist. Diese Suspension sollte mit derselben Spritze aus dem Glas aufgezogen und dem Patienten unverzüglich verabreicht werden.
Über eine Ernährungssonde
Emcitate kann über eine Ernährungssonde verabreicht werden.
Die Zubereitung der Suspension sollte wie oben im Abschnitt zur Einnahme beschrieben erfolgen.
Es muss sichergestellt werden, dass die Ernährungssonde vor der Verabreichung nicht verstopft ist, und es müssen die Anweisungen für die ausgewählte Ernährungssonde bezüglich Spülen, Verabreichung und Spülverfahren befolgt werden.
Der Inhalt der Spritze ist unverzüglich über die Ernährungssonde (30 ml + 10 ml für alle Altersgruppen) zu verabreichen.
Für weitere Informationen zur Gabe über die Ernährungssonde und zur Stabilität der Suspension siehe Abschnitt 6.6.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Schilddrüsenüberfunktion (Hyperthyreose) aus anderen Gründen als MCT8-Mangel (z. B. Morbus Basedow).
Schwangerschaft (siehe Abschnitt 4.6).
Hypermetabolische Anzeichen und Symptome
Zu Beginn der Behandlung mit Emcitate und/oder während der Dosistitration können hypermetabolische Anzeichen und Symptome wie Hyperhidrose, Reizbarkeit, Angstzustände, Schlaflosigkeit, Albträume, Hyperthermie, Tachykardie, vorübergehende Erhöhungen des systolischen Blutdrucks (SBP) oder Durchfall neu auftreten oder sich verschlechtern (siehe Abschnitt 4.8). Diese Anzeichen und Symptome sind in der Regel vorübergehend und klingen spontan innerhalb weniger Tage ab. Wenn die hypermetabolischen Anzeichen und Symptome innerhalb von 2 Wochen nicht abklingen, sollte die Dosis entsprechend den Schritten im Schema zur Dosistitration reduziert werden (siehe Abschnitt 4.2). Nach Abklingen der hypermetabolischen Anzeichen und Symptome kann die Dosistitration, sofern klinisch angemessen, wieder aufgenommen werden.
Herzerkrankungen
Bei Patienten mit Herzerkrankungen ist bei der Dosistitration Vorsicht geboten, da bei diesen Patienten ein erhöhtes Risiko für Nebenwirkungen im Zusammenhang mit Hypermetabolismus bestehen kann (siehe Abschnitt 4.8).
Auswirkung auf Laboruntersuchungen
Bei Immunoassays kreuzreagiert Tiratricol mit T3, was zu unzuverlässigen Testergebnissen führen kann. Es wird empfohlen, die T3-Werte jedes Patienten mittels einer Flüssigchromatografie mit Tandem-Massenspektrometrie (LC/MS/MS) zu messen. Bei der Anwendung einer Immunoassay-Methode ist Vorsicht geboten. Bei der Bestimmung oder Anpassung der Dosis von Tiratricol sind spezifische Leitlinien für die Interpretation von T3-Testergebnissen zu befolgen (siehe Abschnitt 4.2).
Diabetes
Bei Patienten mit Diabetes ist Vorsicht geboten (siehe Abschnitt 4.5).
Leberfunktionsstörung
Die Sicherheit und Wirksamkeit von Emcitate bei Patienten mit Leberfunktionsstörung wurden nicht untersucht. Bei diesen Patienten ist besondere Vorsicht geboten (siehe Abschnitt 4.2).
Nierenfunktionsstörung
Die Sicherheit und Wirksamkeit von Emcitate bei Patienten mit Nierenfunktionsstörung wurde nicht untersucht. Bei diesen Patienten ist besondere Vorsicht geboten (siehe Abschnitt 4.2).
Missbräuchliche Anwendung zur Gewichtsreduzierung
Tiratricol sollte nicht zur Gewichtsreduzierung eingenommen werden. Es kann schwerwiegende oder lebensbedrohliche Nebenwirkungen hervorrufen, insbesondere in Kombination mit Orlistat (siehe Abschnitt 4.5 unter „Orlistat“).
Lactose
Emcitate Tabletten enthalten Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Auswirkungen anderer Arzneimittel auf die Pharmakokinetik von Tiratricol
Es wurden keine klinischen Interaktionsstudien durchgeführt, in denen die Wirkung anderer Arzneimittel auf Tiratricol untersucht wurde. Die im Folgenden beschriebenen potenziellen Wechselwirkungen basieren auf der In-vitro-Charakterisierung von Tiratricol und auf bekannten pharmakokinetischen oder pharmakodynamischen Wechselwirkungen von Thyromimetika mit anderen Arzneimitteln und wurden nicht speziell mit Tiratricol untersucht.
Gleichzeitige Anwendung mit Vorsicht
Arzneimittel, die die Resorption von Tiratricol beeinflussen können
Antazida, Aktivkohle, Calcium, kationische Harze (z. B. Cholestyramin), Eisen, Sucralfat und andere gastrointestinale Wirkstoffe können die gastrointestinale Resorption von Tiratricol beeinträchtigen. Diese Wirkstoffe sollten vor oder nach Tiratricol verabreicht werden (nach Möglichkeit mehr als 2 Stunden vor oder nach Tiratricol). Im Falle von Cholestyramin sollte Tiratricol 1 Stunde vor oder 4 Stunden nach der Verabreichung des Harzes eingenommen werden. Um die gewünschte Wirkung zu erzielen, kann eine Anpassung der Tiratricol-Dosis erforderlich sein.
Protonenpumpenhemmer (Proton Pump Inhibitors, PPIs)
Die gleichzeitige Anwendung mit PPIs kann aufgrund eines durch PPIs wie Omeprazol, Esomeprazol, Pantoprazol, Rabeprazol und Lansoprazol verursachten Anstiegs des pH-Werts im Magen zu einer verringerten Resorption der Schilddrüsenhormone führen. Der T3-Wert im Serum sollte überwacht und bei Einleitung, Änderung oder Abbruch der PPI-Behandlung eine Dosisanpassung von Tiratricol in Erwägung gezogen werden.
Sevelamer
Sevelamer kann die Konzentration von Schilddrüsenhormonen verringern und die Wirksamkeit von Tiratricol vermindern. Sevelamer sollte mehr als 2 Stunden vor oder nach Tiratricol eingenommen werden.
Arzneimittel mit enzyminduzierender Wirkung, einschließlich Antiepileptika
Arzneimittel, die Leberenzyme induzieren können, wie Barbiturate, Phenytoin Carbamazepin, Rifabutin, Rifampicin oder Arzneimittel, die Johanniskraut (Hypericum perforatum) enthalten, können die hepatische Clearance von Tiratricol erhöhen. Der T3-Wert im Serum sollte überwacht und eine Dosisanpassung von Tiratricol in Erwägung gezogen werden, wenn eine antiepileptische Behandlung oder eine Behandlung mit anderen enzyminduzierenden Wirkstoffen eingeleitet, geändert oder abgesetzt wird.
Arzneimittel gegen Malaria
Die gleichzeitige Anwendung von Tiratricol und Arzneimitteln gegen Malaria (Chloroquin, Proguanil) kann zu einer klinischen Hypothyreose führen. Während und nach der Behandlung mit Arzneimitteln gegen Malaria können eine Überwachung des T3-Werts im Serum und eine Dosisanpassung von Tiratricol erforderlich sein.
Arzneimittel, die die Plasmaproteinbindung von Tiratricol/T3 beeinträchtigen können
Es ist bekannt, dass anabole Steroide und Glucocorticoide die Konzentration von Thyroxin-bindendem Globulin (TBG) im Serum senken und zu niedrigeren T3- und Tiratricol-Konzentrationen im Serum führen können.
Salicylate, Antikoagulantien, entzündungshemmende und antikonvulsive Arzneimittel können zur Verdrängung von T3 und potenziell Tiratricol von den Bindungsproteinen (TBG) führen und dadurch die Konzentrationen von Schilddrüsenhormonen im Serum verändern, d. h. niedrigere Gesamtkonzentrationen, freie Konzentrationen bleiben jedoch gleich.
Nicht-empfängnisverhütende Östrogene
Nicht-empfängnisverhütende Östrogene und östrogenhaltige Arzneimittel (einschließlich Hormonersatztherapie) können eine höhere Tiratricol-Behandlungsdosis erfordern.
Orlistat
Orlistat kann die Resorption von Tiratricol verringern, was zu Hypothyreose führen kann (Veränderungen der Schilddrüsenfunktion sollten überwacht werden).
Wirkung von Tiratricol auf die Pharmakokinetik anderer Arzneimittel
Gleichzeitige Anwendung mit Vorsicht
In-vitro-Daten deuten darauf hin, dass Tiratricol CYP3A4 auf Darmebene induzieren kann. Daher sollten Arzneimittel mit geringer therapeutischer Breite, die auf CYP3A4 angewiesen sind, einschließlich, aber nicht beschränkt auf Alfentanil, Cisaprid, Ciclosporin, Mutterkorn-Derivaten, Fentanyl, Pimozid, Chinidin, Sirolimus, Tacrolimus, Atorvastatin, Lovastatin und Simvastatin, mit Vorsicht angewendet werden. Ähnliche Vorsichtsmaßnahmen sollten bei anderen Wirkstoffen angewendet werden, deren Metabolisierung auf CYP3A4 angewiesen ist. Arzneimittel mit enger therapeutischer Breite, bei denen es sich um Substrate der Effluxtransporter P-Glykoprotein (P-gp) oder Breast Cancer Resistance Protein (BCRP) handelt, sollten ebenfalls mit Vorsicht angewendet werden.
Pharmakodynamische Wechselwirkungen
Gleichzeitige Anwendung nicht empfohlen
Andere Arzneimittel zur Behandlung von Schilddrüsenerkrankungen
Die Einnahme von Tiratricol in Kombination mit anderen thyromimetischen Arzneimitteln oder anderen Arzneimitteln zur Behandlung von Schilddrüsenerkrankungen (z. B. Levothyroxin, Propylthiouracil und Carbimazol) kann das Risiko von Symptomen einer Hyperthyreose oder einer Hypothyreose erhöhen.
Psychostimulanzien
Die Verabreichung von Psychostimulanzien (z. B. Koffein, Noradrenalin-Dopamin-Wiederaufnahmehemmer (NDRI) und Amphetaminen) in Kombination mit hohen Dosen von Tiratricol kann zu beschleunigtem Herzklopfen und erhöhtem Blutdruck führen. Die gleichzeitige Anwendung von Psychostimulanzien und Tiratricol wird nicht empfohlen.
Gleichzeitige Anwendung mit Vorsicht
Antidiabetika
Tiratricol kann den Blutzuckerspiegel senken. Bei gleichzeitiger Anwendung mit Tiratricol muss die Dosis von Antidiabetika gegebenenfalls angepasst werden. Eine regelmäßige Überwachung des Blutzuckers ist notwendig (siehe Abschnitt 4.4).
Orale Antikoagulanzien
Die Wirkung der Antikoagulanzien kann während der Behandlung mit Tiratricol verstärkt werden. Dies kann das Blutungsrisiko erhöhen. Bei gleichzeitiger Anwendung mit Tiratricol muss die Dosis der Antikoagulanzien möglicherweise angepasst werden.
MCT8-Mangel ist eine X-chromosomale Erkrankung, die fast ausschließlich Jungen und Männer betrifft.
Schwangerschaft
Tiratricol ist plazentagängig Bisher liegen keine oder nur begrenzte Daten zur Anwendung von Tiratricol bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Emcitate ist während der Schwangerschaft kontraindiziert (siehe Abschnitt 4.3).
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung eine zuverlässige Verhütungsmethode anwenden.
Stillzeit
Es ist nicht bekannt, ob Tiratricol/seine Metaboliten in die Muttermilch übergehen. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Emcitate verzichtet werden soll / die Behandlung mit Emcitate zu unterbrechen ist. Dabei sind sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Eine Studie an Ratten zeigte keine Auswirkungen auf die Fertilität und die Paarungsfähigkeit (siehe Abschnitt 5.3).
Emcitate hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die am häufigsten berichteten Nebenwirkungen im Zusammenhang mit der Behandlung mit Tiratricol waren Hyperhidrose (7 %), Durchfall (6 %), Reizbarkeit (2 %), Angstzustände (2 %) und Albträume (2 %). Diese Nebenwirkungen traten in der Regel zu Beginn der Behandlung und/oder bei Erhöhung der Dosis auf und klangen im Allgemeinen innerhalb weniger Tage ab.
Tabellarische Auflistung der Nebenwirkungen
Die Sicherheitsbewertung von Tiratricol basiert auf Daten aus klinischen Studien. Die Nebenwirkungen sind nach MedDRA-Systemorganklasse und Häufigkeit wie folgt aufgeführt: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 3. Nebenwirkungen
Systemorganklasse | Nebenwirkung | Häufigkeitskategorie |
Psychiatrische Erkrankungen | Reizbarkeit | Häufig |
Herzerkrankungen | Tachykardie | Nicht bekannt |
Erkrankungen des Gastrointestinaltrakts | Durchfall | Häufig |
Erkrankungen der Haut und des Unterhautgewebes | Hyperhidrose | Häufig |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Hyperthermie | Nicht bekannt |
Beschreibung ausgewählter Nebenwirkungen
Hypermetabolische Anzeichen und Symptome
In klinischen Studien bei Patienten mit MCT8-Mangel fiel das Einsetzen der beobachteten Nebenwirkungen Hyperhidrose, Reizbarkeit, Angstzustände und Albträume mit dem Beginn der Behandlung oder der Dosisanpassung zusammen. In allen Fällen waren diese Reaktionen leicht und klangen spontan ab.
Zu Beginn der Behandlung mit Tiratricol und/oder während der Dosistitration können hypermetabolische Anzeichen und Symptome wie Hyperhidrose, Reizbarkeit, Angstzustände, Schlaflosigkeit, Albträume, Hyperthermie, Tachykardie, vorübergehende Erhöhungen des systolischen Blutdrucks (SBP) oder Durchfall neu auftreten oder sich verschlechtern (siehe Abschnitt 4.4).
Kinder und Jugendliche
Die Sicherheitsdaten wurden bei 63 Patienten im Alter zwischen 0 und 17 Jahren in der Triac-Studie I und der Triac-Studie II zusammen bewertet. Zu Beginn der Behandlung waren dreißig (30) Patienten jünger als 2 Jahre, 25 Patienten zwischen 2 und 11 Jahre und 8 Patienten 12 und 17 Jahre alt. Die Daten aus klinischen Studien geben keinen Hinweis darauf, dass sich das Sicherheitsprofil in irgendeiner Untergruppe der Kinder und Jugendlichen vom Sicherheitsprofil bei erwachsenen Patienten unterscheidet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: http://www.bfarm.de
anzuzeigen.
Im Falle einer Überdosierung können hypermetabolische Anzeichen und Symptome auftreten. Diese Symptome können durch die Reduzierung der Dosis von Emcitate oder den vorübergehenden Abbruch der Behandlung gelindert werden.
Pharmakotherapeutische Gruppe: Schilddrüsenhormone, ATC-Code: H03AA04
Wirkmechanismus
Tiratricol (3,3',5-Triiodthyroessigsäure) ist ein natürlich zirkulierender Metabolit des aktiven Schilddrüsenhormons T3 mit einem hohen strukturellen Ähnlichkeitsgrad und folgt dem gleichen Abbauweg (Deiodierung und Konjugation) und der Elimination über Galle und Urin. Tiratricol ist biologisch aktiv, bindet mit hoher Affinität an die Schilddrüsenhormonrezeptoren TRα und TRß und zeigt ähnliche biologische Wirkungen wie T3, wenn auch mit unterschiedlicher Gewebespezifität. Es wurde nachgewiesen, dass Tiratricol im Gegensatz zu T3 und T4 ohne einen funktionierenden MCT8-Transporter in die von MCT8 abhängigen Zellen eindringen kann. Tiratricol kann dadurch T3 in MCT8-abhängigem Gewebe ersetzen und die normale Schilddrüsenhormonaktivität in diesen Geweben wieder herstellen.
Klinische Wirksamkeit und Sicherheit
Die Wirkung von Tiratricol bei der Behandlung von Patienten mit MCT8-Mangel wurde in einer einarmigen, offenen, multizentrischen Studie (Triac-Studie I) untersucht. An der Studie nahmen 46 Patienten teil, die bis zu 12 Monate lang mit einer individuell titrierten Dosis von Tiratricol behandelt wurden. Die Dosis wurde basierend auf dem T3-Wert im Serum (Zielbereich 1,4 bis 2,5 nmol/l) festgelegt. Das Medianalter der Probanden betrug 7,1 Jahre mit einer Spanne von 10 Monaten bis 66,8 Jahren. Vierzig (40) Patienten wurden mindestens 12 Monate lang behandelt. Die mediane tägliche Erhaltungsdosis betrug 700 Mikrogramm (38,9 Mikrogramm/kg Körpergewicht) mit einer Spanne von 350 Mikrogramm bis 2 100 Mikrogramm. Die Behandlung mit Tiratricol senkte den mittleren T3-Wert im Serum von 4,97 nmol/l zu Studienbeginn auf 1,82 nmol/l in Monat 12 (Zielbereich 1,4 bis 2,5 nmol/l). Alle 45 Patienten mit T3-Werten nach der Ausgangsmessung zeigten bis Monat 12 bzw. bis zur letzten verfügbaren Messung eine Abnahme verglichen mit dem Ausgangswert. In Monat 12 bzw. bei der letzten verfügbaren Messung erreichten 25 von 45 Patienten (56 %) einen T3-Wert im Serum innerhalb des Zielbereichs, 13 von 45 Patienten (29 %) hatten einen T3-Wert unterhalb des Zielbereichs, und 7 von 45 Patienten (16 %) hatten einen T3-Wert im Serum oberhalb des Zielbereichs. Die Ergebnisse für den primären Endpunkt sind in Tabelle 4 und Abbildung 1 dargestellt.
Tabelle 4. Mittlere Veränderung des T3-Werts im Serum von Studienbeginn bis Monat 12 in der Triac-Studie I (Intention-to-treat(ITT)-Population)
Variable | N | Studienbeginn | Monat 12 | Differenz | p-Wert |
T3-Wert im Serum (nmol/l) | 45 | 4,97 (1,55) | 1,82 (0,69) | -3,15 [-3,62; -2,68] | < 0,0001 |
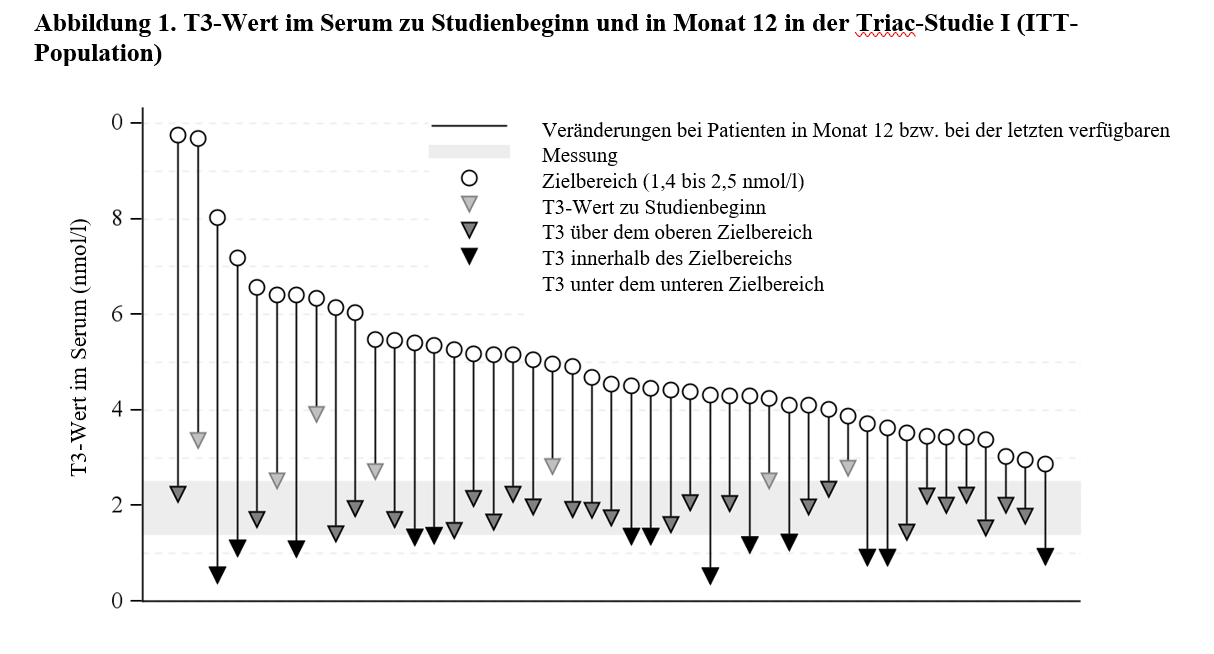
Tabelle 5: Andere Schilddrüsenhormone – Analyse der mittleren Veränderung ab Studienbeginn bis Monat 12 in der Triac Studie I (ITT-Population)
Variable | N | Studienbeginn | Monat 12 | Differenz | p-Wert |
TSH (mU/l) | 45 | 2,91 (1,68) | 1,02 (1,14) | -1,89 [-2,39; -1,39] | < 0,0001 |
Freies T4 (pmol/l) | 45 | 9,68 (2,96) | 3,39 (1,60) | -6,28 [-7,15; -5,41] | < 0,0001 |
T4 gesamt (nmol/l) | 45 | 55,96 (12,95) | 24,38 (9,44) | -31,58 [-35,15; -28,01] | < 0,0001 |
rT3 (nmol/l) | 45 | 0,12 (0,10) | 0,04 (0,04) | -0,08 [-0,10; -0,05] | < 0,0001 |
In der Triac-Studie I steig der mittlere Z-Score für das Körpergewicht relativ zum Alter bei MCT8-Mangel (Vergleich von mit Tiratricol behandelten MCT8-Patienten mit unbehandelten MCT8-Patienten) von 0,46 zu Studienbeginn auf 0,96 in Monat 12 (mittlere Veränderung: 0,51; 95 % KI: 0,25; 0,76), während die mittleren Z-Scores für das Körpergewicht relativ zum Alter (Vergleich von mit Tiratricol behandelten MCT8-Patienten mit einer normalen Population) von -2,85 zu Studienbeginn auf -2,63 in Monat 12 moderat anstieg (mittlere Veränderung: 0,22; 95 % KI: -0,01; 0,45). Die Ergebnisse waren bei Patienten mit oder ohne Ernährungssonde zu Studienbeginn ähnlich. Insgesamt war bei 40 von 45 Patienten (89 %) eine Erhöhung des Körpergewichts zu verzeichnen: Bei 28 von 45 Patienten (62 %) stieg der Z-Score für das Körpergewicht relativ zum Alter an und bei 28 von 36 Patienten (78 %) stieg der Z-Score für das Körpergewicht relativ zum Alter bei MCT8-Mangel an.
Bei Patienten unter 2,5 Jahren stieg der mittlere Z-Score für das Körpergewicht relativ zum Alter bei MCT8-Mangel von -0,10 zu Studienbeginn auf 0,41 in Monat 12 (n = 3), wobei die Daten nur auf wenigen Probanden basieren. Beim mittleren Z-Score für das Körpergewicht relativ zum Alter wurde ein moderater Anstieg von -1,65 zu Studienbeginn auf -1,61 in Monat 12 (n = 4) beobachtet.
Der mittlere Ruhepuls wurde von 112,4 bpm zu Studienbeginn auf 103,5 bpm in Monat 12 reduziert (mittlere Veränderung: -8,9 bpm; 95 % KI: -15,6; -2,3), während der mittlere Z-Score für den Puls relativ zum Alter (Vergleich von mit Tiratricol behandelten Patienten mit MCT8-Mangel mit einer normalen Population) von 1,72 zu Studienbeginn auf 1,38 in Monat 12 zurückging (mittlere Veränderung: -0,33; 95 % KI: -0,77; 0,10). Bei Patienten mit Tachykardie zu Studienbeginn wurde der mittlere Puls von 131,4 bpm zu Studienbeginn auf 109,6 bpm in Monat 12 reduziert (mittlere Veränderung: -21,9 bpm; 95 % KI: -30,0; -13,8), während der mittlere Z-Score für den Puls relativ zum Alter von 2,80 zu Studienbeginn auf 1,75 in Monat 12 sank (mittlere Veränderung: -1,05; 95 % KI: -1,55; -0,54). Insgesamt wurde bei 23 von 34 Patienten (67 %) eine Verlangsamung des Ruhepulses festgestellt. Bei 15 von 16 (94 %) Patienten mit Tachykardie zu Studienbeginn wurde eine Verlangsamung des Ruhepulses gemessen.
Der mittlere systolische Blutdruck wurde von 107,1 mmHg zu Studienbeginn auf 103,0 mmHg in Monat 12 gesenkt (mittlere Veränderung: -4,1 mmHg; 95 % KI: -8,1; 0,1). Bei Patienten mit Bluthochdruck wurde der mittlere systolische Blutdruck von 110,9 mmHg zu Studienbeginn auf 102,5 mmHg in Monat 12 gesenkt (mittlere Veränderung: -8,4 mmHg; 95 % KI: -11,7; -5,0). Der prozentuale Anteil der Patienten mit Bluthochdruck wurde von 40 % zu Studienbeginn auf 17 % in Monat 12 reduziert (p = 0,02). Insgesamt wurde bei 24 von 35 Patienten (69 %) ein Rückgang des systolischen Blutdrucks verzeichnet. Bei 12 von 12 (100 %) Patienten mit Bluthochdruck zu Studienbeginn wurde ein Rückgang des systolischen Blutdrucks festgestellt.
In der Triac-Studie I verbesserten sich die Werte aller Patienten (45 von 45; 100 %) in Bezug auf mindestens einer der Variablen: Körpergewicht, Ruhepuls oder systolischer Blutdruck, und bei 31 von 45 Patienten (69 %) verbesserten sich die Werte in Bezug auf mindestens zwei dieser drei Variablen. Insgesamt verbesserten sich die Werte bei 39 von 45 Patienten (87 %) in Bezug auf mindestens einer der Variablen: Z-Score für das Körpergewicht relativ zum Alter bei MCT8-Mangel, Z-Score für den Ruhepuls oder Z-Score für den systolischen Blutdruck, und bei 21 von 45 Personen (47 %) verbesserten sich die Werte in Bezug auf mindestens zwei dieser drei Variablen.
Die mittlere Anzahl vorzeitiger Vorhofkontraktionen, gemessen anhand des 24-Stunden-EKG, sank von 899,7 PAC/24 Stunden zu Studienbeginn auf 313,9 PAC/24 Stunden in Monat 12 (mittlere Veränderung: -586; 95 % KI: -955; -217).
Die Creatinkinase-Konzentrationen stiegen von 108 U/l zu Studienbeginn auf 160,7 U/l in Monat 12 (mittlere Veränderung: 52,7; 95 % KI: 27,3; 78,1; p = 0,0001).
Resorption
Die Resorption von Tiratricol nach oraler Gabe ist rasch, mit einer medianen Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) von 0,5 Stunden nach Dosen zwischen 175 Mikrogramm und 1 050 Mikrogramm bei nüchternen gesunden Probanden.
Verteilung
Die In-vitro-Plasmaproteinbindung von Tiratricol ist hoch, wobei die Proteinbindung im menschlichen Plasma > 99 % beträgt. Die Bioverfügbarkeit von Tiratricol (F) betrug 67 ± 6 %, was darauf hindeutet, dass Tiratricol aus dem Magen-Darm-Trakt gut absorbiert wird.
Biotransformation
Bei Tiratricol handelt es sich um einen natürlich zirkulierenden Metaboliten des aktiven Schilddrüsenhormons T3 mit einem hohen strukturellen Ähnlichkeitsgrad und demselben Stoffwechselweg. Tiratricol wird im menschlichen Körper hauptsächlich durch schrittweise Deiodierung, Sulfatierung und Glucuronidierung metabolisiert, wobei dies primär in der Leber erfolgt, ähnlich wie bei T3.
Elimination
Nach Erreichen der maximalen Plasmakonzentration (Cmax) sanken die Serumkonzentrationen im Allgemeinen biphasisch und blieben zwischen 3 bis 48 Stunden nach der Einnahme quantifizierbar. Das geometrische Mittel t½ lag zwischen 13,3 und 14,0 Stunden für die Dosen von 350 Mikrogramm bzw. 1 050 Mikrogramm. Tiratricol wird über die Galle und den Urin ausgeschieden.
Linearität
Die Cmax erhöhte sich nach der Behandlung mit Dosen von 175 Mikrogramm, 350 Mikrogramm und 1 050 Mikrogramm (etwa 2 bis 13,5 Mikrogramm/kg Körpergewicht) proportional mit der Dosis, während die Fläche unter der Kurve (area under the curve, AUC) bei steigender Dosis etwas stärker als proportional zunahm.
Pharmakokinetische/pharmakodynamische Zusammenhänge
In der klinischen Studie, in der die Wirkung von Tiratricol bei Patienten mit MCT8-Mangel untersucht wurde, wurde die Dosis auf der Grundlage der T3-Werte individuell titriert.
Es wurden keine konventionellen Studien zur krebserregenden Wirkung mit Tiratricol durchgeführt. Tiratricol zeigte bei Ames-Tests keine mutagene Aktivität und führte weder bei In-vitro- noch bei In-vivo-Untersuchungen zu einer Zunahme der Chromosomenmutationen.In-vitro- und In-vivo-Studien zur Genotoxizität von Tiratricol waren negativ. Studien zur Kanzerogenität mit Tiratricol wurden nicht durchgeführt.
Studien zur embryofetalen Entwicklung zeigten Embryoletalität bei Kaninchen sowie Embryoletalität und strukturelle Myokardschädigung bei Ratten. Im Dosisvergleich in Bezug auf mg/Körperoberfläche waren die NOAEL-Werte (No-observed Adverse Effect Level – Dosis ohne beobachtete schädigende Wirkung) in den Studien an Ratten und Kaninchen etwas niedriger bzw. etwas höher als die höchste klinische Dosis bei erwachsenen Patienten.
In einer Studie an männlichen und weiblichen Ratten, denen hohe und ansonsten toxische Dosen von Tiratricol verabreicht wurden, wurden keine Auswirkungen auf die Paarungsfähigkeit oder Fertilität beobachtet.
Lactose-Monohydrat
Calciumhydrogenphosphat
Maisstärke
Magnesiumstearat
Nicht zutreffend.
18 Monate
Nach der Suspension:
Die 30-ml-Suspension kann bis zu 4 Stunden lang unter 25 °C im Glas gelagert und dann vor der Anwendung unter Rühren 1 Minute lang mit einem Teelöffel erneut aufgelöst werden.
Im Kühlschrank lagern (2 C – 8 °C).
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Auflösung des Arzneimittels, siehe Abschnitt 6.3.
PVC/Aluminium-Blisterpackung.
Packungsgröße mit 60 Tabletten zur Herstellung einer Suspension zum Einnehmen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Das Arzneimittel kann über eine Ernährungssonde verabreicht werden.
Das Arzneimittel wurde mit einer Sonde für die perkutane endoskopische Gastrostomie (PEG-Sonde) aus Silikon (Lumen 12 Charrière Maximallänge 34 cm) und einer Nasensonde aus Polyurethan (Lumen 6 Charrière und 8 Charrière, Maximallänge 56 cm) getestet. Dieses Produkt wurde nicht mit anderen Arten von Sonden oder Sondenmaterialien getestet. Es wird ein Spülvolumen von 3 ml (Wasser) empfohlen.
Rare Thyroid Therapeutics International AB
Klara Norra Kyrkogata 26
111 22 Stockholm
Schweden
EU/1/24/1897/001
/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 12. Februar 2025
Februar 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.