▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
LOQTORZI 240 mg Konzentrat zur Herstellung einer Infusionslösung
Eine Durchstechflasche mit Konzentrat zur Herstellung einer Infusionslösung enthält 240 mg Toripalimab.
Jeder Milliliter Konzentrat zur Herstellung einer Infusionslösung enthält 40 mg Toripalimab.
Toripalimab ist ein humanisierter monoklonaler Immunglobulin G4(IgG4)-Antikörper (mAb), der durch DNA-Rekombinationstechnologie in Eierstockzellen des chinesischen Hamsters hergestellt wird.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Konzentrat zur Herstellung einer Infusionslösung.
Klare bis leicht opaleszierende, farblose bis gelbliche Lösung, im Wesentlichen frei von sichtbaren Partikeln. Das Konzentrat zur Herstellung einer Infusionslösung hat einen pH-Wert von 5,5–6,5 und eine Osmolalität von 260–340 mOsmol/kg.
LOQTORZI wird angewendet in Kombination mit Cisplatin und Gemcitabin für die Erstlinienbehandlung erwachsener Patienten mit rezidivierendem, für eine Operation oder Strahlentherapie nicht infrage kommendem, oder metastasiertem Nasopharynxkarzinom.
LOQTORZI wird angewendet in Kombination mit Cisplatin und Paclitaxel indiziert für die Erstlinienbehandlung erwachsener Patienten mit inoperablem fortgeschrittenem, rezidivierendem oder metastasiertem Plattenepithelkarzinom des Ösophagus.
Die Behandlung ist von Ärzten mit Erfahrung in der Behandlung von Krebserkrankungen einzuleiten und zu überwachen.
Dosierung
Das empfohlene Dosierungsschema für LOQTORZI beträgt 240 mg alle 3 Wochen (q3w) als intravenöse Infusion, wobei die erste Infusion über einen Zeitraum von 60 Minuten zu geben ist. Wenn bei der ersten Infusion keine wesentlichen infusionsbedingten Reaktionen aufgetreten sind, können die folgenden Infusionen über einen Zeitraum von 30 Minuten durchgeführt werden.
Die Behandlung sollte bis zum Fortschreiten der Krankheit, bis zum Auftreten inakzeptabler Toxizität oder maximal 24 Monate lang fortgesetzt werden.
Dosisanpassungen
In Tabelle 1 sind empfohlene Anpassungen zum Management von unerwünschten Wirkungen aufgeführt.
Es ist die Zusammenfassung der Merkmale des Arzneimittels anderer, in Kombination mit LOQTORZI anzuwendender Präparate zu beachten.
Tabelle 1: Empfohlene Behandlungsanpassungen für LOQTORZI
Unerwünschte Wirkung |
Schwere1 |
Behandlungsanpassung |
Immunvermittelte unerwünschte Wirkungen | ||
Pneumonitis |
Grad 2 |
Aussetzen2 |
Grad 3 oder 4 |
Dauerhaft absetzen |
|
Diarrhö/Kolitis |
Grad 2 oder 3 |
Aussetzen2 |
Grad 4 |
Dauerhaft absetzen |
|
Hepatitis |
Anstieg der Aspartataminotransferase (AST)/ |
Aussetzen2 |
Anstieg der AST oder ALT auf mehr als das 5-Fache der ULN |
Dauerhaft absetzen |
|
Endokrinopathien |
Nebenniereninsuffizienz oder Hypophysitis Grad 2–4 |
Aussetzen bis zur klinischen Stabilisierung unter Hormonersatztherapie2 |
Hyperthyreose oder Thyreoiditis Grad 3 oder 4 |
Aussetzen bis zur klinischen Stabilisierung unter angemessenem medizinischem Management |
|
Diabetes mellitus Grad 3–4 |
Aussetzen bis zur klinischen Stabilisierung unter Therapie mit Antihyperglykämika (Insulin) |
|
Hypothyreose Grad 1–4 |
Behandlung mit einer Hormonersatztherapie ohne Unterbrechung von Toripalimab |
|
Nephritis mit Nierenfunktionsstörung |
Erhöhter Kreatininspiegel im Blut Grad 2–3 |
Aussetzen2 |
Erhöhter Kreatininspiegel im Blut Grad 4 |
Dauerhaft absetzen |
|
Exfoliative dermatologische Erkrankungen |
Verdacht auf Stevens-Johnson-Syndrom (SJS), toxische epidermale Nekrolyse (TEN) oder Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS) |
Aussetzen2 |
Bestätigtes SJS, TEN oder DRESS |
Dauerhaft absetzen |
|
Myokarditis |
Grad 2, 3 oder 4 |
Dauerhaft absetzen |
Myositis |
Grad 2–3 |
Je nach Schwere aussetzen oder dauerhaft absetzen2 |
Grad 4 |
Dauerhaft absetzen |
|
Andere unerwünschte Wirkungen (einschließlich unter anderem neurologische Toxizitäten, Pankreatitis, Iritis, Uveitis, immunvermittelte Zystitis und immunvermittelte entzündliche Arthritis) |
Grad 2–3 |
Je nach Art und Schwere aussetzen oder dauerhaft absetzen2 |
Grad 4 |
Dauerhaft absetzen |
|
Infusionsbedingte Reaktionen | ||
Infusionsbedingte Reaktionen |
Grad 1 oder 2 |
Infusion unterbrechen oder Infusionsgeschwindigkeit reduzieren |
Grad 3 oder 4 |
Infusion stoppen. |
|
1 Basierend auf den Common Terminology Criteria for Adverse Events (CTCAE) des National Cancer Institute (NCI), Version 5.0
2 Die Behandlung mit LOQTORZI bei Patienten mit einer Besserung auf Grad 0–1 nach Ausschleichen der Kortikosteroide wieder aufnehmen. Dauerhaft absetzen, wenn innerhalb von 12 Wochen nach Einleitung von Steroiden keine Besserung bis auf unter Grad 1 eintritt oder wenn die Prednison-Dosis innerhalb von 12 Wochen nach Einleitung von Steroiden nicht auf 10 mg pro Tag oder weniger (oder eine entsprechende Dosis) reduziert werden kann oder wenn unter einer Hormonersatztherapie keine klinische Stabilisierung der Endokrinopathie eintritt.
Therapiepass
Alle Ärzte, die LOQTORZI verschreiben, sollten ihre Patienten über den Therapiepass informieren und erklären, was zu tun ist, wenn bei ihnen Symptome immunvermittelter unerwünschter Wirkungen auftreten. Jedem Patienten wird vom Arzt ein Therapiepass ausgehändigt.
Besondere Patientengruppen
Ältere Patienten
Bei Patienten ab 65 Jahren wird keine Dosisanpassung empfohlen (siehe Abschnitt 5.2).
Nierenfunktionsstörung
Bei Patienten mit leichter oder mittelschwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Die Datenlage zur Erteilung von Dosierungsempfehlungen bei Patienten mit schwerer Nierenfunktionsstörung ist unzureichend (siehe Abschnitt 5.2).
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung wird keine Dosisanpassung empfohlen. Die Datenlage zur Erteilung von Dosierungsempfehlungen bei Patienten mit mittelschwerer oder schwerer Leberfunktionsstörung ist unzureichend (siehe Abschnitt 5.2).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von LOQTORZI bei Kindern und Jugendlichen im Alter unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
LOQTORZI ist nur zur intravenösen Anwendung bestimmt und muss als Infusion verabreicht werden. Die erste Infusion sollte über einen Zeitraum von 60 Minuten über eine Infusionspumpe durch einen Inline-Filter (0,2 Mikrometer oder 0,22 Mikrometer Porengröße) erfolgen. Wenn bei der ersten Infusion keine infusionsbedingten Reaktionen aufgetreten sind, können anschließende Infusionen über einen Zeitraum von 30 Minuten durchgeführt werden.
Bei Gabe am selben Tag wie die Chemotherapie sollte LOQTORZI vor der Chemotherapie über einen anderen intravenösen Zugang infundiert werden.
Hinweise zur Verdünnung des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Immunvermittelte unerwünschte Wirkungen
Bei Patienten unter Behandlung mit Antikörpern, die den PD-1/PD-L1-Signalweg (Programmed Cell Death Protein-1/Programmed Death-Ligand 1) blockieren, einschließlich Toripalimab, können immunvermittelte unerwünschte Wirkungen auftreten, die schwerwiegend sein oder bis zum Tod führen können. Immunvermittelte unerwünschte Wirkungen treten in der Regel während der Behandlung mit PD-1/PD-L1-blockierenden Antikörpern auf, Symptome können sich aber auch erst nach dem Absetzen der Behandlung manifestieren. Immunvermittelte unerwünschte Wirkungen können in jedem Organ oder Gewebe auftreten und mehr als ein Körpersystem gleichzeitig betreffen. Die in diesem Abschnitt aufgeführten wichtigen immunvermittelten unerwünschten Wirkungen umfassen nicht alle möglichen schweren und tödlich verlaufenden immunvermittelten Wirkungen.
Die frühzeitige Erkennung und Behandlung immunvermittelter unerwünschter Wirkungen ist von entscheidender Bedeutung, um die sichere Verwendung von PD-1/PD-L1-blockierenden Antikörpern zu gewährleisten. Die Patienten sind engmaschig auf Symptome und Anzeichen immunvermittelter unerwünschter Wirkungen zu überwachen. Zur Baseline sowie in regelmäßigen Abständen während der Behandlung sollten die klinisch-chemischen Parameter, einschließlich Leberenzyme, Kreatinin und Schilddrüsenwerte, überprüft werden. Bei Verdacht auf immunvermittelte unerwünschte Wirkungen sollte eine entsprechende Abklärung erfolgen, um alternative Ursachen, einschließlich einer Infektion, auszuschließen. Es sollte umgehend eine medizinische Behandlung eingeleitet werden, gegebenenfalls einschließlich einer fachärztlichen Beratung.
Je nach Art und Schwere der unerwünschten Wirkung ist die Behandlung mit Toripalimab auszusetzen oder dauerhaft zu beenden (siehe Abschnitt 4.2). Wenn die Behandlung mit Toripalimab ausgesetzt oder dauerhaft abgesetzt wird, ist eine systemische Kortikosteroidtherapie (1 bis 2 mg/kg/Tag Prednison oder Äquivalent) anzuwenden, bis eine Besserung auf mindestens Grad 1 eintritt. Bei Verdacht auf Myokarditis sind hochdosierte Steroide (z. B. Methylprednisolon 1 g/Tag intravenös für 3–5 Tage) einzuleiten. Bei Eintreten einer Besserung auf mindestens Grad 1 ist mit dem Ausschleichen der Kortikosteroide zu beginnen. Bei Patienten, bei denen immunvermittelte unerwünschte Wirkungen durch eine Kortikosteroidtherapie nicht beherrschbar sind, ist die Anwendung anderer systemischer Immunsuppressiva zu erwägen. Bei Bedarf sollte bei Endokrinopathien eine Hormonersatztherapie eingeleitet werden.
Die Behandlung mit Toripalimab kann innerhalb von 12 Wochen nach der letzten Toripalimab-Dosis wieder aufgenommen werden, wenn die unerwünschte Wirkung bis auf Grad ≤ 1 abgeklungen und die Kortikosteroiddosis auf ≤ 10 mg Prednison oder Äquivalent pro Tag reduziert wurde.
Bei erneutem Auftreten einer immunvermittelten unerwünschten Wirkung Grad 3 oder bei einer immunvermittelten unerwünschten Wirkung Grad 4 ist die Behandlung mit Toripalimab dauerhaft abzusetzen, ausgenommen bei Endokrinopathien, die mit Ersatzhormonen beherrschbar sind (siehe Abschnitt 4.2 und 4.8).
Nachfolgend sind Empfehlungen zur Behandlung unerwünschter Wirkungen aufgeführt, die nicht zwingend systemische Steroide erfordern (z. B. Endokrinopathien und Hautreaktionen).
Immunvermittelte Pneumonitis
Toripalimab kann eine immunvermittelte Pneumonitis verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome einer Pneumonitis zu überwachen. Bei Verdacht auf Pneumonitis sollte die Diagnose durch eine radiologische Untersuchung und unter Ausschluss anderer Ursachen bestätigt werden. Bei den Patienten sollte je nach klinischer Indikation eine Anpassung der Behandlung mit Toripalimab und die Gabe von Kortikosteroiden erfolgen (siehe Abschnitt 4.2 und die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Immunvermittelte Kolitis
Toripalimab kann eine immunvermittelte Kolitis verursachen, die mit Diarrhö einhergehen kann (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome einer Kolitis zu überwachen. Die Behandlung sollte je nach klinischer Indikation eine Anpassung der Toripalimab-Gabe, die Gabe von Antidiarrhoika und die Gabe von Kortikosteroiden umfassen (siehe Abschnitt 4.2 und die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben). Bei kortikosteroidrefraktärer Kolitis sollte eine Wiederholung der Infektionsdiagnostik in Betracht gezogen werden, um alternative Ursachen auszuschließen. Bei Patienten mit kortikosteroidrefraktärer immunvermittelter Kolitis, die andere PD-1/PD-L1-blockierende Antikörper erhielten, wurde über eine Infektion mit dem bzw. Reaktivierung des Zytomegalievirus (CMV) berichtet.
Hepatotoxizität und immunvermittelte Hepatitis
Toripalimab kann eine immunvermittelte Hepatitis verursachen (siehe Abschnitt 4.8). Die Patienten sind regelmäßig und je nach Indikation auf der Grundlage einer klinischen Bewertung auf Veränderungen der Leberfunktion zu überwachen. Bei den Patienten sollte je nach klinischer Indikation eine Anpassung der Behandlung mit Toripalimab (siehe Abschnitt 4.2) und die Gabe von Kortikosteroiden erfolgen (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Immunvermittelte Endokrinopathien
Nebenniereninsuffizienz
Toripalimab kann eine primäre oder sekundäre Nebenniereninsuffizienz verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome einer Nebenniereninsuffizienz zu überwachen. Bei einer Nebenniereninsuffizienz Grad 2–4 sollte Toripalimab ausgesetzt werden, bis der Patient unter einer physiologischen Hormonersatztherapie klinisch stabil ist (siehe Abschnitt 4.2).
Hypophysitis
Toripalimab kann eine immunvermittelte Hypophysitis verursachen (siehe Abschnitt 4.8). Eine Hypophysitis kann sich mit akuten Symptomen im Zusammenhang mit Masseneffekten wie Kopfschmerzen, Photophobie oder Gesichtsfeldausfällen äußern. Eine Hypophysitis kann Hypopituitarismus verursachen. Die Patienten sind auf Anzeichen und Symptome einer Hypophysitis zu überwachen. Bei einer Hypophysitis Grad 2–4 sollte Toripalimab ausgesetzt werden, bis der Patient unter einer physiologischen Hormonersatztherapie klinisch stabil ist (siehe Abschnitt 4.2).
Schilddrüsenerkrankungen
Toripalimab kann immunvermittelte Schilddrüsenerkrankungen verursachen (siehe Abschnitt 4.8). Die Patienten sind vor der Behandlung, in regelmäßigen Abständen während der Behandlung und wenn es nach klinischer Beurteilung angezeigt ist, auf Anzeichen und Symptome einer Schilddrüsenerkrankung zu überwachen.
Eine Hypothyreose kann mit einer Ersatztherapie ohne Unterbrechung der Toripalimab-Gabe und ohne Kortikosteroide behandelt werden (siehe Abschnitt 4.2). Eine Thyreoiditis kann mit oder ohne begleitende Schilddrüsenfunktionsstörung auftreten. Thyreoiditis und Hyperthyreose können symptomatisch behandelt werden, gegebenenfalls mit Schilddrüsensuppression und/oder einer Kortikosteroidtherapie bei akuter Thyreoiditis. Bei einer Thyreoiditis oder Hyperthyreose Grad ≥ 3 ist die Anwendung von Toripalimab auszusetzen, bis die Erkrankung medizinisch beherrscht und der Patient klinisch stabil ist. Die Patienten sind auf eine Hypothyreose als Folge einer Hyperthyreose oder Thyreoiditis zu überwachen. Zur Sicherstellung einer angemessenen Hormonsubstitution sind die Schilddrüsenfunktion und die Hormonwerte zu überwachen.
Diabetes mellitus Typ 1, gegebenenfalls einhergehend mit diabetischer Ketoazidose
Toripalimab kann einen immunvermittelten Diabetes mellitus Typ 1 verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Hyperglykämie oder andere Anzeichen und Symptome von Diabetes zu überwachen. Bei Diabetes mellitus Typ I sollte je nach klinischer Indikation eine Insulinbehandlung eingeleitet werden und bei Patienten mit Hyperglykämie Grad ≥ 3 sollte die Behandlung mit Toripalimab ausgesetzt werden. Die Behandlung mit Toripalimab kann fortgesetzt werden, wenn der Diabetes durch medizinische Behandlung, einschließlich Insulintherapie, beherrscht und der Patient klinisch stabil ist (siehe Abschnitt 4.2).
Immunvermittelte Nephritis
Toripalimab kann eine immunvermittelte Nephritis verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Veränderungen der Nierenfunktion zu überwachen, und andere Ursachen einer Nierenfunktionsstörung sind auszuschließen. Je nach klinischer Indikation sollten eine Anpassung der Behandlung mit Toripalimab (siehe Abschnitt 4.2) und die Gabe von Kortikosteroiden erfolgen (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Immunvermittelte unerwünschte Wirkungen auf die Haut
Toripalimab kann einen immunvermittelten Hautausschlag oder eine Dermatitis verursachen (siehe Abschnitt 4.8). Bei Patienten, die PD-1/PD-L1-blockierende Antikörper erhielten, wurde über exfoliative Dermatitis, einschließlich Stevens-Johnson-Syndrom, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen sowie toxische epidermale Nekrolyse, berichtet.
Die Patienten sind auf unerwünschte Wirkungen auf die Haut zu überwachen und je nach klinischer Indikation unter Anpassung von Toripalimab (siehe Abschnitt 4.2) und mit Kortikosteroiden zu behandeln (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Immunvermittelte Myokarditis
Toripalimab kann eine immunvermittelte Myokarditis verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome einer Myokarditis zu überwachen. Bei Verdacht auf eine Myokarditis sollte umgehend mit der Gabe hochdosierter Steroide begonnen werden und umgehend eine kardiologische Konsultation mit diagnostischer Abklärung gemäß den aktuellen klinischen Leitlinien erfolgen. Bei den Patienten sollte je nach klinischer Indikation eine Anpassung der Behandlung mit Toripalimab (siehe Abschnitt 4.2) und die Gabe von Kortikosteroiden erfolgen (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben). Wenn sich das Ereignis nicht innerhalb von 48 Stunden nach Beginn der Kortikosteroidtherapie bessert, ist die zusätzliche Gabe von Immunsuppressiva zu erwägen.
Immunvermittelte Myositis
Toripalimab kann eine immunvermittelte Myositis verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome einer Myositis zu überwachen. Bei Verdacht auf Myositis eine serielle Überwachung der Aldolase und Kreatinkinase durchführen und eine diagnostische Abklärung gemäß den aktuellen klinischen Leitlinien erwägen. Bei den Patienten sollte je nach klinischer Indikation eine Anpassung der Behandlung mit Toripalimab (siehe Abschnitt 4.2) und die Gabe von Kortikosteroiden erfolgen (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Andere immunvermittelte unerwünschte Wirkungen
In Anbetracht des Wirkmechanismus von Toripalimab können andere potenzielle immunvermittelte unerwünschte Wirkungen auftreten, einschließlich potenziell schwerwiegender Ereignisse (z. B. Enzephalitis, demyelinisierende Neuropathie [einschließlich Guillain-Barré-Syndrom], myasthenes Syndrom, Sarkoidose, Vaskulitis, Rhabdomyolyse). Zu den klinisch signifikanten immunvermittelten unerwünschten Wirkungen, die bei weniger als 1 % der in den klinischen Studien mit Toripalimab behandelten Patienten berichtet wurden, gehören Pankreatitis, Iritis, Uveitis, immunvermittelte entzündliche Arthritis und immunvermittelte Zystitis. Die Patienten sind auf Anzeichen und Symptome unerwünschter immunvermittelter Wirkungen zu überwachen und je nach klinischer Indikation unter Anpassung von Toripalimab (siehe Abschnitt 4.2) und mit Kortikosteroiden zu behandeln (siehe die Empfehlungen zur Kortikosteroidbehandlung in Abschnitt 4.4 oben).
Transplantationsbedingte unerwünschte Wirkungen
Nach der Markteinführung wurde bei Patienten, die mit PD-1-Inhibitoren behandelt wurden, über eine Abstoßung solider Organtransplantate berichtet. Die Behandlung mit Toripalimab kann das Risiko einer Abstoßung bei Empfängern solider Organtransplantate erhöhen. Bei diesen Patienten ist der Nutzen einer Behandlung mit Toripalimab gegenüber dem Risiko einer möglichen Organabstoßung abzuwägen.
Bei Patienten, die vor oder nach der Behandlung mit einem PD-1/PD-L1-blockierenden Antikörper eine allogene hämatopoetische Stammzelltransplantation (HSCT) erhalten haben, können tödliche und andere schwerwiegende Komplikationen auftreten. Transplantationsbedingte Komplikationen umfassen hyperakute Graft-versus-Host-Reaktion (GvHD), akute GvHD, chronische GvHD, Lebervenenverschlusskrankheit nach Konditionierung mit reduzierter Intensität und steroidpflichtiges Fiebersyndrom ohne identifizierte infektiöse Ursache. Diese Komplikationen können trotz einer intervenierenden Therapie zwischen der PD-1/PD-L1-Blockade und der allogenen HSCT auftreten. Die Patienten sind engmaschig und unter sofortiger Intervention auf Anzeichen transplantationsbedingter Komplikationen zu überwachen. Es ist eine Abwägung des Nutzens gegenüber den Risiken einer Behandlung mit einem PD-1/PD-L1-blockierenden Antikörper vor oder nach einer allogenen HSCT vorzunehmen.
Infusionsbedingte Reaktionen
Toripalimab kann schwere und potenziell lebensbedrohliche infusionsbedingte Reaktionen verursachen (siehe Abschnitt 4.8). Die Patienten sind auf Anzeichen und Symptome infusionsbedingter Reaktionen zu überwachen. Die Patienten sind je nach klinischer Indikation mit einer Anpassung von Toripalimab und einer unterstützenden Therapie zu behandeln (siehe Abschnitt 4.2). Bei Patienten mit infusionsbedingten Reaktionen kann eine Prämedikation mit Antipyretika und Antihistaminika in Betracht gezogen werden, um das Risiko nachfolgender Infusionsreaktionen zu verringern.
Aus klinischen Studien ausgeschlossene Patienten
Patienten mit aktiver Infektion (aktive Tuberkulose oder Hepatitis B oder C oder HIV-Infektion), Immunschwächestatus (systemische Kortikosteroide > 10 mg Prednisonäquivalent pro Tag innerhalb von 2 Wochen nach Randomisierung), aktiver, systemischer Autoimmunerkrankung (ausgenommen adäquat eingestellte/r Hypothyreose oder Diabetes mellitus), aktiven oder unbehandelten Metastasen im Zentralnervensystem, einem Eastern Cooperative Oncology Group (ECOG) Leistungsstatus (Performance Status, PS) ≥ 2 oder interstitieller Lungenerkrankung in der Anamnese kamen für die Teilnahme an klinischen Studien mit Toripalimab nicht infrage. Über Patienten mit schwerer Nieren- oder mittelschwerer bis schwerer Leberfunktionsstörung liegen nur begrenzte Informationen vor (siehe Abschnitt 5.2).
Da keine Daten vorliegen, sollte Toripalimab bei diesen Patienten nach sorgfältiger Abwägung des individuellen Nutzen-Risiko-Verhältnisses mit Vorsicht angewendet werden.
Sonstige Bestandteile mit bekannter Wirkung
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Dosierungseinheit, d.h., es ist nahezu „natriumfrei“.
Es wurden keine formellen Studien zur Erfassung von Wechselwirkungen durchgeführt. Da Toripalimab durch katabolische Vorgänge aus dem Kreislauf ausgeschieden wird, sind keine metabolischen Arzneimittelwechselwirkungen zu erwarten. Toripalimab ist kein Substrat von Cytochrom P450 oder aktiven Wirkstofftransportern. Toripalimab ist kein Zytokin und wahrscheinlich kein Zytokinmodulator. Darüber hinaus ist keine pharmakokinetische (PK) Wechselwirkung von Toripalimab mit niedermolekularen Wirkstoffen zu erwarten. Es gibt keine Hinweise auf Wechselwirkungen, die durch eine unspezifische Clearance durch Antikörperabbau in Lysosomen vermittelt wird.
Die Anwendung von systemischen Kortikosteroiden oder Immunsuppressiva vor Beginn der Behandlung mit Toripalimab ist zu vermeiden, da diese möglicherweise die pharmakodynamische Aktivität und Wirksamkeit von Toripalimab beeinträchtigen. Allerdings können zur Behandlung immunvermittelter unerwünschte Wirkungen nach Beginn der Behandlung mit Toripalimab systemische Kortikosteroide oder andere Immunsuppressiva eingesetzt werden (siehe Abschnitt 4.4). Kortikosteroide können auch als Prämedikation als antiemetische Prophylaxe und/oder zur Linderung chemotherapiebedingter unerwünschter Wirkungen eingesetzt werden, wenn Toripalimab in Kombination mit einer Chemotherapie angewendet wird.
Frauen im gebärfähigen Alter/Verhütung
Frauen im gebärfähigen Alter müssen während der Behandlung mit Toripalimab und für mindestens 4 Monate nach der letzten Toripalimab-Dosis eine zuverlässige Verhütungsmethode anwenden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Toripalimab bei schwangeren Frauen vor. Es wurden keine tierexperimentellen Studien mit Toripalimab durchgeführt. In tierexperimentellen Studien zeigte sich jedoch, dass die Hemmung des PD-1/PD-L1-Signalwegs zu einem erhöhten Risiko einer immunbedingten Abstoßung des sich entwickelnden Fötus und zum Tod des Fötus führen kann (siehe Abschnitt 5.3). Es ist bekannt, dass menschliches Immunglobulin G4 (IgG4) die Plazentaschranke passiert. Daher kann Toripalimab möglicherweise von der Mutter an den sich entwickelnden Fötus übertragen werden. Toripalimab sollte nicht während der Schwangerschaft oder bei Frauen im gebärfähigen Alter angewendet werden, die keine zuverlässige Empfängnisverhütung anwenden, es sei denn, der klinische Nutzen überwiegt das potenzielle Risiko.
Stillzeit
Es ist nicht bekannt, ob Toripalimab in die Muttermilch übergeht. Es ist bekannt, dass Antikörper (einschließlich IgG4) in die Muttermilch übergehen. Ein Risiko für das gestillte Neugeborene/den Säugling kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Toripalimab verzichtet werden soll bzw. die Behandlung mit Toripalimab zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Wenn sich eine Frau für eine Behandlung mit Toripalimab entscheidet, ist sie anzuweisen, während der Behandlung mit Toripalimab und für mindestens 4 Monate nach der letzten Toripalimab-Dosis nicht zu stillen.
Fertilität
Es wurden keine Studien zur Beurteilung der Wirkung von Toripalimab auf die Fertilität durchgeführt (siehe Abschnitt 5.3).
Toripalimab hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bei einigen Patienten wurde nach der Gabe von Toripalimab über Schwindel und Fatigue berichtet (siehe Abschnitt 4.8).
Zusammenfassung des Sicherheitsprofils
Toripalimab in Kombination mit einer platinhaltigen Chemotherapie (siehe Abschnitt 4.2)
Die Sicherheit von Toripalimab in Kombination mit einer platinhaltigen Chemotherapie wurde in den Studien JUPITER-02 bzw. JUPITER-06 bei 403 Patienten mit NPC oder ösophagealem Plattenepithelkarzinom (OSCC) untersucht, die alle 3 Wochen 240 mg Toripalimab erhielten. Die mediane Behandlungsdauer bei diesen Patienten betrug 6,5 Monate (Bereich: 1 Tag bis 2,1 Jahre). Die nachstehend und in Tabelle 2 aufgeführten Häufigkeiten basieren auf allen gemeldeten unerwünschten Arzneimittelwirkungen, unabhängig von der prüfärztlichen Beurteilung der Kausalität. Bei dieser Patientenpopulation waren die häufigsten unerwünschten Wirkungen Anämie (44,9 %), Leukopenie (41,7 %), Neutropenie (39,0 %), Thrombozytopenie (30,3 %), Übelkeit (29,8 %), Erbrechen (27,3 %), Appetitlosigkeit (23,8 %), Hautausschlag (23,8 %), Fatigue (23,6 %), abnormale Leberfunktionstests (22,3 %), Hypothyreose (18,4 %), Obstipation (16,6 %), Neuropathie (15,1 %), Kolitis (14,1 %), Pyrexie (13,6 %), Husten (11,4 %), Pruritus (11,4 %), verminderte renale Kreatinin-Clearance (11,2 %) und Hyponatriämie (10,2 %). Die Häufigkeit von unerwünschten Wirkungen Grad 3–5 betrug bei Patienten mit NPC 81,5 % unter Kombinationstherapie mit Toripalimab und 83,9 % bei alleiniger Anwendung einer Chemotherapie und bei Patienten mit OSCC 24,9 % unter Kombinationstherapie mit Toripalimab und 13,6 % bei alleiniger Anwendung einer Chemotherapie.
Tabellarische Liste unerwünschter Wirkungen
Die in klinischen Studien mit Toripalimab als Monotherapie oder in Kombination mit Chemotherapie beobachteten unerwünschten Wirkungen sind in Tabelle 2 aufgeführt. Unerwünschte Wirkungen sind nach Systemorganklasse und Häufigkeit angegeben. Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1 000, < 1/100); selten (≥ 1/10 000, < 1/1 000); sehr selten (< 1/10 000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen in der Reihenfolge abnehmender Schwere angegeben.
Tabelle 2 enthält nur behandlungsbedingte unerwünschte Arzneimittelwirkungen. Die Häufigkeit unerwünschter Wirkungen aus klinischen Studien basiert auf der Häufigkeit unerwünschter Ereignisse aller Ursachen, wobei ein Teil der Ereignisse für eine unerwünschte Wirkung andere Ursachen als das Arzneimittel haben kann, z. B. die Krankheit, andere Arzneimittel oder nicht verwandte Ursachen. In klinischen Studien berichtete unerwünschte Wirkungen sind nach Systemorganklasse und Häufigkeit angegeben.
Die Sicherheitsdaten basieren auf 1 514 Patienten unter Toripalimab-Exposition (davon wurden 1 100 Patienten mit Toripalimab als Monotherapie und 514 Patienten mit Toripalimab in Kombination mit einer Chemotherapie behandelt) mit einer mittleren (Bereich 0,03 Monate bis 35,9 Monate) Toripalimab-Expositionsdauer von 7,0 Monaten und einer medianen Expositionsdauer von 3,7 Monaten (Interquartilbereich 8,7 Monate) in 15 klinischen Studien der Phase I, II oder III. Abschnitt 5.1 enthält Informationen zu den demografischen Daten und Baseline-Merkmalen der Teilnehmenden der wichtigsten klinischen Studien.
Bei Anwendung von Toripalimab in Kombination mit einer Chemotherapie ist vor Beginn der Behandlung die Fachinformationen für die jeweilige Kombinationstherapiekomponente zu beachten.
Tabelle 2: Unerwünschte Wirkungen bei Patienten unter Behandlung mit Toripalimab | |
Infektionen und parasitäre Erkrankungen | |
Sehr häufig |
Infektion der oberen Atemwege |
Häufig |
Pneumonie, Harnwegsinfektion, Infektion (nicht spezifiziert nach Lokalisation oder Pathogen), Ohrenentzündungen1, Zahn- und orale Weichgewebeinfektionen2, Herpes-simplex-/Herpes-zoster-Infektion |
Gelegentlich |
Konjunktivitis, Gingivitis, Infektionen der Haut und des Unterhautgewebes3, Hautinfektionen, Bakteriämie, Zeheninfektion, Paronychie/Dermatophytose des Nagels, Osteomyelitis, Lungentuberkulose |
Selten |
Divertikulitis, Hepatitis-B-Reaktivierung, Muskelabszess, Urosepsis |
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) | |
Häufig |
Tumorschmerzen |
Gelegentlich |
Tumorhämorrhagie, Tumorruptur |
Selten |
Myelodysplastisches Syndrom |
Erkrankungen des Blutes und des Lymphsystems | |
Sehr häufig |
Anämie, Leukopenie, Neutropenie, Thrombozytopenie |
Häufig |
Leukozytose, Neutrophilie, Lymphopenie |
Gelegentlich |
Koagulopathie, Knochenmarkinsuffizienz, Myelosuppression |
Selten |
Eosinopenie, Panzytopenie |
Erkrankungen des Immunsystems | |
Gelegentlich |
Hypersensitivität/Serumkrankheit |
Endokrine Erkrankungen | |
Sehr häufig |
Hypothyreose |
Häufig |
Hyperthyreose |
Gelegentlich |
Thyreoiditis, Nebenniereninsuffizienz/Cortisol erniedrigt, Schilddrüsenerkrankung (ausgenommen Hypothyreose und Hyperthyreose), Hypophysitis/Empty-Sella-Syndrom |
Selten |
Hyperparathyreoidismus, Hypopituitarismus |
Stoffwechsel- und Ernährungsstörungen | |
Sehr häufig |
Appetitlosigkeit, Hyponatriämie, Gewichtsabnahme, Hypoproteinämie, Hyperglykämie, Hypokaliämie, Hyperurikämie/Gicht |
Häufig |
Hypochlorämie, Hypomagnesiämie, Hypokalzämie, Hypophosphatämie, Hyperkaliämie, Hyperkalzämie, Hypoglykämie, Dehydration |
Gelegentlich |
Elektrolytstörung, Hyperphosphatämie, Hypernatriämie, Säure-Basen-Störung4, Diabetes mellitus, Mangelernährung, Hypovolämie |
Selten |
Hypolipidämie |
Psychiatrische Erkrankungen | |
Häufig |
Hypersomnie/Insomnie |
Gelegentlich |
Depression/Dysphorie, Angststörung |
Selten |
Psychische Erkrankung, Tic |
Erkrankungen des Nervensystems | |
Sehr häufig |
Neuropathie5 |
Häufig |
Schwindel, Kopfschmerzen, Neurotoxizität, Dysgeusie |
Gelegentlich |
Somnolenz, Synkope, Enzephalopathie, Epilepsie, Tremor, Gedächtnisstörung, Dysarthrie, Erkrankung des Nervensystems, Sprachstörung |
Selten |
Aufmerksamkeitsstörung, intrakranielle Hämorrhagie, Paraplegie |
Augenerkrankungen | |
Häufig |
Verschwommenes Sehen |
Gelegentlich |
Augenentzündung6, Augenbewegungsstörung, Papillenödem |
Selten |
Blepharochalasis, glaukomatozyklische Krise, Hypermetropie, retinale Hämorrhagie |
Erkrankungen des Ohrs und des Labyrinths | |
Häufig |
Ohrenerkrankung7 |
Gelegentlich |
Drehschwindel, Taubheit |
Herzerkrankungen | |
Sehr häufig |
Arrhythmie8 |
Gelegentlich |
Perikarderguss, Herzinsuffizienz/kardiale Dysfunktion, Myokarditis/immunvermittelte Myokarditis, Myokardschädigung/Myokardischämie, Herzbeschwerden |
Selten |
Aortenklappeninsuffizienz, Herzerkrankung |
Gefäßerkrankungen | |
Häufig |
Hypertonie, Hypotonie/orthostatische Hypotonie, Embolie und Thrombose |
Gelegentlich |
Phlebitis |
Selten |
Aortenaneurysma, Flushing |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
Sehr häufig |
Husten |
Häufig |
Dyspnoe, Pneumonitis/immunvermittelte Lungenerkrankung/interstitielle Lungenerkrankung, Erkrankungen der oberen Atemwege9, Hämoptyse, Epistaxis, Pleuraerguss, Schluckauf, Dysphonie, allergische Rhinitis |
Gelegentlich |
Verstopfte Nase, Atemversagen, Bronchospasmus, Nebenhöhlenerkrankung, Aspirationspneumonie, verstärkter Auswurf, tracheoösophageale Fistel |
Selten |
Hydrothorax, Pleuritis, Stimmbandverdickung |
Erkrankungen des Gastrointestinaltrakts | |
Sehr häufig |
Übelkeit/Dyspepsie/Aufstoßen, Erbrechen, Obstipation/Dyschezie, Kolitis/Diarrhö, Abdominalschmerzen |
Häufig |
Stomatitis, abdominelle Distension/Flatulenz, Mundtrockenheit, Dysphagie, Zahnschmerzen, gastrointestinale Hämorrhagie, gastroösophageale Refluxkrankheit/Hyperchlorhydrie |
Gelegentlich |
Darmverschluss/Subileus, Gastritis, Gastroenteritis, Ösophagusverschluss, Pankreatitis, Proktalgie, Magenerkrankung, Magengeschwür, Magen-Darm-Erkrankung, Magendilatation, Magenfistel, orale Hypästhesie |
Selten |
Fekalom, Ösophagusulzeration, Pankreaserkrankung, Pneumatosis intestinalis, geschwollene Zunge, Zungenverfärbung |
Leber- und Gallenerkrankungen | |
Sehr häufig |
Hyperbilirubinämie/Ikterus |
Häufig |
Hepatitis10, Gesamtgallensäuren erhöht |
Gelegentlich |
Leberschmerzen, Cholezystitis, Lebersteatose |
Erkrankungen der Haut und des Unterhautgewebes | |
Sehr häufig |
Hautausschlag11, Pruritus |
Häufig |
Alopezie, Vitiligo, Pigmentierungsstörung |
Gelegentlich |
Nachtschweiß, Hauterkrankung, Hautabschälung, Hyperhidrose, trockene Haut, Hautulzeration, Veränderungen der Haarfarbe, Psoriasis, Lichtempfindlichkeitsreaktion, Hauthyperpigmentierung |
Selten |
Dermatomyositis, Leukodermie, Neurodermitis, Onychomadesis, Hautschmerzen, Pannikulitis, Pemphigus, Purpura senile, Teleangiektasie |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
Sehr häufig |
Muskuloskelettale Schmerzen |
Häufig |
Muskelschwäche, Arthritis/verminderte Beweglichkeit der Gelenke/Periarthritis |
Gelegentlich |
Muskelkrämpfe, Bandscheibenvorfall, Myositis |
Selten |
Gliedmaßenraumforderung |
Erkrankungen der Nieren und Harnwege | |
Sehr häufig |
Proteinurie, Hämaturie |
Häufig |
Nierenschädigung/Nephropathie |
Gelegentlich |
Pollakiurie, Hydronephrose, Pyelokaliektasie, Harnleiterdilatation |
Selten |
Nichtinfektiöse Zystitis, Hydroureter, immunvermittelte Nierenerkrankung |
Erkrankungen der Geschlechtsorgane und der Brustdrüse | |
Gelegentlich |
Benigne Prostatahyperplasie, Brustschmerzen, Ödeme im Genitalbereich, Skrotalödem |
Selten |
Hypomenorrhö, Menorrhagie, Menstruationsstörung, unregelmäßige Menstruation, Prostataverkalkung, vulvovaginale Entzündung |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
Sehr häufig |
Fatigue, Pyrexie, Schmerzen12 |
Häufig |
Ödem, grippeartige Erkrankung, Gesichtsödem, Schüttelfrost, Augenerkrankung13 |
Gelegentlich |
Gesichtsschmerzen, Schwellung, Temperaturintoleranz, Durst |
Selten |
Reaktionen an der Verabreichungsstelle, Hyperplasie, Medizinprodukt-bedingte Schmerzen, Sekretabgabe |
Untersuchungen | |
Sehr häufig |
Leberfunktionstest abnormal, Schilddrüsenfunktionstest abnormal, erhöhte oder erniedrigte Lipide, Urinanalyse abnormal14 |
Häufig |
Renale Kreatinin-Clearance verringert, Kreatinphosphokinase im Blut verringert/Kreatinphosphokinase im Blut erhöht, Laktatdehydrogenase im Blut erhöht, Amylase erhöht, Lymphozytenzahl abnormal/Monozytenzahl abnormal, alkalische Phosphatase im Blut erhöht, Harnstoff im Blut erhöht, Gewichtszunahme, Lipase erhöht, Elektrokardiogramm abnormal, C-reaktives Protein erhöht, okkultes Blut positiv, Herzuntersuchung abnormal15 |
Gelegentlich |
Thrombozytenzahl erhöht, positive Anti-Schilddrüsen-Antikörper, Eosinophilenzahl abnormal, Prolaktinspiegel im Blut erhöht, Testosteronspiegel im Blut vermindert, Follikel-stimulierendes Hormon im Blut erhöht, luteinisierendes Hormon im Blut erhöht, Urinausscheidung vermindert |
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen | |
Gelegentlich |
Infusionsbedingte Reaktion, Kontusion/Muskelverletzung, Rippenfraktur |
Die folgenden Begriffe stellen eine Gruppe zusammengehöriger Ereignisse dar, die einen medizinischen Zustand und nicht ein einzelnes Ereignis beschreiben.
1Ohreninfektionen umfassen Mastoiditis, Myringitis und Otitis media. |
2Zahn- und orale Weichgewebeinfektionen umfassen orale Candidiasis, Perikoronitis und Parodontitis. |
3Infektionen der Haut und des Unterhautgewebes umfassen Cellulitis, Follikulitis und subkutaner Abszess. |
4Säure-Basen-Störung umfasst metabolische Azidose, metabolische Alkalose und Stoffwechselerkrankung. |
5Neuropathie umfasst Anästhesie, Anosmie, Kribbeln, Hypästhesie, Lhermitte-Zeichen, Nervenverletzung, periphere Neuropathie, Parästhesie, Parosmie, periphere motorische Neuropathie, periphere sensorische Neuropathie, Peroneusparese, Zungenlähmung, Störung des VI. Hirnnervs, Verletzung des VI. Hirnnervs und Stimmbandlähmung. |
6Augenentzündung umfasst Augenentzündung, Iritis, Keratitis und Uveitis. |
7Ohrenerkrankung umfasst Ohrenschmerzen, Erkrankung der Eustachischen Röhre, Hypoakusis, Mittelohrentzündung, Otorrhö und Tinnitus. |
8Basierend auf einer Standardabfrage einschließlich Bradyarrhythmien und Tachyarrhythmien. |
9Erkrankungen der oberen Atemwege umfassen Katarrh, trockener Rachen, Kehlkopfödem, Kehlkopfschmerzen, verstopfte Nase, Rhinalgie, Rhinorrhö und Rachenreizung. |
10Hepatitis umfasst arzneimittelbedingte Leberschädigung, Leberversagen, Leberfunktion abnormal und immunvermittelte Hepatitis. |
11Hautausschlag umfasst Dermatitis, akneiforme Dermatitis, allergische Dermatitis, Arzneimittelexanthem, Ekzem, Erythem, Erythema multiforme, Handdermatitis, palmar-plantares Erythrodysästhesie-Syndrom, Papel, Hautausschlag, erythematöser Ausschlag, generalisierter Ausschlag, makulopapulöser Ausschlag, papulöser Ausschlag, juckender Ausschlag, pustulöser Ausschlag, vesikulärer Ausschlag, Hautplaque und Urtikaria. |
12Schmerzen umfassen Brustkorbbeschwerden, Brustkorbschmerzen, Augenschmerzen, Lymphknotenschmerzen, nicht-kardiale Brustkorbschmerzen und Schmerzen. |
13Augenerkrankung umfasst Katarakt, Diplopie, trockenes Auge, Augenjucken und Augenschwellung. |
14Urinanalyse abnormal umfasst Vorhandensein von Bilirubin im Urin, Vorhandensein von Kristallen im Urin, Vorhandensein von Glucose im Urin, Harnstoff im Urin erhöht, Harnzylinder, Vorhandensein von Harnzylindern, Vorhandensein von Urinsediment, Bilirubin im Urin erhöht, Vorhandensein von Ketonkörperchen im Urin, Urobilinogen im Urin erhöht und Urin positiv auf Leukozyten. |
15Herzuntersuchung abnormal umfasst erhöhte Kreatinphosphokinase MB im Blut, erhöhtes B-Typ natriuretisches Peptid und erhöhtes Troponin. |
Beschreibung ausgewählter unerwünschter Wirkungen
Die Daten zu den folgenden immunvermittelten unerwünschten Wirkungen basieren auf 403 Patienten unter Behandlung mit Toripalimab in einer Dosis von 240 mg alle 3 Wochen in Kombination mit einer Platin- und Gemcitabin-Chemotherapie (n = 146) oder in Kombination mit Cisplatin und Paclitaxel (n = 257). Die Empfehlungen zur Behandlung dieser unerwünschten Wirkungen sind in den Abschnitten 4.2 und 4.4 beschrieben.
Immunvermittelte unerwünschte Wirkungen (siehe Abschnitt 4.4).
Immunvermittelte Pneumonitis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Pneumonitis bei 3,2 % (13/403) der Patienten auf, die Toripalimab erhielten, einschließlich 2 unerwünschter Wirkungen Grad 3 (0,5 %) und 7 unerwünschter Wirkungen Grad 2 (1,7 %). Die mediane Zeit bis zum Auftreten der Pneumonitis betrug 5,4 Monate (Bereich 1,3 bis 16,6 Monate). Die mediane Dauer betrug 2,8 Monate (Bereich 0,8 bis 20,9 Monate). 69,2 % (9/13) der Patienten erhielten Kortikosteroide. Bei 3 Patienten (0,7 %) wurde Toripalimab dauerhaft abgesetzt und bei 5 Patienten (1,2 %) ausgesetzt. Bei 31,0 % (4/13) der Patienten heilte die immunvermittelte Pneumonitis aus.
Immunvermittelte Kolitis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Kolitis bei 0,7 % (3/403) der Patienten auf, die Toripalimab erhielten, einschließlich 2 unerwünschter Wirkungen Grad 3 (0,5 %) und 1 unerwünschten Wirkung Grad 2 (0,2 %). Die mediane Zeit bis zum Auftreten der Kolitis betrug 3,7 Monate (Bereich 1,5 bis 5,1 Monate). Die mediane Dauer betrug 1,3 Monate (Bereich 1,3 bis 1,3 Monate). 66,7 % (2/3) dieser Patienten erhielten Kortikosteroide. Bei 2 Patienten (0,5 %) wurde Toripalimab dauerhaft abgesetzt und bei 1 Patienten (0,2 %) ausgesetzt. Bei 33 % (1/3) dieser Patienten heilte die immunvermittelte Kolitis aus.
Hepatotoxizität und immunvermittelte Hepatitis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Hepatitis bei 2,0 % (8/403) der Patienten auf, die Toripalimab erhielten, einschließlich 2 unerwünschter Wirkungen Grad 4 (0,5 %), 5 unerwünschter Wirkungen Grad 3 (1,2 %) und 1 unerwünschten Wirkung Grad 2 (0,2 %). Die mediane Zeit bis zum Auftreten der Hepatitis betrug 4,0 Monate (Bereich 0,7 bis 22,7 Monate). Die mediane Dauer betrug 0,6 Monate (Bereich 0,4 bis 3,2 Monate). Von den 8 Patienten erhielten 7 (87,5 %) Kortikosteroide. Bei 5 Patienten (1,2 %) wurde Toripalimab dauerhaft abgesetzt und bei 2 Patienten (0,5 %) ausgesetzt. Bei 87,5 % (7/8) dieser Patienten heilte die immunvermittelte Hepatitis aus.
Immunvermittelte Endokrinopathien
In den Studien JUPITER-02 und JUPITER-06 trat eine Nebenniereninsuffizienz bei 0,2 % (1/403) der Patienten auf, die Toripalimab erhielten, einschließlich 1 unerwünschten Wirkung Grad 3 (0,2 %). Die Zeit bis zum Auftreten der unerwünschten Wirkung betrug 2,0 Monate. Dieser Patient wurde mit Kortikosteroiden behandelt. Toripalimab wurde dauerhaft abgesetzt.
In den Studien JUPITER-02 und JUPITER-06 trat eine Thyreoiditis bei 2,0 % (8/403) der Patienten auf, die Toripalimab erhielten, einschließlich 4 unerwünschter Wirkungen Grad 2 (1,0 %) und 4 unerwünschter Wirkungen Grad 1 (1,0 %). Die mediane Zeit bis zum Auftreten der Thyreoiditis betrug 5,9 Monate (Bereich 0,7 bis 13,5 Monate). Die mediane Dauer betrug 11,7 Monate (Bereich 7,4 bis 17,8 Monate). Kortikosteroide waren bei 1/8 Patienten (12,5 %) und eine Hormonersatztherapie war bei 5/8 Patienten (62,5 %) erforderlich. Bei 1/403 Patienten (0,2 %) wurde Toripalimab dauerhaft abgesetzt und bei 1/403 Patienten (0,2 %) unterbrochen. Bei 12,5 % (1/8) dieser Patienten heilte die Thyreoiditis aus.
In den Studien JUPITER-02 und JUPITER-06 trat eine Hyperthyreose bei 2,0 % (8/403) der Patienten auf, die Toripalimab erhielten, wobei es sich jeweils um unerwünschte Wirkungen Grad 1 handelte. Die mediane Zeit bis zum Auftreten der Hyperthyreose betrug 6,5 Monate (Bereich 1,5 bis 12,5 Monate). Die mediane Dauer betrug 1,4 Monate (Bereich 0,7 bis 3,7 Monate).
In den Studien JUPITER-02 und JUPITER-06 trat eine Hypothyreose bei 17,1 % (69/403) der Patienten auf, die Toripalimab erhielten, einschließlich 46 unerwünschter Wirkungen Grad 2 (11,4 %) und 23 unerwünschter Wirkungen Grad 1 (5,7 %). Die mediane Zeit bis zum Auftreten der Hypothyreose betrug 5,9 Monate (Bereich 1,2 bis 20,7 Monate). Die mediane Dauer betrug 3,2 Monate (Bereich 0,4 bis 30,6 Monate). Bei 72,5 % (50/69) der Patienten war eine Schilddrüsenhormonersatztherapie erforderlich. 1/69 Patienten (1,4 %) erhielt Kortikosteroide. Toripalimab wurde bei keinem Patienten dauerhaft abgesetzt und bei 1,2 % (5/403) unterbrochen.
In den Studien JUPITER-02 und JUPITER-06 trat Diabetes mellitus bei 0,2 % (1/403) der Patienten auf, die Toripalimab erhielten, einschließlich 1 unerwünschten Wirkung Grad 3 (0,2 %) und keiner unerwünschten Wirkung Grad 2. Die mediane Zeit bis zum Auftreten des Diabetes mellitus betrug 0,7 Monate. Der Patient erhielt keine Kortikosteroide, wurde aber mit Insulin behandelt. Bei dem Patienten wurde Toripalimab weder dauerhaft abgesetzt noch unterbrochen.
In den Studien JUPITER-02 und JUPITER-06 trat eine Hypophysitis bei 0,2 % (1/403) der Patienten auf, die Toripalimab erhielten, einschließlich 1 unerwünschten Wirkung Grad 2 (0,2 %). Die mediane Zeit bis zum Auftreten der Hypophysitis betrug 23,7 Monate. Es wurden Kortikosteroide gegeben, und bei dem Patienten wurde Toripalimab weder dauerhaft abgesetzt noch unterbrochen.
Immunvermittelte unerwünschte Wirkungen auf die Haut
In den Studien JUPITER-02 und JUPITER-06 traten immunvermittelte unerwünschte Wirkungen auf die Haut bei 9,4 % (38/403) der Patienten auf, die Toripalimab erhielten, einschließlich 12 unerwünschter Wirkungen Grad 3 (3,0 %) und 8 unerwünschter Wirkungen Grad 2 (2,0 %). Die mediane Zeit bis zum Auftreten immunvermittelter unerwünschter Wirkungen auf die Haut betrug 1,0 Monate (Bereich 0,1 bis 23,1 Monate). Die mediane Dauer betrug 1,2 Monate (Bereich 0,1 bis 13,1 Monate). Die Gabe systemischer Kortikosteroide war bei 18,4 % (7/38) der Patienten mit immunvermittelten unerwünschten Wirkungen auf die Haut erforderlich. Bei 1,5 % (6) der Patienten führten immunvermittelte unerwünschte Wirkungen auf die Haut zum dauerhaften Absetzen oder zur Unterbrechung von Toripalimab. Bei 73,7 % (28/38) dieser Patienten klangen die immunvermittelten unerwünschten Wirkungen auf die Haut ab.
Immunvermittelte Myokarditis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Myokarditis bei 0,7 % (3/403) der Patienten auf, die Toripalimab erhielten, einschließlich 2 unerwünschter Wirkungen Grad 4 (0,5 %) und 1 unerwünschten Wirkung Grad 3 (0,2 %). Die mediane Zeit bis zum Auftreten der immunvermittelten Myokarditis betrug 1,7 Monate (Bereich 1,4 bis 4,1 Monate). Die mediane Dauer betrug 1,3 Monate (Bereich 1,0 bis 1,6 Monate). Alle drei Patienten mit immunvermittelter Myokarditis erhielten Kortikosteroide. Zwei Patienten setzten Toripalimab dauerhaft ab, und kein Patient unterbrach die Dosierung. Bei 33,3 % (1/3) dieser Patienten heilte die immunvermittelte Myokarditis aus.
Immunvermittelte Myositis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Myositis bei 0,5 % (2/403) der Patienten auf, die Toripalimab erhielten, einschließlich 2 unerwünschter Wirkungen Grad 3 (0,5 %) und keiner unerwünschten Wirkung Grad 2. Die mediane Zeit bis zum Auftreten einer immunvermittelten Myositis betrug 2,5 Monate (Bereich 1,2 bis 3,9 Monate). Die zwei Patienten mit immunvermittelter Myokarditis erhielten Kortikosteroide, und bei beiden wurde Toripalimab dauerhaft abgesetzt.
Immunvermittelte Nephritis
In den Studien JUPITER-02 und JUPITER-06 trat eine immunvermittelte Nephritis bei 0,2 % (1/403) der Patienten auf, die Toripalimab erhielten. Die Zeit bis zum Auftreten der immunvermittelten Nephritis betrug 18,2 Monate und die Dauer betrug 3,3 Monate. Der Patient mit immunvermittelter Nephritis (Grad 4) benötigte systemische Kortikosteroide und die Nephritis führte zum Absetzen von Toripalimab. Die Nephritis bei diesem Patienten heilte aus.
Andere immunvermittelte unerwünschte Wirkungen
In den Studien JUPITER-02 und JUPITER-06 trat bei 0,5 % (2/403) der Patienten, die Toripalimab erhielten, eine immunvermittelte Zystitis auf, einschließlich 1 unerwünschten Wirkung Grad 3 (0,2 %) und 1 unerwünschten Wirkung Grad 1 (0,2 %). Die mediane Zeit bis zum Auftreten der immunvermittelten Zystitis betrug 5,0 Monate (Bereich 3,4 bis 6,6 Monate). Der eine Patient mit Zystitis Grad 3 benötigte eine Kortikosteroidtherapie und setzte Toripalimab außerdem dauerhaft ab. Der andere Patient unterbrach die Dosierung nicht. Bei dem einen Patienten mit Zystitis Grad 3, der eine Kortikosteroidtherapie erhielt, heilte die immunvermittelte Zystitis aus.
Infusionsbedingte Reaktionen
Von den 403 Patienten in den Studien JUPITER-02 oder JUPITER-06, die Toripalimab in Kombination mit einer platinhaltigen Chemotherapie erhielten, traten bei 11 Patienten (2,7 %) infusionsbedingte Reaktionen auf, einschließlich unerwünschter Wirkungen Grad 4 (0,2 %), Grad 3 (0,2 %) und Grad 2 (0,5 %).
Insgesamt traten bei 28 (1,8 %) von 1 514 Patienten unter Behandlung mit Toripalimab infusionsbedingte Reaktionen auf, einschließlich von Reaktionen Grad 4 (0,07 %) und Grad 3 (0,13 %). Bei 3 Patienten (0,2 %) führten infusionsbedingte Reaktionen zum dauerhaften Absetzen von Toripalimab. Häufige Symptome einer infusionsbedingten Reaktion sind Fieber, Schüttelfrost, Hautausschlag, Juckreiz, Übelkeit und Hypotonie.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht die Möglichkeit einer Immunogenität. Bei Patienten, die Toripalimab erhielten, wurden bei 8,7 % (128/1 479) der auswertbaren getesteten Patienten behandlungsbedingte Antikörper gegen Toripalimab nachgewiesen. Es gab keine Hinweise auf einen klinisch relevanten Effekt der Entwicklung von Antikörpern gegen Toripalimab auf dessen Pharmakokinetik. In allen Studien betrug die mediane Zeit bis zum Auftreten der Anti-Drug-Antikörper (ADA) 46 Tage (Bereich 14 bis 506 Tage). Die Anzahl der Patienten ist nicht ausreichend, um die Wirkung von ADA auf die Wirksamkeit angemessen beurteilen zu können.
Ältere Patienten
Von den 403 Patienten, die in klinischen Studien mit Toripalimab in Kombination mit einer platinbasierten Chemotherapie behandelt wurden, waren 73,2 % (295/403) jünger als 65 Jahre und 26,8 % (108/403) 65 Jahre oder älter.
Insgesamt wurden zwischen Patienten ≥ 65 Jahren und jüngeren Patienten, die Toripalimab erhielten, keine Unterschiede im Hinblick auf die Sicherheit festgestellt.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierli che Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, je den Verdachtsfall einer Nebenwirkung dem
Paul-Ehrlich-Institut
Paul-Ehrlich-Straße 51–59
63225 Langen
Website: www.pei.de
E-Mail: pharmakovigilanz@pei.de
anzuzeigen.
Im Falle einer Überdosierung sollten die Patienten engmaschig auf Anzeichen oder Symptome von unerwünschten Wirkungen überwacht und eine angemessene symptomatische Behandlung eingeleitet werden.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, ATC-Code: L01FF13
Wirkmechanismus
Toripalimab ist ein humanisierter monoklonaler IgG4-Antikörper, der an den PD-1-Rezeptor bindet und dessen Wechselwirkung mit PD-L1 und PD-L2 blockiert. Dadurch wird die über den PD-1-Signalweg vermittelte Hemmung der Immunantwort, einschließlich der Antitumor-Immunantwort, aufgehoben. Die Bindung der PD-1-Liganden PD-L1 und PD-L2 an den PD-1-Rezeptor auf T-Zellen hemmt die Proliferation, die Zytokinproduktion und die zytotoxische Aktivität der T-Zelle.
Klinische Wirksamkeit und Sicherheit
Nasopharynxkarzinom
Die Wirksamkeit von Toripalimab in Kombination mit Cisplatin und Gemcitabin wurde in der Studie JUPITER-02 untersucht, einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie mit 289 Patienten mit metastasiertem oder rezidivierendem, lokal fortgeschrittenem Nasopharynxkarzinom (NPC), bei dem eine kurative Therapie nicht infrage kam und die zuvor keine systemische Chemotherapie wegen rezidivierender oder metastasierender Erkrankung erhalten hatten. Bei Patienten mit rezidivierendem NPC nach einer Behandlung mit kurativer Intention musste zwischen der letzten Dosis der Strahlentherapie oder Chemotherapie und dem Rezidiv ein zeitlicher Abstand von mindestens 6 Monaten liegen. Patienten mit Autoimmunerkrankung, ausgenommen eine stabile Hypothyreose oder Typ-I-Diabetes, und Patienten, die eine systemische Immunsuppression benötigten, waren von der Teilnahme ausgeschlossen.
Die Randomisierung erfolgte stratifiziert nach ECOG-PS (0 vs. 1) und Krankheitsstadium (rezidivierend vs. metastasiert) zum Zeitpunkt der Aufnahme in die Studie. Die Patienten wurden randomisiert (1:1), um eine der folgenden Behandlungen zu erhalten:
240 mg Toripalimab intravenös an Tag 1 in Kombination mit Cisplatin 80 mg/m2 an Tag 1 und Gemcitabin 1 000 mg/m2 an den Tagen 1 und 8 alle 3 Wochen für bis zu 6 Zyklen, gefolgt von 240 mg Toripalimab einmal alle 3 Wochen, oder
Placebo intravenös an Tag 1 in Kombination mit Cisplatin 80 mg/m2 an Tag 1 und Gemcitabin 1 000 mg/m2 an den Tagen 1 und 8 alle 3 Wochen für bis zu 6 Zyklen, gefolgt von Placebo einmal alle 3 Wochen.
Die Behandlung mit Toripalimab oder Placebo wurde bis zum Fortschreiten der Krankheit gemäß den Kriterien zur Bewertung des Ansprechens bei soliden Tumoren
(RECIST) Version 1.1 (mit der nachstehend genannten Ausnahme), dem Auftreten inakzeptabler Toxizität oder maximal 2 Jahre lang fortgesetzt. Die Gabe von Toripalimab war über die radiologische Progression hinaus zulässig, wenn der Patient nach Einschätzung des Prüfarztes davon profitierte. Tumorbeurteilungen wurden in den ersten 12 Monaten alle 6 Wochen und danach alle 9 Wochen durchgeführt. Der wichtigste Wirksamkeitsindikator war das progressionsfreie Überleben (PFS) gemäß RECIST Version 1.1 per Beurteilung durch einen verblindeten unabhängigen Prüfausschuss (Blinded Independent Review Committee, BIRC).
Die Merkmale des Studienkollektivs waren: medianes Alter 48 Jahre (Bereich: 19 bis 72 Jahre), 4,8 % im Alter von 65 Jahren oder älter, 83 % männlich, 100 % Asiaten und ECOG-PS von 0 (57 %) oder 1 (43 %). Bei ungefähr 86 % des Studienkollektivs lag zum Zeitpunkt der Randomisierung eine metastasierende Erkrankung vor, darunter bei 98 % ein nicht-keratinisierendes Plattenepithelkarzinom und bei 1 % ein keratinisierendes Plattenepithelkarzinom als histologische Unterformen eines NPC und bei 1 % ein nicht klassifiziertes NPC/andere. Die meisten Patienten (63 %) hatten einen Epstein-Barr-Virus(EBV)-Serumtiter ≥ 2 000 E/ml.
Die Studie zeigte bei Patienten, die randomisiert Toripalimab in Kombination mit Cisplatin/Gemcitabin erhielten, im Vergleich zu Cisplatin und Gemcitabin mit Placebo statistisch signifikante Verbesserungen des PFS per BIRC-Beurteilung und des OS.
Die Wirksamkeitsergebnisse sind nachstehend in Tabelle 3, Abbildung 1 und Abbildung 2 zusammengefasst.
Tabelle 3: Wirksamkeitsergebnisse in der Studie JUPITER-02
Endpunkte1 |
Toripalimab + Cisplatin/ Gemcitabin |
Placebo + Cisplatin/ Gemcitabin |
Progressionsfreies Überleben (PFS) per BIRC-Beurteilung |
||
Anzahl an PFS-Ereignissen (%) |
63 (43,2) |
87 (60,8) |
Medianes PFS, Monate (95 %-KI) |
21,4 (11,7; n. a.) |
8,2 (7,0; 9,8) |
Hazard Ratio (95 %-KI)2 |
0,52 (0,37; 0,73) |
|
Nominaler p-Wert3 |
< 0,0001 |
|
Gesamtüberleben (OS) |
||
Anzahl der Sterbefälle (%) |
57 (39,0) |
76 (53,1) |
Medianes OS, in Monaten (95 %-KI) |
n. a. (38,7; n. a.) |
33,7 (27,0; 44,2) |
Hazard Ratio (95 %-KI)2 |
0,63 (0,45; 0,89) |
|
p-Wert3 |
0,0083 |
|
1Die PFS-Abschlussanalyse beruhte auf den Daten mit einem Cutoff-Datum zum 08. Juni 2021 und die OS-Abschlussanalyse beruhte auf den Daten mit einem Cutoff-Datum zum 18. November 2022.
2Die Hazard Ratio und ihr Konfidenzintervall wurden mithilfe eines geschichteten Cox-Proportional-Hazards-Modells berechnet.
3Zweiseitiger p-Wert, basierend auf einem stratifizierten Log-Rank-Test.
BIRC = verblindeter unabhängiger Prüfausschuss (Blinded Independent Review Committee); KI = Konfidenzintervall; n. a. = nicht abschätzbar
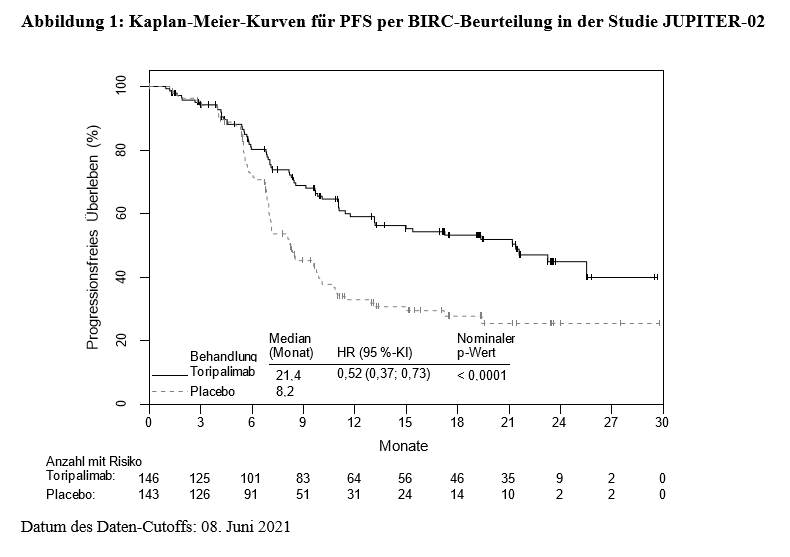
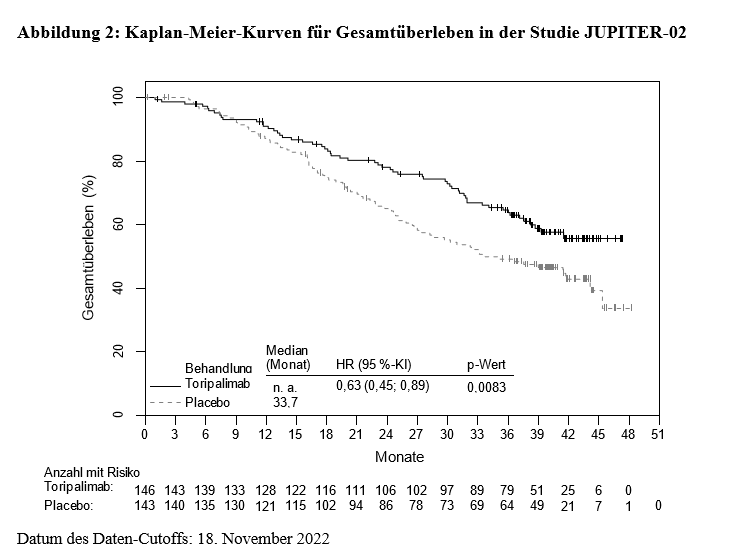
In explorativen PFS- und OFS-Subgruppenanalysen schien das Ausmaß der Therapieeffekte in den Patientenuntergruppen auf der Grundlage der PD-L1-Expression oder der EBV-Titer ähnlich zu sein.
Ältere Patienten
Eine Minderheit der Patienten (4,8 %; 14/289) war ≥ 65 Jahre alt. Die Daten sind zu begrenzt, um Schlussfolgerungen zu dieser Patientengruppe zu ziehen.
Ösophageales Plattenepithelkarzinom
Die Wirksamkeit von Toripalimab in Kombination mit Paclitaxel and Cisplatin wurde in der Studie JUPITER‑06 untersucht, einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie in einer einzelnen Region mit 514 Patienten mit metastasiertem oder rezidivierendem, lokal fortgeschrittenem ösophagealem Plattenepithelkarzinom (OSCC), die zuvor keine systemische Chemotherapie wegen rezidivierender oder metastasierender Erkrankung erhalten hatten. Bei Patienten mit rezidivierendem OSCC nach einer Behandlung mit kurativer Intention musste zwischen der letzten Dosis der adjuvanten, neoadjuvanten Chemotherapie, Strahlentherapie oder Radiochemotherapie und dem Rezidiv ein zeitlicher Abstand von mindestens 6 Monaten oder zwischen der letzten Dosis einer adjuvanten Chemotherapie/Radiochemotherapie mit Paclitaxel und Cisplatin ein zeitlicher Abstand von mindestens 12 Monaten liegen. Patienten mit Autoimmunerkrankung, ausgenommen eine stabile Hypothyreose oder Typ-I-Diabetes, und Patienten, die eine systemische Immunsuppression benötigten, waren von der Teilnahme ausgeschlossen.
Die Randomisierung erfolgte stratifiziert nach ECOG-PS (0 vs. 1) und vorheriger Strahlentherapie (ja vs. nein). Die Patienten wurden randomisiert (1:1), um eine der folgenden Behandlungen zu erhalten:
240 mg Toripalimab intravenös in Kombination mit Paclitaxel 175 mg/m2 intravenös und Cisplatin 75 mg/m2 intravenös an Tag 1 alle 3 Wochen für 4 bis 6 Zyklen, gefolgt von 240 mg Toripalimab einmal alle 3 Wochen, oder
Placebo intravenös in Kombination mit Paclitaxel 175 mg/m2 intravenös und Cisplatin 75 mg/m2 intravenös an Tag 1 alle 3 Wochen für 4 bis 6 Zyklen, gefolgt von Placebo einmal alle 3 Wochen.
Die Behandlung mit Toripalimab oder Placebo wurde bis zum Fortschreiten der Krankheit gemäß RECIST Version 1.1, dem Auftreten inakzeptabler Toxizität oder maximal 2 Jahre lang fortgesetzt. Tumorbeurteilungen wurden in den ersten 12 Monaten alle 6 Wochen und danach alle 9 Wochen durchgeführt. Die koprimären Endpunkte waren das progressionsfreie Überleben (PFS) gemäß RECIST Version 1.1 per Beurteilung durch einen verblindeten unabhängigen Prüfausschuss (Blinded Independent Review Committee, BIRC) und das OS.
Die Merkmale des Studienkollektivs waren: medianes Alter 63 Jahre (Bereich: 20 bis 75 Jahre), 38 % im Alter von 65 Jahren oder älter, 85 % männlich, 100 % Asiaten und ECOG-PS von 0 (26 %) oder 1 (74 %). Bei 79 % Prozent der Patienten war die Erkrankung zum Zeitpunkt der Aufnahme in die Studie metastasiert.
Die Ergebnisse der Abschlussanalyse des vom BIRC festgestellten PFS zeigten eine statistisch signifikante Verbesserung des PFS. Bei der Abschlussanalyse des OS (Daten-Cutoff 23. Februar 2023) ergab die Studie eine konsistente Verbesserung des OS (HR 0,72; 95 %-KI 0,58‑0,88).
In Tabelle 4, Abbildung 3 und Abbildung 4 nachstehend sind die Wirksamkeitsergebnisse in Bezug auf das OS und das PFS per BIRC-Beurteilung zusammengefasst.
Tabelle 4: Wirksamkeitsergebnisse in der Studie JUPITER-06
Toripalimab + Paclitaxel/Cisplatin |
Placebo + Paclitaxel/Cisplatin |
|
Gesamtüberleben (OS)1 |
||
Anzahl an OS-Ereignissen (%) |
172 (66,9) |
195 (75,9) |
Medianes OS, Monate (95 %-KI) |
17,7 (14,6; 20,8) |
12,9 (11,6; 14,1) |
Hazard Ratio (95 %-KI)2 |
0,72 (0,58; 0,88) |
|
p-Wert3 |
0,0016 |
|
Progressionsfreies Überleben (PFS) per BIRC-Beurteilung4 |
||
Anzahl an PFS-Ereignissen (%) |
132 (51,4) |
164 (63,8) |
Medianes PFS, Monate (95 %-KI) |
5,7 (5,6; 7,0) |
5,5 (5,2; 5,6) |
Hazard Ratio2 (95 %-KI) |
0,58 (0,46; 0,74) |
|
p-Wert3 |
< 0,0001 |
|
1Der Daten-Cutoff für die Abschlussanalyse des OS war der 23. Februar 2021.
2Die Hazard Ratio und ihr Konfidenzintervall wurden mithilfe des geschichteten Cox-Proportional-Hazards-Modells berechnet.
3Zweiseitiger p-Wert, basierend auf dem stratifizierten Log-Rank-Test.
4Der Daten-Cutoff für die Abschlussanalyse des PFS war der 22. März 2021.
BIRC = verblindeter unabhängiger Prüfausschuss (Blinded Independent Review Committee); KI = Konfidenzintervall
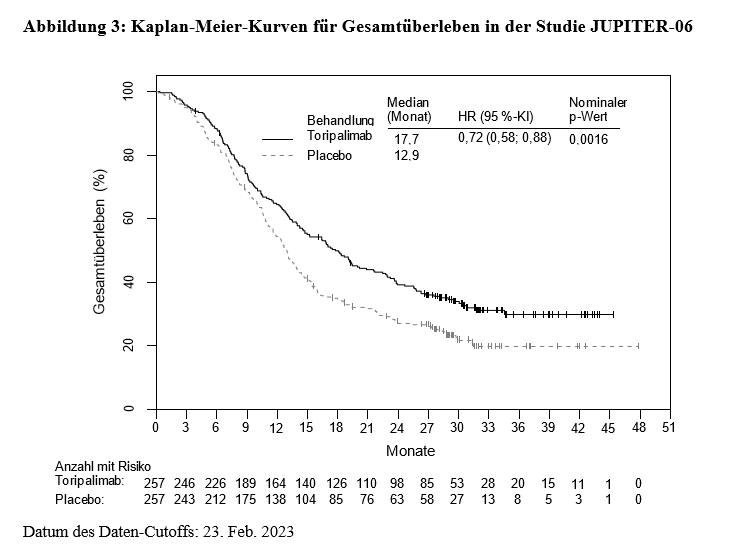
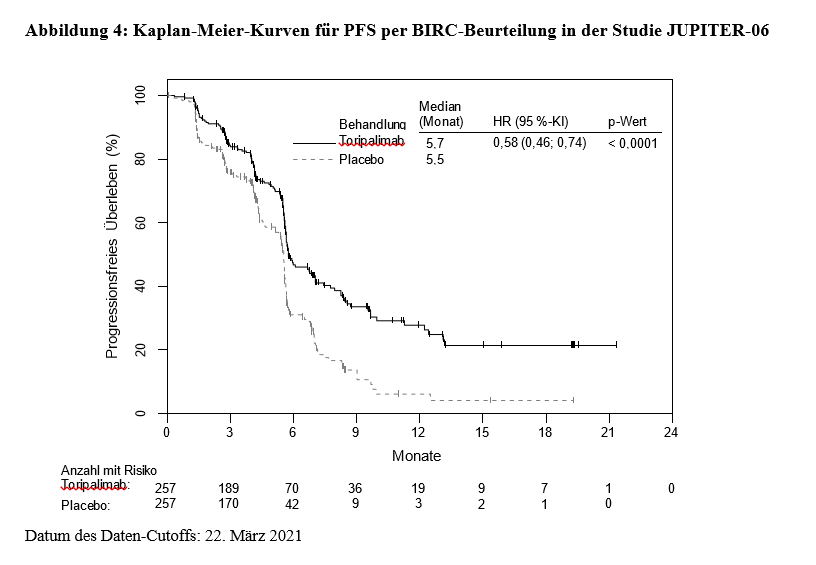
Wirksamkeit und PD-L1-Status
In explorativen PFS- und OS-Subgruppenanalysen schien die Größenordnung der Behandlungseffekte in allen Patientenuntergruppen auf der Grundlage der PD-L1-Expression ähnlich zu sein.
Ältere Patienten
Es gab 195 Patienten (38 %), die 65 Jahre oder älter waren. Insgesamt wurden zwischen Patienten ≥ 65 Jahren und jüngeren Patienten, die Toripalimab in Kombination mit Paclitaxel/Cisplatin erhielten, keine Unterschiede im Hinblick auf die Wirksamkeit festgestellt.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für LOQTORZI eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen aus Studien in allen pädiatrischen Altersklassen zur Behandlung aller Erkrankungen in der Kategorie maligne Neoplasien (mit Ausnahme von Neoplasien im ZNS, hämatopoietischen Neoplasien, Neoplasien in lymphoidem Gewebe und Melanom) gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Pharmakokinetik von Toripalimab wurde mithilfe von Populations-PK-Analysen charakterisiert, die Daten von 574 Patienten aus 5 klinischen Studien zu verschiedenen soliden Tumoren umfassten, die eine feste (80 bis 480 mg q2w oder q3w) oder gewichtsbasierte (Bereich: 1 bis 10 mg/kg q2w) Dosierung erhielten, darunter 92 Patienten mit NPC und 236 Patienten mit OSCC, die in der Studie JUPITER-02 bzw. JUPITER-06 Toripalimab alle 3 Wochen in einer Dosis von 240 mg erhielten.
Sofern nicht anders angegeben, sind die pharmakokinetischen Parameter von Toripalimab als geometrischer Mittelwert (Variationskoeffizient [VK] %) angegeben.
Resorption
Toripalimab wird intravenös gegeben, daher ist es vollständig bioverfügbar.
Verteilung
Toripalimab verteilt sich hauptsächlich im Plasma mit einem geometrischen mittleren Verteilungsvolumen im Steady-State von etwa 3,8 l (VK = 27,4 %).
Biotransformation
Es wurden keine dedizierten Studien zur Metabolisierung durchgeführt. Da es sich bei Toripalimab um einen monoklonalen Antikörper handelt, wird es voraussichtlich katabolisch oder durch rezeptorvermittelte Endozytose zu kleinen Peptiden, Aminosäuren und kleinen Kohlenhydraten metabolisiert. Die Abbauprodukte werden renal ausgeschieden oder ohne biologische Wirkung in den Nährstoffpool zurückgeführt.
Elimination
Die Pharmakokinetik von Toripalimab folgte einem 2-Kompartiment-Modell mit zeitlich variierender Clearance (CL). Die mittlere CL betrug 12,01 ml/h (VK = 27 %) nach der ersten Dosis und 8,49 ml/h (VK = 24,4 %) im Steady-State. Der geometrische Mittelwert (VK%) der terminalen Halbwertszeit beträgt 14 Tage (32,5 %) im Steady-State, wenn Toripalimab in einer Dosierung von 240 mg alle 3 Wochen angewendet wird.
Linearität/Nichtlinearität
Die Toripalimab-Exposition, ausgedrückt durch Spitzenkonzentrationen (Cmax), erhöhte sich dosisproportional über den Dosisbereich von 80 bis 480 mg q2w. Der geometrische Mittelwert der Talkonzentrationen (Cmin) im Steady-State wurde anhand des Populations-PK-Modells bei Patienten, die alle 3 Wochen 240 mg erhielten, auf 26,3 μg/ml geschätzt. Die mittlere Akkumulation der Cmin im Steady-State ist im Vergleich zur Cmin nach der ersten Dosis um das 2,7-Fache erhöht.
Pharmakokinetische/pharmakodynamische Zusammenhänge
Die Kurven der Expositions-Wirkungs-Beziehungen bei Toripalimab sind in Bezug auf die Wirksamkeit im Bereich der Expositionen, die bei Nasopharynxkarzinom in der Studie JUPITER-02 und bei OSCC in der Studie JUPITER-06 erreicht wurden, im Wesentlichen flach. Die Expositions-Wirkungs-Beziehungen bei Toripalimab in Bezug auf die Sicherheit zeigten negative (umgekehrte) Beziehungen über den gesamten Bereich der erreichten Expositionen. Dabei handelt es sich jedoch wahrscheinlich um ein Artefakt infolge einer Akkumulation von Toripalimab.
Die antizipierte vollständige Rezeptorbelegung von PD-1 in Immunzellen wurde bei Expositionen unterhalb der mittleren Talkonzentrationen nach der ersten Dosis und im Steady-State bei einer Dosis von 240 mg q3w erreicht.
Besondere Patientengruppen
Es wurden keine klinisch signifikanten Unterschiede in der Pharmakokinetik von Toripalimab basierend auf dem Alter (Bereich: 19 bis 85 Jahre), dem Körpergewicht (Bereich: 39 bis 164 kg), dem Geschlecht, der begleitenden Chemotherapie, leichter oder mittelschwerer Nierenfunktionsstörung, leichter Leberfunktionsstörung, Tumorlast und der primären Krebserkrankung beobachtet.
Nierenfunktionsstörung
Die Auswirkungen einer Nierenfunktionsstörung basierend auf der geschätzten Kreatinin-Clearance auf die Clearance und das Verteilungsvolumen von Toripalimab wurden anhand von populationspharmakokinetischen Analysen untersucht. Es wurden keine Unterschiede in der Clearance oder im Verteilungsvolumen zwischen Patienten mit leichter (ClKr 60 bis 89 ml/min; n = 483) oder mittelschwerer (ClKr 30 bis 59 ml/min; n = 114) Nierenfunktionsstörung und Patienten mit normaler Nierenfunktion festgestellt. Die Auswirkung einer schweren Nierenfunktionsstörung (ClKr 15 bis 29 ml/min) auf die Pharmakokinetik von Toripalimab wurde nicht untersucht.
Leberfunktionsstörung
Die Auswirkungen einer Leberfunktionsstörung nach dem National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) Bewertungssystem für Leberfunktionsstörungen auf die Clearance und das Verteilungsvolumen von Toripalimab wurden anhand von populationspharmakokinetischen Analysen untersucht. Es wurden keine Unterschiede in der Clearance oder im Verteilungsvolumen zwischen Patienten mit leichter (Grad 1, n = 166) Leberfunktionsstörung (Gesamtbilirubin bis zum 1,5-Fachen der Obergrenze des Normalwerts (ULN) oder Gesamtbilirubin innerhalb normaler Grenzen und Aspartattransaminase (AST) oder Alanintransaminase (ALT) > 1 x und ≤ 3 x ULN) im Vergleich zu Patienten mit normaler Leberfunktion festgestellt. In den klinischen Studien mit Toripalimab gab es eine begrenzte Anzahl von Patienten mit mittelschwerer (Grad 2, n = 1; Gesamtbilirubin > 1,5 x bis 3 x ULN und jeglicher AST-Wert) Leberfunktionsstörung und keine Patienten mit schwerer (Grad 3; Gesamtbilirubin > 3 x ULN und jeglicher AST-Wert) Leberfunktionsstörung.
Es wurden keine Studien zur Überprüfung des Potenzials von Toripalimab hinsichtlich Karzinogenität oder Genotoxizität durchgeführt.
Es wurden keine tierexperimentellen Reproduktionsstudien mit Toripalimab durchgeführt, um dessen Wirkung auf die Reproduktion und die fötale Entwicklung zu untersuchen. Eine zentrale Funktion des PD-1/PD-L1-Signalwegs besteht darin, die Schwangerschaft aufrechtzuerhalten, indem die Immuntoleranz der Mutter gegenüber dem Fötus gewahrt wird. In murinen Schwangerschaftsmodellen wurde gezeigt, dass die Blockade des PD-L1-Signals die Toleranz gegenüber dem Fötus stört und zu einem erhöhten fötalen Verlust führt.
Es wurden keine Fertilitätsstudien mit Toripalimab durchgeführt. In 4- und 26-wöchigen toxikologischen Studien bei Cynomolgus-Affen mit wiederholter Gabe wurden keine unerwünschten oder nennenswerten Wirkungen auf die männlichen und weiblichen Fortpflanzungsorgane festgestellt. Diese Tiere waren aber wahrscheinlich noch nicht geschlechtsreif.
Zitronensäure-Monohydrat
Mannitol
Polysorbat 80
Natriumchlorid
Natriumcitrat-Dihydrat
Wasser für Injektionszwecke
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Ungeöffnete Durchstechflasche
3 Jahre.
Nach dem Verdünnen
Die chemische und physikalische Haltbarkeit nach Anbruch und Verdünnung des Arzneimittels wurde für 24 Stunden bei 2 °C bis 8 °C oder bei 20 °C bis 25 °C nachgewiesen. Aus mikrobiologischer Sicht sollte das Arzneimittel sofort verwendet werden, es sei denn, die Verdünnungsmethode schließt das Risiko einer mikrobiellen Kontamination aus. Wenn es nicht sofort verwendet wird, liegen die Aufbewahrungszeiten und -bedingungen während des Gebrauchs in der Verantwortung des Anwenders.
Im Kühlschrank lagern (2° C - 8° C).
Nicht einfrieren.
In der Originalverpackung aufbewahren um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
Durchstechflasche aus neutralem Borosilikatglas Typ 1, verschlossen mit einem Chlorbutyl-Gummistopfen und einer 20 mm-Flip-off-Kappe (Aluminium), mit 6 ml Konzentrat zur Herstellung einer Infusionslösung.
Jeder Karton enthält eine Durchstechflasche.
Vorbereitung
Die Lösung visuell auf Partikel und Verfärbungen überprüfen. Die Lösung ist klar bis leicht opaleszierend, farblos bis gelblich. Die Durchstechflasche verwerfen, wenn sichtbare Partikel vorhanden sind.
LOQTORZI muss vor der intravenösen Gabe verdünnt werden.
Das erforderliche Volumen LOQTORZI entnehmen und langsam in einen 100-ml- oder 250-ml-Infusionsbeutel mit 9 mg/ml (0,9 %) Natriumchloridlösung zur Injektion injizieren. Die verdünnte Lösung durch vorsichtiges Umdrehen mischen. Nicht schütteln. Die Endkonzentration der verdünnten Lösung sollte zwischen 1 mg/ml und 3 mg/ml liegen.
Anwendung
Die verdünnte Lösung intravenös über eine Infusionspumpe unter Verwendung eines sterilen Inline-Filters (0,2 Mikrometer oder 0,22 Mikrometer Porengröße) infundieren.
Erste Infusion: Über mindestens 60 Minuten durchführen.
Nachfolgende Infusionen: Wenn bei der ersten Infusion keine infusionsbedingten Reaktionen aufgetreten sind, können nachfolgende Infusionen über einen Zeitraum von 30 Minuten erfolgen.
Keine anderen Arzneimittel gleichzeitig über denselben intravenösen Zugang infundieren.
Bei Gabe am selben Tag wie die Chemotherapie sollte LOQTORZI vor der Chemotherapie infundiert werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu beseitigen.
Topalliance Biosciences Europe Limited
Ground Floor
Two Dockland Central
Guild Street
I.f.s.c.
Dublin 1
Co. Dublin
D01 K2C5
Irland
EU/1/24/1853/001
Datum der Erteilung der Zulassung: 19-09-2024
09/2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.