Vevizye 1 mg/ml Augentropfen, Lösung
Ein ml Lösung enthält 1 mg Ciclosporin.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Augentropfen, Lösung
Klare, farblose Lösung.
Behandlung eines mittelschweren bis schweren Syndroms des trockenen Auges (Keratoconjunctivitis sicca) bei erwachsenen Patienten, bei denen trotz Behandlung mit Tränenersatzmitteln keine Besserung eingetreten ist (siehe Abschnitt 5.1).
Die Behandlung muss durch einen Ophthalmologen eingeleitet und überwacht werden.
Dosierung
Die empfohlene Dosis beträgt zweimal täglich einen Tropfen (entsprechend 0,01 mg Ciclosporin) in jedes Auge mit einem Abstand von etwa 12 Stunden.
Wenn eine Dosis versäumt wurde, ist die Behandlung mit der nächsten Dosis wie gewohnt fortzusetzen. Die Patienten sind anzuweisen, nicht mehr als einen Tropfen in jedes Auge zu geben.
Ältere Patienten
Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Es gibt im Anwendungsgebiet des trockenen Auges keinen relevanten Nutzen von Ciclosporin bei Kindern und Jugendlichen.
Art der Anwendung
Nur zur Anwendung am Auge.
Die Patienten sind darauf hinzuweisen, sich vor der Anwendung ihre Hände zu waschen. Die Patienten sind anzuweisen, die Tropferspitze nicht mit dem Auge oder einer anderen Oberfläche in Berührung kommen zu lassen, da dies zu einer Verunreinigung der Lösung führen kann.
Wird mehr als ein topisches Ophthalmikum angewendet, müssen die einzelnen Anwendungen mindestens 15 Minuten auseinander liegen (siehe Abschnitt 4.4). Für Patienten, die Kontaktlinsen tragen, siehe Abschnitt 4.4.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Okulare oder periokulare Malignome oder prämaligne Veränderungen.
Aktive oder vermutete okulare oder periokulare Infektionen.
Überwachung
Bei der topischen okularen Ciclosporin-Therapie werden regelmäßige Untersuchungen des Auges empfohlen, z. B. innerhalb von 3 Monaten nach Beginn der Behandlung und danach etwa alle 6 Monate.
Glaukom
Es gibt nur begrenzte Erfahrungen mit Ciclosporin bei der Behandlung von Patienten mit okulärer Hypertonie oder Glaukom. Patienten, die Arzneimittel zur Behandlung eines Glaukoms und Ciclosporin-Augentropfen erhalten, sind regelmäßig klinisch zu überwachen.
Kontaktlinsen
Vevizye darf nicht angewendet werden, während Kontaktlinsen getragen werden. Wenn Kontaktlinsen getragen werden, müssen sie vor der Anwendung der Lösung herausgenommen werden. Die Linsen können 15 Minuten nach der Anwendung von Vevizye wieder eingesetzt werden.
Wirkungen auf das Immunsystem
Arzneimittel zur Anwendung am Auge, die einen Einfluss auf das Immunsystem haben, einschließlich Ciclosporin, können die Abwehr gegen Infektionen und Malignome beeinträchtigen. Bei Anzeichen einer Augeninfektion soll der Patient einen Arzt aufsuchen.
Es wurden keine Studien zur Erfassung von Wechselwirkungen mit Vevizye durchgeführt.
Es sind keine systemischen Wechselwirkungen zu erwarten, da Ciclosporin nach Anwendung von Vevizye nicht systemisch verfügbar wird. Die gleichzeitige Anwendung von Augentropfen, die Kortikosteroide enthalten, könnte die Wirkungen von Ciclosporin auf das Immunsystem verstärken (siehe Abschnitt 4.4).
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Vevizye bei Schwangeren vor.
Tierexperimentelle Studien haben nach systemischer Anwendung von Ciclosporin eine Reproduktionstoxizität gezeigt, allerdings nach Expositionen die deutlich über der maximalen humantherapeutischen Exposition lagen, was auf eine geringe Relevanz für die klinische Anwendung von Vevizye hinweist.
Die Anwendung von Vevizye wird während der Schwangerschaft nicht empfohlen, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus.
Stillzeit
Es wird angenommen, dass Ciclosporin keine Auswirkungen auf das gestillte Neugeborene/Kind hat, da die systemische Exposition der stillenden Frau gegenüber dem Ciclosporin in Vevizye vernachlässigbar ist. Aus Vorsichtsgründen soll eine Anwendung von Vevizye während der Stillzeit vermieden werden.
Fertilität
Bisher liegen keine Erfahrungen zur Wirkung von Vevizye auf die Fertilität beim Menschen vor.
Es wird angenommen, dass Ciclosporin keine Auswirkungen auf die Fertilität hat, weil die systemische Exposition gegenüber Ciclosporin vernachlässigbar ist.
Vevizye hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Wenn bei der Instillation vorübergehend verschwommenes Sehen auftritt, muss der Patient warten, bis er wieder klar sehen kann, bevor er ein Fahrzeug führt oder Maschinen bedient.
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen sind Reaktionen an der Instillationsstelle (8,1 %), gefolgt von verschwommenem Sehen (0,8 %). Reaktionen an der Instillationsstelle traten bei Patienten im Alter von ≥ 65 Jahren häufiger auf als bei jüngeren Patienten.
Tabellarische Liste der Nebenwirkungen
Die folgenden Nebenwirkungen wurden in klinischen Studien beobachtet.
Die Nebenwirkungen sind im Folgenden entsprechend der Systemorganklassifikation gemäß MedDRA (SOC und Preferred Term) aufgeführt. Sie sind anhand der Häufigkeit unterteilt: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1: Nebenwirkungen
Systemorganklasse |
Häufigkeit |
Nebenwirkungen |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Schmerzen an der Instillationsstelle (Brennen) |
Augenerkrankungen |
Gelegentlich |
Sehen verschwommen, |
Beschreibung ausgewählter Nebenwirkungen:
Schmerzen an der Instillationsstelle (berichtet als Brennen) (7,9 %) war die am häufigsten gemeldete Nebenwirkung im Zusammenhang mit der Anwendung von Vevizye während klinischer Studien. Andere Reaktionen an der Instillationsstelle wie Erythem oder Pruritus traten seltener auf (0,1 %). Alle Reaktionen an der Instillationsstelle sind in der Regel leicht und vorübergehend.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das (siehe unten) aufgeführte nationale Meldesystem anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: http://www.bfarm.de
Es ist unwahrscheinlich, dass es nach Anwendung am Auge zu einer topischen Überdosierung kommt. Wenn eine Überdosierung mit Vevizye auftritt, ist symptomatisch zu behandeln.
Pharmakotherapeutische Gruppe: Ophthalmika, andere Ophthalmika, ATC-Code: S01XA18.
Wirkmechanismus
Ciclosporin ist ein Calcineurininhibitor mit antienztündlichen und immunsuppressiven Eigenschaften. Die Hemmung von Calcineurin führt zu verschiedenen sekundären Effekten: (a) Blockierung der Öffnung der mitochondrialen Permeabilitätsübergangspore (MPTP), wodurch die Aktivierung von Caspasen in den Mitochondrien gehemmt wird, was wiederum die Apoptose entzündeter Bindehautzellen blockiert und die Becherzelldichte wiederherstellt; (b) in aktivierten T‑Zellen auf der Augenoberfläche werden MPTP geöffnet, resultierend in der Aktivierung der Apoptose; (c) die Translokation des Nuklearfaktors-kappa B (NFκB) und der Mitogen-aktivierte Proteinkinaseweg werden blockiert, wodurch die Transkription und Sekretion von Entzündungszytokinen und die anschließende Rekrutierung von T‑Zellen gehemmt wird.
Die spreitenden Eigenschaften des wasserfreien Vehikels verringern die Reibung und tragen so zur Wirksamkeit bei.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit von Vevizye bei der Behandlung des trockenen Auges wurde in zwei randomisierten, multizentrischen, doppelt maskierten, vehikelkontrollierten Studien (ESSENCE‑1 und ESSENCE‑2) untersucht. In beide Studien wurden Patienten mit mittelschwerem bis schwerem trockenen Auge aufgenommen, wobei diese Schweregrade durch einen Gesamtwert der Hornhautfärbung (tCFS) von ≥ 10 auf der Skala des National Eye Institute (NEI), einen Schirmer-Testwert am nicht anästhesierten Auge zwischen 1 und 10 mm, einen Gesamtwert für Lissamingrün auf der Bindehaut von ≥ 2 und das Vorhandensein von Symptomen definiert waren.
In der ESSENCE‑1‑Studie wurden 328 Patienten in einem Verhältnis von 1:1 randomisiert und erhielten 3 Monate lang zweimal täglich Vevizye (n = 162) oder das Vehikel (n = 166). In der ESSENCE‑2‑Studie wurden 834 Patienten in einem Verhältnis von 1:1 randomisiert und erhielten 1 Monat lang zweimal täglich Vevizye (n = 423) oder das Vehikel (n = 411).
Der primäre Endpunkt war in beiden Studien die Veränderung des tCFS-Scores an Tag 29 gegenüber dem Ausgangswert. Der tCFS-Score entsprach dem Summenwert (Bereich 0‑15) der 5 Hornhautareale (inferior, superior, zentral, nasal und temporal), wobei jedes Areal vom Prüfarzt anhand der Skala des National Eye Institute (NEI) von Grad 0 (keine Färbung) bis Grad 3 (starke Färbung) bewertet wurde. Primäre Symptomendpunkte waren der Ocular Surface Disease Index (OSDI, Bereich 0‑100) in ESSENCE‑1 und der Trockenheitswert (visuelle Analogskala, Bereich 0‑100) in ESSENCE‑2. Zu den wichtigsten sekundären Endpunkten gehörten der tCFS-Score an Tag 15, tCFS-Responder, definiert als Verbesserung um ≥ 3 Grade, der Lissamingrün-Färbe-Score (Oxford-Summe aus temporal und nasal; Bereich 0‑10) an Tag 29, der Fluorescein-Färbe-Score der zentralen Hornhaut (cCFS [Skala des National Eye Institute; Bereich 0‑3]) sowie der Score für verschwommenes Sehen (visuelle Analogskala, Bereich 0‑100) und Schirmer-Responder an Tag 85 in Essence‑1 und an Tag 29 in Essence‑2
Die Mehrheit der Patienten in diesem klinischen Programm war weiblich (73 %), das Durchschnittsalter (Standardabweichung [SD]) betrug 58 (15,2) Jahre und 38 % waren 65 Jahre und älter. Der mittlere (SD) Ausgangswert für tCFS lag bei 11,5 (1,35), der mittlere (SD) Ausgangswert für cCFS lag bei 2,1 (0,60), der mittlere (SD) Ausgangswert für die Lissamingrün-Färbung der Bindehaut betrug 3,9 (1,71), der mittlere (SD) Ausgangswert des Schirmer-Tränen-Tests am nicht anästhesierten Auge betrug 5,0 mm (2,83), der mittlere (SD) OSDI-Ausgangswert lag bei 47,1 (19,23) und der mittlere (SD) Ausgangswert der Trockenheit bei 69,9 (15,43).
An Tag 29 wurde in beiden Studien eine statistisch signifikante Verringerung der tCFS zugunsten von Vevizye beobachtet (siehe Abbildung 1).
Abbildung 1: Mittlere Veränderung (SD) der tCFS an Tag 29 zum Ausgangswert
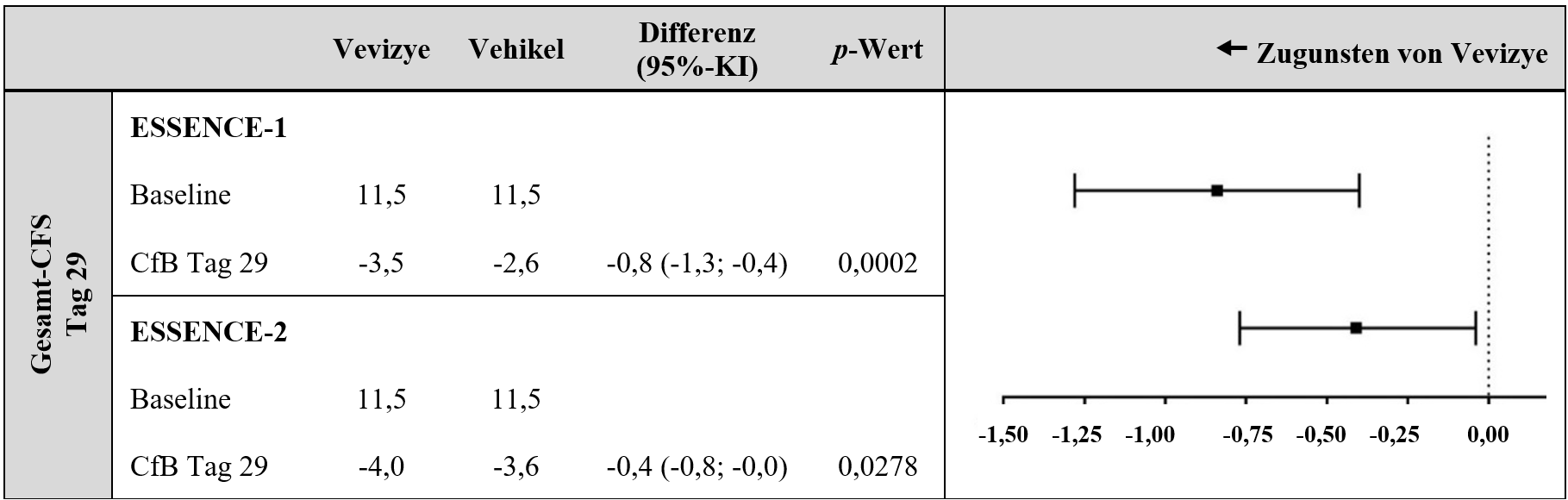
CFS = Fluorescein-Färbung der Hornhaut; CfB = Änderung gegenüber Baseline.
Responder-Analysen zeigten, dass der Anteil der Patienten mit einer klinisch bedeutsamen tCFS-Verbesserung von ≥ 3 Graden an Tag 29 in beiden Studien statistisch signifikant unterschiedlich war zugunsten von Vevizye (siehe Tabelle 2).
Tabelle 2: Prozentsatz der Patienten, die an Tag 29 eine Verbesserung des Gesamtwertes der Hornhaut-Fluorescein-Färbung (tCFS) um ≥ 3 Grade erreichen, in Studien an Patienten mit trockenem Auge
ESSENCE‑1 |
ESSENCE‑2 |
|||
Vevizye |
Vehikel |
Vevizye |
Vehikel |
|
Anzahl der Teilnehmer an Tag 29 |
157 |
165 |
409 |
395 |
≥ 3 Grade Verbesserung der tCFS an Tag 29 (% der Teilnehmer) |
52,9 % |
40,6 % |
71,6 % |
59,7 % |
Differenz (95%‑KI) |
12,3 % (1,3 %, 23,0 %) |
12,6 % (6,0 %, 19,3 %) |
||
p‑Wert |
0,0337 |
0,0002 |
||
In der ESSENCE‑1‑Studie zeigte der zweite hierarchisch getestete primäre Symptomendpunkt, die Veränderung des OSDI an Tag 29 gegenüber dem Ausgangswert, eine numerische Verbesserung in der Vevizye-Gruppe (Mittelwert der kleinsten Quadrate [LS] ‑8,8), erreichte jedoch keine statistische Signifikanz im Vergleich zum Vehikel (LS‑Mittelwert ‑6,8) (p = 0,2634).
In der ESSENCE‑2‑Studie verbesserte sich der zweite hierarchisch geprüfte primäre Symptomendpunkt, der Trockenheitswert, in beiden Gruppen statistisch signifikant im Vergleich zum Ausgangswert: Der LS‑Mittelwert für Vevizye lag bei ‑12,2 und der LS‑Mittelwert für das Vehikel bei ‑13,6; der Unterschied zwischen den Gruppen war nicht signifikant (p = 0,3842).
Alle anderen wichtigen sekundären Endpunkte zu Anzeichen der Augenoberfläche (tCFS an Tag 15, Färbung der Bindehaut an Tag 29 und Färbung der zentralen Hornheut an Tag 29) zeigten in beiden Studien statistisch signifikante Effekte zugunsten von Vevizye (siehe Abbildung 2).
Darüber hinaus zeigten Patienten mit signifikanten Scores der zentralen Färbung bei Baseline, die mit Vevizye behandelt wurden, in beiden Studien an Tag 29 eine statistisch signifikant stärkere Verringerung des Wertes für verschwommenes Sehen im Vergleich zu dieser Gruppe von Patienten, die mit dem Vehikel behandelt wurden (siehe Abbildung 2).
Abbildung 2: Mittlere Veränderung (SD) gegenüber dem Ausgangswert bei wichtigen sekundären Endpunkten in beiden Zulassungsstudien
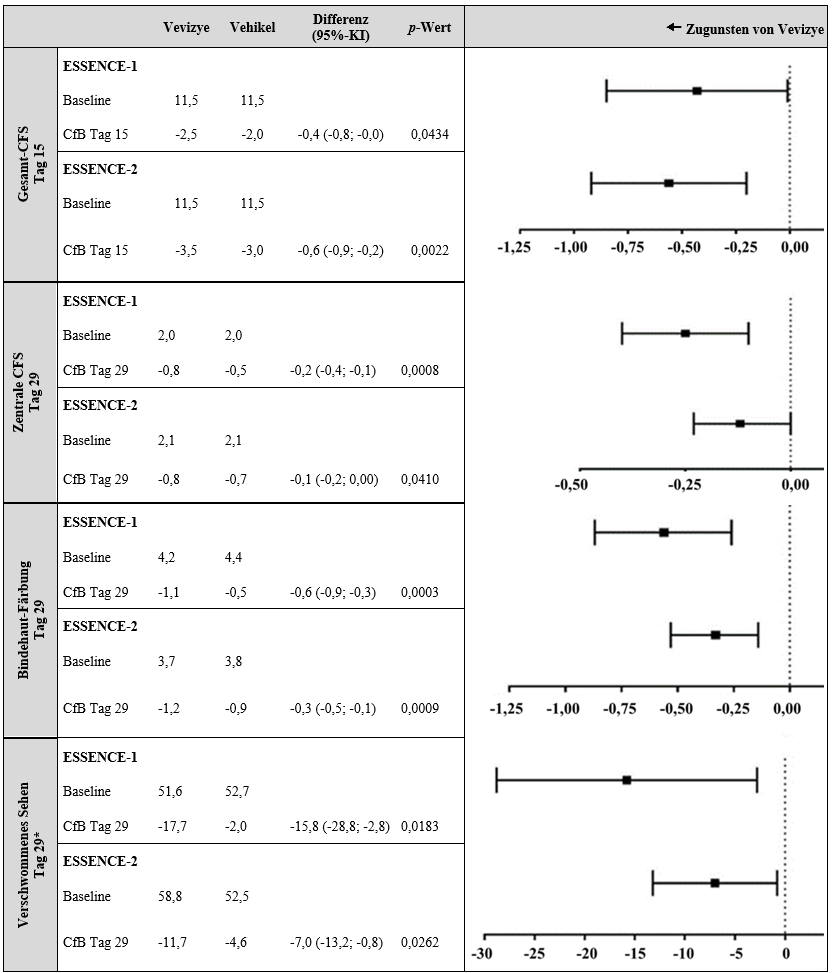
* Subgruppe mit starker zentraler Färbung; CFS = Fluorescein-Färbung der Hornhaut; CfB = Änderung gegenüber Baseline.
Es wurden statistisch signifikant höhere Anteile an Respondern auf den Schirmer-Tränen-Test im aktiven Arm im Vergleich zum Vehikel gezeigt: in ESSENCE‑1 an Tag 85 (Δ 6,74 % [95%‑KI 0,50‑12,98 %] p = 0,0344) und in ESSENCE‑2 an Tag 29 (Δ 3,92 % [95%‑KI 0,02‑7,82 %]
p = 0,0487).
Insgesamt nahmen 202 Patienten, die ESSENCE‑2 abgeschlossen hatten, an einer offenen Verlängerungsstudie über 12 Monate teil (ESSENCE‑2‑OLE). Geeignete Patienten erhalten hier Vevizye beidseitig zweimal täglich für 1 weiteres Jahr. Mehr als 80 % der Patienten waren nach 4 Wochen Responder (≥ 3 Grade im tCFS), und dieses Ansprechen wurde während des Beobachtungszeitraums beibehalten.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Vevizye eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen für das Syndrom des trockenen Auges gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Pharmakokinetik von Ciclosporin wurde an 47 Freiwilligen aus zwei klinischen Studien untersucht. Die Konzentrationen von Ciclosporin im Blut nach einmaliger oder mehrfacher Anwendung von Vevizye konnten nicht gemessen werden, da alle analysierten Proben Werte unterhalb der unteren Bestimmungsgrenze (0,100 ng/ml) aufwiesen.
Die physiochemischen Eigenschaften des Vehikels verbessern die lokale Verteilung und Bioverfügbarkeit von Ciclosporin.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktions- und Entwicklungstoxizität, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten, die mit der Vevizye-Formulierung durchgeführt wurden und auf der wissenschaftlichen Literatur zu Ciclosporin basieren, keine besonderen Gefahren für den Menschen erkennen, da keine systemische Exposition für Ciclosporin nachgewiesen wurde.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe und zur Genotoxizität lassen die präklinischen Daten zum sonstigen Bestandteil Perfluorbutylpentan keine besonderen Gefahren für den Menschen erkennen.
Studien zur Beurteilung der Risiken für die Umwelt (Environmental risk assessment [ERA]) haben gezeigt, dass die Möglichkeit besteht, dass der sonstige Bestandteil Perfluorbutylpentan persistent ist.
Perfluorbutylpentan 1,1,1,2,2,3,3,4,4-Nonafluornonan
Ethanol
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
2 Jahre.
Vevizye kann bis zu 4 Wochen nach dem ersten Öffnen der Flasche angewendet werden. Die Flasche muss bei Nichtgebrauch fest verschlossen bleiben.
Nicht über 25 °C lagern.
Nicht einfrieren oder im Kühlschrank lagern.
Vevizye 1 mg/ml Augentropfen, Lösung werden in einer durchsichtigen Flasche aus Polypropylen mit einer durchsichtigen Polyethylenspitze und einer weißen Schutzkappe aus Polyethylen mit Originalitätsring geliefert.
Umkarton mit einer oder drei 5‑ml‑Flaschen mit je 2‑ml‑Füllung.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Dieses Arzneimittel kann ein Risiko für die Umwelt darstellen (siehe Abschnitt 5.3). Pharmazeutische Abfälle dürfen nicht über die Toilette oder das Waschbecken entsorgt werden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Laboratoires Théa
Zone Industrielle du Brézet
12 rue Louis Blériot
63100 Clermont-Ferrand
Frankreich
EU/1/24/1857/001 1 Flasche mit 2 ml
EU/1/24/1857/002 3 Flaschen mit je 2 ml
Datum der Erteilung der Zulassung: 19. September 2024
April 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig