▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Voranigo 10 mg Filmtabletten
Voranigo 40 mg Filmtabletten
Voranigo 10 mg Filmtabletten
Jede Filmtablette enthält 10 mg Vorasidenib (als Hemicitrat-Hemihydrat).
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Filmtablette enthält Lactose-Monohydrat, entsprechend 0,60 mg Lactose (siehe Abschnitt 4.4).
Voranigo 40 mg Filmtabletten
Jede Filmtablette enthält 40 mg Vorasidenib (als Hemicitrat-Hemihydrat).
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Filmtablette enthält Lactose-Monohydrat, entsprechend 2,39 mg Lactose (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette
Voranigo 10 mg Filmtabletten
Weiße bis cremefarbene, runde Tabletten mit einem Durchmesser von 6 mm und dem Aufdruck "10" auf einer Seite.
Voranigo 40 mg Filmtabletten
Weiße bis cremefarbene, längliche Tabletten mit einer Länge von 14,8 mm und einer Breite von 6,3 mm, mit dem Aufdruck "40" auf einer Seite.
Voranigo als Monotherapie wird angewendet zur Behandlung von überwiegend nicht kontrastmittelanreichernden Grad 2 Astrozytomen oder Oligodendrogliomen mit einer IDH1-R132-Mutation oder einer IDH2-R172-Mutation bei erwachsenen und jugendlichen Patienten ab 12 Jahren und einem Gewicht von mindestens 40 kg, die nur chirurgische Intervention hatten und keine unmittelbare Strahlen- oder Chemotherapie benötigen (siehe Abschnitt 5.1).
Die Behandlung sollte von einem Arzt eingeleitet und überwacht werden, der Erfahrung in der Anwendung von Arzneimitteln gegen Krebs hat.
Vor der Einnahme von Voranigo muss bei den Patienten eine Isocitrat-Dehydrogenase-1 (IDH1)-R132- oder eine Isocitrat-Dehydrogenase-2 (IDH2)-R172 Mutation durch einen geeigneten diagnostischen Test nachgewiesen werden. Das Vorliegen einer IDH1-R132- oder IDH2-R172-Mutation sollte mit einem CE-gekennzeichneten in-vitro-Diagnostikum (IVD) mit dem entsprechenden Verwendungszweck nachgewiesen werden. Ist kein CE-gekennzeichnetes IVD verfügbar, sollte die IDH1-R132- oder IDH2-R172-Mutation mit einem alternativen validierten Test nachgewiesen werden.
Dosierung
Die empfohlene Dosierung von Voranigo bei Erwachsenen und Jugendlichen ab 12 Jahren beträgt 40 mg einmal täglich bei Patienten mit einem Körpergewicht von mindestens 40 kg. Für Patienten, die weniger als 40 kg wiegen, kann keine Dosierungsempfehlung gegeben werden, da für diese Patientengruppe keine klinischen Daten vorliegen.
Die Behandlung sollte so lange fortgesetzt werden, wie ein klinischer Nutzen zu beobachten ist oder bis die Behandlung vom Patienten nicht mehr vertragen wird.
Verpasste oder verspätete Einnahme
Wenn eine Dosis ausgelassen oder nicht zur üblichen Zeit eingenommen wurde, sollte sie so bald wie möglich innerhalb von 6 Stunden nach der verpassten Dosis eingenommen werden. Die nächste Dosis sollte zum regulär vorgesehenen Zeitpunkt eingenommen werden.
Wenn eine Dosis um mehr als 6 Stunden versäumt wurde, sollte sie ausgelassen und die nächste Dosis zum regulären Zeitpunkt eingenommen werden.
Wenn eine Dosis erbrochen wurde, sollten keine Tabletten als Ersatz eingenommen werden. Die Tabletten sollten am folgenden Tag wie gewohnt eingenommen werden.
Vorsichtsmaßnahmen vor Verabreichung und Überwachung
Ein großes Blutbild und laborchemische Blutuntersuchungen, einschließlich der Leberenzyme, sollten vor Beginn der Behandlung, alle zwei Wochen während der ersten zwei Behandlungsmonate, dann einmal monatlich während der ersten zwei Jahre der Behandlung und danach je nach klinischer Indikation untersucht werden. Bei bestimmten Patienten kann eine häufigere und kontinuierliche Überwachung erforderlich sein (siehe Abschnitt 4.4).
Dosisanpassungen bei Nebenwirkungen
Je nach individueller Sicherheit und Verträglichkeit kann eine Dosisunterbrechung oder Dosisreduktion erforderlich sein. Die empfohlenen Dosisreduktionsstufen sind in Tabelle 1 angeführt.
Tabelle 1: Empfohlene Dosisreduktionsstufen | ||
Dosis-Level |
Dosierung und Zeitplan |
Anzahl und Stärke der Tabletten |
Anfangsdosis |
40 mg einmal täglich |
Eine 40 mg Tablette / einmal täglich |
Erste Dosisreduktion |
20 mg einmal täglich |
Zwei 10 mg Tabletten / einmal täglich |
Zweite Dosisreduktion |
10 mg einmal täglich |
Eine 10 mg Tablette / einmal täglich |
Die empfohlenen Dosisanpassungen von Voranigo und die Behandlung von Nebenwirkungen sind in Tabelle 2 aufgeführt.
Tabelle 2: Empfohlene Dosisanpassungen für Voranigo und Maßnahmen bei Nebenwirkungen
Nebenwirkung |
Schweregrada |
Maßnahmen und Dosisanpassungen |
Hepatotoxizität |
Grad 1 |
Setzen Sie die Behandlung mit Voranigo in der derzeitigen Dosierung fort. |
Grad 2 |
Erstes Auftreten: Unterbrechen Sie die Behandlung mit Voranigo und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung der Werte auf ≤ Grad 1 oder auf den Ausgangswert.
Wiederauftreten: Unterbrechen Sie die Behandlung mit Voranigo und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung auf ≤ Grad 1 oder auf den Ausgangswert und nehmen Sie dann die Behandlung mit Voranigo in reduzierter Dosierung wieder auf (siehe Tabelle 1). |
|
Grad 3 |
Erstes Auftreten: Unterbrechen Sie die Behandlung mit Voranigo und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung der Werte auf ≤ Grad 1 oder auf den Ausgangswert.
Wiederauftreten: Setzen Sie Voranigo dauerhaft ab und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung auf ≤ Grad 1 oder auf den Ausgangswert. |
|
Grad 2 oder 3 |
Setzen Sie Voranigo dauerhaft ab und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung auf ≤ Grad 1 oder auf den Ausgangswert. |
|
Grad 4 |
Setzen Sie Voranigo dauerhaft ab und überwachen Sie die Leberenzyme zweimal wöchentlich bis zur Erholung auf ≤ Grad 1 oder auf den Ausgangswert. |
|
Andere Nebenwirkungen |
Grad 3 |
Erstes Auftreten: Unterbrechen Sie die Behandlung mit Voranigo bis zur Erholung der Werte auf ≤ Grad 1 oder auf den Ausgangswert.
Wiederauftreten: Setzen Sie Voranigo dauerhaft ab. |
Grad 4 |
Setzen Sie Voranigo dauerhaft ab. |
|
Abkürzungen: ALT = Alanin-Aminotransferase; AST = Aspartat-Aminotransferase; ULN = Obere Grenze der Norm (Upper Limit of Normal) | ||
a Nebenwirkungen, eingestuft nach den gemeinsamen Terminologiekriterien für unerwünschte Ereignisse des Nationalen Krebsinstituts (Common Terminology criteria for Adverse Events, NCI-CTCAE), Version 5.0. | ||
b Wenn eine alternative Ätiologie festgestellt wird, kann die Behandlung mit Voranigo in reduzierter Dosierung (siehe Tabelle 1) nach Abklingen auf Grad 1 oder auf den Ausgangswert wieder aufgenommen werden. | ||
Besondere Patientengruppen
Ältere Patienten
Es wird keine Dosisanpassung für Patienten ≥ 65 Jahre empfohlen (siehe Abschnitt 5.2).
Nierenfunktionsstörung
Bei Patienten mit Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate [eGFR] > 40 ml/min/1,73 m2) wird keine Anpassung der Anfangsdosis empfohlen. Die Pharmakokinetik von Vorasidenib und dem Metaboliten AGI-69460 wurde bei Patienten mit einer eGFR ≤ 40 ml/min/1,73 m2 oder dialysepflichtigen Nierenfunktionsstörungen nicht untersucht. Vorasidenib sollte nicht bei Patienten mit einer eGFR ≤ 40 ml/min/1,73 m2 oder bei dialysepflichtigen Patienten angewendet werden (siehe Abschnitte 4.4 und 5.2).
Leberfunktionsstörung
Bei Patienten mit milder oder mäßiger Leberfunktionsstörung (Child-Pugh-Klasse A oder B) wird keine Anpassung der Anfangsdosis empfohlen. Die Pharmakokinetik von Vorasidenib und AGI-69460 wurde bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) nicht untersucht. Vorasidenib sollte bei Patienten mit schwerer Leberfunktionsstörung mit Vorsicht angewendet werden und diese Patientengruppe sollte engmaschig überwacht werden (siehe Abschnitte 4.4 und 5.2).
Kinder und Jugendliche
Es liegen keine klinischen Daten bei Kindern im Alter von 12 bis < 18 Jahren vor (siehe Abschnitt 5.1).
Art der Anwendung
Voranigo ist zur oralen Anwendung bestimmt.
Die Tabletten sollten einmal täglich etwa zur gleichen Zeit eingenommen werden. Die Patienten sollten mindestens 2 Stunden vor und 1 Stunde nach der Einnahme von Voranigo keine Nahrung zu sich nehmen (siehe Abschnitt 5.2). Die Tabletten sollen im Ganzen mit einem Glas Wasser geschluckt werden. Sie sollen nicht geteilt, zerkleinert oder gekaut werden, da keine Daten vorliegen, die eine ähnliche Bioverfügbarkeit des Arzneimittels bestätigen, wenn Tablettenmanipulationen vorgenommen werden.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Hepatotoxizität
Bei Patienten, die mit Vorasidenib behandelt wurden, wurden Erhöhungen der Leberenzyme, einschließlich Alanin-Aminotransferase (ALT) und Aspartat-Aminotransferase (AST), um mehr als das Dreifache der oberen Normgrenze (ULN) sowie eine Erhöhung des Gesamtbilirubins um mehr als das Zweifache der ULN berichtet (siehe Abschnitt 4.8). Bei einem mit Vorasidenib behandelten Patienten wurden Leberversagen und Lebernekrose beobachtet, und bei einem weiteren mit Vorasidenib behandelten Patienten wurde eine Autoimmunhepatitis beobachtet.
Die Leberenzyme (einschließlich ALT, AST und Gamma-Glutamyl-Transferase (GGT)) sowie das Gesamtbilirubin müssen vor Beginn der Behandlung, alle 2 Wochen während der ersten 2 Monate der Behandlung, dann einmal monatlich während der ersten 2 Jahre der Behandlung und danach nach klinischer Indikation kontrolliert werden. Bei ALT- oder AST-Erhöhungen ≤ dem 3‑fachen des ULN ist eine wöchentliche Überwachung in Betracht zu ziehen. Je nach Schweregrad der Leberenzymanomalien ist die Behandlung zu unterbrechen, die Dosis zu reduzieren oder die Behandlung dauerhaft abzubrechen (siehe Abschnitt 4.2).
Karzinogenitätsrisiko
Tierversuche weisen möglicherweise auf ein potenzielles Karzinogenitätsrisiko hin (insbesondere in der Leber, siehe Abschnitt 5.3). Es wurden noch keine Karzinogenitätsstudien durchgeführt und die Daten zur langfristigen klinischen Sicherheit sind unzureichend. Daher kann ein Karzinogenitätsrisiko beim Menschen nicht ausgeschlossen werden.
Frauen im gebärfähigen Alter / Empfängnisverhütung
Vorasidenib kann den Fötus schädigen, wenn es von einer schwangeren Frau eingenommen wird. Es wird empfohlen, bei Frauen im gebärfähigen Alter vor Beginn der Behandlung einen Schwangerschaftstest durchzuführen. Frauen im gebärfähigen Alter sollten während der Behandlung und für mindestens 2 Monate nach der letzten Dosis eine wirksame Verhütungsmethode anwenden. Frauen, die planen, ein Kind zu bekommen, sollte eine reproduktionsmedizinische Beratung empfohlen werden.
Vorasidenib kann die Konzentration von hormonellen Verhütungsmitteln vermindern, daher wird die gleichzeitige Anwendung einer Barrieremethode zur Empfängnisverhütung während der Behandlung und für mindestens 2 Monate nach der letzten Dosis empfohlen (siehe Abschnitte 4.5 und 4.6).
Männliche Patienten
Männer mit Partnerinnen im gebärfähigen Alter sollten während der Behandlung und für mindestens 2 Monate nach der letzten Dosis eine wirksame Verhütungsmethode anwenden. Männer sollten sich vor der Behandlung über die Kryokonservierung von Sperma beraten lassen (siehe Abschnitt 4.6).
Leberfunktionsstörung
Die Sicherheit und Wirksamkeit von Vorasidenib wurde bei Patienten mit schweren Leberfunktionsstörungen (Child-Pugh-Klasse C) nicht belegt. Vorasidenib sollte bei Patienten mit vorbestehenden schweren Leberfunktionsstörungen (Child-Pugh-Klasse C) mit Vorsicht angewendet werden und diese Patientengruppe sollte engmaschig überwacht werden (siehe Abschnitte 4.2 und 5.2).
Nierenfunktionsstörung
Die Pharmakokinetik und Sicherheit von Vorasidenib wurde bei Patienten mit Nierenfunktionsstörungen (eGFR ≤ 40 ml/min/1,73 m2) oder dialysepflichtigen Nierenfunktionsstörungen nicht untersucht. Vorasidenib sollte bei diesen Patienten nicht angewendet werden (siehe Abschnitte 4.2 und 5.2).
Lactose
Voranigo enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d. h., es ist nahezu "natriumfrei".
In in vitro Untersuchungen wurde gezeigt, dass Vorasidenib ein starker Induktor ist, der den Pregnan-X-Rezeptor (PXR) aktiviert und die Plasmakonzentration gleichzeitig verabreichter Medikamente beeinflussen kann, die durch Enzyme oder Transporter metabolisiert oder transportiert werden, deren Expression durch PXR vermittelt wird.
Auswirkungen anderer Arzneimittel auf Vorasidenib
Starke CYP1A2-Inhibitoren
Die gleichzeitige Gabe von Vorasidenib mit starken CYP1A2-Inhibitoren (Fluvoxamin und Ciprofloxacin) kann die Vorasidenib-Plasmakonzentration erhöhen. Die gleichzeitige Anwendung von starken CYP1A2-Inhibitoren sollte vermieden werden, und während der Behandlung mit Vorasidenib sollten alternative Therapien in Betracht gezogen werden, die keine starken Inhibitoren von CYP1A2 sind.
In einer in vivo Arzneimittelinteraktionsstudie erhöhte die gleichzeitige Gabe von 20 mg Vorasidenib mit einem starken CYP1A2-Inhibitor (500 mg Ciprofloxacin zweimal täglich über 14 Tage) die maximale Plasmakonzentration von Vorasidenib (Cmax) um 29 % und die Fläche unter der Plasmakonzentrationskurve (AUC) um 153 %.
Moderate CYP1A2-Induktoren
Die gleichzeitige Gabe von Vorasidenib mit moderaten CYP1A2-Induktoren (Phenytoin und Rifampicin) kann die Vorasidenib-Plasmakonzentration verringern. Ziehen Sie während der Behandlung mit Vorasidenib alternative Therapien in Betracht, die keine moderaten CYP1A2-Induktoren beinhalten.
Magensäure reduzierende Mittel
Es wurden keine klinisch signifikanten Unterschiede in der Pharmakokinetik von Vorasidenib nach gleichzeitiger Gabe von Vorasidenib mit dem Antazidum Omeprazol beobachtet.
Auswirkungen von Vorasidenib auf andere Arzneimittel
Cytochrom P450 (CYP)-Substrate mit enger therapeutischer Breite
Die gleichzeitige Gabe von Vorasidenib mit CYP2B6-, CYP2C8-, CYP2C9-, CYP2C19- oder CYP3A4-Substraten mit enger therapeutischer Breite (einschließlich, aber nicht beschränkt auf Amitriptylin, Alfentanil, Carbamazepin, Ciclosporin, Dosulepin, Everolimus, Fentanyl, Fosphenytoin, Ifosfamid, Imipramin, Phenobarbital, Phenytoin, Pimozid, Chinidin, Sirolimus, Tacrolimus, Tamoxifen, Trimipramin, Valproinsäure und Warfarin) kann die Plasmakonzentrationen dieser Arzneimittel verringern. Die gleichzeitige Anwendung von Substraten dieser Enzyme mit enger therapeutischer Breite sollte bei Patienten, die Vorasidenib einnehmen, vermieden werden.
Sensitive Substrate von CYP-Enzymen ohne enge therapeutische Breite
Die gleichzeitige Gabe von Vorasidenib mit sensitiven Substraten von CYP2B6, CYP2C8, CYP2C9, CYP2C19 oder CYP3A4 ohne enge therapeutische Breite (einschließlich, aber nicht beschränkt auf Bupropion, Buspiron, Celecoxib, Darunavir, Ibrutinib, Midazolam, Repaglinid, Saquinavir, Tipranavir und Triazolam) kann die Plasmakonzentrationen dieser Arzneimittel verringern. Ziehen Sie während der Behandlung mit Vorasidenib alternative Therapien in Betracht, die keine sensitiven Substrate dieser Enzyme sind.
Wechselwirkungen mit Transportern
In vitro ist Vorasidenib ein Inhibitor des Brustkrebs-Resistenzproteins (BCRP) (siehe Abschnitt 5.2). Bei der Gabe von Vorasidenib zusammen mit BCRP-Substraten (einschließlich, aber nicht beschränkt auf Rosuvastatin) ist Vorsicht geboten.
Hormonelle Verhütungsmittel
Vorasidenib kann die Konzentrationen von hormonellen Verhütungsmitteln vermindern, daher wird die gleichzeitige Anwendung einer Barrieremethode zur Empfängnisverhütung während der Behandlung und für mindestens 2 Monate nach der letzten Dosis empfohlen (siehe Abschnitte 4.4 und 4.6).
Frauen im gebärfähigen Alter / Empfängnisverhütung
Bei Frauen im gebärfähigen Alter wird vor Beginn der Behandlung mit Vorasidenib ein Schwangerschaftstest empfohlen (siehe Abschnitt 4.4).
Frauen im gebärfähigen Alter und Männer mit Partnerinnen im gebärfähigen Alter sollten während der Behandlung und für mindestens 2 Monate nach der letzten Dosis eine wirksame Empfängnisverhütung anwenden. Da der Einfluss von Vorasidenib auf den Metabolismus und die Wirksamkeit von systemisch wirkenden hormonellen Kontrazeptiva nicht untersucht wurde, sollten Barrieremethoden als zweite Form der Empfängnisverhütung angewendet werden, um eine Schwangerschaft zu vermeiden (siehe Abschnitte 4.4 und 4.5).
Schwangerschaft
Es liegen keine oder nur wenige Daten über die Anwendung von Vorasidenib bei schwangeren Frauen vor. Tierexperimentelle Studien haben eine Toxizität für die embryo-fötale Entwicklung gezeigt (siehe Abschnitt 5.3).
Vorasidenib darf während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Verhütungsmittel anwenden, nicht angewendet werden. Frauen im gebärfähigen Alter oder männliche Patienten mit Partnerinnen im gebärfähigen Alter sollten über das potenzielle Risiko für den Fötus aufgeklärt werden.
Stillzeit
Es ist nicht bekannt, ob Vorasidenib und seine Metaboliten in die Muttermilch übergehen. Das Stillen sollte während der Behandlung und für mindestens 2 Monate nach der letzten Dosis unterbrochen werden.
Fertilität
Es sind keine Daten am Menschen zu den Auswirkungen von Vorasidenib auf die Fertilität vorhanden. Bei Toxizitätsstudien mit wiederholter Dosisgabe an weiblichen und männlichen Tieren wurden Auffälligkeiten bei den Fortpflanzungsorganen beobachtet (siehe Abschnitt 5.3). Die klinische Relevanz dieser Beobachtungen ist nicht bekannt. Patientinnen und Patienten, die planen, ein Kind zu bekommen, sollte eine reproduktionsmedizinische Beratung empfohlen werden, und Männer sollten sich vor der Behandlung über die Kryokonservierung von Sperma beraten lassen (siehe Abschnitt 4.4).
Vorasidenib hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen, einschließlich Anomalien der Laborwerte, waren ein erhöhter ALT-Wert (59,3 %), ein erhöhter AST-Wert (45,5 %), ein erhöhter GGT-Wert (37,7 %), Ermüdung (36,5 %) und Durchfall (24,6 %).
Die häufigsten Nebenwirkungen mit Grad ≥ 3 waren erhöhte ALT- (9,6 %), erhöhte AST- (4,2 %) und erhöhte GGT-Werte (3,0 %).
Schwerwiegende Nebenwirkungen in Form einer Erhöhung der ALT-Werte traten bei 0,6 % der Patienten auf, die Voranigo erhielten.
Ein dauerhafter Abbruch der Behandlung mit Vorasidenib aufgrund einer ALT-Wert-Erhöhung ≥ Grad 3 wurde bei 3,0 % der Patienten berichtet.
Bei 18,6 % der mit Vorasidenib behandelten Patienten kam es zu einer Dosisunterbrechung aufgrund einer Nebenwirkung. Die häufigsten Nebenwirkungen, die eine Dosisunterbrechung erforderlich machten, waren erhöhte ALT-Werte (14,4 %) und erhöhte AST-Werte (6,0 %).
Eine Dosisreduktion von Vorasidenib aufgrund einer Nebenwirkung trat bei 9,6 % der Patienten auf. Die häufigste Nebenwirkung, die eine Dosisreduktion erforderte, war ein erhöhter ALT-Wert (7,8 %).
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen, die bei mit Vorasidenib behandelten Patienten gemeldet wurden, sind unten in Tabelle 3 nach MedDRA Systemorganklasse und Häufigkeit gelistet.
Die Häufigkeiten sind definiert als sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gelegentlich (≥ 1/1 000 bis < 1/100), selten (≥ 1/10 000 bis < 1/1 000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad dargestellt.
Tabelle 3: Nebenwirkungen bei Patienten, die in der INDIGO-Studie mit Vorasidenib behandelt wurden (Studie AG881-C-004) (N = 167)
Systemorganklasse |
Häufigkeit |
Nebenwirkungen |
Erkrankungen des Blutes und des Lymphsystems |
Sehr häufig |
Thrombozytenzahl verminderta |
Stoffwechsel- und Ernährungsstörungen |
Häufig |
Hyperglykämie |
Appetit vermindert | ||
Hypophosphatämie | ||
Erkrankungen des Nervensystems |
Sehr häufig |
Schwindelgefühl |
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Häufig |
Dyspnoe |
Erkrankungen des Gastrointestinaltrakts |
Sehr häufig |
Diarrhoe |
Abdominalschmerz | ||
Häufig |
Gastro-oesophageale Refluxkrankheit |
|
Leber- und Gallenerkrankungen |
Sehr häufig |
Alanin-Aminotransferase erhöhta |
Aspartat-Aminotransferase erhöhta | ||
Gamma‑Glutamyltransferase erhöhta | ||
Häufig |
Alkalische Phosphatase erhöhta |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr häufig |
Ermüdung |
a Anomalie des Laborwertes, definiert als neu aufgetreten oder um mindestens einen Grad verschlechtert gegenüber dem Ausgangswert, oder der Ausgangswert ist unbekannt. | ||
Beschreibung ausgewählter Nebenwirkungen
Leber- und Gallenerkrankungen
In der Studie AG881-C-004 traten bei 18,6 % der 167 mit Vorasidenib behandelten Patienten Erhöhungen der ALT-Werte um das 3‑fache des ULN und bei 8,4 % Erhöhungen der AST-Werte um das 3‑fache des ULN auf. Bei 1,2 % dieser Patienten traten gleichzeitig Erhöhungen der ALT- oder AST-Werte um das 3‑fache des ULN sowie des Gesamtbilirubins um das 2‑fache des ULN auf. Die Erhöhungen der Leberenzyme und des Bilirubins waren vorübergehend und besserten sich oder verschwanden mit einer Dosisänderung oder dem dauerhaften Absetzen der Behandlung (siehe Abschnitte 4.2 und 4.4). Bei einem mit Vorasidenib behandelten Patienten wurden Leberversagen und Lebernekrose beobachtet, und bei einem weiteren mit Vorasidenib behandelten Patienten wurde eine Autoimmunhepatitis beobachtet (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
Im Falle einer Überdosierung wird sich die Toxizität wahrscheinlich als Verschlimmerung der mit Vorasidenib assoziierten Nebenwirkungen manifestieren (siehe Abschnitt 4.8). Die Patienten sollten engmaschig überwacht werden und eine angemessene unterstützende Behandlung erhalten (siehe Abschnitte 4.2 und 4.4). Es gibt kein spezifisches Antidot für eine Vorasidenib-Überdosierung.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel; andere antineoplastische Mittel
ATC-Code: L01XM04
Wirkmechanismus
Vorasidenib ist ein Hemmstoff, der auf die mutierten Enzyme IDH1 und IDH2 abzielt. Bei Patienten mit einem Astrozytom oder Oligodendrogliom führen IDH1- und IDH2-Mutationen zu einer Überproduktion des onkogenen Metaboliten 2‑Hydroxyglutarat (2‑ HG), was zu einer gestörten Zelldifferenzierung führt, die zur Onkogenese beiträgt. Die Hemmung der mutierten Proteine IDH1 und IDH2 durch Vorasidenib hemmt die anormale Produktion von 2‑HG, was zu einer Ausdifferenzierung der malignen Zellen und einer Verringerung ihrer Proliferation führt. Präklinische Studien, die die Fähigkeit von Vorasidenib zur Verringerung der Tumorgröße untersuchen, wurden nicht durchgeführt.
Pharmakodynamische Wirkungen
Es wurde beobachtet, dass eine therapeutische Tagesdosis von Vorasidenib die 2-HG-Konzentrationen im Tumor bei Probanden mit IDH1- oder IDH2-mutiertem Gliom senkt.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit und Sicherheit von Vorasidenib wurde in der INDIGO-Studie untersucht, einer randomisierten (1:1), multizentrischen, doppelblinden, placebokontrollierten Phase-3-Studie mit 331 Erwachsenen und Jugendlichen im Alter von ≥ 12 Jahren und einem Gewicht von ≥ 40 kg. Bei den teilnahmeberechtigten Patienten musste ein Astrozytom oder Oligodendrogliom des Grades 2 gemäß den WHO-Kriterien von 2016 mit einer IDH1-R132-Mutation oder einer IDH2-R172-Mutation vorliegen; zudem mussten sie (einen) chirurgische(n) Eingriff(e), einschließlich Biopsie, subtotaler Resektion oder vollständiger Resektion (gross total resection, GTR), als einzige Behandlung erhalten haben und nach Ansicht des Prüfarztes keine unmittelbare Notwendigkeit für eine Chemo- oder Strahlentherapie aufweisen. In die Studie wurden Patienten aufgenommen, die eine im MRT auswertbare, messbare, nicht fortschreitende Erkrankung aufwiesen, die von einem verblindeten, unabhängigen Prüfungsausschuss (BIRC) bestätigt wurde. Patienten mit zentral bestätigter, fortschreitender Erkrankung durften teilnehmen, vorausgesetzt, das Fortschreiten war minimal, nicht nodulär, nicht messbar und hatte sich zwischen den beiden letzten Scans nicht verändert. Die INDIGO-Studie schloss Patienten aus, die zuvor eine Anti-Tumor-Behandlung, einschließlich Chemo- oder Strahlentherapie, erhalten hatten. Der IDH1- oder IDH2-Mutationsstatus wurde prospektiv mit dem Oncomine Dx Target Test bestimmt.
Die Patienten wurden randomisiert und erhielten entweder Vorasidenib 40 mg oral einmal täglich oder ein entsprechendes Placebo bis zum radiologischen Fortschreiten der Erkrankung oder bis zu einer inakzeptablen Toxizität. Die Randomisierung erfolgte stratifiziert nach dem lokalen 1p19q-Status (co‑deletiert oder nicht co‑deletiert) und der Ausgangsgröße des Tumors (Durchmesser ≥ 2 cm oder < 2 cm). Patienten, die auf Placebo randomisiert wurden, durften nach einer dokumentierten radiologischen Krankheitsprogression auf Vorasidenib umgestellt werden, sofern sie nach Ansicht des Prüfarztes nicht sofort eine Chemo- oder Strahlentherapie benötigten.
Das primäre Maß für die Wirksamkeit war das radiologische progressionsfreie Überleben (PFS), das von einem BIRC nach den modifizierten Kriterien für die Beurteilung des Ansprechens in der Neuroonkologie bei niedriggradigen Gliomen (modified Response Assessment in Neuro‑Oncology for Low Grade Glioma, RANO‑ LGG) (nur radiologische Progression) bewertet wurde.
Die demografischen Daten und Krankheitsmerkmale der Patienten waren zwischen den Behandlungsarmen ausgeglichen. Unter den 168 Patienten, die auf Vorasidenib randomisiert wurden, lag das Durchschnittsalter bei 41 Jahren (Spanne: 21 bis 71 Jahre), wobei 98,8 % der Patienten 18-64 Jahre alt waren. Ein einziger pädiatrischer Patient im Alter von 16 Jahren wurde auf Placebo randomisiert, und kein Patient unter 18 Jahren wurde auf Vorasidenib randomisiert. Die Mehrheit der Patienten war männlich (60,1 %), 74,4 % waren Patienten weißer Hautfarbe, 3,0 % waren asiatischer Herkunft, 1,2 % waren Patienten mit schwarzer Hautfarbe, 1,2 % andere und 19,6 % machten keine Angaben; 53,6 % der Patienten hatten einen Karnofsky-Performance-Status (KPS) von 100, 45,8 % einen KPS von 90-80 und 0,6 % einen KPS von 70-60. Die meisten Patienten hatten mindestens eine frühere Operation wegen eines Glioms (75 %) und 25 % hatten ≥ 2 frühere Operationen. In beiden Armen hatten 95 % der Patienten eine IDH1-R132-Mutation und 5 % eine IDH2-R172-Mutation.
Die Ergebnisse zur Wirksamkeit für PFS sind in Tabelle 4 und in Abbildung 1 zusammengefasst.
Tabelle 4: Ergebnisse zur Wirksamkeit der INDIGO-Studie (Studie AG881-C-004)
Wirksamkeitsparameter |
Voranigo |
Placebo |
Progressionsfreies Überleben (PFS) | ||
Anzahl der Ereignisse, n (%) |
47 (28,0) |
88 (54,0) |
Medianes PFS, Monate (95 % KI)a |
27,7 (17,0; NE) |
11,1 (11,0; 13,7) |
Hazard Ratio (95 % KI)b |
0,39 (0,27; 0,56) |
|
p‑Wertc |
0,000000067 |
|
Abkürzungen: KI = Konfidenzintervall; NE = Nicht schätzbar | ||
a Das 95 %-Konfidenzintervall für den Median wurde nach der Methode von Brookmeyer und Crowley berechnet. | ||
b Geschätzt mit dem Cox-Proportional-Hazard-Modell, das um die folgenden Stratifikationsfaktoren bereinigt wurde: 1p19q-Status und Ausgangsgröße des Tumors. | ||
c Geschätzt anhand eines einseitigen stratifizierten Logrank-Tests. Das PFS wurde mit einem einseitigen Wirksamkeitsgrad α‑Level von 0,000359 getestet, basierend auf einer aktualisierten Wirksamkeitsgrenze, die dem Informationsanteil von 82 % entspricht. | ||
Abbildung 1: Kaplan‑Meier-Kurve für das progressionsfreie Überleben nach BIRC-Review in der INDIGO-Studie
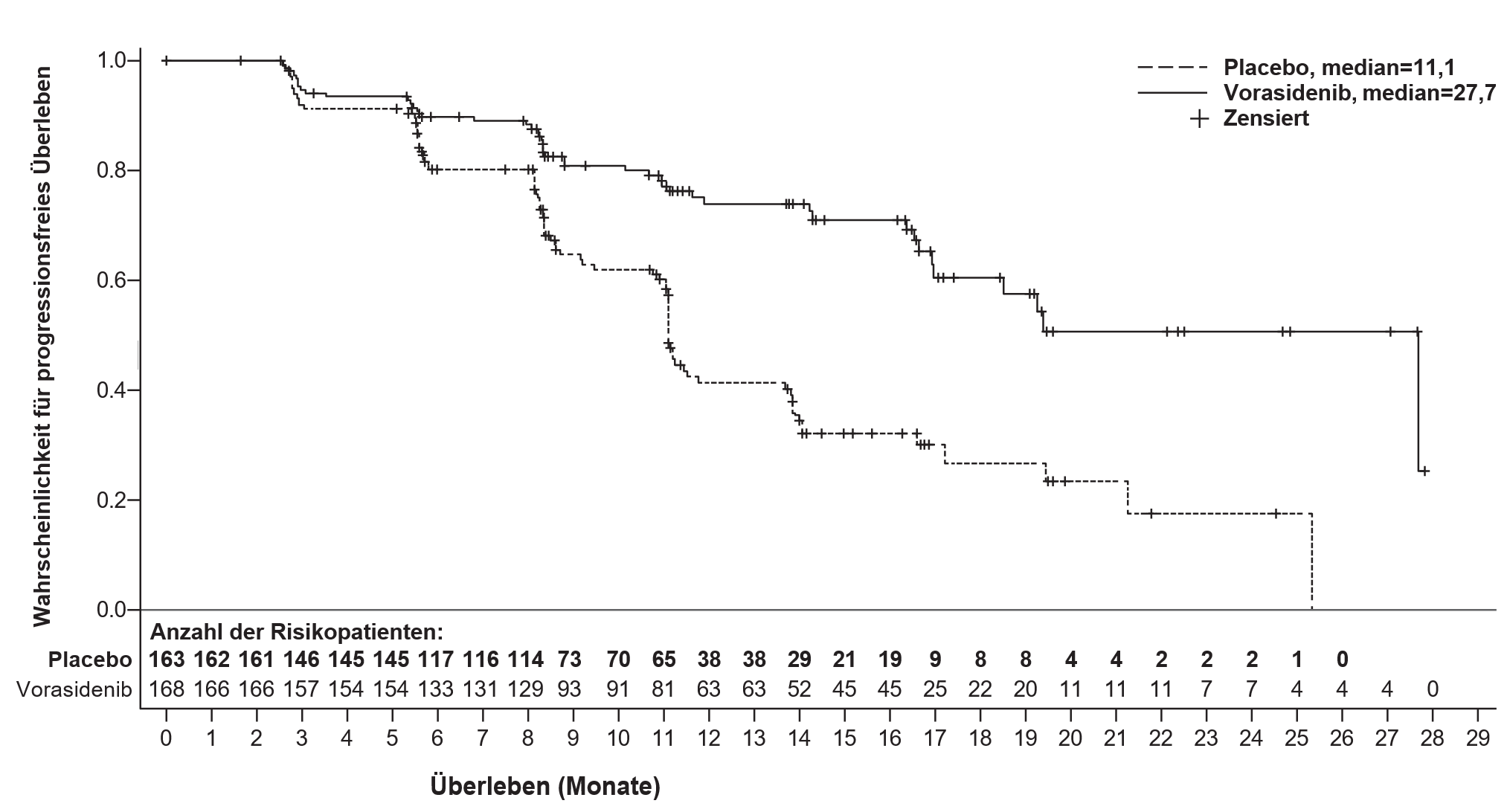
Eine aktualisierte PFS-Analyse des BIRC, die bei 96 % (N = 158) der Ereignisse durchgeführt wurde, bestätigte den Nutzen von Vorasidenib im Vergleich zu Placebo (Hazard Ratio: 0,35 [95 % KI: 0,25, 0,49]). Nach 24 Monaten betrug die progressionsfreie Überlebensrate 59 % (95 % KI: 48,4, 67,8) in der Vorasidenib-Gruppe und 26 % (95 % KI: 17,9, 35,3) in der Placebo-Gruppe. Das mediane progressionsfreie Überleben (PFS) war für den Vorasidenib-Arm nicht schätzbar (95 % KI: 22,1, nicht schätzbar) und betrug für den Placebo-Arm 11,4 (95 % KI: 11,1, 13,9) Monate.
Kinder und Jugendliche
Jugendliche im Alter von 12 bis unter 18 Jahren
Die Anwendung von Vorasidenib bei Patienten im Alter von 12 bis unter 18 Jahren mit IDH1- oder IDH2-mutiertem Astrozytom oder Oligodendrogliom wird durch pharmakokinetische Daten unterstützt, die zeigen, dass das Alter keine klinisch bedeutsame Auswirkung auf die Pharmakokinetik von Vorasidenib hat (siehe Abschnitt 5.2).
Die Pharmakokinetik von Vorasidenib wurde bei Patienten mit niedriggradigem Gliom mit einer IDH1- oder IDH2-Mutation und bei gesunden Probanden untersucht. Das pharmakokinetische Profil von Vorasidenib ist bei Patienten mit niedriggradigem Gliom und gesunden Probanden ähnlich.
Resorption
Nach einer oralen Einzeldosis von 40 mg betrug die mediane Zeit bis zur Cmax (Tmax) für Vorasidenib 2,0 Stunden, der geometrische Mittelwert der Cmax betrug 75,4 ng/ml (CV %: 44), und der geometrische Mittelwert der AUC betrug 2 860 h*ng/ml (CV %: 56). Im Steady State betrug der geometrische Mittelwert der Cmax von Vorasidenib 133 ng/ml (CV %: 73) und der geometrische Mittelwert der AUC 1 988 h*ng/ml (CV %: 95). Bei den meisten Patienten trat innerhalb von 24 Stunden nach der Einnahme des Arzneimittels ein zweiter Plasmakonzentrationspeak auf, der jedoch niedriger war als der beobachtete Cmax-Wert 2 Stunden nach der Einnahme. Obwohl die absolute Bioverfügbarkeit nicht direkt bestimmt wurde, wird die Resorption von Vorasidenib für die 40-mg-Filmtabletten als moderat bis hoch eingeschätzt.
Das Akkumulationsverhältnis betrug ungefähr 3,8 für Cmax und 4,4 für die AUC. Stabile Plasmaspiegel wurden nach 2 bis 3 Wochen bei einmaliger täglicher Einnahme erreicht.
Die mittlere Cmax und AUC von Vorasidenib stiegen um das 3,1‑ bzw. 1,4‑fache, wenn Vorasidenib zusammen mit einer fettreichen Mahlzeit eingenommen wurde. Die Einnahme von Vorasidenib mit einer fettarmen Mahlzeit führte zu einem Anstieg der Cmax und der AUC von Vorasidenib um das 2,3 bzw. 1,4‑fache (siehe Abschnitt 4.2).
Verteilung
Vorasidenib hat ein mittleres scheinbares Verteilungsvolumen von 3 930 l (CV %: 40). Das Verteilungsvolumen von Vorasidenib nach einer einzigen Mikrodosis von 0,1 mg intravenös beträgt 1 110 l. Die gebundene Plasmaproteinfraktion für Vorasidenib und AGI-69460 betrug 97 % bzw. 87 %. Sowohl Vorasidenib als auch AGI-69460 binden bevorzugt an Serumalbumin und nicht an saures Alpha-1-Glykoprotein. Das Blut-Plasma-Verhältnis von Vorasidenib liegt bei 0,87, das Blut-Plasma-Verhältnis von AGI-69460 bei 1,38 und das Verhältnis von Hirntumor- zu Plasmakonzentration von Vorasidenib bei 1,6.
Biotransformation
Vorasidenib wird hauptsächlich durch CYP1A2 verstoffwechselt, mit vernachlässigbaren bis geringen Beiträgen von CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 und CYP3A4/5. Nicht-CYP-abhängige Stoffwechselwege, können bis zu 30 % zur metabolischen Clearance von Vorasidenib in der Leber beitragen.
AGI-69460 ist ein nachgeschalteter aktiver Metabolit von Vorasidenib. Nach einer oralen Einzeldosis von 40 mg Vorasidenib betrug die beobachtete Tmax für den Metaboliten AGI-69460 336 Stunden, der beobachtete geometrische Mittelwert Cmax betrug 3,32 ng/ml (CV %: 55,6) und der geometrische Mittelwert der AUC0-t betrug 1 172 h*ng/ml (CV %: 61). Im Steady State betrug der geometrische Mittelwert von AGI-69460 Cmin,ss 111 ng/ml (CV %: 58) und der geometrische Mittelwert der AUC0-4 an Tag 1 des 2. Zyklus betrug 190 h*ng/ml (CV %: 90).
Wechselwirkungen
In vitro besitzt Vorasidenib eine starke Induktionswirkung auf sensitive CYP3A4-Substrate und eine mäßige Induktionswirkung auf empfindliche CYP2B6- und CYP2C19-Substrate (siehe Abschnitt 4.5).
In-vitro-Daten weisen darauf hin, dass Vorasidenib ein Inhibitor von BCRP ist. Vorasidenib hemmt nicht das P-Glykoprotein (P‑gp) und den hepatischen Organo-Anion-Transporter (organic anion transporting polypeptide, OATP)1B1. In-vitro ist AGI-69460 ein Inhibitor von BCRP und OATP1B3.
Vorasidenib ist kein Substrat von P-gp, BCRP oder der hepatischen Transporter OATP1B1 und OATP1B3.
Elimination
Etwa 89 % der verabreichten radioaktiven Dosis von Vorasidenib, die in einer Pulver-in-Kapsel-Formulierung mit einer absoluten Bioverfügbarkeit von < 34 % verabreicht wurde, wurde im Laufe von 44 Tagen ausgeschieden, davon 85 % im Stuhl und 4,5 % im Urin. Der Großteil der verabreichten Radioaktivität, die im Stuhl wiederdetektiert wurde, war unverändertes Vorasidenib (55 %), während im Urin kein unverändertes Vorasidenib nachgewiesen wurde.
Die mittlere terminale Halbwertszeit von Vorasidenib beträgt 238 Stunden (CV %: 57), die effektive Halbwertszeit liegt bei 63,2 Stunden (CV %: 75) und die mittlere scheinbare Clearance beträgt 14,0 l/h (CV %: 56).
Linearität/Nicht‑Linearität
Nach Verabreichung von Voranigo steigen Vorasidenib Cmax und AUC proportional zwischen 10 und 40 mg an.
Spezielle Patientengruppen
Ältere Patienten
Bei älteren Patienten bis zu 75 Jahren wurden keine klinisch bedeutsamen Auswirkungen auf die Pharmakokinetik von Vorasidenib beobachtet (siehe Abschnitt 4.2).
Nierenfunktionsstörung
Nierenfunktionsstörung (eGFR > 40 ml/min/1,73 m2) hatten keine klinisch signifikanten Auswirkungen auf die Pharmakokinetik von Vorasidenib. Die Pharmakokinetik von Vorasidenib bei Patienten mit einer eGFR ≤ 40 ml/min/1,73 m2 oder einer dialysepflichtigen Niereninsuffizienz ist nicht bekannt.
Leberfuntionsstörung
Eine moderate Beeinträchtigung der Leberfunktion (Child-Pugh-Klasse B) hatte keine klinisch signifikanten Auswirkungen auf die Pharmakokinetik von Vorasidenib und AGI-69460. Bei Patienten mit moderater Leberfunktionsstörung traten nach einer oralen Einzeldosis von 20 mg Vorasidenib keine klinisch relevanten Veränderungen der gesamten oder freien (ungebundenen) Vorasidenib-Konzentrationen auf (ähnliche Vorasidenib-Cmax-Werte und ein Anstieg der Vorasidenib-AUC0-t um 26,0 % wurden beobachtet, während die AGI-69460-Exposition abnahm). Die Pharmakokinetik von Vorasidenib und AGI-69460 bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) ist nicht bekannt (siehe Abschnitte 4.2 und 4.4).
Andere
Es wurden keine klinisch signifikanten Auswirkungen auf die Pharmakokinetik von Vorasidenib in Abhängigkeit von Alter (16 bis 75 Jahre), Rasse, Ethnizität und Körpergewicht (43,5 bis 168 kg) beobachtet. Bei weiblichen Patienten wurde eine 1,6‑fach höhere Vorasidenib-Exposition im Vergleich zu männlichen Patienten beobachtet.
Kinder und Jugendliche
Pharmakokinetische Daten zeigten, dass das Alter keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik von Vorasidenib hat. Es wird erwartet, dass die Exposition von Vorasidenib bei Erwachsenen und jugendlichen Patienten ab 12 Jahren ähnlich ist.
Die wichtigsten Zieltoxizitäten, die in Studien zur Toxizität bei wiederholter Verabreichung festgestellt wurden, betreffen Leber, Magen-Darm-Trakt, Haut, Nieren, Skelettmuskeln, Fortpflanzungsorgane und Brustdrüse.
Vorasidenib war im in-vitro-Test zur bakteriellen reversen Mutation (Ames-Test), im in-vitro-Mikronukleustest an menschlichen Lymphozyten und im in-vivo-Mikronukleustest an Rattenknochenmark nicht genotoxisch. AGI-69460, sein wichtigster zirkulierender Metabolit, war im Ames-Test, im in-vitro-Mikronukleustest an menschlichen Lymphozyten und in den in-vivo-Mikronukleus- und Comet-Tests an Rattenknochenmark nicht genotoxisch.
In der 13-wöchigen Studie an Affen wurde bei der primären Nekropsie eine Hyperplasie der Kupffer-Zellen beobachtet, die sich nach der Erholungsphase bei der 8‑fachen klinischen Exposition verschlimmerte. Darüber hinaus deuten die Ergebnisse von Studien zur Toxizität bei Ratten auf eine hormonelle Störung hin. Diese Befunde können auf ein potenzielles karzinogenes Risiko hindeuten. Studien zur Karzinogenität wurden mit Vorasidenib noch nicht durchgeführt.
Mit Vorasidenib wurden keine Fertilitätsstudien an Tieren durchgeführt. Auswirkungen auf die Fortpflanzungsorgane wurden bei Toxizitätsstudien mit wiederholter Gabe nach Verabreichung von Vorasidenib an Ratten festgestellt. Zu den unerwünschten Wirkungen auf die weiblichen Fortpflanzungsorgane gehörten Atrophie der Eierstöcke, der Gebärmutter, des Gebärmutterhalses und der Vagina sowie Veränderungen des Östruszyklus. Bei männlichen Ratten wurden Auswirkungen auf Nebenhoden (Zelltrümmer), Samenblase/Prostata (Atrophie) und Hoden (Gewicht, tubuläre Degeneration) festgestellt. Diese Auswirkungen wurden in der 13-wöchigen Studie an Ratten bei der niedrigsten getesteten Dosis von 5 mg/kg/Tag beobachtet; dies entspricht einer Exposition, die 26-mal höher war als die menschliche Exposition bei einer Tagesdosis von 50 mg.
Vorasidenib verursachte eine embryo-fetale Toxizität bei trächtigen Ratten und Kaninchen (höhere Inzidenz von Resorptionen, verzögerte Verknöcherung, viszerale Missbildungen bei Niere und Hoden bei Ratten). Diese Auswirkungen traten bei Dosen auf, die im Vergleich zu Patienten, die die therapeutische Tagesdosis erhielten, höher waren. Die NOAEL (No Observed Adverse Effect Level) Expositionsverhältnisse bzgl. der embryo-fetalen Entwicklung bei Ratten und Kaninchen lagen bei 8,0 bis 28,5 bzw. 1,1 bis 4,9 an den Trächtigkeitstagen 6 und 17 bei der Ratte und 6 und 19 beim Kaninchen.
Tablettenkern
Mikrokristalline Cellulose (E460)
Croscarmellose-Natrium
Mikrokristalline Cellulose, Siliciumdioxid-beschichtet (enthält mikrokristalline Cellulose und colloidales, wasserfreies Siliciumdioxid)
Magnesiumstearat (E470b)
Natriumlaurylsulfat (E487)
Filmüberzug
Hypromellose
Titandioxid (E171)
Lactose-Monohydrat
Macrogol (E1521)
Druckfarbe
Schwarzes Eisenoxid (E172)
Propylenglycol (E1520)
Hypromellose (E464)
Nicht zutreffend.
30 Monate.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Weiße HDPE-Flasche mit einem kindersicheren Verschluss aus Polypropylen (PP) und einer mit Polyethylen (PE) beschichteten Induktionshitzeversiegelung mit drei Silikagel-Trockenmitteln in HDPE-Behältern. Packungsgröße von 30 Filmtabletten.
Die Patienten sollten darauf hingewiesen werden, das in der Tablettenflasche enthaltene Silikagel-Trockenmittel nicht zu schlucken.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankreich
EU/1/25/1912/001
EU/1/25/1912/002
Datum der Erteilung der Zulassung: 17. September 2025
September 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Servier Deutschland GmbH
Elsenheimerstr. 53
D-80687 München
Tel: +49 (0)89 57095-01
Fax: +49 (0)89 57095-126
E-mail: info-de@servier.com