▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
Jaydess®
13,5 mg intrauterines Wirkstofffreisetzungssystem
Das intrauterine Wirkstofffreisetzungssystem enthält 13,5 mg Levonorgestrel.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Details zu Freisetzungsraten, siehe Abschnitt 5.2.
Intrauterines Wirkstofffreisetzungssystem (IUS).
Das Arzneimittel besteht aus einem weißen oder fast weißen, mit einer halb durchsichtigen Membran umhüllten Arzneimittelkern, der um den vertikalen Schaft eines T-förmigen Körpers befestigt ist. Zusätzlich enthält der vertikale Schaft nahe den horizontalen Armen einen Silberring. An dem einen Ende des vertikalen Schafts des weißen, T-förmigen Körpers befindet sich eine Öse, am anderen Ende zwei horizontale Arme. An der Öse sind braun gefärbte Rückholfäden befestigt. Der vertikale Schaft des IUS befindet sich im Insertionsröhrchen an der Spitze der Insertionsvorrichtung. IUS und Insertionsvorrichtung sind im Wesentlichen frei von sichtbaren Verunreinigungen.
Abmessungen von Jaydess: 28 x 30 x 1,55 mm
Kontrazeption für eine Anwendungsdauer von bis zu 3 Jahren.
Dosierung
Jaydess wird in das Cavum uteri eingelegt und ist bis zu drei Jahre lang wirksam.
Insertion
Es wird empfohlen, dass die Insertion von Jaydess nur durch einen in der Insertion von IUS erfahrenen und/oder für die Insertion von Jaydess geschulten Arzt/Ärztin vorgenommen wird.
Vor der Insertion sollte die Patientin sorgfältig untersucht werden, um etwaige Kontraindikationen für die Insertion des IUS festzustellen. Schließen Sie vor der Insertion eine Schwangerschaft aus. Ziehen Sie die Möglichkeit einer Ovulation und Konzeption in Betracht, bevor Sie dieses Arzneimittel anwenden. Jaydess ist nicht zur Anwendung als postkoitales Kontrazeptivum geeignet (siehe Abschnitt 4.3 und Abschnitt 4.4 Medizinische Untersuchungen/Konsultationen).
Tabelle 1: Wann Jaydess bei Frauen im gebärfähigen Alter eingelegt werden soll
Beginn der Anwendung von Jaydess |
|
Postpartale Insertion |
Zusätzlich zu den obigen Anleitungen (Beginn der Anwendung von Jaydess): |
Insertion nach einem Abort im ersten Trimenon |
Jaydess kann sofort nach einem Abort im ersten Trimenon eingelegt werden. In diesem Fall ist keine zusätzliche Kontrazeption erforderlich. |
Austausch von Jaydess |
Jaydess kann zu jedem beliebigen Zeitpunkt während des Menstruationszyklus durch ein neues IUS ersetzt werden. In diesem Fall ist keine zusätzliche Kontrazeption erforderlich. |
Wechsel von einer anderen Verhütungsmethode (z. B. kombinierte hormonelle Verhütungsmittel, Implantat) |
|
Wichtige Informationen, die während oder nach der Insertion zu beachten sind
Wenn die Insertion schwierig ist und/oder außergewöhnliche Schmerzen oder Blutungen während oder nach der Insertion auftreten, sollte die Möglichkeit einer Perforation in Betracht gezogen werden und es sollten geeignete Maßnahmen wie eine körperliche Untersuchung und eine Ultraschallkontrolle ergriffen werden.
Die Patientin sollte 4 bis 6 Wochen nach der Insertion nachuntersucht werden, um die Rückholfäden zu kontrollieren und um sicherzustellen, dass das System korrekt positioniert ist. Eine körperliche Untersuchung allein (inklusive Kontrolle der Rückholfäden) ist möglicherweise nicht ausreichend, um eine partielle Perforation auszuschließen und eine Ultraschallkontrolle kann in Betracht gezogen werden (siehe Abschnitt 4.4).
Jaydess kann durch die Kombination des im Ultraschall sichtbaren Silberringes und der braun gefärbten Rückholfäden von anderen IUS unterschieden werden. Der T-förmige Rahmen von Jaydess enthält Bariumsulfat, wodurch er bei einer Röntgenuntersuchung sichtbar ist.
Entfernen/ Austausch
Jaydess wird durch sanftes Ziehen an den Rückholfäden mit einer Zange entfernt. Die Anwendung von übermäßiger Kraft/scharfen Instrumenten während des Entfernens kann zum Bruch des Systems führen. Nach dem Entfernen von Jaydess sollte das System untersucht werden, um sicherzustellen, dass es intakt ist und vollständig entfernt wurde. Wenn die Rückholfäden nicht sichtbar sind, muss durch eine Ultraschalluntersuchung oder eine andere Methode die Lage des Systems festgestellt werden. Falls sich das System im Cavum uteri befindet, kann es mit Hilfe einer schmalen Zange entfernt werden. Dies kann eine Dilatation des Zervikalkanals oder einen anderen operativen Eingriff erforderlich machen.
Das System sollte spätestens am Ende des dritten Jahres entfernt werden.
Weiterführen der Kontrazeption nach dem Entfernen
Wenn die Frau bei derselben Methode bleiben möchte, kann sofort nach dem Entfernen des bisherigen ein neues System eingelegt werden.
Wenn die Frau nicht bei derselben Methode bleiben möchte, aber eine Schwangerschaft nicht erwünscht ist, sollte Jaydess innerhalb von 7 Tagen nach Beginn der Menstruation entfernt werden, sofern ein Menstruationszyklus besteht. Wenn das System zu einem anderen Zeitpunkt des Zyklus entfernt wird oder die Frau keine regelmäßigen Menstruationsblutungen hat und die Frau innerhalb der letzten Woche Geschlechtsverkehr hatte, besteht ein Schwangerschaftsrisiko. Um einen kontinuierlichen Empfängnisschutz zu gewährleisten, sollte mindestens 7 Tage vor der Entfernung eine Barrieremethode zur Schwangerschaftsverhütung (z. B. Kondome) angewendet werden. Nach der Entfernung sollte sofort mit der neuen Verhütungsmethode begonnen werden (beachten Sie die Anweisungen zur Anwendung der neuen Verhütungsmethode).
Ältere Patientinnen
Jaydess wurde bei Frauen im Alter von > 65 Jahren nicht untersucht. Die Anwendung von Jaydess bei postmenopausalen Frauen ist nicht angezeigt.
Patientinnen mit eingeschränkter Leberfunktion
Jaydess wurde bei Frauen mit eingeschränkter Leberfunktion nicht untersucht. Jaydess ist bei Frauen mit akuter Lebererkrankung oder Lebertumor kontraindiziert (siehe Abschnitt 4.3).
Patientinnen mit eingeschränkter Nierenfunktion
Jaydess wurde bei Frauen mit eingeschränkter Nierenfunktion nicht untersucht.
Kinder und Jugendliche
Die Anwendung dieses Arzneimittels vor der Menarche ist nicht angezeigt. Für Daten zu Sicherheit und Wirksamkeit bei Adoleszenten siehe Abschnitt 5.1.
Art der Anwendung
Das System muss unter aseptischen Bedingungen von einem Arzt/einer Ärztin eingelegt werden.
Jaydess wird in einem Inserter in einer sterilen Verpackung geliefert, die erst zum Zeitpunkt der Insertion geöffnet werden sollte. Nicht resterilisieren. In der gelieferten Form ist Jaydess nur zur einmaligen Anwendung vorgesehen. Nicht verwenden, wenn die Blisterpackung beschädigt oder geöffnet ist. Nicht nach dem auf der Faltschachtel und der Blisterpackung angegebenen Verfallsdatum „Verwendbar bis“ einlegen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Jaydess wird im Umkarton mit einer Patientinnenerinnerungskarte geliefert. Füllen Sie die Patientinnenerinnerungskarte aus und übergeben Sie diese an die Patientin nach dem Einsetzen.
Vorbereitung der Insertion
Untersuchen Sie die Patientin, um Kontraindikationen für die Insertion von Jaydess auszuschließen (siehe Abschnitt 4.3 und Abschnitt 4.4 Medizinische Untersuchungen/Konsultationen).
Führen Sie ein Spekulum ein, stellen Sie die Zervix dar und desinfizieren Sie anschließend sorgfältig Zervix und Vagina mit einer geeigneten antiseptischen Lösung.
Wenn notwendig, lassen Sie sich von einem Assistenten/einer Assistentin unterstützen.
Ergreifen Sie die vordere Muttermundslippe mit einer Kugelzange oder einer anderen Fasszange, um den Uterus zu stabilisieren. Wenn ein retrovertierter Uterus vorliegt, kann es sinnvoller sein, die hintere Muttermundslippe zu ergreifen. Zur Streckung des Zervikalkanals kann ein leichter Zug auf die Zange ausgeübt werden. Während der Insertion sollte die Zange in Position gehalten und ein leichter Gegenzug auf die Zervix aufrecht erhalten werden.
Schieben Sie eine Uterussonde durch den Zervikalkanal bis zum Fundus uteri vor, um die Länge und die Richtung des Cavum uteri zu bestimmen und etwaige intrauterine Anomalien (z. B. Septum, submuköse Myome) oder ein früher eingelegtes intrauterines Kontrazeptivum, das nicht entfernt wurde, auszuschließen. Bei Schwierigkeiten, erwägen Sie gegebenenfalls eine Dilatation des Zervikalkanals. Ist eine Zervixdilatation erforderlich, ziehen Sie den Gebrauch von Analgetika und/oder eine Parazervikalblockade in Erwägung.
Insertion
|
1. Öffnen Sie zuerst die sterile Verpackung vollständig (Abbildung 1). Benutzen Sie dann sterile Handschuhe und führen das Insertionsverfahren unter aseptischen Bedingungen durch. 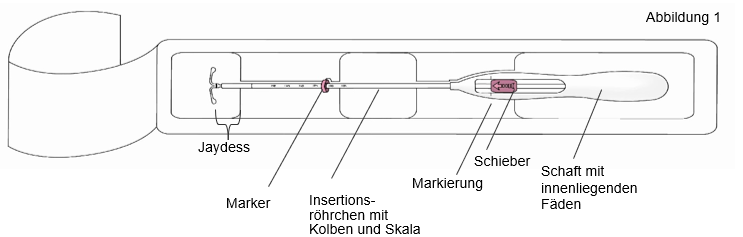 | |
2. Drücken Sie den Schieber in Pfeilrichtung bis zur äußersten Position nach vorne, um Jaydess in das Insertions-röhrchen zu laden (Abbildung 2). |
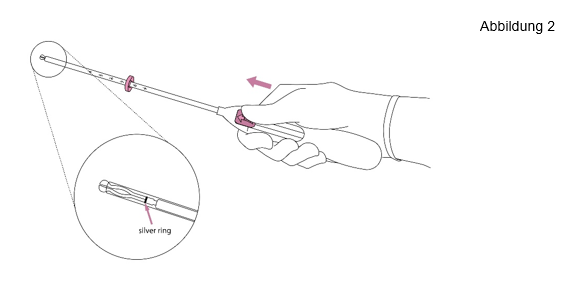 |
WICHTIG! Ziehen Sie den Schieber nicht zurück, da dies eine vorzeitige Freisetzung von Jaydess zur Folge haben kann. Einmal freigesetzt, kann Jaydess nicht erneut geladen werden. | |
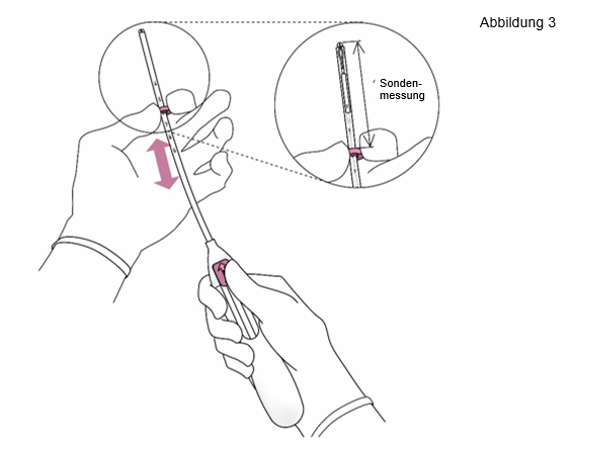
3. Halten Sie den Schieber in der äußersten Position und stellen Sie den oberen Rand des Markers auf die mit der Sonde gemessene Länge des Cavum uteri ein (Abbildung 3). |
 |
4. Während Sie den Schieber in der äußersten Position halten, führen Sie das Insertionsröhr-chen durch die Zervix ein, bis der Marker ca. 1,5‑2,0 cm von der Portio entfernt ist (Abbildung 4). |
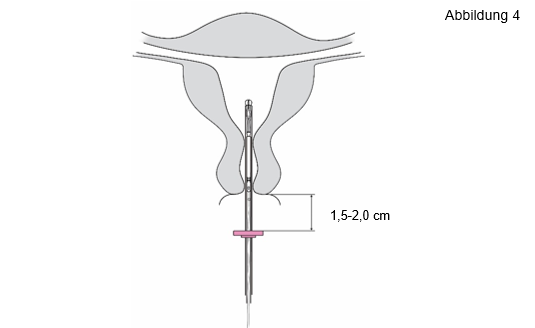 |
WICHTIG! Das Insertionsröhrchen nicht mit Gewalt einführen. Dilatieren Sie den Zervikalkanal, wenn nötig. | |
5. Während Sie den Inserter ruhig in seiner Position halten, ziehen Sie den Schieber bis zur Markierung herunter, um die horizontalen Arme von Jaydess zu entfalten (Abbildung 5). Warten Sie 5‑10 Sekunden, damit sich die horizontalen Arme vollständig entfalten können. |
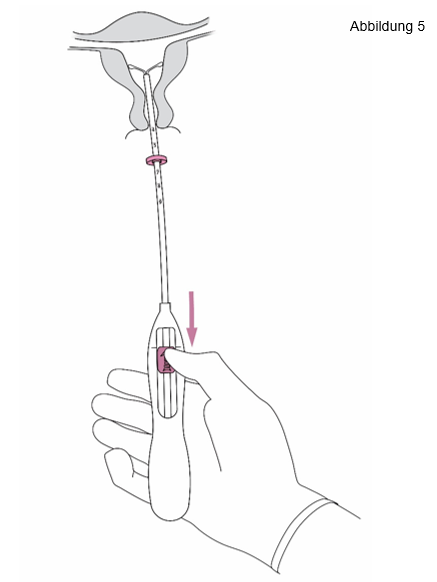 |
6. Schieben Sie den Inserter sanft in Richtung Fundus uteri vor, bis der Marker |
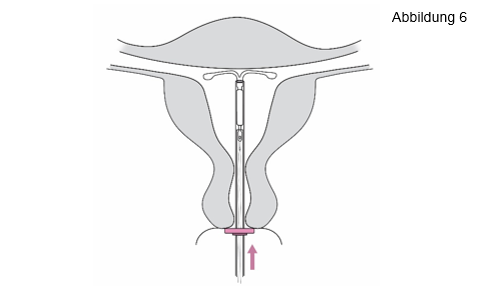 |
7. Halten Sie weiterhin den Inserter ruhig in Position und setzen Sie Jaydess frei, indem Sie den Schieber vollständig hinunterziehen (Abbildung 7). |
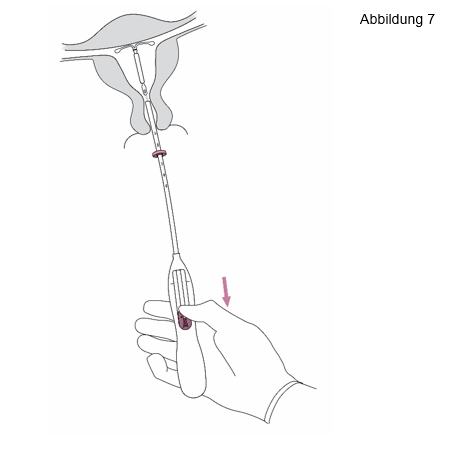 |
WICHTIG! Sollten Sie vermuten, dass sich das System nicht in korrekter Position befindet, überprüfen Sie die Lage von Jaydess (z. B. mit Ultraschall). Entfernen Sie das System, wenn es nicht korrekt im Cavum uteri liegt. Ein entferntes System darf nicht wieder eingesetzt werden. | |
Entfernen/Austausch
Zum Entfernen/Austauschen siehe Abschnitt 4.2, „Insertion und Entfernen/Austausch“.
|
Jaydess wird durch sanftes Ziehen an den Rückholfäden mittels einer Zange entfernt (Abbildung 8). Unmittelbar nach dem Entfernen kann eine neue Jaydess eingelegt werden. Nach dem Entfernen von Jaydess sollte das System untersucht werden um sicherzustellen, dass es intakt ist und vollständig entfernt wurde. |
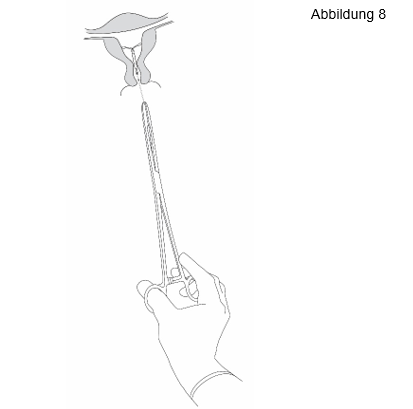 |
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile;
Schwangerschaft (siehe Abschnitt 4.6);
akute oder rezidivierende entzündliche Beckenerkrankung (PID) oder Krankheiten, die mit einem erhöhten Risiko für Beckeninfektionen verbunden sind;
akute Zervizitis oder Vaginitis;
postpartale Endometritis oder septischer Abort in den vorangegangenen drei Monaten;
bestehende zervikale intraepitheliale Neoplasie;
maligne Erkrankung von Uterus oder Zervix;
gestagen-sensitive Tumoren, z. B. Mammakarzinom;
irreguläre uterine Blutung unbekannter Ätiologie;
angeborene oder erworbene Fehlbildung des Uterus einschließlich Uterusmyomen, die die Insertion und/oder Retention des intrauterinen Wirkstofffreisetzungssystems behindern würden (d. h. wenn sie die Gebärmutterhöhle verformen);
akute Lebererkrankung oder Lebertumor.
Jaydess ist mit besonderer Vorsicht nach Konsultation eines Facharztes anzuwenden oder gegebenenfalls zu entfernen, wenn eine der folgenden Erkrankungen vorliegt oder zum ersten Mal auftritt:
Migräne, fokale Migräne mit asymmetrischem Sehverlust oder andere Symptome, die auf eine transitorische zerebrale Ischämie hinweisen
außergewöhnlich starke Kopfschmerzen
Ikterus
deutliche Blutdrucksteigerung
schwere arterielle Erkrankungen wie z. B. Schlaganfall oder Herzinfarkt.
Niedrig dosiertes Levonorgestrel kann die Glucosetoleranz beeinflussen, deshalb sollte bei Diabetikerinnen, die Jaydess anwenden, der Blutzuckerspiegel überwacht werden. Im Allgemeinen ist jedoch eine Änderung des Therapieschemas bei Diabetikerinnen, die ein IUS mit Levonorgestrel anwenden, nicht notwendig.
Medizinische Untersuchungen/Konsultationen
Vor der Einlage muss die Patientin über Nutzen und Risiken von Jaydess, einschließlich der Anzeichen und Symptome einer Perforation sowie des Risikos einer ektopischen Schwangerschaft, siehe unten, aufgeklärt werden. Es sollte eine körperliche Untersuchung einschließlich Becken und Mammae durchgeführt werden. Ein Zervikalabstrich sollte erfolgen, wenn dies für ärztlich erforderlich gehalten wird. Eine Schwangerschaft und sexuell übertragbare Krankheiten sind auszuschließen. Genitalinfektionen sollten vor der Einlage erfolgreich behandelt werden. Die Lage des Uterus und die Größe der Gebärmutterhöhle sollten bestimmt werden. Die korrekte Positionierung von Jaydess im Fundus ist wichtig, um die Wirksamkeit zu maximieren und um das Risiko einer Expulsion zu senken. Die Anleitungen zur Insertion sollten genau befolgt werden.
Dem Training der korrekten Insertionstechnik sollte besondere Beachtung geschenkt werden.
Insertion und Entfernen können mit leichten Schmerzen und Blutungen einhergehen. Das Verfahren kann eine vasovagale Reaktion hervorrufen (z. B. Synkope oder bei Epileptikerinnen einen Krampfanfall).
Die Patientin sollte 4 bis 6 Wochen nach der Insertion nachuntersucht werden, um die Rückholfäden zu überprüfen und um sicherzustellen, dass das System korrekt positioniert ist. Eine vaginale Ultraschalluntersuchung kann in Erwägung gezogen werden, um die korrekte Position des Systems festzustellen. Wenn Jaydess nicht im Cavum uteri lokalisiert werden kann, sollte eine Expulsion oder eine vollständige Perforation in Betracht gezogen werden (siehe Abschnitt „Perforation“ weiter unten), und es kann eine Röntgenuntersuchung durchgeführt werden. Danach sollte einmal jährlich eine Nachuntersuchung durchgeführt werden, wenn klinisch indiziert auch häufiger.
Jaydess ist nicht zur postkoitalen Kontrazeption geeignet.
Die Anwendung von Jaydess zur Behandlung von starken Menstruationsblutungen oder zur Endometriumprotektion während einer Estrogen-Substitutionstherapie ist nicht belegt und wird deshalb hierfür nicht zur Anwendung empfohlen.
Perforation
Perforation oder Penetration des Corpus uteri oder der Zervix können durch ein intrauterines Kontrazeptivum (IUC) verursacht werden. Am häufigsten geschieht dies bei der Insertion, obwohl dies möglicherweise erst einige Zeit später festgestellt wird. Dadurch kann die Wirksamkeit von Jaydess verringert sein. Im Falle einer schwierig verlaufenden Insertion und/oder wenn während oder nach der Insertion außergewöhnliche Schmerzen oder Blutungen auftreten, müssen unverzüglich geeignete Maßnahmen wie eine körperliche Untersuchung und eine Ultraschallkontrolle ergriffen werden, um eine Perforation auszuschließen. In einigen Fällen kann das System außerhalb des Cavum uteri lokalisiert werden. In solchen Fällen ist das System unverzüglich zu entfernen; unter Umständen ist ein chirurgischer Eingriff erforderlich.
In einer groß angelegten, prospektiven, vergleichenden, nicht-interventionellen Kohortenstudie bei IUS-Anwenderinnen (N=61.448 Frauen) mit einer 1-jährigen Beobachtungsdauer lag die Perforations-Inzidenz bei 1,3 (95% CI: 1,1 – 1,6) per 1.000 Insertionen in der gesamten Studien-Kohorte; 1,4 (95% CI: 1,1 – 1,8) per 1.000 Insertionen in der LNG-IUS-Kohorte und 1,1 (95% CI: 0,7 – 1,6) per 1.000 Insertionen in der Kupfer-Intrauterinpessar (IUP)-Kohorte.
Die Studie zeigte, dass das Risiko einer Perforation sowohl bei stillenden Frauen zum Zeitpunkt der Insertion als auch bei Frauen bis 36 Wochen nach der Entbindung erhöht ist (siehe Tabelle 2). Beide Risikofaktoren sind unabhängig vom Typ des eingesetzten IUC.
Tabelle 2: Perforations-Inzidenz per 1.000 Insertionen für die gesamte Studien-Kohorte beobachtet über 1 Jahr, gegliedert nach zum Zeitpunkt der Insertion stillende/nichtstillende Frauen und der Zeitspanne zwischen Entbindung und Insertion (Frauen nach der Geburt)
Stillende Frauen zum Zeitpunkt der Insertion |
Nicht stillende Frauen zum Zeitpunkt der Insertion |
|
Insertion ≤ 36 Wochen nach Entbindung |
5,6 |
1,7 |
Insertion > 36 Wochen nach Entbindung |
1,6 |
0,7 |
Bei Ausweitung der Beobachtungsperiode auf 5 Jahre in einer Subgruppe zu dieser Studie (N=39.009 Frauen mit einem anderen LNG-IUS oder einem Kupfer-IUP, bei 73 % dieser Frauen lagen Daten über die komplette 5-Jahres Follow-up Periode vor), lag die Inzidenz von Perforationen während der gesamten 5-Jahres Periode bei 2,0 (95 % CI: 1,6-2,5) pro 1.000 Insertionen. Stillen während der Zeit der Insertion und eine Insertion bis zu 36 Wochen nach einer Entbindung wurden als Risikofaktoren auch in der Subgruppe, die bis zu 5 Jahre beobachtet wurde, identifiziert.
Das Risiko einer Perforation kann bei Frauen mit fixiertem retrovertierten Uterus erhöht sein.
Kontrolluntersuchungen nach der Insertion sollten gemäß der Anleitung im Abschnitt „Medizinische Untersuchungen/Konsultationen“ vorgenommen werden, die bei klinischer Indikation angepasst werden kann, sollten bei der Patientin Risikofaktoren für eine Perforation vorliegen. Dabei sollte in Betracht gezogen werden, eine vaginale Ultraschalluntersuchung durchzuführen, um die korrekte Position des Systems 4 bis 6 Wochen nach der Insertion zu bestimmen.
Nicht auffindbare Rückholfäden
Sind bei Nachkontrollen die Rückholfäden an der Zervix nicht sichtbar, muss eine unbemerkte Expulsion und eine Schwangerschaft ausgeschlossen werden. Die Rückholfäden können sich in die Gebärmutter oder in den Zervikalkanal zurückgezogen haben und bei der nächsten Menstruation wieder sichtbar werden. Ist eine Schwangerschaft ausgeschlossen, so lassen sich die Fäden meist durch vorsichtiges Sondieren des Zervikalkanals mit einem geeigneten Instrument lokalisieren. Sind die Fäden nicht auffindbar, könnte das Intrauterinsystem ausgestoßen worden sein (Expulsion) oder die Gebärmutterwand durchstoßen haben (Perforation). Durch eine vaginale Ultraschalluntersuchung kann die Lage des Systems ermittelt werden. Ist eine Ultraschalluntersuchung nicht möglich oder erfolglos, lässt sich Jaydess durch eine Röntgenuntersuchung lokalisieren.
Ektopische Schwangerschaft
In klinischen Studien lag die Gesamtinzidenz an ektopischen Schwangerschaften unter Jaydess bei ca. 0,11 pro 100 Frauenjahre. Ungefähr die Hälfte der Schwangerschaften, die unter Jaydess auftreten, sind wahrscheinlich ektopisch.
Frauen, die die Anwendung von Jaydess in Erwägung ziehen, sollten über die Anzeichen, Symptome und Risiken einer ektopischen Schwangerschaft aufgeklärt werden. Bei Frauen, die während der Anwendung von Jaydess schwanger werden, muss die Möglichkeit einer ektopischen Schwangerschaft in Betracht gezogen werden, und diese Frauen müssen auf eine ektopische Schwangerschaft hin untersucht werden.
Frauen mit einer anamnestischen ektopischen Schwangerschaft, Eileiteroperation oder entzündlicher Erkrankung des kleinen Beckens haben ein erhöhtes Risiko für das Auftreten einer ektopischen Schwangerschaft. Bei Unterleibsschmerzen ist die Möglichkeit einer ektopischen Schwangerschaft in Betracht zu ziehen, insbesondere in Verbindung mit ausbleibenden Regelblutungen oder wenn bei einer amenorrhoischen Frau wieder eine Blutung auftritt.
Da eine ektopische Schwangerschaft Auswirkungen auf die spätere Fertilität haben kann, sollte vor Anwendung von Jaydess eine sorgfältige Nutzen- und Risikoabwägung erfolgen, inbesondere bei nulliparen Frauen.
Anwendung bei nulliparen Frauen: Jaydess ist nicht die erste Wahl zur Kontrazeption bei nulliparen Frauen, da klinische Erfahrungen nur begrenzt vorliegen.
Auswirkungen auf das Blutungsmuster
Bei den meisten Anwenderinnen von Jaydess sind Auswirkungen auf das Blutungsmuster zu erwarten. Diese Veränderungen sind durch die direkte Wirkung von Levonorgestrel auf das Endometrium bedingt und korrelieren unter Umständen nicht mit der ovariellen Aktivität.
In den ersten Anwendungsmonaten sind unregelmäßige Blutungen und Schmierblutungen häufig zu erwarten. Danach führt die starke Unterdrückung der Endometriumproliferation zu kürzeren und schwächeren Menstruationsblutungen. Eine schwache Blutung entwickelt sich häufig zu einer Oligomenorrhoe oder Amenorrhoe.
In klinischen Studien entwickelten sich graduell seltenere Blutungen und/oder eine Amenorrhoe. Am Ende des dritten Jahres bestanden bei ca. 22,3% bzw. 11,6% der Anwenderinnen seltenere Blutungen und/oder eine Amenorrhoe. Die Möglichkeit einer Schwangerschaft muss in Betracht gezogen werden, sollte innerhalb von sechs Wochen nach Beginn der letzten Menstruation keine Blutung einsetzen. Wiederholte Schwangerschaftstests sind bei amenorrhoischen Frauen nicht erforderlich, sofern nicht andere Zeichen auf eine Schwangerschaft hindeuten.
Wenn die Blutungen mit der Zeit stärker und/oder unregelmäßiger werden, sollten geeignete diagnostische Maßnahmen ergriffen werden, da unregelmäßige Blutungen ein Symptom für Endometriumpolypen, Hyperplasie oder Krebs sein können. Starke Blutungen können auch ein Zeichen einer unbemerkten Expulsion des IUS sein.
Infektionen des kleinen Beckens
Obwohl Jaydess und der Inserter steril sind, können sie bei einer bakteriellen Kontamination während des Insertionsverfahrens als Vehikel zum Transport für Mikroorganismen in den oberen Genitaltrakt dienen. Bei jeglichen IUS oder Intrauterinpessaren wurde von Infektionen des kleinen Beckens berichtet. In klinischen Studien wurden entzündliche Beckenerkrankungen (pelvic inflammatory disease, PID) häufiger zu Beginn der Anwendung von Jaydess beobachtet. Dies stimmt mit publizierten Daten für Kupfer-Intrauterinpessare überein, bei denen die Häufigkeit von PID in den ersten 3 Wochen nach der Insertion am höchsten ist und danach abnimmt.
Vor der Entscheidung für eine Anwendung von Jaydess, sollten Patientinnen vollständig auf Risikofaktoren für Infektionen des kleinen Beckens (z. B. mehrere Sexualpartner, sexuell übertragbare Infektionen, Vorgeschichte einer PID) untersucht werden. Beckenentzündungen wie z. B. PID können schwerwiegende Folgen haben, und die Fertilität beeinträchtigen sowie das Risiko für eine ektopische Schwangerschaft erhöhen.
Wie bei anderen gynäkologischen oder operativen Maßnahmen kann, wenn auch äußerst selten, nach einer IUS-Insertion eine schwere Infektion oder Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) auftreten.
Wenn bei einer Anwenderin eine rezidivierende Endometritis oder eine entzündliche Beckenerkrankung auftritt oder wenn eine akute Infektion schwerwiegend verläuft oder nicht auf die Behandlung anspricht, muss Jaydess entfernt werden.
Auch bei nur schwachen Symptomen einer Infektion sind bakteriologische Untersuchungen und eine Beobachtung der Patientin angezeigt.
Expulsion
In klinischen Studien mit Jaydess war die Inzidenz einer Expulsion niedrig (<4% der Insertionen) und lag im selben Bereich anderer Intrauterinsysteme. Symptome einer teilweisen oder vollständigen Expulsion von Jaydess können Blutungen oder Schmerzen beinhalten. Das intrauterine Wirkstofffreisetzungssystem kann jedoch auch ausgestoßen werden, ohne dass es die Patientin bemerkt, und damit zum Verlust der empfängnisverhütenden Wirkung führen. Da Jaydess die Menstruationsstärke verringert, kann eine verstärkte Menstruationsblutung ein Hinweis auf eine Expulsion sein.
Das Risiko einer Expulsion ist erhöht bei:
Frauen mit starken Menstruationsblutungen in der Vorgeschichte
Frauen mit einem BMI über dem Normbereich zum Zeitpunkt der Insertion. Das Risiko steigt kontinuierlich mit zunehmendem BMI.
Die Frauen sollten hinsichtlich möglicher Anzeichen einer Expulsion sowie zur Überprüfung der Rückholfäden von Jaydess beraten werden. Es wird empfohlen, einen Arzt aufzusuchen, wenn die Rückholfäden von Jaydess nicht mehr gefühlt werden können. In diesem Fall ist eine Barrieremethode zur Schwangerschaftsverhütung (beispielsweise ein Kondom) anzuwenden, bis die Lokalisation von Jaydess bestätigt werden konnte.
Bei einer partiellen Expulsion kann die Wirkung von Jaydess vermindert sein.
Eine teilweise ausgestoßene Jaydess sollte entfernt werden. Zum Zeitpunkt der Entfernung kann sofort ein neues System eingelegt werden, sofern eine Schwangerschaft ausgeschlossen wurde.
Ovarialzysten/vergrößerte Follikel
Da die empfängnisverhütende Wirkung von Jaydess hauptsächlich auf lokalen Wirkungen im Uterus beruht, kommt es in der Regel zu keiner Veränderung der ovariellen Funktion, einschließlich normaler Follikelentwicklung, Ovulation und Follikelatresie bei Frauen im gebärfähigen Alter. Manchmal ist die Atresie der Follikel verzögert und die Follikulogenese dauert an. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden und wurden in klinischen Studien bei ca. 13,2 % der Frauen, die Jaydess anwenden, als unerwünschte Arzneimittelwirkung berichtet (einschließlich Ovarialzysten, hämorrhagischen Ovarialzysten und rupturierten Ovarialzysten). Meist verursachen diese Zysten keine Beschwerden, sie können jedoch in einigen Fällen von Unterbauchschmerzen oder Dyspareunie begleitet sein.
In den meisten Fällen bilden sich die vergrößerten Follikel im Laufe eines zwei- bis dreimonatigen Beobachtungszeitraums spontan zurück. Sollte dies nicht der Fall sein, können fortlaufende Ultraschallkontrollen sowie andere diagnostische oder therapeutische Maßnahmen angezeigt sein. In seltenen Fällen kann ein chirurgischer Eingriff erforderlich sein.
Psychiatrische Erkrankungen
Depressive Verstimmung und Depression stellen bei der Anwendung hormoneller Kontrazeptiva allgemein bekannte Nebenwirkungen dar (siehe Abschnitt 4.8). Depressionen können schwerwiegend sein und sind ein allgemein bekannter Risikofaktor für suizidales Verhalten und Suizid. Frauen sollte geraten werden, sich im Falle von Stimmungsschwankungen und depressiven Symptomen - auch wenn diese kurz nach Einleitung der Behandlung auftreten - mit ihrem Arzt in Verbindung zu setzen.
Vorsichtsmaßnahmen bei der Entfernung
Die Anwendung von übermäßiger Kraft/scharfen Instrumenten während des Entfernens kann zu einem Bruch des Systems führen (siehe Abschnitt 4.2). Nach dem Entfernen von Jaydess sollte das System untersucht werden, um sicherzustellen, dass es intakt ist und vollständig entfernt wurde.
Hinweis: Die Fachinformationen der jeweils gleichzeitig verordneten Arzneimittel sollten auf mögliche Wechselwirkungen hin überprüft werden.
Effekte anderer Arzneimittel auf Jaydess
Wechselwirkungen können mit Arzneimitteln auftreten, die hepatische mikrosomale Enzyme induzieren, woraus eine gesteigerte oder verringerte Clearance von Sexualhormonen resultieren kann.
Substanzen, die die Clearance von Levonorgestrel erhöhen, z. B.
Phenytoin, Barbiturate, Primidon, Carbamazepin, Rifampicin und möglicherweise auch Oxcarbazepin, Topiramat, Felbamat, Griseofulvin und Johanniskraut enthaltende Arzneimittel.
Der Einfluss dieser Arzneimittel auf die kontrazeptive Wirksamkeit von Jaydess ist nicht bekannt, aufgrund des lokalen Wirkmechanismus wird aber nicht angenommen, dass dieser von großer Bedeutung ist.
Substanzen mit einem variablen Effekt auf die Clearance von Levonorgestrel, z. B.
Viele HIV/HCV-Protease-Inhibitoren und nicht-nukleosidische Reverse-Transkriptase-Hemmer können bei gleichzeitiger Verabreichung mit Sexualhormonen die Plasmakonzentrationen des Gestagens erhöhen oder verringern.
Substanzen, die die Clearance von Levonorgestrel verringern (Enzym-Hemmer):
Starke und moderate CYP3A4-Inhibitoren wie Azol-Antimykotika (z. B. Fluconazol, Itraconazol, Ketoconazol, Voriconazol), Verapamil, Makrolide (z.B. Clarithromycin, Erythromycin), Diltiazem und Grapefruitsaft können die Plasmakonzentrationen des Gestagens erhöhen.
Magnetresonanztomographie (MRT)
Nicht-klinische Tests haben gezeigt, dass eine Patientin nach der Einlage von Jaydess unter folgenden Bedingungen ohne Gefahr einer MR-Untersuchung unterzogen werden kann:
Statisches Magnetfeld von höchstens 3 Tesla
maximales räumliches Gradientenfeld von höchstens 720 Gauß/cm.
Unter diesen Bedingungen betrug während eines 15-minütigen Scans der maximale Temperaturanstieg
an der Jaydess-Position 1,8 C. Wenn das Untersuchungsfeld in genau demselben Bereich oder relativ
nahe zu Jaydess liegt, kann es zu geringfügigen Bildartefakten kommen.
Fertilität
Die Anwendung eines Levonorgestrel-freisetzenden intrauterinen Systems hat keine Auswirkungen auf den Verlauf der zukünftigen Fertilität. Nach dem Entfernen des intrauterinen Systems erreichen Frauen wieder die gleiche Fertilität wie zuvor (siehe Abschnitt 5.1).
Schwangerschaft
Die Einlage von Jaydess während einer Schwangerschaft ist kontraindiziert, siehe Abschnitt 4.3.
Kommt es während der Anwendung von Jaydess zu einer Schwangerschaft, sollte das System sollte so schnell wie möglich entfernt werden, da bei jedem in situ belassenen intrauterinen Kontrazeptivum das Risiko eines Abortes oder einer Frühgeburt erhöht sein kann. Das Entfernen von Jaydess oder die Untersuchung des Uterus kann ebenfalls zu einem spontanen Abort führen. Eine ektopische Schwangerschaft ist auszuschließen
Falls seitens der Anwenderin der Wunsch nach Fortsetzung der Schwangerschaft besteht und das System nicht entfernt werden kann, sollte über die Risiken und möglichen Konsequenzen einer vorzeitigen Geburt für den Säugling informiert werden. Der Verlauf einer solchen Schwangerschaft sollte engmaschig überwacht werden. Die Frau sollte angewiesen werden, alle Symptome einer möglichen Schwangerschaftskomplikation, wie Bauchkrämpfe mit Fieber, zu berichten.
Desweiteren kann aufgrund der intrauterinen Levonorgestrelexposition ein erhöhtes Risiko für das Auftreten virilisierender Effekte bei einem weiblichen Fetus nicht ausgeschlossen werden. Es wurden einzelne Fälle von Maskulinisierung der externen Genitalien von weiblichen Feten nach einer lokalen Levonorgestrelexposition durch ein eingesetztes levonorgestrelfreisetzendes intrauterines System während der Schwangerschaft berichtet.
Stillzeit
Im Allgemeinen scheint es keine schädliche Wirkung auf Wachstum oder Entwicklung eines Säuglings zu geben, wenn sechs Wochen nach der Geburt eine rein Gestagen-haltige Verhütungsmethode zur Anwendung kommt. Ein Levonorgestrel-freisetzendes intrauterines System hat keinen Einfluss auf die Quantität oder Qualität der Muttermilch. Bei stillenden Müttern treten geringe Gestagenmengen (ca. 0,1 % der Levonorgestreldosis) in die Muttermilch über.
Jaydess hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Bei den meisten Frauen kommt es nach der Insertion von Jaydess zu Veränderungen im Blutungsmuster. Die Häufigkeit von Amenorrhoe und von seltenen Blutungen nimmt mit der Zeit zu, während die Häufigkeit von längeren, unregelmäßigen und häufigen Blutungen abnimmt. In klinischen Studien wurden folgende Blutungsmuster beobachtet:
Tabelle 3: In klinischen Studien unter Jaydess beobachtete Blutungsmuster
Jaydess |
Erste 90 Tage |
Zweite 90 Tage |
Ende des 1. Jahres |
Ende des 3. Jahres |
Amenorrhoe |
< 1% |
3% |
6% |
12% |
Seltene Blutung |
8% |
19% |
20% |
22% |
Häufige Blutung |
31% |
12% |
8% |
4% |
Unregelmäßige Blutung |
39% |
25% |
18% |
15% |
Längere Blutung* |
55% |
14% |
6% |
2% |
*Probandinnen mit unregelmäßiger und längerer Blutung können auch in einer der anderen Kategorien (außer Amenorrhoe) aufgeführt sein.
Tabellarische Zusammenfassung der Nebenwirkungen
In der nachstehenden Tabelle sind die unter Jaydess berichteten Häufigkeiten unerwünschter Arzneimittelwirkungen zusammengefasst. Innerhalb jeder Häufigkeitsgruppierung werden die Nebenwirkungen in absteigendem Schweregrad angegeben. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (≥ 1/10),
Häufig (≥ 1/100, < 1/10),
Gelegentlich (≥ 1/1.000, < 1/100),
Selten (≥ 1/10.000, < 1/1.000),
Sehr selten (< 1/10.000).
Systemorganklasse |
Sehr häufig |
Häufig |
Gelegentlich |
Psychiatrische Erkrankungen |
Depressive Stimmung/Depression, |
||
Erkrankungen des Nervensystems |
Kopfschmerzen |
Migräne |
|
Gefäßerkrankungen |
Schwindel |
||
Erkrankungen des Gastrointestinaltrakts |
Abdominal-/Beckenschmerz |
Übelkeit |
|
Erkrankungen der Haut und des Unterhautgewebes |
Akne/Seborrhoe |
Alopezie |
Hirsutismus |
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Blutungsänderungen einschließlich vermehrte und verminderte Menstruationsblutungen, Schmierblutungen, seltene Menstruationsblutungen und Amenorrhoe, |
Infektionen des oberen Genitaltrakts, |
Uterusperforation** |
Untersuchungen |
Gewichtszunahme |
* In klinischen Studien mussten Ovarialzysten als Nebenwirkungen gemeldet werden, wenn es sich um ungewöhnliche, nicht-funktionelle Zysten handelte und/oder im Ultraschall ein Durchmesser > 3 cm gemessen wurde.
** Diese Häufigkeit basiert auf einer groß angelegten prospektiven vergleichenden nicht-interventionellen Kohortenstudie bei Anwenderinnen von LNG-IUS und Kupfer-IUP, die zeigte, dass Stillen zum Zeitpunkt der Insertion und Insertion bis zu 36 Wochen nach der Entbindung unabhängige Risikofaktoren für eine Perforation darstellen (siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“). In klinischen Studien zu Jaydess, in denen stillende Frauen ausgeschlossen waren, war die Häufigkeit von Perforationen „selten“.
Beschreibung ausgewählter Nebenwirkungen
Bei der Anwendung eines Levonorgestrel-haltigen IUS wurden Fälle von Überempfindlichkeit einschließlich Ausschlag, Urtikaria und Angioödem berichtet.
Wird eine Frau während der Anwendung von Jaydess schwanger, ist hierbei die relative Wahrscheinlichkeit für eine ektopische Schwangerschaft erhöht (siehe Abschnitt 4.4, „Ektopische Schwangerschaft“).
Die Rückholfäden können beim Geschlechtsverkehr vom Partner gespürt werden.
Die folgenden unerwünschten Arzneimittelwirkungen wurden in Verbindung mit dem Insertionsverfahren oder dem Entfernen von Jaydess berichtet:
Schmerzen oder Blutung während der Maßnahme, durch die Insertion bedingte vasovagale Reaktion mit Schwindel oder Synkope. Die Maßnahme kann bei Epileptikerinnen einen Krampfanfall hervorrufen.
Fälle einer Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) wurden nach IUC-Insertion berichtet (siehe Abschnitt 4.4 „Infektionen des kleinen Beckens“).
Kinder und Jugendliche
Das Sicherheitsprofil von Jaydess wurde in einer Studie an 304 Jugendlichen untersucht und war mit dem bei Erwachsenen übereinstimmend.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Nicht zutreffend.
Pharmakotherapeutische Gruppe: Plastik-IUP mit Gestagen, ATC-Code: G02BA03
Pharmakodynamische Wirkungen
Jaydess hat hauptsächlich lokale Gestagen-Wirkungen im Cavum uteri.
Die hohe Levonorgestrel-Konzentration im Endometrium führt zu einer Herunterregulation der endometrialen Estrogen- und Progesteron-Rezeptoren. Das Endometrium wird dem zirkulierenden Estradiol gegenüber relativ unempfindlich, und es wird eine starke antiproliferative Wirkung beobachtet. Während der Anwendung werden morphologische Veränderungen des Endometriums und eine schwache lokale Fremdkörperreaktion beobachtet. Die Verdickung des Zervixschleims verhindert die Passage von Spermien durch den Zervikalkanal. Das lokale Milieu im Uterus und in den Tuben hemmt die Mobilität und Funktion der Spermien und verhindert dadurch die Befruchtung. In klinischen Studien mit Jaydess wurde bei der Mehrzahl der untersuchten Probandinnen eine Ovulation beobachtet. Belege für eine Ovulation wurden im ersten Jahr bei 34 von 35 Frauen, im zweiten Jahr bei 26 von 27 Frauen und im dritten Jahr bei allen 26 Frauen gefunden.
Klinische Wirksamkeit und Sicherheit
Die kontrazeptive Wirksamkeit von Jaydess wurde in einer klinischen Studie mit 1.432 Frauen im Alter von 18‑35 Jahren einschließlich 38,8 % (556) nulliparen Frauen, von denen 83,6 % (465) Jaydess-Anwenderinnen nulligravid waren, untersucht. Der 1-Jahres-Pearl-Index betrug 0,41 (95 %-Konfidenzintervall 0,13‑0,96) und der 3-Jahres-Pearl-Index lag bei 0,33 (95%-Konfidenzintervall 0,16‑0,60). Die Versagerquote betrug nach einem Jahr näherungsweise 0,4 %, die kumulative Versagerquote lag nach 3 Jahren bei näherungsweise 0,9 %. Die Versagerquote umfasst auch Schwangerschaften, die nach nicht erkannten Expulsionen und Perforationen auftraten. Die Anwendung eines Levonorgestrel-freisetzenden intrauterinen Systems hat keine Auswirkungen auf den Verlauf der zukünftigen Fertilität. Basierend auf Daten für ein höher dosiertes Levonorgestrel-haltiges IUS wurden ca. 80 % der Frauen mit Kinderwunsch innerhalb von 12 Monaten nach dem Entfernen des Systems schwanger.
Das Sicherheitsprofil von Jaydess wurde in einer Studie an 304 Jugendlichen untersucht und war mit dem bei Erwachsenen übereinstimmend. Es wird erwartet, dass die Wirksamkeit von Jaydess bei Adoleszenten im Alter von unter 18 Jahren gleich dem für Anwenderinnen im Alter von 18 Jahren und älter ist.
Die Veränderungen im Blutungsverhalten unter Jaydess beruhen auf der direkten Wirkung von Levonorgestrel auf das Endometrium und korrelieren nicht zwangsläufig mit dem ovariellen Zyklus. Es gibt keine klaren Unterscheidungsmerkmale hinsichtlich der Follikelentwicklung, Ovulation oder Estradiol- und Progesteronproduktion bei Frauen mit unterschiedlichem Blutungsverhalten. Im Zuge der Hemmung der Endometriumproliferation kann es zunächst zu vermehrten Schmierblutungen während der ersten Anwendungsmonate kommen. Danach bewirkt die starke Suppression des Endometriums eine Abnahme der Dauer und Stärke der Menstruationsblutung während der Anwendung von Jaydess. Schwache Blutungen gehen häufig in eine Oligomenorrhoe oder Amenorrhoe über. Die Funktion der Ovarien bleibt erhalten und die Estradiolspiegel unbeeinflusst, auch bei amenorrhoischen Jaydess-Anwenderinnen.
Levonorgestrel wird lokal in das Cavum uteri freigesetzt. Die in vivo Freisetzungskurve ist durch einen initial steilen Abfall charakterisiert, der zunehmend nachlässt und zu geringen Änderungen nach einem Jahr bis zum Ende des vorgesehenen 3-jährigen Anwendungszeitraum führt. Tabelle 4 enthält die geschätzten Abgaberaten in vivo zu verschiedenen Zeitpunkten.
Tabelle 4: Geschätzte Abgaberaten in vivo auf der Grundlage von Restgehaltdaten ex vivo
Zeitpunkt |
Geschätzte Abgaberate in vivo |
24 Tage nach Insertion |
14 |
60 Tage nach Insertion |
10 |
1 Jahr nach Insertion |
6 |
3 Jahre nach Insertion |
5 |
Durchschnitt über erstes Jahr |
8 |
Durchschnitt über 3 Jahre |
6 |
Resorption
Nach der Insertion wird Levonorgestrel vom IUS unverzüglich in das Cavum uteri freigesetzt, wie anhand der Messung von Serumkonzentrationen gezeigt wurde. Mehr als 90 % des freigesetzten Levonorgestrels ist systemisch verfügbar. Die maximalen Serumkonzentrationen von Levonorgestrel werden innerhalb von zwei Wochen nach der Insertion von Jaydess erreicht. Sieben Tage nach der Insertion wurde eine mittlere Levonorgestrel-Konzentration von 162 pg/ml (5. Perzentil: 102 pg/ml-95. Perzentil: 249 pg/ml) ermittelt. Danach nehmen die Serumkonzentrationen von Levonorgestrel allmählich ab und erreichen nach 3 Jahren eine mittlere Konzentration von 59 pg/ml (5. Perzentil: 36 pg/ml-95. Perzentil: 92 pg/ml). Bei der Anwendung eines Levonorgestrel-freisetzenden intrauterinen Systems führt die hohe lokale Wirkstoffexposition im Cavum uteri zu einem hohen Konzentrationsgradienten zwischen Endometrium und Myometrium (Gradient zwischen Endometrium und Myometrium > 100‑fach) und zu niedrigen Levonorgestrel-Konzentrationen im Serum (Gradient zwischen Endometrium und Serum > 1.000‑fach).
Verteilung
Levonorgestrel wird unspezifisch von Serumalbumin und spezifisch von SHBG gebunden. Weniger als 2 % des zirkulierenden Levonorgestrels liegen als ungebundenes Steroid vor. Levonorgestrel bindet mit hoher Affinität an SHBG. Dementsprechend haben Änderungen der SHBG-Konzentration im Serum einen Anstieg (bei höheren SHBG-Konzentrationen) oder eine Abnahme (bei niedrigeren SHBG-Konzentrationen) des Gesamtserumgehalts von Levonorgestrel zur Folge. Die Konzentration des SHBG sank durchschnittlich um etwa 15 % innerhalb des ersten Monats nach Insertion von Jaydess und blieb während der dreijährigen Benutzungsdauer stabil. Das durchschnittliche scheinbare Verteilungsvolumen von Levonorgestrel beträgt ungefähr 106 l.
Biotransformation
Levonorgestrel wird in erheblichem Maß metabolisiert. Die wichtigsten Stoffwechselwege sind eine Reduktion der Δ4-3-Oxo-Gruppe und Hydroxylierungen an den Positionen 2α, 1β und 16β, gefolgt von der Konjugation. CYP3A4 ist das Hauptenzym beim oxydativen Metabolismus von LNG. Die verfügbaren Daten legen nahe, dass die CYP vermittelte Biotransformation von geringerer Bedeutung sein könnte als Reduktion und Konjugation.
Elimination
Die Gesamtplasmaclearance von Levonorgestrel beträgt ungefähr 1,0 ml/min/kg. Levonorgestrel wird nur in sehr geringen Mengen in unveränderter Form ausgeschieden. Die Metaboliten werden über Faeces und Urin mit einem Exkretionsverhältnis von ungefähr 1 ausgeschieden. Die Ausscheidungshalbwertszeit beträgt ungefähr 1 Tag.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Levonorgestrel ist von der SHBG-Konzentration abhängig, die ihrerseits durch Estrogene und Androgene beeinflusst wird. Eine Abnahme der SHBG-Konzentration führt zu einer Abnahme der Gesamtkonzentration an Levonorgestrel im Serum, dies deutet auf eine nicht-lineare Pharmakokinetik von Levonorgestrel in Bezug auf die Zeit hin. Aufgrund der überwiegend lokalen Wirkung von Jaydess ist kein Einfluss auf die Wirksamkeit von Jaydess zu erwarten.
Kinder und Jugendliche
In einer einjährigen Phase-III Studie mit weiblichen Jugendlichen nach der ersten Menstruation (mittleres Alter 16,2, zwischen 12 und 18 Jahren) zeigte die pharmakokinetische Analyse von 283 Jugendlichen eine leicht erhöhte LNG-Serumkonzentration (etwa 10%) bei Adoleszenten im Vergleich zu Erwachsenen. Dies korreliert mit dem üblicherweise niedrigeren Körpergewicht von Adoleszenten. Der geschätzte Bereich für Adoleszenten liegt dabei jedoch innerhalb des geschätzten Bereichs für Erwachsene und zeigt damit hohe Vergleichbarkeit.
Zwischen Jugendlichen und Erwachsenen werden nach dem Einlegen von Jaydess keine Unterschiede in der Pharmakokinetik von LNG erwartet.
Ethnische Unterschiede
Eine dreijährige Phase-III-Studie im asiatisch-pazifischen Raum (93% asiatische Frauen, 7% andere Ethnien) wurde mit Jaydess durchgeführt. Ein Vergleich der pharmakokinetischen Eigenschaften von Levonorgestrel bei der asiatischen Bevölkerung in dieser Studie mit der kaukasischen Bevölkerung in einer anderen Phase-III-Studie zeigte keinen klinisch-relevanten Unterschied in der systemischen Exposition und anderen pharmakokinetischen Parametern. Darüber hinaus war die tägliche Freisetzungsrate von Jaydess in beiden Populationen gleich.
Es werden keine pharmakokinetischen Unterschiede bei weißen und asiatischen Frauen mit Jaydess erwartet.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Pharmakokinetik und Toxizität einschließlich Genotoxizität und zum kanzerogenen Potential von Levonorgestrel lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Studien an Affen, denen intrauterin ein Levonorgestrel-freisetzendes Hormonreservoir über die Dauer von 9 bis 12 Monaten eingesetzt wurde, bestätigten eine lokale pharmakologische Wirkung mit guter lokaler Verträglichkeit ohne Zeichen einer systemischen Toxizität. Bei Kaninchen wurde nach der intrauterinen Anwendung von Levonorgestrel keine Embryotoxizität beobachtet. Untersuchungen zur Unbedenklichkeit der Elastomerkomponenten des Hormonreservoirs, der Polyethylenmaterialien und auch des Silberrings des Arzneimittels, des Silberprofils und der Kombination aus Elastomer und Levonorgestrel zeigten basierend sowohl auf der Beurteilung der Gentoxikologie in Standardtestsystemen in vitro und in vivo als auch auf Biokompatibilitätstests an Mäusen, Ratten, Meerschweinchen, Kaninchen und in in vitro-Testsystemen keine Bioinkompatibilität.
Polydimethylsiloxan, quervernetzt
Hochdisperses Siliciumdioxid
Polyethylen
Bariumsulfat
Eisen(II, III)-oxid (E172)
Silber
Nicht zutreffend.
3 Jahre
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Das Arzneimittel ist einzeln in eine thermogeformte Blisterpackung (PETG) mit abziehbarem Deckel (PE) verpackt.
Packungsgrößen: 1 x 1 und 5 x 1.
Jaydess wird in einer sterilen Verpackung geliefert, die erst zum Zeitpunkt der Insertion geöffnet werden sollte. Jedes System ist mit aseptischen Vorsichtsmaßnahmen zu handhaben. Falls die Versiegelung des sterilen Umschlags aufgebrochen ist, ist das darin liegende System entsprechend den nationalen Anforderungen an die Handhabung biogefährlichen Abfalls zu beseitigen. Entsprechend sind eine entfernte Jaydess und ein benutzter Inserter auf dieselbe Weise zu beseitigen. Die äußere Schachtel und die innere Blisterpackung können als Haushaltsabfall entsorgt werden.
Das System muss unter aseptischen Bedingungen von einer Ärztin/einem Arzt eingelegt werden (siehe Abschnitt 4.2).
Bayer Vital GmbH
51368 Leverkusen
Tel.: (0214) 30-51 348
Fax: (0214) 2605-51 603
E-Mail: medical-information@bayer.com
86537.00.00
Datum der Erteilung der Zulassung 02. April 2013
Datum der letzten Verlängerung der Zulassung 21. Dezember 2018
Oktober 2025
Verschreibungspflichtig
__________________________________________________________________________________
Vor der Anwendung dieses Arzneimittels muss die Patientin im Rahmen eines Einverständnisverfahrens über die Risiken bei der Anwendung aufgeklärt werden. Im Rahmen dieser Aufklärung muss der Patientin die Jaydess-Gebrauchsinformation und der Einverständnisbogen ausgehändigt werden. Der Einverständnisbogen muss von der Patientin und dem Arzt vor der Insertion von Jaydess unterschrieben werden (siehe Einverständnisbogen).
DE/21