Bosulif® 100 mg Filmtabletten
Bosulif® 400 mg Filmtabletten
Bosulif® 500 mg Filmtabletten
Bosulif® 50 mg Hartkapseln
Bosulif® 100 mg Hartkapseln
Bosulif 100 mg Filmtabletten
Jede Filmtablette enthält 100 mg Bosutinib (als Monohydrat).
Bosulif 400 mg Filmtabletten
Jede Filmtablette enthält 400 mg Bosutinib (als Monohydrat).
Bosulif 500 mg Filmtabletten
Jede Filmtablette enthält 500 mg Bosutinib (als Monohydrat).
Bosulif 50 mg Hartkapseln
Jede Hartkapsel enthält 50 mg Bosutinib (als Monohydrat).
Bosulif 100 mg Hartkapseln
Jede Hartkapsel enthält 100 mg Bosutinib (als Monohydrat).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette
Bosulif 100 mg Filmtabletten
Gelbe, ovale (Breite: 5,6 mm; Länge: 10,7 mm), bikonvexe Filmtablette mit der Prägung „Pfizer“ auf der einen Seite und „100“ auf der anderen Seite.
Bosulif 400 mg Filmtabletten
Orangefarbene, ovale (Breite: 8,8 mm; Länge: 16,9 mm), bikonvexe Filmtablette mit der Prägung „Pfizer“ auf der einen Seite und „400“ auf der anderen Seite.
Bosulif 500 mg Filmtabletten
Rote, ovale (Breite: 9,5 mm; Länge: 18,3 mm), bikonvexe Filmtablette mit der Prägung „Pfizer“ auf der einen Seite und „500“ auf der anderen Seite.
Hartkapsel
Bosulif 50 mg Hartkapseln
Weißes Unterteil/orangefarbenes Oberteil (Länge etwa: 18 mm) mit dem in schwarzer Tinte aufgebrachten Aufdruck „BOS 50“ auf dem Unterteil und „Pfizer“ auf dem Oberteil.
Bosulif 100 mg Hartkapseln
Weißes Unterteil/rotbraunes Oberteil (Länge etwa: 22 mm) mit dem in schwarzer Tinte aufgebrachten Aufdruck „BOS 100“ auf dem Unterteil und „Pfizer“ auf dem Oberteil.
Bosulif ist angezeigt zur Behandlung von:
erwachsenen und pädiatrischen Patienten ab 6 Jahren mit neu diagnostizierter (ND) Philadelphia‑Chromosom‑positiver chronischer myeloischer Leukämie (Ph+ CML) in der chronischen Phase (CP).
erwachsenen und pädiatrischen Patienten ab 6 Jahren mit Ph+ CML in der CP, die mit mindestens einem Tyrosinkinaseinhibitor [TKI] vorbehandelt wurden und bei denen Imatinib, Nilotinib und Dasatinib nicht als geeignete Behandlungsoptionen angesehen werden.
erwachsenen Patienten mit Ph+ CML in der akzelerierten Phase (AP) und Blastenkrise (BK), die mit mindestens einem Tyrosinkinaseinhibitor [TKI] vorbehandelt wurden und bei denen Imatinib, Nilotinib und Dasatinib nicht als geeignete Behandlungsoption angesehen werden.
Dosierung
Erwachsene Patienten mit neu diagnostizierter Ph+ CML in der CP
Die empfohlene Dosis beträgt 400 mg Bosutinib einmal täglich.
Erwachsene Patienten mit Ph+ CML in der CP, AP oder BK mit Resistenz oder Unverträglichkeit gegenüber einer Vorbehandlung
Die empfohlene Dosis beträgt 500 mg Bosutinib einmal täglich.
Die Behandlung mit Bosutinib wurde in klinischen Studien für beide Indikationen bis zum Krankheitsprogress oder bis zur Unverträglichkeit gegenüber der Therapie fortgesetzt.
Pädiatrische Patienten mit neu diagnostizierter Ph+ CML in der CP oder mit Ph+ CML in der CP mit Resistenz oder Unverträglichkeit gegenüber einer Vorbehandlung
Die empfohlene Dosierung von Bosutinib für neu diagnostizierte pädiatrische Patienten beträgt 300 mg/m2 Körperoberfläche (KOF) zum Einnehmen einmal täglich, und die empfohlene Dosierung für pädiatrische Patienten mit Resistenz oder Unverträglichkeit (R/ I) gegenüber einer Vorbehandlung beträgt 400 mg/m2 KOF zum Einnehmen einmal täglich; Dosisempfehlungen sind in Tabelle 1 aufgeführt. Gegebenenfalls kann die gewünschte Dosis durch eine Kombination verschiedener Stärken von Bosutinib-Filmtabletten und/oder -Hartkapseln erreicht werden.
Tabelle 1 – Bosutinib-Dosierung bei pädiatrischen Patienten mit neu diagnostizierter Ph+ CML in der CP oder mit Ph+ CML in der CP mit Resistenz oder Unverträglichkeit gegenüber einer Vorbehandlung
KOF |
Empfohlene Dosis bei ND |
Empfohlene Dosis bei R/I |
0,55–<0,63 m2 |
200 mg |
250 mg |
0,63–<0,75 m2 |
200 mg |
300 mg |
0,75–<0,9 m2 |
250 mg |
350 mg |
0,9–<1,1 m2 |
300 mg |
400 mg |
≥ 1,1 m2 |
400 mg* |
500 mg* |
* maximale Initialdosis (entsprechend der maximalen Initialdosis in der Indikation für Erwachsene)
Abkürzungen: AP = akzelerierte Phase; BP = Blastenphase; KOF = Körperoberfläche; CML = chronische myeloische Leukämie; CP = chronische Phase; ND = neu diagnostizierte Erkrankung; Ph+ = Philadelphia-Chromosom-positiv; R/I = Resistenz oder Unverträglichkeit.
Dosisanpassung
Bei erwachsenen Patienten mit CML, die eine Resistenz oder Unverträglichkeit gegenüber einer vorherigen Therapie aufweisen, können die Dosen bei Patienten mit einem nicht zufriedenstellenden Ansprechen oder mit Anzeichen für eine Progression und bei Nichtvorliegen von unerwünschten Ereignissen von Grad 3 oder 4 oder von anhaltenden unerwünschten Ereignissen von Grad 2 auf 600 mg erhöht werden.
Bei erwachsenen Patienten mit neu diagnostizierter CML in der CP können die Dosen in Schritten von 100 mg auf maximal 600 mg einmal täglich gesteigert werden, wenn die Patienten in Monat 3 keine Breakpoint-Cluster-Region-Abelson (BCR‑ABL)-Transkriptlevel ≤ 10 % aufweisen, zum Zeitpunkt der Dosiserhöhung keine unerwünschten Ereignisse von Grad 3 oder 4 entwickelt haben und alle nicht-hämatologischen Toxizitäten von Grad 2 auf mindestens Grad 1 zurückgegangen sind.
Bei pädiatrischen Patienten mit einer KOF < 1,1 m2 und einem unzureichendem Ansprechen nach 3 Monaten ist eine Erhöhung der Dosis in Schritten von 50 mg bis zu einer Maximaldosis von 100 mg über der an an die KOF angepassten empfohlenen Dosis in Betracht zu ziehen. Bei pädiatrischen Patienten mit einer KOF ≥ 1,1 m2 und einem unzureichenden Ansprechen nach 3 Monaten ist analog zu den Empfehlungen für Erwachsene eine Erhöhung der Dosis in Schritten von 100 mg in Betracht zu ziehen. Wenn bei pädiatrischen Patienten das klinische Ansprechen unzureichend ist und keine weitere Dosiserhöhung vorgenommen werden kann, wird die Behandlung abgebrochen.
Die Maximaldosis bei pädiatrischen Patienten beträgt 600 mg einmal täglich bei vorbehandelter CML und 500 mg einmal täglich bei neu diagnostizierter CML.
Dosen über 600 mg/Tag wurden nicht untersucht und sollten daher nicht gegeben werden.
Dosisanpassung bei Nebenwirkungen
Bei Auftreten einer klinisch signifikanten mäßigen oder schweren nicht‑hämatologischen Toxizität sollte die Anwendung von Bosutinib unterbrochen werden. Nachdem die Toxizität abgeklungen ist, kann die Therapie mit einer um 100 mg reduzierten Dosis einmal täglich fortgeführt werden. Wenn klinisch angemessen, sollte erwogen werden, die Dosis wieder auf die einmal tägliche Dosis vor der Dosisreduktion zu erhöhen (siehe Abschnitt 4.4). Es wurden Dosen unter 300 mg/Tag bei Patienten angewendet; die Wirksamkeit ist jedoch nicht erwiesen.
Erhöhte Lebertransaminasen
Bei einer Erhöhung der Lebertransaminasen um > 5 × des oberen Normalwerts (upper limit of normal, ULN) sollte die Anwendung von Bosutinib so lange unterbrochen werden, bis sie auf ≤ 2,5 × ULN zurückgegangen sind. Danach kann die Behandlung mit 400 mg einmal täglich fortgeführt werden. Wenn der Rückgang dieser Werte länger als 4 Wochen dauert, sollte ein Abbruch der Bosutinib----Behandlung in Betracht gezogen werden. Sind gleichzeitig mit der Erhöhung der Transaminasen auf ≥ 3 × ULN die Bilirubinwerte auf > 2 × ULN und der alkalische Phosphatase‑Wert um < 2 × ULN erhöht, sollte die Behandlung mit Bosutinib abgebrochen werden (siehe Abschnitt 4.4).
Diarrhö
Bei einer Diarrhö 3. bis 4. Grades gemäß NCI Common Terminology Criteria for Adverse Events (CTCAE) sollte die Behandlung mit Bosutinib unterbrochen und kann bei einer Besserung auf Grad ≤ 1 mit einer Dosis von 400 mg einmal täglich fortgeführt werden (siehe Abschnitt 4.4).
Bei pädiatrischen Patienten können aufgrund nicht-hämatologischer Toxizitäten ähnliche Dosisanpassungen wie bei Erwachsenen vorgenommen werden, die Dosisreduktionsstufen können jedoch abweichen. Bei pädiatrischen Patienten mit einer KOF < 1,1 m2 ist eine initiale Dosisreduktion um 50 mg, gefolgt von weiteren Reduktionen um 50 mg in Betracht zu ziehen, wenn die unerwünschte Arzneimittelwirkung (UAW) fortbesteht (entsprechend den Empfehlungen aus Tabelle 2). Bei pädiatrischen Patienten mit einer KOF ≥ 1,1 m2 wird die Dosis ähnlich wie bei Erwachsenen reduziert.
Hämatologische Nebenwirkungen
Eine Dosisreduktion wird bei schwerer oder anhaltender Neutropenie und Thrombozytopenie, wie in Tabelle 2 beschrieben, empfohlen:
Tabelle 2 - Dosisanpassung bei Neutropenie und Thrombozytopenie bei erwachsenen und pädiatrischen Patienten
|
ANZa < 1,0 × 109/l und/ oder Thrombozyten < 50 × 109/l |
Gabe von Bosutinib aussetzen, bis ANZ ≥ 1,0 × 109/l und Thrombozyten ≥ 50 × 109/l Bei einer Erholung innerhalb von 2 Wochen Behandlung mit Bosutinib mit der gleichen Dosis fortführen. Bleiben die Blutwerte länger als 2 Wochen niedrig, Dosis bei erwachsenen und pädiatrischen Patienten mit einer KOF ≥ 1,1 m² nach der Erholung um 100 mg reduzieren oder bei pädiatrischen Patienten mit einer KOF < 1,1 m2 um 50 mg reduzieren und Behandlung fortführen. Tritt die Zytopenie erneut auf, Dosis bei erwachsenen und pädiatrischen Patienten mit einer KOF ≥ 1,1 m2 nach der Erholung um weitere 100 mg reduzieren oder bei pädiatrischen Patienten mit einer KOF < 1,1 m2 um weitere 50 mg reduzieren und Behandlung fortführen. Bei erwachsenen und pädiatrischen Patienten mit einer KOF ≥ 1,1 m2 wurden Dosen unter 300 mg/Tag angewendet; die Wirksamkeit ist jedoch nicht erwiesen. Bei pädiatrischen Patienten wurden Dosen unter 300 mg/ m2 angewendet; die Wirksamkeit ist jedoch nicht erwiesen. |
a ANZ = absolute Neutrophilenzahl; KOF = Körperoberfläche
Versäumte Dosis
Wenn eine Dosis um mehr als 12 Stunden versäumt wird, hat der Patient keine zusätzliche Dosis zu erhalten. Der Patient sollte die übliche verschriebene Dosis am darauffolgenden Tag einnehmen.
Besondere Bevölkerungsgruppen
Ältere Patienten (≥ 65 Jahre)
Bei älteren Patienten ist keine spezielle Dosisempfehlung notwendig. Da zu älteren Patienten nur begrenzte Informationen vorliegen, ist bei dieser Patientengruppe Vorsicht geboten.
Nierenfunktionsstörung
Patienten mit einem Serumkreatinin > 1,5 × ULN wurden von den CML-Studien ausgeschlossen. Bei Patienten mit mäßiger und schwerer Nierenfunktionsstörung wurde während der Studien eine zunehmende Exposition (area under the curve, AUC) festgestellt.
Patienten mit neu diagnostizierter Ph+ CML in der CP
Bei erwachsenen Patienten mit mäßiger Nierenfunktionsstörung (Creatinine Clearance [CLCr] 30 bis 50 ml/min, berechnet mittels Cockcroft‑Gault‑Formel) beträgt die empfohlene Bosutinib-Dosis 300 mg täglich mit einer Mahlzeit (siehe Abschnitte 4.4 und 5.2).
Bei erwachsenen Patienten mit schwerer Nierenfunktionsstörung (CLCr < 30 ml/min, berechnet mittels Cockcroft‑Gault‑Formel) beträgt die empfohlene Bosutinib-Dosis 200 mg täglich mit einer Mahlzeit (siehe Abschnitte 4.4 und 5.2).
Eine Dosissteigerung auf 400 mg einmal täglich mit einer Mahlzeit bei erwachsenen Patienten mit mäßiger Nierenfunktionsstörung oder auf 300 mg einmal täglich bei Patienten mit schwerer Nierenfunktionsstörung kann erwogen werden, wenn weder schwere noch anhaltende mäßige Nebenwirkungen auftreten und wenn sie kein angemessenes hämatologisches, zytogenetisches oder molekulares Ansprechen erreichen.
Ph+ CML in der CP, AP oder BK mit Resistenz oder Unverträglichkeit gegenüber einer Vorbehandlung
Bei erwachsenen Patienten mit mäßiger Nierenfunktionsstörung (CLCr 30 bis 50 ml/min, berechnet mittels Cockcroft‑Gault‑Formel) beträgt die empfohlene Bosutinib-Dosis 400 mg täglich (siehe Abschnitte 4.4 und 5.2).
Bei Patienten mit schwerer Nierenfunktionsstörung (CLCr < 30 ml/min, berechnet mittels Cockcroft‑Gault‑Formel) beträgt die empfohlene Bosutinib-Dosis 300 mg täglich (siehe Abschnitte 4.4 und 5.2).
Eine Dosissteigerung auf 500 mg einmal täglich bei erwachsenen Patienten mit mäßiger Nierenfunktionsstörung oder auf 400 mg einmal täglich bei Patienten mit schwerer Nierenfunktionsstörung kann bei den Patienten erwogen werden, bei denen weder schwere noch anhaltende mäßige Nebenwirkungen auftraten und die kein angemessenes hämatologisches, zytogenetisches oder molekulares Ansprechen erreichen.
Herzerkrankungen
Patienten mit unkontrollierter oder signifikanter Herzerkrankung (z. B. kürzlich aufgetretener Myokardinfarkt, kongestive Herzinsuffizienz oder instabile Angina) wurden von den klinischen Studien ausgeschlossen. Bei Patienten mit einer erheblichen Herzerkrankung ist Vorsicht geboten (siehe Abschnitt 4.4).
Kürzlich aufgetretene oder bestehende klinisch signifikante Erkrankung des Gastrointestinaltrakts
Patienten mit einer kürzlich aufgetretenen oder bestehenden klinisch signifikanten Erkrankung des Gastrointestinaltrakts (z. B. starkes Erbrechen und/ oder Diarrhö) wurden von den klinischen Studien ausgeschlossen. Bei Patienten mit kürzlich aufgetretener oder bestehender klinisch signifikanter Erkrankung des Gastrointestinaltrakts ist Vorsicht geboten (siehe Abschnitt 4.4).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Bosutinib bei pädiatrischen Patienten unter 1 Jahr mit neu diagnostizierter Ph+ CML oder mit Resistenz oder Unverträglichkeit in der CP ist nicht erwiesen. Es liegen keine Daten vor. Die Informationen zu pädiatrischen Patienten unter 6 Jahren sind zu begrenzt, so dass keine Dosierungsempfehlungen gegeben werden können (siehe Abschnitt 5.1).
Art der Anwendung
Bosulif ist einmal täglich zusammen mit einer Mahlzeit einzunehmen (siehe Abschnitt 5.2).
Die Filmtabletten sollten im Ganzen geschluckt werden. Filmtabletten nicht zerteilen, zerdrücken, zerbrechen oder zerkauen.
Die Hartkapseln können im Ganzen geschluckt werden. Bei Patienten, welche die Hartkapsel(n) nicht im Ganzen schlucken können, kann jede Hartkapsel einzeln geöffnet und ihr Inhalt mit Apfelmus oder Joghurt vermischt werden. Das Vermischen des Inhalts der Hartkapsel mit Apfelmus oder Joghurt darf nicht als Ersatz für eine vollständige Mahlzeit angesehen werden, sondern das Arzneimittel sollte zusammen mit einer Mahlzeit eingenommen werden, um die Verträglichkeit für den Magen-Darm-Trakt zu erhöhen.
Wenn das Arzneimittel mit Apfelmus oder Joghurt gemischt wird, sollten die Patienten die fertige Mischung unverzüglich vollständig ohne zu kauen verzehren. Die Mischung ist nicht für den späteren Verzehr aufzubewahren. Wurde nicht die gesamte Zubereitung verzehrt, ist keine zusätzliche Dosis zu verabreichen, und es wird empfohlen, bis zum nächsten Tag mit der Fortsetzung der Dosierung zu warten. Um die Verabreichung zu erleichtern, ist die empfohlene Menge an Apfelmus oder Joghurt in Tabelle 3 aufgeführt.
Tabelle 3 – Bosutinib-Dosis bei Einnahme der Hartkapseln und Menge an weicher Nahrung
Dosis |
Menge an Apfelmus oder Joghurt |
200 mg |
20 ml (4 Teelöffel) |
250 mg |
25 ml (5 Teelöffel) |
300 mg |
30 ml (6 Teelöffel) |
350 mg |
30 ml (6 Teelöffel) |
400 mg |
35 ml (7 Teelöffel) |
500 mg |
45 ml (9 Teelöffel) |
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Leberfunktionsstörung (siehe Abschnitte 5.1 und 5.2)
Leberfunktionsstörungen
Eine Behandlung erwachsener und pädiatrischer Patienten mit Bosutinib ist mit Erhöhungen von Serumtransaminasen (Alanin‑Aminotransferase [ALT], Aspartat‑Aminotransferase [AST]) assoziiert.
Transaminasenerhöhungen traten im Allgemeinen früh während der Behandlung auf (bei > 80 % der Patienten, die Transaminasenerhöhungen jeglichen Grades entwickelten, trat das erste Ereignis innerhalb der ersten 3 Monate auf). Bei Patienten, die Bosutinib erhalten, sollten vor Behandlungsbeginn, während der ersten 3 Behandlungsmonate monatlich und soweit klinisch indiziert Leberfunktionstests erfolgen.
Bei Patienten mit Transaminasenerhöhungen sollte die Behandlung mit Bosutinib vorübergehend ausgesetzt (mit Erwägung einer Dosisreduktion nach Erholung auf Grad 1 oder den Ausgangswert) und/ oder abgebrochen werden. Erhöhungen der Transaminasen, insbesondere unter einer gleichzeitigen Erhöhung des Bilirubins, können ein früher Hinweis auf eine arzneimittelinduzierte Leberschädigung sein; diese Patienten sollten entsprechend behandelt werden (siehe Abschnitte 4.2 und 4.8).
Diarrhö und Erbrechen
Eine Behandlung erwachsener und pädiatrischer Patienten mit Bosutinib ist mit Diarrhö und Erbrechen assoziiert. Daher sollten Patienten mit kürzlich aufgetretener oder bestehender klinisch signifikanter gastrointestinaler Erkrankung dieses Arzneimittel mit Vorsicht und nur nach eingehender Nutzen-Risiko-Beurteilung anwenden, da die entsprechenden Patienten aus den klinischen Studien ausgeschlossen wurden. Patienten mit Diarrhö und Erbrechen sollten entsprechend dem aktuellen Behandlungsstandard, einschließlich Arzneimitteln zur Behandlung von Diarrhö oder Brechreiz und/ oder Flüssigkeitssubstitution, behandelt werden. Darüber hinaus können Diarrhö und Erbrechen durch vorübergehendes Aussetzen von Bosutinib, eine Dosisreduktion und/ oder den Abbruch der Bosutinib-Therapie gelindert werden (siehe Abschnitte 4.2 und 4.8). Das Antiemetikum Domperidon hat das Potenzial, die Verlängerung des QT-Intervalls (QTc) zu verstärken und Torsade-de-pointes-Arrhythmien zu induzieren; daher sollte die gleichzeitige Anwendung von Domperidon vermieden werden. Es sollte nur angewendet werden, wenn andere Arzneimittel nicht wirksam sind. In solchen Situationen ist eine individuelle Nutzen-Risiko-Bewertung zwingend erforderlich und die Patienten sollten hinsichtlich des Auftretens einer QTc-Verlängerung überwacht werden.
Myelosuppression
Eine Behandlung erwachsener und pädiatrischer Patienten mit Bosutinib ist mit einer Myelosuppression assoziiert, die mit Anämie, Neutropenie und Thrombozytopenie einhergeht. Das komplette Blutbild sollte im 1. Behandlungsmonat wöchentlich, danach monatlich oder soweit klinisch indiziert bestimmt werden. Die Myelosuppression sollte/ kann durch vorübergehendes Aussetzen von Bosutinib, eine Dosisreduktion und/ oder den Abbruch der Bosutinib-Therapie gelindert werden (siehe Abschnitte 4.2 und 4.8).
Flüssigkeitsretention
Eine Behandlung erwachsener Patienten mit Bosutinib kann mit einer Flüssigkeitsretention, einschließlich Perikarderguss, Pleuraerguss, Lungenödem und/ oder peripherem Ödem assoziiert sein. Die Behandlung von Kindern und Jugendlichen mit Bosutinib kann mit einem niedriggradigen Perikarderguss und peripherem Ödem assoziiert sein.
Die Patienten sollten überwacht und mit einer Standardtherapie behandelt werden.
Darüber hinaus kann die Flüssigkeitsretention durch vorübergehendes Aussetzen von Bosutinib, eine Dosisreduktion und/ oder den Abbruch der Bosutinib-Therapie gelindert werden (siehe Abschnitte 4.2 und 4.8).
Serumlipase
Es wurde eine Erhöhung der Serumlipase beobachtet. Bei Patienten mit einer vorangegangenen Pankreatitis ist Vorsicht geboten. Geht eine Lipaseerhöhung mit abdominellen Symptomen einher, sollten die Bosutinib-Therapie unterbrochen und entsprechende diagnostische Maßnahmen erwogen werden, um eine Pankreatitis auszuschließen (Abschnitt 4.2).
Infektionen
Bosutinib kann die Anfälligkeit von Patienten für bakterielle, virale, Pilz- oder Protozoen-Infektionen erhöhen.
Kardiovaskuläre Toxizität
Bosulif kann eine kardiovaskuläre Toxizität verursachen, einschließlich Herzinsuffizienz und kardialer ischämischer Ereignisse. Ereignisse von Herzinsuffizienz traten bei vorbehandelten Patienten häufiger auf als bei Patienten mit neu diagnostizierter CML und waren häufiger bei Patienten mit fortgeschrittenem Alter oder Risikofaktoren, einschließlich Herzinsuffizienz in der medizinischen Vorgeschichte. Kardiale ischämische Ereignisse traten sowohl bei vorbehandelten Patienten als auch bei Patienten mit neu diagnostizierter CML auf und waren häufiger bei Patienten mit Risikofaktoren für eine koronare Herzerkrankung, einschließlich Diabetes, Body-Mass-Index größer als 30, Hypertonie und Gefäßerkrankungen in der Vorgeschichte.
Patienten sollten auf Anzeichen und Symptome überwacht werden, die auf eine Herzinsuffizienz und eine kardiale Ischämie hindeuten und wie klinisch indiziert behandelt werden. Bei einer kardiovaskulären Toxizität kann auch die Dosisgabe unterbrochen, die Dosis reduziert oder Bosutinib abgesetzt werden.
Proarrhythmisches Potenzial
Im automatisiert ausgelesenen EKG wurde eine QTc-Verlängerung ohne begleitende Arrhythmien beobachtet. Bosutinib sollte mit Vorsicht angewendet werden bei Patienten mit einer Vorgeschichte oder Veranlagung für eine QTc-Verlängerung, oder Patienten, die an einer unkontrollierten oder signifikanten Herzerkrankung, einschließlich eines kürzlich aufgetretenen Myokardinfarkts, kongestiver Herzinsuffizienz, instabiler Angina oder klinisch signifikanter Bradykardie leiden, oder Patienten, die Arzneimittel einnehmen, die bekannterweise zu einer Verlängerung des QTc führen (z. B. Antiarrhythmika und andere Substanzen, die eine QTc-Verlängerung verursachen können [siehe Abschnitt 4.5]). Eine Hypokaliämie und eine Hypomagnesiämie können diesen Effekt verstärken.
Eine Beobachtung hinsichtlich einer Auswirkung auf das QTc ist angezeigt. Ein Ausgangs-Elektrokardiogramm (EKG) wird vor Beginn der Bosutinib‑Therapie und falls klinisch indiziert empfohlen. Eine Hypokaliämie oder eine Hypomagnesiämie müssen vor Bosutinib‑Einnahme korrigiert und während der Behandlung regelmäßig überprüft werden.
Nierenfunktionsstörung
Die Behandlung erwachsener und pädiatrischer CML-Patienten mit Bosutinib kann zu einer klinisch signifikanten Verminderung der Nierenfunktion führen. In klinischen Studien wurde bei Patienten im Verlauf der Behandlung mit Bosutinib eine Verminderung der geschätzten glomerulären Filtrationsrate (eGFR) beobachtet (siehe Abschnitt 4.8).
Es ist wichtig, dass die Nierenfunktion vor Beginn der Behandlung beurteilt und während der Therapie mit Bosutinib engmaschig überwacht wird. Besondere Aufmerksamkeit ist dabei auf solche Patienten zu richten, die bereits eine eingeschränkte Nierenfunktion haben oder Risikofaktoren für eine Nierenfunktionsstörung aufweisen; dazu gehört die gleichzeitige Anwendung von Arzneimitteln mit nephrotoxischem Potenzial, wie z. B. Diuretika, Angiotensin-Converting-Enzym (ACE)-Inhibitoren, Angiotensin‑Rezeptor-Blockern und nichtsteroidalen Antirheumatika (NSARs).
In einer Studie zur Nierenfunktionsstörung war die Bosutinib-Exposition bei Probanden mit mäßig bis schwer beeinträchtigter Nierenfunktion erhöht. Für Patienten mit mäßiger oder schwerer Nierenfunktionsstörung wird eine Dosisreduktion empfohlen (siehe Abschnitte 4.2 und 5.2).
Patienten mit einem Serumkreatinin-Wert > 1,5 × ULN wurden von den CML-Studien ausgeschlossen (siehe Abschnitte 4.2 und 5.2).
Die klinischen Daten für CML-Patienten mit mäßiger Nierenfunktionsstörung, die eine gesteigerte Dosis von 600 mg Bosutinib erhielten, sind sehr begrenzt (N = 3).
Asiaten
Populationspharmakokinetische Analysen zeigten, dass Asiaten eine niedrigere Clearance hatten, die zu einer erhöhten Exposition führte. Daher sollten diese Patienten insbesondere im Fall einer Dosiseskalation sorgfältig auf Nebenwirkungen überwacht werden.
Schwere Hautreaktionen
Bosutinib kann schwerwiegende Hautreaktionen wie Stevens-Johnson-Syndrom und Lyell-Syndrom (toxische epidermale Nekrolyse) hervorrufen. Bei Patienten, bei denen es während der Behandlung zu einer schweren Hautreaktion kommt, sollte Bosutinib dauerhaft abgesetzt werden.
Tumorlyse-Syndrom
Da es unter der Behandlung mit Bosutinib zu einem Tumorlyse-Syndrom (TLS) kommen kann, werden vor der Einleitung der Therapie ein Ausgleich des Flüssigkeitshaushalts bei klinisch erheblicher Dehydratation und die Behandlung erhöhter Harnsäurewerte empfohlen (siehe Abschnitt 4.8).
Hepatitis-B-Reaktivierung
Bei Patienten, die chronische Träger dieses Virus sind, ist eine Hepatitis-B-Reaktivierung aufgetreten, nachdem sie BCR‑ABL‑TKI erhalten hatten. Einige Fälle führten zu akutem Leberversagen oder zu fulminanter Hepatitis, die eine Lebertransplantation notwendig machten oder zum Tod führten.
Patienten sollten vor Beginn der Behandlung mit Bosutinib auf eine HBV-Infektion hin untersucht werden. Vor Einleitung der Behandlung bei Patienten mit positiver HBV‑Serologie (einschließlich jener mit aktiver Erkrankung) sollten Experten für Lebererkrankungen und für die Behandlung von HBV zurate gezogen werden; dies sollte auch bei Patienten erfolgen, die während der Behandlung positiv auf eine HBV-Infektion getestet werden. HBV-Träger, die mit Bosutinib behandelt werden, sollten während der Behandlung und über einige Monate nach Ende der Therapie engmaschig bezüglich der Anzeichen und Symptome einer aktiven HBV-Infektion überwacht werden (siehe Abschnitt 4.8).
Photosensibilität
Die Exposition gegenüber direktem Sonnenlicht oder ultravioletter (UV) Strahlung ist wegen des Risikos der mit der Behandlung mit Bosutinib verbundenen Lichtempfindlichkeit zu vermeiden oder zu minimieren. Die Patienten müssen angewiesen werden, Maßnahmen wie Schutzkleidung und Sonnenschutz mit hohem Lichtschutzfaktor (LSF) zu verwenden.
Cytochrom‑P‑450 (CYP)3A‑Inhibitoren
Die gleichzeitige Anwendung von Bosutinib und starken oder moderaten CYP3A-Inhibitoren sollte vermieden werden, da es dadurch zu einem Anstieg der Plasmakonzentration von Bosutinib kommt (siehe Abschnitt 4.5).
Nach Möglichkeit wird die Auswahl eines alternativen Arzneimittels ohne oder mit minimalem CYP3A-Hemmpotenzial zur gleichzeitigen Anwendung empfohlen.
Muss ein starker oder mäßiger CYP3A-Inhibitor während der Bosutinib‑Behandlung gegeben werden, sollte eine Unterbrechung der Bosutinib‑Behandlung oder eine Dosisreduktion von Bosutinib in Betracht gezogen werden.
CYP3A‑Induktoren
Die gleichzeitige Anwendung von Bosutinib mit starken oder mäßigen CYP3A-Induktoren sollte vermieden werden, da es dadurch zu einer Senkung der Plasmakonzentration von Bosutinib kommt (siehe Abschnitt 4.5).
Wechselwirkungen mit Nahrungsmitteln
Grapefruitprodukte einschließlich Grapefruitsaft und andere Produkte, die bekanntermaßen eine Hemmung von CYP3A verursachen, sollten vermieden werden (siehe Abschnitt 4.5).
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette mit 100 mg, 400 mg oder 500 mg bzw. pro Hartkapsel mit 50 mg oder 100 mg. Patienten unter einer natriumarmen Diät können informiert werden, dass dieses Arzneimittel nahezu „natriumfrei“ ist.
Wirkungen anderer Arzneimittel auf Bosutinib
CYP3A‑Inhibitoren
Die gleichzeitige Gabe von Bosutinib zusammen mit starken CYP3A-Inhibitoren (unter anderem Itraconazol, Ketoconazol, Posaconazol, Voriconazol, Clarithromycin, Telithromycin, Nefazodon, Mibefradil, Indinavir, Lopinavir/Ritonavir, Nelfinavir, Ritonavir, Saquinavir, Boceprevir, Telaprevir, Grapefruitprodukten einschließlich Grapefruitsaft) oder mäßigen CYP3A-Inhibitoren (unter anderem Fluconazol, Ciprofloxacin, Erythromycin, Diltiazem, Verapamil, Amprenavir, Atazanavir, Darunavir/Ritonavir, Fosamprenavir, Aprepitant, Crizotinib, Imatinib) sollte vermieden werden, da es dadurch zu einer Erhöhung der Plasmakonzentration von Bosutinib kommt.
Bei der gleichzeitigen Einnahme schwacher CYP3A-Inhibitoren zusammen mit Bosutinib ist Vorsicht geboten.
Nach Möglichkeit wird die Auswahl eines alternativen Arzneimittels ohne oder mit minimalem CYP3A-Hemmpotenzial zur gleichzeitigen Anwendung empfohlen.
Muss ein starker oder mäßiger CYP3A-Inhibitor während der Bosutinib‑Behandlung gegeben werden, sollte eine Unterbrechung der Bosutinib‑Behandlung oder eine Dosisreduktion von Bosutinib in Betracht gezogen werden.
In einer Studie mit 24 gesunden Probanden, die 5 Dosen von 400 mg Ketoconazol (ein starker CYP3A-Inhibitor) pro Tag zusammen mit einer Einzeldosis von 100 mg Bosutinib im nüchternen Zustand erhielten, erhöhte Ketoconazol die Cmax von Bosutinib um das 5,2-Fache und die AUC von Bosutinib im Plasma um das 8,6-Fache im Vergleich zur alleinigen Gabe von Bosutinib.
In einer Studie mit 20 gesunden Probanden, die eine Einzeldosis von 125 mg Aprepitant (ein mäßiger CYP3A-Inhibitor) zusammen mit einer Einzeldosis von 500 mg Bosutinib im nicht nüchternen Zustand erhielten, erhöhte Aprepitant die Cmax von Bosutinib um das 1,5-Fache und die AUC von Bosutinib im Plasma um das 2,0-Fache im Vergleich zur alleinigen Gabe von Bosutinib.
CYP3A‑Induktoren
Die gleichzeitige Anwendung von Bosutinib mit starken CYP3A-Induktoren (unter anderem Carbamazepin, Phenytoin, Rifampicin, Johanniskraut) oder mäßigen CYP3A-Induktoren (unter anderem Bosentan, Efavirenz, Etravirin, Modafinil, Nafcillin) sollte vermieden werden, da es dadurch zu einer Senkung der Plasmakonzentration von Bosutinib kommt.
Aufgrund der starken Abnahme der Bosutinib-Exposition, die bei einer gleichzeitigen Gabe von Bosutinib mit Rifampicin auftrat, ist es unwahrscheinlich, dass eine Dosiserhöhung von Bosutinib bei gleichzeitiger Anwendung von starken oder mäßigen CYP3A-Induktoren den Expositionsverlust ausreichend kompensiert.
Bei der gleichzeitigen Einnahme leichter CYP3A-Induktoren zusammen mit Bosutinib ist Vorsicht geboten.
Nach der gleichzeitigen Gabe einer Einzeldosis Bosutinib mit 6 Dosen von 600 mg Rifampicin pro Tag bei 24 gesunden, nicht nüchternen Probanden sank die Bosutinib-Exposition (Cmax und AUC im Plasma) auf 14 % bzw. 6 % der Werte, die bei der alleinigen Anwendung von 500 mg Bosutinib gemessen wurden.
Protonenpumpenhemmer (PPIs)
Bei gleichzeitiger Gabe von PPIs zusammen mit Bosutinib ist Vorsicht geboten. Kurzwirksame Antazida sollten als Alternative zu PPIs in Betracht gezogen werden, und die Einnahme von Bosutinib und der Antazida sollte nach Möglichkeit zu unterschiedlichen Zeitpunkten erfolgen (d. h. Einnahme von Bosutinib morgens und Einnahme der Antazida abends). Bosutinib zeigt in vitro eine pH‑abhängige Wasserlöslichkeit. Bei der gleichzeitigen Anwendung einer oralen Einzeldosis Bosutinib (400 mg) zusammen mit mehreren oralen Dosen Lansoprazol (60 mg) in einer Studie mit 24 gesunden, nüchternen Probanden sanken die Werte von Bosulif-Cmax und -AUC auf 54 % bzw. 74 %, entsprechend den Werten bei einer alleinigen Gabe von Bosutinib (400 mg).
Wirkungen von Bosutinib auf andere Arzneimittel
In einer Studie mit 27 gesunden Probanden, die eine Einzeldosis von 500 mg Bosutinib zusammen mit einer Einzeldosis von 150 mg Dabigatranetexilatmesilat (ein Substrat von P-Glykoproteinen [P-gp]) im nicht nüchternen Zustand erhielten, erhöhte Bosutinib nicht die Cmax oder die AUC von Dabigatran im Plasma im Vergleich zur alleinigen Gabe von Dabigatranetexilatmesilat. Die Ergebnisse der Studie weisen darauf hin, dass Bosutinib keine klinisch relevanten P-gp-inhibitorischen Wirkungen hat.
Eine In-vitro-Studie zeigt, dass bei therapeutischer Dosierung Arzneimittelwechselwirkungen unwahrscheinlich sind aufgrund einer durch Bosutinib verursachten Induktion des Metabolismus von Arzneimitteln, die Substrate für CYP1A2, CYP2B6, CYP2C9, CYP2C19 und CYP3A4 sind.
In-vitro-Studien deuten darauf hin, dass bei therapeutischen Dosen klinische Arzneimittelwechselwirkungen unwahrscheinlich sind aufgrund einer durch Bosutinib verursachten Hemmung des Metabolismus von Arzneimitteln, die Substrate für CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 oder CYP3A4/ 5 sind.
In-vitro-Studien deuten darauf hin, dass das Potenzial von Bosutinib in klinisch relevanten Konzentrationen für die Hemmung von Breast Cancer Resistance Protein (BCRP, systemisch), organischem Anionen-transportierendem Polypeptid (OATP)1B1, OATP1B3, organischem Anionentransporter (OAT)1, OAT3, organischem Kationentransporter (OCT)2 zwar gering ist, die Hemmung von BCRP im Gastrointestinaltrakt und OCT1 jedoch nicht auszuschließen ist.
Antiarrhythmika und andere Substanzen, die eine QT-Verlängerung bewirken können
Vorsicht ist geboten bei der Anwendung von Bosutinib bei Patienten, bei denen eine QT-Verlängerung vorliegt oder sich entwickeln könnte, einschließlich der Patienten, die Antiarrhythmika wie z. B. Amiodaron, Disopyramid, Procainamid, Chinidin und Sotalol oder andere Arzneimittel einnehmen, die zu einer QT-Verlängerung führen können (z. B. Chloroquin, Halofantrin, Clarithromycin, Domperidon, Haloperidol, Methadon und Moxifloxacin) (siehe Abschnitt 4.4).
Frauen im gebärfähigen Alter/ Kontrazeption
Frauen im gebärfähigen Alter sollten angewiesen werden, während der Behandlung mit Bosutinib und für mindestens 1 Monat nach der letzten Dosis eine zuverlässige Verhütungsmethode anzuwenden und es zu vermeiden, während der Behandlung mit Bosutinib schwanger zu werden. Darüber hinaus sollte die Patientin darauf hingewiesen werden, dass Erbrechen und Diarrhö die vollständige Resorption oraler Kontrazeptiva verhindern und damit deren Wirksamkeit vermindern können.
Schwangerschaft
Es liegen begrenzte Daten für die Verwendung von Bosutinib bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Die Behandlung mit Bosutinib während der Schwangerschaft oder bei Frauen im gebärfähigen Alter, die keine Empfängnisverhütung anwenden, wird nicht empfohlen. Wird Bosutinib während der Schwangerschaft angewendet oder wird die Patientin während der Behandlung mit Bosutinib schwanger, sollte sie über mögliche Risiken für den Fötus aufgeklärt werden.
Stillzeit
Es ist nicht bekannt, ob Bosutinib und seine Metaboliten in die Muttermilch übergehen. Eine an Ratten durchgeführte Studie mit [14C] radioaktiv markiertem Bosutinib wies eine von Bosutinib abgeleitete Radioaktivität in der Muttermilch nach (siehe Abschnitt 5.3). Ein potenzielles Risiko für das zu stillende Kind kann nicht ausgeschlossen werden. Das Stillen soll während der Behandlung mit Bosutinib unterbrochen werden.
Fertilität
Auf Grundlage nichtklinischer Erkenntnisse wird davon ausgegangen, dass Bosutinib die Fortpflanzungsfunktion und die Fertilität beim Menschen beeinträchtigen kann (siehe Abschnitt 5.3).
Männer, die mit Bosutinib behandelt werden, sollten sich vor Beginn der Behandlung über die Möglichkeit einer Spermakonservierung beraten lassen, da durch die Therapie mit Bosutinib die Möglichkeit einer verminderten Fruchtbarkeit besteht.
Bosutinib hat keinen oder einen vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Patienten, bei denen unter Bosutinib Schwindelgefühl, Fatigue, Beeinträchtigung des Sehvermögens oder andere Nebenwirkungen auftreten, die mit einer möglichen Beeinträchtigung der Verkehrstüchtigkeit und der sicheren Fähigkeit zum Bedienen von Maschinen verbunden sein könnten, sollten diese Tätigkeiten jedoch so lange unterlassen, wie die Nebenwirkungen andauern.
Zusammenfassung des Sicherheitsprofils
Insgesamt erhielten 1 372 erwachsene Leukämie-Patienten mindestens eine Dosis Bosutinib als alleinige Behandlung. Die mediane Therapiedauer betrug 26,30 Monate (Spanne: 0,03 bis 170,49 Monate). Diese Patienten hatten entweder eine neu diagnostizierte CP‑CML oder waren resistent oder intolerant gegenüber einer Vortherapie und hatten CML in der chronischen oder akzelerierten Phase oder Blastenkrise oder Ph+ akute lymphatische Leukämie (ALL). Die Sicherheitsanalysen schlossen Daten aus einer abgeschlossenen Anschlussstudie ein.
Mindestens eine Nebenwirkung jeglichen Toxizitätsgrades wurde bei 1 349 (98,3 %) Patienten berichtet. Die häufigsten Nebenwirkungen, die bei ≥ 20 % der Patienten berichtet wurden, waren Diarrhö (80,4 %), Übelkeit (41,5 %), Abdominalschmerz (35,6 %), Thrombozytopenie (34,4 %), Erbrechen (33,7 %), Ausschlag (32,8 %), ALT erhöht (28,0 %), Anämie (27,2 %), Fieber (23,4 %), AST erhöht (22,5 %), Fatigue (32,0 %) und Kopfschmerzen (20,3 %). Mindestens eine Grad 3- oder Grad 4-Nebenwirkung wurde bei 943 (68,7 %) Patienten berichtet. Die Grad 3- oder Grad 4-Nebenwirkungen, die von ≥ 5 % der Patienten berichtet wurden, waren Thrombozytopenie (19,7 %), ALT erhöht (14,6 %), Neutropenie (10,6 %), Diarrhö (10,6 %), Anämie (10,3 %), Lipase erhöht (10,1 %), AST erhöht (6,7 %) und Ausschlag (5,0 %).
Tabellarische Auflistung der Nebenwirkungen
Diese Nebenwirkungen werden nach Systemorganklassen und Häufigkeit aufgeführt. Häufigkeiten werden wie folgt definiert: Sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 4 - Nebenwirkungen für Bosutinib
Infektionen und parasitäre Erkrankungen | |
Sehr häufig |
Nasopharyngitis |
Häufig |
Grippeb |
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen) | |
Gelegentlich |
Tumorlysesyndrom** |
Erkrankungen des Blutes und des Lymphsystems | |
Sehr häufig |
Thrombozytopenied |
Häufig |
Leukopenieg |
Gelegentlich |
Febrile Neutropenie |
Erkrankungen des Immunsystems | |
Häufig |
Arzneimittelüberempfindlichkeit |
Gelegentlich |
Anaphylaktischer Schock |
Stoffwechsel- und Ernährungsstörungen | |
Sehr häufig |
Verminderter Appetit |
Häufig |
Hypophosphatämieh |
Erkrankungen des Nervensystems | |
Sehr häufig |
Kopfschmerzen |
Häufig |
Dysgeusie |
Erkrankungen des Ohrs und des Labyrinths | |
Häufig |
Tinnitus |
Herzerkrankungen | |
Häufig |
Perikarderguss, Herzinsuffizienzj, kardiale Ischämiek |
Gelegentlich |
Perikarditis |
Gefäßerkrankungen | |
Häufig |
Hypertoniel |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
Sehr häufig |
Husten |
Häufig |
Pulmonale Hypertoniem |
Gelegentlich |
Respiratorische Insuffizienz |
Nicht bekannt |
Interstitielle Lungenerkrankung |
Erkrankungen des Gastrointestinaltrakts | |
Sehr häufig |
Diarrhö |
Häufig |
Gastritis |
Leber- und Gallenerkrankungen | |
Häufig |
Leberfunktion anomalr |
Gelegentlich |
Leberverletzungt |
Erkrankungen der Haut und des Unterhautgewebes | |
Sehr häufig |
Ausschlagu |
Häufig |
Pruritus |
Gelegentlich |
Medikamentenausschlag |
Nicht bekannt |
Stevens‑Johnson-Syndrom**, Epidermolysis acuta toxica** |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | |
Sehr häufig |
Arthralgie, Rückenschmerzen |
Häufig |
Myalgie |
Erkrankungen der Nieren und Harnwege | |
Häufig |
Akute Nierenschädigung |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |
Sehr häufig |
Ermüdungw |
Häufig |
Brustkorbschmerzy |
Untersuchungen | |
Sehr häufig |
Alaninaminotransferase erhöhtz |
Häufig |
Amylase erhöhtbb |
aa Lipase erhöht umfasst Hyperlipasämie, Lipase erhöht | |
Kinder und Jugendliche
In der offenen, multizentrischen, internationalen, einarmigen Phase-I/II-Studie BCHILD erhielten insgesamt 55 pädiatrische Patienten im Alter ≥ 1 Jahr mindestens 1 Dosis Bosutinib. Die mediane Behandlungsdauer betrug 13,5 Monate (Spanne: 0,2 bis 60,9 Monate). Die Patienten hatten entweder eine neu diagnostizierte Ph+ CML in der CP oder eine resistente oder therapie-intolerante Ph+ CML in der CP und CML in der AP.
Bei 54 pädiatrischen Patienten (98,2 %) wurde mindestens eine Nebenwirkung jeglichen Toxizitätsgrades berichtet. Die am häufigsten berichteten Nebenwirkungen waren Diarrhö (82 %), Abdominalschmerz (65 %), Erbrechen (56 %), Übelkeit (51 %), Ausschlag (36 %), Ermüdung (35 %), Thrombozytopenie (35 %), Kopfschmerzen (33 %), Fieber (33 %), Erhöhung der ALT (29 %) und Verminderung desAppetits (24 %).
Die am häufigsten berichteten Nebenwirkungen des Grades 3 oder 4 waren Thrombozytopenie (18 %), Erhöhung der ALT (15 %) und Diarrhö (13 %).
Erkrankungen des Blutes und des Lymphsystems
Ereignisse des Blutes und des Lymphsystems, die bei den 55 pädiatrischen Patienten in der BCHILD-Studie auftraten, umfassten Thrombozytopenie bei 19 Patienten (34,5 %), Anämie bei 10 Patienten (18,2 %) und Neutropenie bei 7 Patienten (12,7 %). Ein Patient brach die Behandlung aufgrund einer Neutropenie des Grades 4 ab. Bei 37,5 % der Patienten mit Ereignissen des Blutes und des Lymphsystems wurde die Behandlung unterbrochen, und bei 16,7 % war eine Dosisreduktion erforderlich. Bei keinem der Patienten, bei denen die Dosisgabe unterbrochen wurde, trat bei Wiederaufnahme der Behandlung mit Bosutinib ein positiver Wiederholungsbefund auf. Die mediane Zeit bis zum Auftreten des ersten Ereignisses betrug 13 Tage (Spanne: 1 bis 757 Tage), und die mediane kumulative Dauer von Ereignissen des Grades 3 oder 4 betrug 16,0 Tage (Spanne: 4 bis 47 Tage).
Leber- und Gallenerkrankungen
Bei den 55 Teilnehmern lag die Inzidenz der in den Labordaten festgestellten ALT- bzw. AST-Erhöhungen bei 67,3 % bzw. 63,6 %, und 43 Teilnehmer (78,2 %) berichteten über einen Anstieg der ALT- bzw. AST-Werte. Die meisten Fälle einer Transaminasenerhöhung traten im frühen Therapieverlauf auf. Von den Teilnehmern mit Transaminasenerhöhungen jeglichen Grades berichteten 83,7 % innerhalb von 3 Monaten über das erste Ereignis. Die mediane Zeit bis zum Auftreten von erhöhter ALT bzw. erhöhter AST betrug 22,0 Tage (Spanne: 9 bis 847 Tage) bzw. 18,5 Tage (Spanne: 9 bis 169 Tage). Die mediane Dauer bei Ereignissen des Grades 3/4 betrug 18,0 Tage (Spanne: 2 bis 132 Tage) bzw. 12 Tage (Spanne: 5 bis 19 Tage) für erhöhte ALT bzw. erhöhte AST.
Erkrankungen des Gastrointestinaltrakts
Erkrankungen des Gastrointestinaltrakts in Form von Diarrhö, Erbrechen und Übelkeit traten bei 81,8 %, 56,4 % bzw. 50,9 % der 55 in der BCHILD-Studie mit Bosutinib behandelten pädiatrischen Patienten auf. Drei Patienten (5,5 %) brachen die Behandlung mit Bosutinib aufgrund von Diarrhö (N = 3), Abdominalschmerz (N = 2), Übelkeit (N = 1) und/ oder Erbrechen (N = 1) ab. Bei 9 (19 %) der pädiatrischen Patienten mit Erkrankungen des Gastrointestinaltrakts wurde die Behandlung unterbrochen, und bei 4 (8,3 %) war eine Dosisreduktion erforderlich. Von den 9 Patienten, bei denen die Behandlung unterbrochen werden musste, nahmen 8 (88,9 %) die Behandlung wieder auf. 55,6 % dieser Patienten nahmen die Behandlung erfolgreich wieder auf. Die mediane Zeit bis zum Auftreten von Diarrhö betrug 2 Tage, und die mediane Dauer von Diarrhö jeglichen Grades betrug 2 Tage.
Nierenerkrankungen
In der pädiatrischen Studie wiesen 45 der insgesamt 55 Patienten (82 %) eine normale eGFR (≥ 90 ml/min/1,73 m2) auf, die auf Grundlage der Schwartz-Bedside Gleichung zu Studienbeginn ermittelt wurde. Von diesen 45 Patienten nahm die eGFR nach 13,47 Monaten bei 19 (34,5 %) auf Grad 1 (60 bis < 90 ml/min/1,73 m2) ab und bei 1 (1,8 %) Patienten auf Grad 2 (30 bis < 60 ml/min/1,73 m2). Bei keinem Teilnehmer betrug die eGFR nach Studienbeginn < 45 ml/min/1,73 m2, unabhängig von den Ausgangswerten.
Beschreibung ausgewählter Nebenwirkungen
Erkrankungen des Blutes und des Lymphsystems
Von den 372 (27,1 %) erwachsenen Patienten mit Anämie als berichteter Nebenwirkung setzten 6 Patienten Bosutinib aufgrund von Anämie ab. Eine maximale Toxizität von Grad 1 trat bei 95 (25,5 %) Patienten, eine maximale Toxizität von Grad 2 bei 135 (36,3 %) Patienten, eine maximale Toxizität von Grad 3 bei 113 (30,4 %) Patienten und eine maximale Toxizität von Grad 4 bei 29 (7,8 %) Patienten auf. Bei diesen Patienten betrug die mediane Dauer bis zum Auftreten des ersten Ereignisses 29 Tage (Spanne: 1 bis 3 999 Tage), die mediane Dauer pro Ereignis betrug 22 Tage (Spanne: 1 bis 3 682 Tage).
Von den 209 (15,2 %) erwachsenen Patienten mit Neutropenie als berichteter Nebenwirkung setzten 19 Patienten Bosutinib aufgrund von Neutropenie ab. Eine maximale Toxizität vonGrad 1 trat bei 19 Patienten (9,1 %) auf, eine maximale Toxizität von Grad 2 bei 45 (21,5 %) Patienten, eine maximale Toxizität von Grad 3 bei 95 (45,5 %) Patienten und eine maximale Toxizität von Grad 4 bei 50 (23,9 %) Patienten auf. Bei diesen Patienten betrug die mediane Zeit bis zum Auftreten des ersten Ereignisses 56 Tage (Spanne: 1 bis 1 769 Tage), und die mediane Dauer pro Ereignis betrug 15 Tage (Spanne: 1 bis 913 Tage).
Von den 472 (34,4 %) erwachsenen Patienten mit Thrombozytopenie als berichteter Nebenwirkung setzten 42 Patienten Bosutinib aufgrund von Thrombozytopenie ab. Eine maximale Toxizität von Grad 1 trat bei 114 (24,2 %) Patienten, eine maximale Toxizität von Grad 2 bei 88 (18,6 %) Patienten, eine maximale Toxizität von Grad 3 bei 172 (36,4 %) Patienten und eine maximale Toxizität von Grad 4 bei 98 (20,8 %) Patienten auf. Bei diesen Patienten betrug die mediane Zeit bis zum Auftreten des ersten Ereignisses 28 Tage (Spanne: 1 bis 1 688 Tage), und die mediane Dauer pro Ereignis betrug 15 Tage (Spanne: 1 bis 3 921 Tage).
Leber- und Gallenerkrankungen
Im Rahmen der Studie betrug die beobachtete mediane Dauer bis zum Auftreten der berichteten Nebenwirkungen unter erwachsenen Patienten mit entweder erhöhten ALT- oder AST-Werten (alle Grade) 29 Tage (Spanne: 1 bis 3 995 Tage für ALT und AST). Die mediane Dauer eines Ereignisses betrug 17 Tage für ALT (Spanne: 1 bis 1 148 Tage) bzw. 15 Tage für AST (Spanne: 1 bis 803 Tage).
Bei 2/1 711 (0,1 %) der mit Bosutinib behandelten erwachsenen Patienten kam es zu zwei Fällen mit arzneimittelinduzierter Leberverletzung (definiert als gleichzeitige Erhöhung von ALT oder AST auf ≥ 3 × ULN und des Gesamtbilirubins auf > 2 × ULN und der alkalischen Phosphatase auf < 2 × ULN) ohne alternative Ursachen.
Hepatitis‑B‑Reaktivierung
In Zusammenhang mit BCR‑ABL-Tyrosinkinase-Inhibitoren wurden Hepatitis-B-Reaktivierungen beobachtet. Einige Fälle führten zu akutem Leberversagen oder zu fulminanter Hepatitis, die eine Lebertransplantation notwendig machten oder zum Tod führten (siehe Abschnitt 4.4).
Erkrankungen des Gastrointestinaltrakts
Von den 1 103 (80,4 %) Patienten, die eine Diarrhö erlitten, setzten 14 Patienten Bosutinib aufgrund von Diarrhö ab. Begleitende Arzneimittel zur Behandlung der Diarrhö erhielten 756 (68,5 %) Patienten. Eine maximale Toxizität von Grad 1 trat bei 575 (52,1 %) Patienten, eine maximale Toxizität von Grad 2 bei 383 (34,7 %) Patienten, eine maximale Toxizität von Grad 3 bei 144 (13,1 %) Patienten und eine maximale Toxizität von Grad 4 bei 1 Patienten (0,1 %) auf. Unter den Patienten mit Diarrhö betrug die mediane Dauer bis zum Auftreten des ersten Ereignisses 2 Tage (Spanne: 1 bis 2 702 Tage), die mediane Dauer der Diarrhö (jeglichen Grades) betrug 2 Tage (Spanne: 1 bis 4 247 Tage).
Unter den 1 103 Patienten mit Diarrhö wurde bei 218 (19,8 %) Patienten die Behandlung unterbrochen und bei 208 (95,4 %) dieser Patienten wurde die Behandlung mit Bosutinib danach wieder aufgenommen. Bei 201 (96,6 %) dieser Patienten, bei denen die Behandlung wieder aufgenommen wurde, kam es zu keinem erneuten Ereignis bzw. zu keinem nachfolgenden Diarrhö‑bedingten Behandlungsabbruch.
Herzerkrankungen
Unter den 1 372 Patienten traten bei 50 (3,6 %) Patienten Herzinsuffizienz und bei 57 (4,2 %) Patienten kardiale ischämische Ereignisse auf.
7 Patienten (0,5 %) erlitten eine QTcF-Verlängerung (länger als 500 ms). Bei 11 Patienten (0,8 %) kam es zu einer QTcF-Verlängerung > 60 ms gegenüber der Eingangsuntersuchung. Patienten mit unkontrollierter oder signifikanter Herzerkrankung einschließlich einer QTc‑Verlängerung bei Studienbeginn, wurden in die klinischen Studien nicht eingeschlossen (siehe Abschnitte 5.1 und 5.3).
Nierenerkrankungen
Bei Patienten mit neu diagnostizierter CML in der CP, die 400 mg erhielten, betrug die mediane Abnahme der eGFR gegenüber dem Ausgangswert (anhand der MDRD-Gleichung ermittelt) nach 1 Jahr 11,1 ml/min/1,73 m2 und nach 5 Jahren 14,1 ml/min/1,73 m2 für Patienten in Behandlung. Bei zuvor unbehandelten CML‑Patienten, die 500 mg erhielten, betrug die mediane Abnahme der eGFR nach 1 Jahr 9,2 ml/min/1,73 m2, nach 5 Jahren 12,0 ml/min/1,73 m2 und nach 10 Jahren 16,6 ml/min/1,73 m2 für Patienten in Behandlung. Bei vorbehandelten Patienten mit CML in der CP und im fortgeschrittenen Stadium, die mit 500 mg behandelt wurden, betrug die mediane Abnahme der eGFR nach 1 Jahr 7,6 ml/min/1,73 m2, nach 5 Jahren 12,3 ml/min/1,73 m2 und nach 10 Jahren 15,9 ml/min/1,73 m2 für Patienten in Behandlung. Bei Patienten mit Ph+ CML, die zuvor mit mindestens 1 TKI behandelt wurden und 500 mg erhielten, betrug die mediane Abnahme der eGFR gegenüber dem Ausgangswert nach 1 Jahr 9,2 ml/min/1,73 m2 und nach 4 Jahren 14,5 ml/min/1,73 m2 für Patienten in Behandlung.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: http://www.bfarm.de
Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: +43 (0) 50 555 36207
Website: http://www.basg.gv.at/
Die Erfahrungen zur Überdosierung von Bosutinib in klinischen Studien sind auf Einzelfälle beschränkt. Bei einer Überdosierung mit Bosutinib sollten die Patienten beobachtet werden und es sollte eine entsprechende unterstützende Behandlung durchgeführt werden.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitoren, ATC‑Code: L01EA04
Wirkmechanismus
Bosutinib gehört zur pharmakologischen Arzneimittelklasse der Kinaseinhibitoren. Bosutinib hemmt die pathologisch veränderte BCR‑ABL‑Kinase, die zur Entwicklung einer CML führt. Modellierungsstudien zeigen, dass Bosutinib an die Kinasedomäne von BCR‑ABL bindet. Bosutinib hemmt ebenfalls die Aktivität von Kinasen der Src-Familie, einschließlich Src-, Lyn- und Hck‑Kinasen. Bosutinib bewirkt eine minimale Hemmung von Platelet Derived Growth Factor (PDGF)-Rezeptoren und c-Kit.
In-vitro-Studien zeigen, dass Bosutinib die Proliferation und das Überleben etablierter CML-Zelllinien, von Zelllinien der Ph+ ALL und von Patienteneigenen primären primitiven CML-Zellen hemmt. Bosutinib hemmte 16 von 18 Imatinib-resistenten Formen von BCR‑ABL, die in murinen myeloischen Zelllinien exprimiert waren. Die Bosutinib-Behandlung bewirkte eine Reduktion der CML-Tumorlast bei Nacktmäusen und eine Senkung der Tumorlast muriner myeloischer Malignome, die Imatinib-resistente Formen von BCR‑ABL exprimieren. Darüber hinaus hemmt Bosutinib Rezeptortyrosinkinasen c-Fms, EphA- und B-Rezeptoren, Kinasen der Trk-Familie, Kinasen der Axl-Familie, Kinasen der Tec-Familie, einige Mitglieder der ErbB-Familie, die Nicht-Rezeptor-Tyrosinkinase Csk, Serin/ Threonin-Kinasen der Ste20-Familie und 2 Calmodulin-abhängige Proteinkinasen.
Pharmakodynamische Wirkungen
Die Wirkung von Bosutinib 500 mg auf das korrigierte QTc wurde in einer randomisierten, in Bezug auf Bosutinib doppelblinden, placebo- und Moxifloxacin-kontrollierten, offenen Einzeldosis-Crossover-Studie an gesunden Probanden untersucht.
Die Daten dieser Studie belegen, dass die tägliche Einnahme der Dosis von 500 mg Bosulif in Verbindung mit Mahlzeiten und unter Bedingungen, die eine Erhöhung auf supratherapeutische Plasmakonzentrationen bewirken, bei gesunden Probanden nicht zu einer Verlängerung des QTc führt. Nach oraler Gabe einer Einzeldosis von Bosutinib 500 mg (therapeutische Dosis) bzw. von Bosutinib 500 mg mit Ketoconazol 400 mg (um eine supratherapeutische Bosutinib-Konzentrationen zu erreichen) an gesunde Probanden lag die obere Grenze des einseitigen 95%-Konfidenzintervalls (KI) um die mittlere QTc-Veränderung zu allen Zeitpunkten nach der Anwendung der Dosis unter 10 ms. In dieser Studie wurden keine unerwünschten Ereignisse beobachtet, die auf eine QTc‑Verlängerung hindeuten.
Im Rahmen einer Studie mit Probanden mit beeinträchtigter Leberfunktion wurde eine steigende Häufigkeit der QTc-Verlängerung > 450 ms mit zunehmender Beeinträchtigung der Leberfunktion beobachtet. In der klinischen Phase-I/II-Studie bei Patienten mit einer vorbehandelten Ph+ Leukämie, die 500 mg Bosutinib erhielten, wurde bei 9 (1,6 %) von 570 Patienten eine QTcF-Verlängerung > 60 ms im Vergleich zum Ausgangswert beobachtet. In der klinischen Phase-III-Studie mit Patienten mit neu diagnostizierter CP‑CML, die mit 400 mg Bosutinib behandelt wurden, wurde im Bosutinib-Behandlungsarm (N = 268) bei keinem Patienten eine QTcF-Verlängerung von > 60 ms im Vergleich zum Ausgangswert beobachtet. In der klinischen Phase-III-Studie mit Patienten mit neu diagnostizierter Ph+ CML in der chronischen Phase, die mit 500 mg Bosutinib behandelt wurden, wurde bei 2 (0,8 %) von 248 Patienten, denen Bosutinib gegeben wurde, eine QTcF-Verlängerung > 60 ms im Vergleich zum Ausgangswert beobachtet. In der klinischen Phase-IV-Studie an Patienten mit Ph+ CML, die zuvor mit mindestens 1 TKI behandelt wurden und 500 mg Bosutinib erhielten (N = 163), gab es keinen Patienten mit einer QTcF-Verlängerung > 60 ms im Vergleich zum Ausgangswert. Es kann nicht ausgeschlossen werden, dass Bosutinib über ein proarrhythmisches Potenzial verfügt.
Klinische Wirksamkeit
Klinische Studie mit zuvor unbehandelten erwachsenen Patienten mit CP-CML
Studie Bosutinib 400 mg
Es wurde eine zweiarmige, offene, multizentrische Phase-III‑Überlegenheitsstudie durchgeführt, um die Wirksamkeit und Sicherheit von Bosutinib 400 mg einmal täglich als Monotherapie verglichen mit Imatinib 400 mg einmal täglich als Monotherapie bei erwachsenen Patienten mit neu diagnostizierter Ph+ CP‑CML zu untersuchen. In der Studie wurden 536 Patienten (268 in jedem Behandlungsarm) mit Ph+ oder Ph- neu diagnostizierter CP‑CML (intent‑to‑treat-population, ITT) randomisiert einschließlich 487 Patienten mit Ph+ CML, die b2a2- und/ oder b3a2‑Transkripte und bei der Eingangsuntersuchung > 0 BCR‑ABL‑Kopien aufwiesen (modifizierte intent‑to‑treat-population, mITT).
Der primäre Wirksamkeitsendpunkt war der Anteil an Patienten mit gutem molekularen Ansprechen (major molecular response, MMR) zum Zeitpunkt 12 Monate (48 Wochen) im Bosutinib‑Behandlungsarm verglichen mit dem im Imatinib‑Behandlungsarm in der mITT‑Population. MMR war definiert als ≤ 0,1 % BCR‑ABL/ABL-Quotient auf der internationalen Skala (entsprechend einer Log-Reduktion von ≥ 3 im Vergleich zum standardisierten Ausgangswert), bei mindestens 3 000 ABL-Transkripten, gemessen vom Zentrallabor.
Die wichtigsten sekundären Endpunkte schlossen das komplette zytogenetische Ansprechen (Complete Cytogenetic Response, CCyR) innerhalb von 12 Monaten, Dauer des CCyR, Dauer des MMR, das ereignisfreie Überleben (event‑free survival, EFS) und das Gesamtüberleben (overall survival, OS) ein. Das CCyR innerhalb von 12 Monaten war definiert als die Abwesenheit von Ph+ Metaphasen im Knochenmark auf Basis einer Chromosomenbandenanalyse von ≥ 20 beurteilten Metaphasen aus Knochenmarksaspirat oder ein MMR, wenn eine adäquate zytogenetische Beurteilung nicht verfügbar war. Es wurde keine Adjustierung der p‑Werte für die neben dem MMR zum Zeitpunkt 12 Monate und CCyR innerhalb von 12 Monaten definierten Endpunkte für Mehrfachvergleiche vorgenommen.
Die Basischarakteristika wie Alter (medianes Alter war 52 Jahre für die Bosutinib‑Gruppe und 53 Jahre für die Imatinib‑Gruppe, wobei 19,5 % bzw. 17,4 % der Patienten 65 Jahre oder älter waren); Geschlecht (42,3 % bzw. 44,0 % Frauen); ethnische Zugehörigkeit (78,0 % bzw. 77,6 % Kaukasier, 12,2 % bzw. 12,4 % Asiaten, 4,1 % bzw. 4,1 % Schwarze oder Afroamerikaner und 5,7 % bzw. 5,4 % Andere, mit einem Unbekannten in der Imatinib-Gruppe) und Sokal-Risiko-Score (niedriges Risiko 35,0 % bzw. 39,4 %, intermediäres Risiko 43,5 % bzw. 38,2 %, hohes Risiko 21,5 % bzw. 22,4 %) waren für die mITT-Population zwischen beiden Behandlungsarmen gut ausgeglichen.
Nach einer Beobachtungszeit von 60 Monaten in der mITT-Population erhielten 60,2 % der mit Bosutinib behandelten Patienten (N = 246) und 59,8 % der mit Imatinib behandelten Patienten (N = 239) immer noch die Erstlinientherapie.
Nach einer Beobachtungszeit von 60 Monaten in der mITT-Population hatten 0,8 % der mit Bosutinib behandelten Patienten verglichen mit 1,7 % der mit Imatinib behandelten Patienten die Behandlung aufgrund einer Progression in die AP oder BK abgesetzt. 6 (2,4 %) Bosutinib‑Patienten und 7 (2,9 %) Imatinib‑Patienten zeigten eine Transformation in die AP oder BK der CML. 5,3 % der Patienten in der Bosutinib‑Gruppe verglichen mit 15,5 % der Patienten in der Imatinib‑Gruppe setzten die Behandlung aufgrund eines unzureichenden Ansprechens bzw. Therapieversagens nach prüfärztlicher Bewertung ab. 12 (4,9 %) Patienten verstarben während der Therapie mit Bosutinib und 14 (5,8 %) Patienten unter Imatinib. Es traten keine weiteren Transformationen in der ITT-Population auf. Im Bosutinib-Arm traten 2 weitere Todesfälle in der ITT-Population auf.
Die Wirksamkeitsergebnisse in Bezug auf MMR und CCyR sind in Tabelle 5 zusammengefasst.
Tabelle 5 - Zusammenfassung des MMR zum Zeitpunkt 12 und 18 Monate und des CCyR innerhalb von 12 Monaten je Behandlungsarm in der mITT-Population
Ansprechen |
Bosutinib |
Imatinib |
Odds Ratio (95%-KI)a |
Gutes molekulares Ansprechen |
116 (47,2)b |
89 (36,9) |
1,55 (1,07; 2,23) |
Einseitiger p-Wert |
0,0100b |
||
MMR zum Zeitpunkt 18 Monate, n (%) |
140 (56,9) |
115 (47,7) |
1,45 (1,02; 2,07) |
Einseitiger p-Wert |
0,0208c |
||
Komplettes zytogenetisches Ansprechen |
190 (77,2)b |
160 (66,4) |
1,74 (1,16; 2,61) |
Einseitiger p-Wert |
0,0037b |
||
Hinweis: MMR war definiert als ≤ 0,1 % BCR‑ABL/ABL-Quotient auf der internationalen Skala (entsprechend einer Log-Reduktion von ≥ 3 im Vergleich zum standardisierten Ausgangswert), bei mindestens 3 000 ABL‑Transkripten gemäß Beurteilung durch das Zentrallabor. Das komplette zytogenetische Ansprechen war definiert als die Abwesenheit von Ph+ Metaphasen auf Basis einer Chromosomenbandenanalyse von ≥ 20 beurteilten Metaphasen aus Knochenmarksaspirat oder ein MMR, wenn eine adäquate zytogenetische Beurteilung nicht verfügbar war.
Abkürzungen: BCR‑ABL = Breakpoint Cluster Region‑Abelson; KI = Konfidenzintervall; CMH = Cochran‑Mantel‑Haenszel; CCyR = komplettes zytogenetisches Ansprechen; mITT = modifizierte intent‑to‑treat; MMR = gutes molekulares Ansprechen; N/ n = Anzahl Patienten; Ph+ = Philadelphia‑Chromosom‑positiv.
a Adjustiert nach geografischer Region und Sokal-Risiko-Score bei Randomisierung.
b Statistisch signifikanter Vergleich bei vordefiniertem Signifikanzniveau; auf Basis des CMH-Tests stratifiziert nach geographischer Region und nach Sokal-Risiko-Score bei Randomisierung.
c Auf Basis des CMH-Tests stratifiziert nach geografischer Region und Sokal-Risiko-Score bei Randomisierung.
Die MR4-Rate zum Zeitpunkt 12 Monate (definiert als ≤ 0,01 % BCR‑ABL [entsprechend einer Log‑Reduktion von ≥ 4 im Vergleich zum standardisierten Ausgangswert] bei mindestens 9 800 ABL‑Transkripten) war im Bosutinib‑Arm im Vergleich zum Imatinib‑Arm in der mITT‑Population höher (20,7 % [95%-KI: 15,7 %; 25,8 %] gegenüber 12,0 % [95%-KI: 7,9 %; 16,1 %], Odds Ratio (OR) 1,88 [95%-KI: 1,15; 3,08], einseitiger p‑Wert = 0,0052).
Nach 3, 6 und 9 Monaten war der Anteil an Patienten mit MMR im Bosutinib‑Arm höher als im Imatinib‑Arm (Tabelle 6).
Tabelle 6 - Vergleich des MMR zum Zeitpunkt 3, 6 und 9 Monate je Behandlungsarm in der mITT-Population
Zeitpunkt |
Anzahl (%) Patienten mit MMR |
Odds Ratio (95%-KI)a |
|
Bosutinib |
Imatinib |
||
Monat 3 |
10 (4,1) |
4 (1,7) |
2,48 |
Einseitiger p-Wertb |
0,0578 |
||
Monat 6 |
86 (35,0) |
44 (18,3) |
2,42 (1,59; 3,69) |
Einseitiger p-Wertb |
< 0,0001 |
||
Monat 9 |
104 (42,3) |
71 (29,5) |
1,78 (1,22; 2,60) |
Einseitiger p-Wertb |
0,0015 |
||
Hinweis: Die Prozentangaben basierten auf der Anzahl an Patienten in jedem Behandlungsarm. Das MMR war definiert als ≤ 0,1% BCR‑ABL/ABL-Quotient auf der internationalen Skala (entsprechend ≥ 3-Log-Reduktion im Vergleich zum standardisierten Ausgangswert) bei mindestens 3 000 ABL‑Transkripten gemäß Beurteilung durch das Zentrallabor. | |||
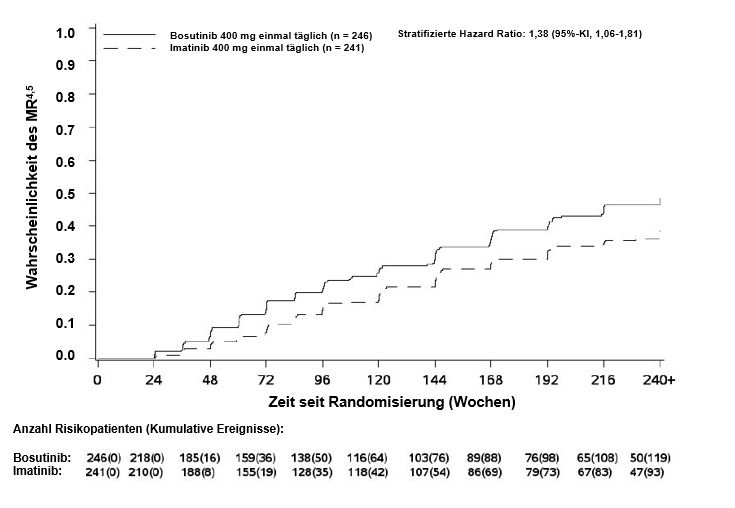
Innerhalb von 60 Monaten war in der mITT-Population der Anteil an Patienten mit MMR, MR4 und MR4,5 im Bosutinib-Arm höher als im Imatinib-Arm (Tabelle 7). Die MMR-Raten innerhalb von 60 Monaten in den Sokal-Risiko-Subgruppen sind in Tabelle 8 zusammengefasst.
Tabelle 7 – Zusammenfassung des molekularen Ansprechens innerhalb von 60 Monaten in der mITT-Population
Ansprechen |
Bosutinib |
Imatinib |
Odds Ratio |
Molekulares Ansprechen innerhalb von 60 Monaten, n (%) |
|||
MMR |
182 (74,0) |
158 (65,6) |
1,52 (1,02; 2,25) |
MR4 |
145 (58,9) |
120 (49,8) |
1,46 (1,02; 2,09) |
MR4,5 |
119 (48,4) |
93 (38,6) |
1,50 (1,05; 2,16) |
Hinweis: MMR/MR4/MR4,5 waren definiert als ≤ 0,1/0,01/0,0032 % BCR-ABL/ABL-Quotient auf der internationalen Skala (entsprechend einer Log-Reduktion von ≥ 3/4/4,5 im Vergleich zum standardisierten Ausgangswert) bei mindestens 3 000/9 800/30 990 ABL‑Transkripten gemäß Beurteilung durch das Zentrallabor.
Abkürzungen: BCR‑ABL = Breakpoint Cluster Region‑Abelson; KI = Konfidenzintervall; mITT = modifizierte intent-to-treat; MMR = gutes molekulares Ansprechen; N/ n = Anzahl Patienten.
a Adjustiert nach geografischer Region und Sokal-Risiko-Score bei Randomisierung.
Tabelle 8 – Zusammenfassung des MMR innerhalb von 60 Monaten nach Sokal-Risiko-Score in der mITT-Population
Ansprechen |
Bosutinib |
Imatinib |
Odds Ratio |
Niedriges Sokal-Risiko |
N = 86 |
N = 95 |
1,40 (0,71; 2,76) |
Intermediäres Sokal-Risiko |
N = 107 |
N = 92 |
1,37 (0,74; 2,52) |
Hohes Sokal-Risiko |
N = 53 |
N = 54 |
1,97 (0,90; 4,32) |
Hinweis: Die Prozentangaben basierten auf der Anzahl an Patienten in jedem Behandlungsarm. Das MMR war definiert als ≤ 0,1 % BCR‑ABL/ABL-Quotient auf der internationalen Skala (entsprechend ≥ 3-Log-Reduktion im Vergleich zum standardisierten Ausgangswert) bei mindestens 3 000 ABL‑Transkripten gemäß Beurteilung durch das Zentrallabor.
Abkürzungen: BCR‑ABL = Breakpoint Cluster Region‑Abelson; KI = Konfidenzintervall; mITT = modifizierte intent‑to‑treat; MMR = gutes molekulares Ansprechen; N/ n = Anzahl Patienten.
Die kumulative Inzidenz des CCyR war in der mITT-Population nach Adjustierung für das Risiko eines Behandlungsabbruchs ohne CCyR im Bosutinib‑Arm höher als im Imatinib‑Arm (83,3 % [95%‑KI: 78,1 %; 87,4 %] gegenüber 76,8 % [95%-KI: 70,9 %; 81,6 %] zum Zeitpunkt 60 Monate; Hazard Ratio [HR] nach einem stratifizierten Proportional‑Subdistributional‑Hazard‑Modell: 1,35 [95%-KI: 1,11; 1,64]). Die mediane Dauer bis zum CCyR (ausschließlich Responder) betrug im Bosutinib‑Arm 24,0 Wochen (Spanne: 11,4 bis 120,7) gegenüber 24,3 Wochen (Spanne: 11,4 bis 96,6) im Imatinib‑Arm.
Die mediane Zeit bis zum MMR, MR4 und MR4.5 (ausschließlich Responder) betrug im Bosutinib-Arm in der mITT-Population jeweils 36,1 Wochen (Spanne: 11,9 bis 241,9), 83,7 Wochen (Bereich: 12,4 bis 244,3) bzw. 108,0 Wochen (Spanne: 24,1 bis 242,1) gegenüber 47,7 Wochen (Spanne: 12,1 bis 216,1), 84,4 Wochen (Spanne: 23,6 bis 241,9) bzw. 120,4 Wochen (Spanne: 24,6 bis 240,7) im Imatinib-Arm.
Die kumulative Inzidenz des MMR, MR4 und MR4,5 nach Adjustierung für das konkurrierende Risiko eines Behandlungsabbruchs ohne Ereignis war im Bosutinib-Arm höher als im Imatinib-Arm, wie in den Abbildungen 1 bis 3 gezeigt.
Abbildung 1 – Kumulative Inzidenz des MMR (mITT-Population)

Abbildung 2 – Kumulative Inzidenz des MR4 (mITT-Population)
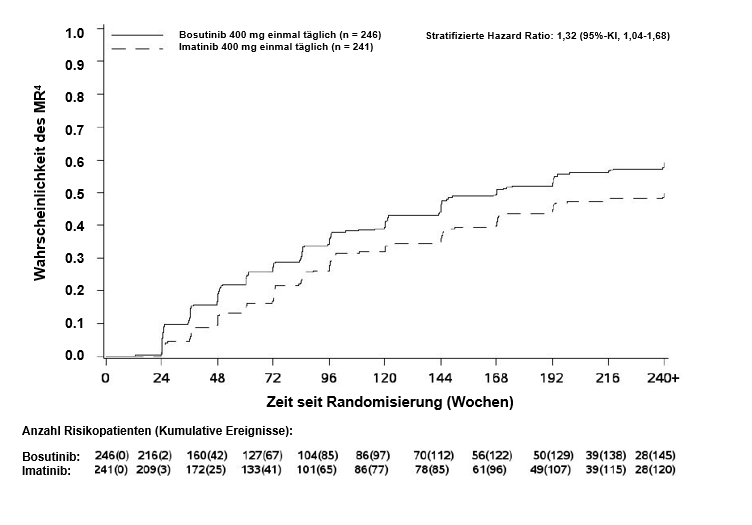
Abbildung 3 – Kumulative Inzidenz des MR4,5 (mITT-Population)
Von den Patienten in der mITT-Population, die ein CCyR erreichten, betrug die nach Kaplan-Meier-Methode geschätzte Aufrechterhaltung des Ansprechens nach 4 Jahren 97,4 % (95%-KI: 93,9 %; 98,9 %) bei Patienten im Bosutinib-Arm bzw. 93,7 % (95%-KI: 88,9 %; 96,5 %) bei Patienten im Imatinib-Arm (HR 0,39 [95%-KI: 0,14; 1,13]). Von den Patienten, die ein MMR erreichten, betrug die nach Kaplan-Meier-Methode geschätzte Aufrechterhaltung des Ansprechens nach 4 Jahren 92,2 % (95%-KI: 86,8 %; 95,4 %) bei Patienten im Bosutinib-Arm bzw. 92,0 % (95%-KI: 85,9 %; 95,5 %) bei Patienten im Imatinib-Arm (HR 1,09 [95%-KI: 0,49; 2,44]).
Innerhalb von 60 Monaten zeigten 43,9 % (95%-KI: 37,7 %; 50,1 %) der Bosutinib- bzw. 38,6 % (95%-KI: 32,4 %; 44,7 %) der Imatinib-Patienten (OR 1,24 [95%-KI: 0,87; 1,78]) in der mITT-Population eine Aufrechterhaltung des MR4, definiert durch die folgenden Kriterien: Behandlung über einen Zeitraum von mindestens 3 Jahren mit mindestens MR4 bei allen Untersuchungen innerhalb eines einjährigen Zeitraums.
Die kumulative Inzidenz von EFS-Ereignissen in der mITT-Population während der Behandlung betrug zum Zeitpunkt 60 Monate 6,9 % (95%-KI: 4,2 %; 10,5 %) im Bosutinib-Arm und 10,4 % (95%-KI: 6,9 %; 14,6 %) im Imatinib-Arm (HR 0,64, 95%-KI: 0,35; 1,17).
Das nach Kaplan‑Meier-Methode geschätzte OS zum Zeitpunkt 60 Monate für Bosutinib- bzw. Imatinib‑Patienten in der mITT‑Population betrug 94,9 % (95%-KI: 91,1 %; 97,0 %) bzw. 94,0 % (95%-KI: 90,1 %; 96,4 %, (HR 0,80; 95%-KI: 0,37; 1,73).
In einer retrospektiven Analyse erreichten von den auswertbaren Patienten in der ITT-Population mehr Patienten im Bosutinib-Arm [200 von 248 (80,6 %)] ein frühes molekulares Ansprechen (BCR‑ABL-Transkriptlevel zum Zeitpunkt Monat 3 ≤ 10 %) verglichen mit Patienten im Imatinib-Arm [153 von 253 (60,5 %), OR 2,72 (95%-KI: 1,82; 4,08)]. MMR und EFS-Ereignisse zum Zeitpunkt 60 Monate bei Bosutinib-Patienten mit und ohne frühes molekulares Ansprechen sind in Tabelle 9 zusammengefasst.
Tabelle 9 – Ergebnisse zum Zeitpunkt 60 Monate bei Bosutinib-Patienten mit BCR-ABL ≤ 10 % gegenüber > 10 % zum Zeitpunkt 3 Monate in der ITT-Population
Bosutinib (N = 248) |
Patienten mit BCR‑ABL ≤ 10 % zum Zeitpunkt 3 Monate |
Patienten mit BCR‑ABL > 10 % zum Zeitpunkt 3 Monate |
Hazard Ratio |
Kumulative Inzidenz des MMR, % (95%-KI) |
84,0 (78,1; 88,4) |
56,5 (41,1; 69,4) |
2,67 (1,90; 3,75) |
Kumulative Inzidenz von EFS-Ereignissen, % (95%-KI) |
5,5 (2,9; 9,3) |
12,5 (5,1; 23,4) |
0,40 (0,14; 1,17) |
Abkürzungen: BCR‑ABL = Breakpoint Cluster Region‑Abelson; KI = Konfidenzintervall; ITT = intent‑to‑treat; MMR = gutes molekulares Ansprechen; EFS = ereignisfreies Überleben; N = Anzahl Patienten mit ≥ 3 000 ABL-Kopien zum Zeitpunkt Monat 3.
a Adjustiert nach geografischer Region und Sokal-Risiko-Score bei Randomisierung.
Zum Zeitpunkt 60 Monate war die Zahl der Patienten in der mITT-Population mit neu nachweisbaren Mutationen im Bosutinib-Arm (6 [2,4 %]) niedriger als im Imatinib-Arm (12 [5,0 %]).
Klinische Phase-I/II-Studie bei Patienten mit CML in der CP, AP oder BK, die gegenüber Imatinib resistent oder intolerant sind
Es wurde eine einarmige, offene, multizentrische Phase-I/ II-Studie durchgeführt, um die Wirksamkeit und Sicherheit von Bosutinib 500 mg (einmal täglich) bei Patienten mit CML, die gegenüber Imatinib resistent oder intolerant sind, mit separaten Kohorten für CML in der chronischen Phase, akzelerierten Phase und Blastenkrise zu belegen, die zuvor mit 1 TKI (Imatinib) oder mehr als 1 TKI (zuerst Imatinib, danach Dasatinib und/ oder Nilotinib) behandelt worden waren.
In dieser Studie wurden 570 Patienten mit Bosutinib behandelt. Eingeschlossen waren Patienten mit CML in der chronischen Phase, die zuvor mit nur 1 TKI (Imatinib) behandelt worden waren, Patienten mit CML in der chronischen Phase, die zuvor mit Imatinib und mindestens 1 zusätzlichen TKI (Dasatinib und/ oder Nilotinib) behandelt worden waren, Patienten mit CML in der akzelerierten Phase oder in der Blastenkrise, die zuvor mit mindestens 1 TKI (Imatinib) behandelt worden waren, und Patienten mit Ph+ ALL, die zuvor mit mindestens 1 TKI (Imatinib) behandelt worden waren.
Der primäre Wirksamkeitsendpunkt der Studie war die Rate guten zytogenetischen Ansprechens (major cytogenetic response, MCyR) nach 24 Wochen bei Patienten mit CML in der chronischen Phase, die gegenüber Imatinib resistent waren und zuvor mit nur 1 TKI (Imatinib) behandelt worden waren. Weitere Wirksamkeitsendpunkte waren die kumulativen zytogenetischen und molekularen Ansprechraten, die Zeit bis zum Erreichen und die Dauer des zytogenetischen und molekularen Ansprechens, das Ansprechen bei Mutationen zum Zeitpunkt der Eingangsuntersuchung, der Übergang in die akzelerierte Phase oder Blastenkrise sowie progressionsfreies Überleben und OS für alle Kohorten.
Patienten, die am Ende der Phase-I/II-Studie weiterhin Bosutinib erhielten und nach Einschätzung des Prüfarztes von der Bosutinib-Behandlung profitierten, sowie Patienten, die Bosutinib in der Phase-I/II-Studie bereits abgesetzt hatten und sich in der Langzeitnachbeobachtung des Überlebens befanden oder die Phase-I/II-Studie abgeschlossen hatten, waren für die Aufnahme in die Anschlussstudie geeignet. Jeder Patient blieb in der Anschlussstudie entweder unter Bosutinib-Behandlung oder in der Langzeitbeobachtung des Überlebens, bis eine 10‑jährige Nachbeobachtung des letzten Patienten abgeschlossen war, gerechnet ab dem Datum des Erhalts der ersten Bosutinib‑Dosis in der Phase‑I/II-Studie.
Wirksamkeitsendpunkte der Anschlussstudie umfassten die Dauer des zytogenetischen und des molekularen Ansprechens, den Übergang in die AP/ BK, progressionsfreies Überleben und OS.
Die Wirksamkeitsanalysen schlossen Daten aus der abgeschlossenen Anschlussstudie ein.
CML-Patienten in der CP
Die Wirksamkeitsergebnisse für Patienten mit Ph+ CML in der CP, die zuvor mit Imatinib und mindestens 1 zusätzlichen TKI (Beobachtungszeitraum mindestens 120 Monate; mediane Behandlungsdauer: 9 Monate [Spanne: 0,23 bis 164,28 Monate] und jeweils 20,2 % und 7,6 % nach 60 bzw. 120 Monaten noch in Behandlung) behandelt worden waren, sowie die Ergebnisse für Patienten mit Ph+ CML in der CP, die zuvor nur mit Imatinib (Beobachtungszeitraum mindestens 120 Monate; mediane Behandlungsdauer: 26 Monate [Spanne: 0,16 bis 170,49 Monate] und jeweils 40,5 % und 19,4 % nach 60 bzw. 120 Monaten noch in Behandlung) behandelt worden waren, sind in Tabelle 9 aufgeführt.
CML-Patienten in der AP und BK
Die Wirksamkeitsergebnisse für Patienten mit Ph+ CML in der AP (Beobachtungszeitraum mindestens 120 Monate; mediane Behandlungsdauer: 10 Monate [Spanne: 0,10 bis 156,15 Monate] und jeweils 12,7 % und 7,6 % nach 60 bzw. 120 Monaten noch in Behandlung) und in der Blastenkrise (Beobachtungszeitraum mindestens 120 Monate; mediane Behandlungsdauer: 2,8 Monate [Spanne: 0,03 bis 71,38 Monate] und jeweils 3,1 % und 0 % nach 60 bzw. 120 Monaten noch in Behandlung) sind in Tabelle 10 aufgeführt.
Tabelle 10 - Ergebnisse zur Wirksamkeit bei vorbehandelten Patienten mit CML in der chronischen und fortgeschrittenen Phase*
Ph+ CML in der chronischen Phase, nur mit Imatinib vorbehandelt |
Ph+ CML in der chronischen Phase, mit Imatinib und Dasatinib oder Nilotinib vorbehandelt |
Akzelerierte Phase, |
Blastenphase, mindestens mit Imatinib vorbehandelt |
|
Kumulatives zytogenetisches Ansprechena |
N = 262 |
N = 112 |
N = 72 |
N = 54 |
|
MCyR, % (95%-KI) CCyR, % (95%-KI) |
59,9 (53,7; 65,9) 49,6 (43,4; 55,8) |
42,0 (32,7; 51,7) |
40,3 (28,9; 52,5) |
37,0 (24,3; 51,3) 27,8 (16,5; 41,6) |
Kumulatives molekulares Ansprechena |
N = 197 |
N = 107 |
N = 54 |
N = 48 |
|
MMR, % (95%-KI) MR4, % (95%-KI) |
42,1 (35,1; 49,4) 37,1 (30,3; 44,2) |
17,8 (11,0; 26,3) |
16,7 (7,9; 29,3) |
10,4 (3,5; 22,7) 10,4 (3,5; 22,7) |
Zeit bis zum MCyR ausschließlichb für Responder, Median (Spanne), Wochen |
12,3 (4,0; 346,0) |
12,3 (3,9; 550,6) |
12,0 (3,9; 144,7) |
8,2 (3,9; 25,1) |
Dauer des MCyRb |
N = 157 |
N = 47 |
N = 29 |
N = 20 |
K.-M.-Schätzung zum Zeitpunkt 5 Jahre, % (95%-KI)c |
70,7 (63,1; 78,3) |
66,6 (51,5; 81,7) |
40,8 (20,9; 60,7) |
21,2 (0,1; 42,3) |
K.-M.-Schätzung zum Zeitpunkt 10 Jahre, % (95%-KI)c |
65,3 (56,6; 74,0) |
55,3 (36,3; 74,4) |
40,8 (20,9; 60,7) |
NE |
Median, Wochen (95%‑KI) |
NR |
NR |
84,0 (24,0; NE) |
29,1 (11,9; 38,3) |
Zeit bis zum CCyR ausschließlichb für Responder, Median (Spanne), Wochen |
24,0 (7,7; 240,6) |
24,0 (11,6; 216,0) |
23,8 (4,1; 120,0) |
8,4 (3,9; 25,1) |
Dauer des CCyRb |
N = 130 |
N = 36 |
N = 22 |
N = 15 |
K.-M.-Schätzung zum Zeitpunkt 5 Jahre, % (95%-KI)c |
69,7 (61,3; 78,2) |
54,4 (36,7; 72,1) |
40,0 (18,5; 61,5) |
24,9 (0,9; 48,9) |
K.-M.-Schätzung zum Zeitpunkt 10 Jahre, % (95%-KI)c |
63,4 (54,0; 72,8) |
40,8 (22,0; 59,6) |
40,0 (18,5; 61,5) |
NE |
Median, Wochen (95%‑KI) |
NR |
252,0 (24,0; NE) |
72,0 (36,1; NE) |
20,0 (9,1; 29,6) |
Zeit bis zum MMR ausschließlichb für Responder, Median (Spanne), Wochen |
35,6 (3,1; 367,1) |
12,4 (4,0; 171,7) |
36,1 (12,1; 144,1) |
4,7 (3,9; 168,9) |
Dauer des MMRb |
N = 83 |
N = 19 |
N = 9 |
N = 5 |
K.-M.-Schätzung zum Zeitpunkt 5 Jahre, % (95%-KI)c |
74,1 (64,2; 83,9) |
70,0 (47,5; 92,5) |
66,7 (35,9; 97,5) |
60,0 (17,1; 100,0) |
K.-M.-Schätzung zum Zeitpunkt 10 Jahre, % (95%-KI)c |
63,4 (50,2; 76,6) |
70,0 (47,5; 92,5) |
66,7 (35,9; 97,5) |
NE |
Median, Wochen (95%‑KI) |
NR |
NR |
NR |
NR |
Zeit bis zum MR4 ausschließlichb für Responder, Median (Spanne), Wochen |
28,0 (3,1; 583,1) |
23,8 (4,0; 240,1) |
24,1 (22,9; 96,0) |
4,7 (3,9; 284,9) |
Dauer des MR4b,e |
N = 73 |
NA |
NA |
NA |
K.-M.-Schätzung zum Zeitpunkt 5 Jahre, % (95%-KI)c |
74,7 (64,2; 85,2) |
|||
K.-M.-Schätzung zum Zeitpunkt 10 Jahre, % (95%-KI)c |
60,8 (46,1; 75,4) |
|||
Median, Wochen (95%‑KI) |
NR |
|||
Übergang in die AP/ BKc |
N = 284 |
N = 119 |
N = 79 |
NA |
Progressionsfreies Überlebenc |
N = 284 |
N = 119 |
N = 79 |
N = 64 |
KumInz, zum Zeitpunkt 5 Jahre, % |
19,7 (15,6; 24,9) |
24,4 (17,8; 33,4) |
41,8 (32,2; 54,2) |
67,2 (56,6; 79,7) |
KumInz, zum Zeitpunkt 10 Jahre, % |
23,9 (19,5; 29,5) |
26,9 (20,0; 36,2) |
41,8 (32,2; 54,2) |
NE |
Gesamtüberlebenc |
N = 284 |
N = 119 |
N = 79 |
N = 64 |
K.-M.-Schätzung, zum Zeitpunkt 5 Jahre, % |
83,5 (78,7; 88,3) |
74,1 (64,8; 83,4) |
58,5 (46,9; 70,2) |
22,5 (7,1; 37,9) |
K.-M.-Schätzung, zum Zeitpunkt 10 Jahre, % |
71,5 (64,4; 78,7) |
60,4 (47,2; 73,7) |
50,7 (36,5; 65,0) |
22,5 (7,1; 37,9) |
Median, Monate (95%‑KI) |
NR |
NR |
NR |
10,9 (8,7; 19,7) |
Datum der Dateneinsicht: Phase-I/II-Studie: 02. Oktober 2015, Anschlussstudie: 02. September 2020
Kriterien für zytogenetisches Ansprechen: MCyR beinhaltete komplettes [0 % Ph+ Metaphasen im Knochenmark oder < 1 % positive Zellen aus Fluoreszenz-in-situ-Hybridisierung (FISH)] oder partielles (1 bis 35 %) zytogenetisches Ansprechen. Das zytogenetische Ansprechen basierte auf dem prozentualen Anteil an Ph+ Metaphasen unter ≥ 20 Metaphase-Zellen in jeder Knochenmarkprobe. Eine FISH-Analyse (≥ 200 Zellen) konnte für zytogenetische Beurteilungen nach der Eingangsuntersuchung angewendet werden, wenn ≥ 20 Metaphasen nicht verfügbar waren. In der Anschlussstudie wurde die CCyR auf Grundlage der MMR imputiert, wenn eine valide zytogenetische Beurteilung an einem bestimmten Datum nicht verfügbar war.
Kriterien für molekulares Ansprechen: In der Phase I/II-Studie war das MMR/MR4 definiert als ≤ 0,1/0,01 % BCR-ABL-Transkripte gemäß Beurteilung durch ein Zentrallabor (nicht auf der internationalen Skala). In der Anschlussstudie wurde das MMR/MR4 der Responser auf dem Prüfbogen (Case Report Form, CRF) gemäß Beurteilung durch ein lokales Labor angegeben.
Abkürzungen: AP = akzelerierte Phase; BK = Blastenkrise; Ph+ = Philadelphia‑Chromosom‑positiv; CP = chronische Phase; CML = chronische myeloische Leukämie; K.‑M. = Kaplan-Meier; N = Anzahl Patienten; NA = nicht zutreffend (not applicable); NR = im kürzesten Beobachtungszeitraum nicht erreicht (not reached); NE = nicht schätzbar (not estimable); KI = Konfidenzintervall; MCyR = gutes zytogenetisches Ansprechen; CCyR = komplettes zytogenetisches Ansprechen; KumInz = kumulative Inzidenz; MMR = gutes molekulares Ansprechen, BCR-ABL = Breakpoint Cluster Region-Abelson.
a Beinhaltet Patienten (N) mit einer validen Beurteilung der Eingangsuntersuchung für zytogenetische Untersuchungen und Patienten außerhalb Chinas, Südafrikas, Indiens oder Russlands für molekulare Untersuchungen, da die Proben in diesen Ländern nicht für molekulare Untersuchungen exportiert werden konnten. Diese Analysen ließen es zu, dass Patienten, die zur Eingangsuntersuchung ein Ansprechen zeigten und dieses Ansprechen nach der Eingangsuntersuchung aufrechterhielten, als Responder aufgenommen wurden. Beobachtungszeitraum mindestens (Zeit von der ersten Dosis des letzten Patienten bis zum Datum der Dateneinsicht) 120 Monate.
b Beinhaltet Patienten (N), die ein Ansprechen erreichten oder aufrechterhielten.
c Beinhaltet Patienten (N), die mindestens eine Dosis Bosutinib erhielten.
d Kumulative Inzidenzanalyse mit Anpassung an das konkurrierende Risiko eines Behandlungsabbruchs ohne Ereignis.
e Nicht analyisiert für Gruppen mit begrenzter Anzahl.
Das Gesamtüberleben in den CP-, AP- und BK-Kohorten ist in Abbildung 4 graphisch dargestellt.
Abbildung 4– Kaplan-Meier-Schätzung des Gesamtüberlebens (OS) in CP2L, CP3L, AP und BK
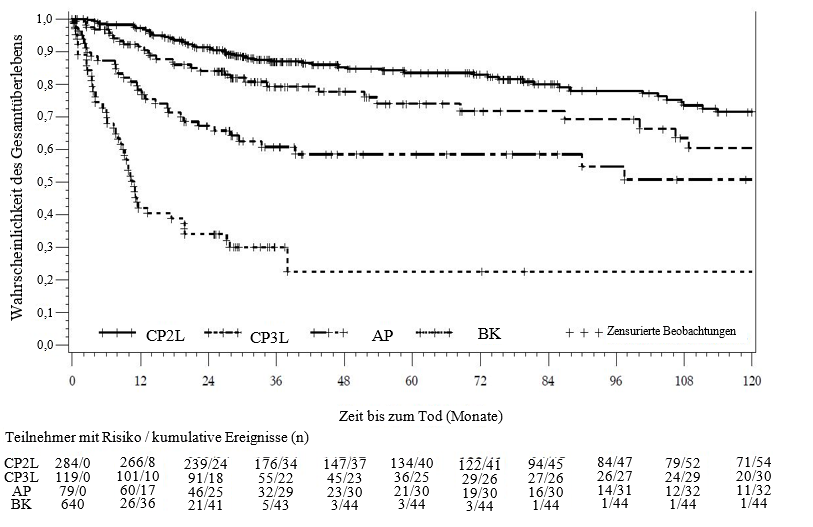
Basierend auf den limitierten klinischen Informationen aus der Phase-I/ II-Studie wurden einige Hinweise für klinische Aktivität bei Patienten mit BCR‑ABL-Mutationen (siehe Tabelle 11) gefunden.
Tabelle 11 - Ansprechen auf Therapie in Abhängigkeit vom Typ der BCR‑ABL-Mutation zum Zeitpunkt des Studieneinschlusses in der auswertbaren CML-Population (chronische Phase): | ||
Status der BCR‑ABL-Mutation zum Zeitpunkt der Eingangsuntersuchung |
Inzidenz zum Zeitpunkt der Eingangsuntersuchung n (%)a |
MCyR erreicht oder gehalten |
Bewertete Mutationen |
98 (100,0) |
36/92 (39,1) |
keine Mutation |
59 (60,2) |
23/55 (41,8) |
mindestens 1 Mutation |
39 (39,8) |
13/37 (35,1) |
Dasatinib-Resistenz-Mutationen |
10 (10,2) |
1/9 (11,1) |
E255K/ V |
2 (2,0) |
0/2 |
F317L |
8 (8,2) |
1/7 (14,3) |
Nilotinib-Resistenz-Mutationenc |
13 (13,3) |
8/13 (61,5) |
Y253H |
6 (6,1) |
5/6 (83,3) |
E255K/ V |
2 (2,0) |
0/2 |
F359C/I/V |
7 (7,1) |
5/7 (71,4) |
Datum der Dateneinsicht: Phase-I/II-Studie: 02. Oktober 2015, Anschlussstudie: 02. September 2020
Hinweis: Die Mutationen zum Zeitpunkt der Eingangsuntersuchung wurden identifiziert, bevor der Patient die 1. Dosis der Studienmedikation erhielt.
Abkürzungen: BCR‑ABL = Breakpoint Cluster Region‑Abelson; CP = chronische Phase; CML = chronische myeloische Leukämie; MCyR = gutes zytogenetisches Ansprechen; N/ n = Anzahl Patienten; Resp = Responder; Eval = evaluierbar (auswertbar).
a Der Anteil basiert auf der Anzahl Patienten mit Bewertung des Mutationsstatus zur Eingangsuntersuchung.
b Die auswertbare Population umfasst Patienten mit einer validen Krankheitsbewertung zum Zeitpunkt der Eingangsuntersuchung.
c 2 Patienten hatten mehr als eine Mutation in dieser Kategorie.
Ein Patient mit der E225V-Mutation, der zuvor mit Nilotinib behandelt wurde, erreichte ein CHR als bestes Ansprechen.
In-vitro-Tests ergaben, dass Bosutinib nur marginale Aktivität gegenüber der T315I- oder der V299L-Mutation besitzt. Daher ist eine klinische Aktivität bei Patienten mit diesen Mutationen nicht zu erwarten.
Klinische Phase-IV-Studie zu Ph+ CML bei Patienten, die zuvor mit mindestens 1 TKI behandelt wurden
Es wurde eine einarmige, offene, nicht randomisierte, multizentrische Phase‑IV‑Studie zur Bewertung der Wirksamkeit und Sicherheit von Bosutinib 500 mg einmal täglich bei Patienten mit TKI‑resistenter oder TKI‑intoleranter CML mit separaten Kohorten für Erkrankungen in der CP, AP oder BK, die zuvor mit mindestens 1 TKI behandelt worden waren, durchgeführt.
In der Studie wurden 163 Patienten mit Bosutinib behandelt, davon 46 Patienten mit Ph+ CML in der CP, die zuvor mit 1 TKI (Imatinib, Dasatinib oder Nilotinib) behandelt worden waren, 61 Patienten mit Ph+ CML in der CP, die zuvor mit 2 TKI (Imatinib und/oder Dasatinib und/oder Nilotinib) behandelt worden waren, 49 Patienten mit Ph+ CML in der CP, die zuvor mit 3 TKI (Imatinib, Dasatinib und Nilotinib) behandelt worden waren, 4 Patienten mit Ph+ CML in der AP, die zuvor mit mindestens 1 TKI (2 Patienten mit 2 vorhergehenden TKI und 2 Patienten mit 3 vorhergehenden TKI) behandelt worden waren, und 3 Patienten mit Ph- CML, die zuvor mit mindestens 1 TKI behandelt worden waren.
Primärer Wirksamkeitsendpunkt war das kumulative bestätigte MCyR nach 1 Jahr (Woche 52) bei Patienten mit Ph+ CML in der CP, die zuvor mit 1 oder 2 TKI behandelt worden waren, und bei Patienten mit Ph+ CML in der CP, die zuvor mit 3 TKI behandelt worden waren. Bei Patienten mit Ph+ CML in der AP und BK mit beliebiger vorhergehender TKI-Therapie war der primäre Wirksamkeitsendpunkt das kumulative bestätigte hämatologische Gesamtansprechen (overall haematological response, OHR) nach 1 Jahr (Woche 52). Weitere Wirksamkeitsendpunkte bei Patienten mit Ph+ CML in der CP waren das kumulative zytogenetische und molekulare Ansprechen, die Dauer des zytogenetischen und molekularen Ansprechens, das Ansprechen bei Mutationen zum Zeitpunkt der Eingangsuntersuchung, der Übergang in die AP/ BK sowie PFS und OS. Zu den zusätzlichen Endpunkten in der Ph+ AP/ BK-Kohorte gehörten die kumulativen zytogenetischen und molekularen Ansprechraten sowie PFS und OS.
CML-Patienten in der CP
Der primäre Endpunkt der kumulativen bestätigen MCyR-Rate nach 1 Jahr (52 Wochen) betrug 76,5 % (95%-KI: 66,9; 84,5) bei Patienten, die zuvor 1 oder 2 TKI erhalten hatten, und 62,2 % (95%-KI: 46,5; 76,2) bei Patienten, die zuvor 3 TKI erhalten hatten.
Zusätzliche Wirksamkeitsergebnisse beim Abschluss der Studie nach einem Beobachtungszeitraum von mindestens 3 Jahren bei Patienten mit Ph+ CML in der CP, die zuvor 1 TKI (mediane Behandlungsdauer: 47,5 Monate [Spanne: 0,9 bis 50,1 Monate] und 60,9 % noch in Behandlung), 2 TKI (mediane Behandlungsdauer: 41,9 Monate [Spanne: 0,4 bis 48,9 Monate] und 45,9 % noch in Behandlung) bzw. 3 TKI (mediane Behandlungsdauer: 20,0 Monate [Spanne: 0,2 bis 48,9 Monate] und 38,8 % noch in Behandlung) erhalten hatten, sind in Tabelle 12 dargestellt.
Tabelle 12 – Ergebnisse zur Wirksamkeit bei vorbehandelten Patienten mit Ph+ CML in der chronischen Phase
Ph+ CML in der CP mit 1 TKI-Vorbehandlung |
Ph+ CML in der CP mit 2 TKI-Vorbehandlungen |
Ph+ CML in der CP mit 3 TKI-Vorbehandlungen |
Gesamtkohorte mit Ph+ CML in der CP |
|
Kumulatives bestätigtes MCyRa nach 1 Jahr, % (95%-KI) |
N = 43 |
N = 55 |
N = 45 |
N = 143 |
83,7 (69,3; 93,2) |
70,9 (57,1; 82,4) |
62,2 (46,5; 76,2) |
72,0 (63,9; 79,2) |
|
Kumulatives zytogenetisches Ansprechena,b |
N = 43 |
N = 55 |
N = 45 |
N = 143 |
MCyR, % (95%-KI) |
88,4 (74,9; 96,1) |
85,5 (73,3; 93,5) |
77,8 (62,9; 88,8) |
83,9 (76,9; 89,5) |
CCyR, % (95%-KI) |
86,0 (72,1; 94,7) |
83,6 (71,2; 92,2) |
73,3 (58,1; 85,4) |
81,1 (73,7; 87,2) |
Kumulatives molekulares Ansprechena,b |
N = 46 |
N = 55 |
N = 48 |
N = 149 |
MMR, % (95%-KI) |
82,6 (68,6; 92,2) |
76,4 (63,0; 86,8) |
56,3 (41,2; 70,5) |
71,8 (63,9; 78,9) |
MR4, % (95%-KI) |
73,9 (58,9; 85,7) |
63,6 (49,6; 76,2) |
41,7 (27,6; 56,8) |
59,7 (51,4; 67,7) |
MR4,5, % (95%-KI) |
58,7 (43,2; 73,0) |
50,9 (37,1; 64,6) |
35,4 (22,2; 50,5) |
48,3 (40,1; 56,6) |
Zeit bis zum zytogenetischen Ansprechen ausschließlich für Responder,b Median (Spanne), Monate |
||||
MCyR |
3,0 (1,0; 11,8) |
2,9 (0,3; 6,4) |
3,0 (1,8; 8,8) |
3,0 (0,3; 11,8) |
CCyR |
3,0 (1,0; 17,6) |
2,9 (0,3; 6,4) |
3,0 (1,8; 8,8) |
3,0 (0,3; 17,6) |
Dauer des zytogenetischen Ansprechensb |
||||
MCyR, K.-M.-Schätzung zum Zeitpunkt 3 Jahre, % (95%-KI) |
96,6 (77,9; 99,5) |
94,4 (79,2; 98,6) |
96,9 (79,8; 99,6) |
95,6 (88,7; 98,4) |
CCyR, K.-M.-Schätzung zum Zeitpunkt 3 Jahre, % (95%-KI) |
96,4 (77,2; 99,5) |
94,4 (79,2; 98,6) |
100,0 (100,0; 100,0) |
96,5 (89,5; 98,9) |
Zeit bis zum molekularen Ansprechen ausschließlich für Responder, Median (Spanne), Monate |
||||
MMR |
3,0 (2,8; 23,3) |
3,0 (1,0; 35,9) |
3,1 (1,8; 9,3) |
3,0 (1,0; 35,9) |
MR4 |
6,0 (2,8; 47,4) |
3,1 (1,0; 36,1) |
3,2 (1,8; 47,9) |
5,5 (1,0; 47,9) |
MR4,5 |
9,2 (2,8; 47,6) |
6,0 (2,8; 36,2) |
5,8 (1,8; 18,0) |
6,0 (1,8; 47,6) |
Dauer des molekularen Ansprechensb |
||||
MMR, K.-M.-Schätzung zum Zeitpunkt 3 Jahre, % (95%-KI) |
90,7 (73,9; 96,9) |
81,5 (63,2; 91,3) |
90,2 (65,9; 97,5) |
87,2 (78,0; 92,7) |
MR4, K.-M.-Schätzung zum Zeitpunkt 3 Jahre, % (95%-KI) |
89,5 (70,9; 96,5) |
68,7 (48,0; 82,5) |
85,2 (51,9; 96,2) |
80,7 (69,4; 88,1) |
Datum der Dateneinsicht: 23. November 2020. | ||||
Die kumulative Inzidenz des MMR, MR4 und MR4,5 nach Adjustierung für das konkurrierende Risiko eines Behandlungsabbruchs ohne Ereignis ist in Abbildung 5 gezeigt.
Abbildung 5 – Kumulative Inzidenz des molekularen Ansprechens (auswertbare Population in der CP)
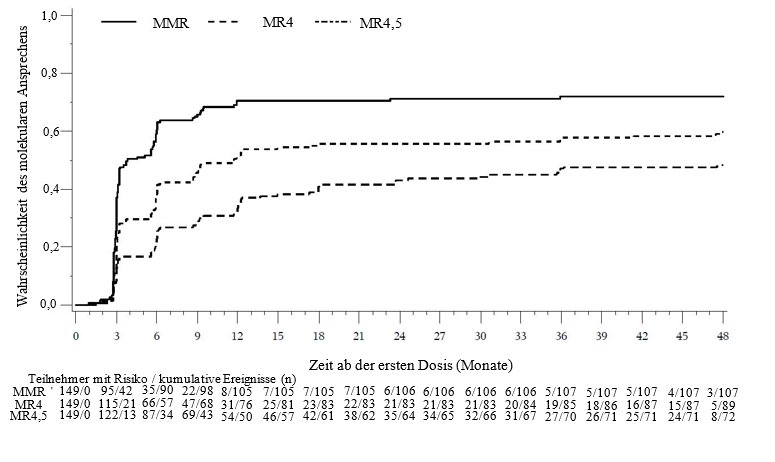
Das erreichte molekulare Ansprechen nach Behandlungsart ist in der Tabelle 13 gezeigt.
Tabelle 13 – Erreichtes molekulares Ansprechen
Ph+ CML in der CP mit 1 TKI-Vorbehandlung |
Ph+ CML in der CP mit 2 TKI-Vorbehandlungen |
Ph+ CML in der CP mit 3 TKI-Vorbehandlungen |
Gesamtkohorte mit Ph+ CML in der CP |
|
Patienten ohne MMR bei Studienbeginna |
N = 25 |
N = 28 |
N = 26 |
N = 79 |
MMR, % (95%-KI) |
76,0 (54,9; 90,6) |
64,3 (44,1; 81,4) |
38,5 (20,2; 59,4) |
59,5 (47,9; 70,4) |
Patienten ohne MR4 bei Studienbeginna |
N = 37 |
N = 38 |
N = 37 |
N = 112 |
MR4, % (95%-KI) |
70,3 (53,0; 84,1) |
55,3 (38,3; 71,4) |
32,4 (18,0; 49,8) |
52,7 (43,0; 62,2) |
Patienten ohne MR4,5 bei Studienbeginna |
N = 42 |
N = 46 |
N = 43 |
N = 131 |
MR4,5, % (95%-KI) |
54,8 (38,7; 70,2) |
43,5 (28,9; 58,9) |
30,2 (17,2; 46,1) |
42,7 (34,1; 51,7) |
Patienten mit MMR bei Studienbeginna |
N = 21 |
N = 27 |
N = 22 |
N = 70 |
Besseres MR, % (95%-KI) |
85,7 (63,7; 97,0) |
66,7 (46,0; 83,5) |
63,6 (40,7; 82,8) |
71,4 (59,4; 81,6) |
Datum der Dateneinsicht: 23Nov2020.
Abkürzungen: Ph+ = Philadelphia-Chromosomen‑positiv; CP = chronische Phase; CML = chronische myeloische Leukämie; N = Anzahl Patienten; KI = Konfidenzintervall; MMR = gutes molekulares Ansprechen; MR = molekulares Ansprechen; MR4 = ≥ 4 Log‑Reduktion der BCR‑ABL-Transkripte im Vergleich zum standardisierten Ausgangswert; MR4,5 = ≥ 4,5‑Log-Reduktion der BCR‑ABL-Transkripte im Vergleich zum standardisierten Ausgangswert.
a Beinhaltet Patienten (n) mit einer validen Beurteilung der Eingangsuntersuchung. Um als Responder zu gelten, müssen Patienten ein verbessertes Ansprechen gegenüber dem Ausgangswert erreicht haben. Kriterien für molekulares Ansprechen: MMR, MR4 und MR4,5 waren definiert als jeweils ≤ 0,1 %, ≤ 0,01 % und ≤ 0,0032 % BCR-ABL/ABL-Quotient auf der internationalen Skala (entsprechend einer Log-Reduktion von jeweils ≥ 3, ≥ 4 und ≥ 4,5 im Vergleich zum standardisierten Ausgangswert), bei jeweils mindestens 10 000, 10 000 und 32 000 ABL-Transkripten, gemessen vom Zentrallabor.
Bei Patienten in der CP gab es während der Behandlung keine Progression in die AP oder BK der CML.
CML-Patienten in der AP
Bei Patienten mit Ph+ CML in der AP betrug die mediane Behandlungsdauer 22,1 Monate (Spanne: 1,6 bis 50,1 Monate) und das kumulative bestätigte OHR nach 1 Jahr (52 Wochen) 75,0 % (95%-KI: 19,4; 99,4). Letzteres galt auch für die CCyR-Rate. Bei allen 3 Patienten blieb das CCyR unter der Therapie erhalten.
Ansprechen nach BCR ABL-Mutationen zum Zeitpunkt der Eingangsuntersuchung
Zehn Patienten in der CP-Kohorte wiesen bei Studienbeginn Mutationen auf (A365V, E453K, E255K, E255V, Q252H, L298V [jeweils n = 1] sowie Y253F und G250E [jeweils n = 2]). Bei einem Patienten in der CP-Kohorte wurde an Studientag 8 eine F359I-Mutation festgestellt. Ein Patient in der AP-Kohorte hatte beim Studieneinschluss 2 Mutationen (F311L und L387F). In der CP-Kohorte wurde bei Patienten mit Mutationen bei 4/11 Patienten (36,4 %) ein molekulares Ansprechen festgestellt. Ein Patient mit einer E255V-Mutation erreichte ein MMR, und 3 Patienten mit den Mutationen F359I, Y253F und A365V erreichten jeweils ein MR4,5. Bei dem Patienten mit den Mutationen in der AP-Kohorte wurde kein Ansprechen erreicht.
Kinder und Jugendliche
Die Wirksamkeit von Bosulif bei pädiatrischen Patienten wurde in der BCHILD-Studie „Eine Phase-I/II-Studie zu Bosutinib bei pädiatrischen Patienten mit neu diagnostizierter Ph+ CML in der chronischen Phase oder mit Ph+ CML mit Resistenz/Unverträglichkeit“ untersucht.
Die BCHILD-Studie ist eine multizentrische, internationale, einarmige, offene Phase-I/II-Studie zur Bestimmung einer empfohlenen Dosis Bosutinib zum Einnehmen einmal täglich bei pädiatrischen Patienten (im Alter von 1 bis < 18 Jahren) mit neu diagnostizierter Ph+ CML in der chronischen Phase (ND-CML) oder Ph+ CML, die zuvor mit mindestens einem TKI behandelt wurden (R/I-CML), und um eine vorläufige Einschätzung der Sicherheit, Verträglichkeit und Wirksamkeit zu erhalten und die Pharmakokinetik von Bosutinib in dieser Patientenpopulation zu untersuchen.
Pädiatrische Patienten mit neu diagnostizierter Ph+ CML in der CP
Die Wirksamkeit von Bosulif bei pädiatrischen Patienten mit neu diagnostizierter Ph+ CML in der CP (CP1L) wurde als Teil der BCHILD-Studie untersucht. Im Phase-II-Dosisexpansionsteil erhielten 30 Patienten mit ND-CML Bosutinib in einer Dosis von 300 mg/m2 einmal täglich. Die mediane Dauer der Nachbeobachtung im Hinblick auf das Gesamtüberleben in der Gesamtkohorte (N = 30) betrug bei ND-CML-Patienten 21,91 (1,08; 45,11) Monate, und die mediane Behandlungsdauer betrug 13,68 (0,20; 43,70). Das kumulative zytogenetische und molekulare Ansprechen zu einem beliebigen Zeitpunkt bei Patienten mit ND-CML ist in Tabelle 15 zusammenfassend dargestellt. Von den Respondern trat bei einem Patienten ein Verlust des CCyR und des MCyR auf.
Von den auswertbaren ND-Patienten (ABL-Kopien ≥ 10 000) wiesen 81,08 % (95%-KI: 64,2; 97,7) nach 3 Monaten einen BCR-ABL-Quotienten von ≤ 10 %, und 62,5 % (95%-KI: 38,8; 86,2) einen BCR-ABL-Quotienten von ≤ 1 % nach 6 Monaten auf.
Es gab keine Todesfälle in der ND-Kohorte und keine Progression in die AP oder BK.
Pädiatrische Ph+ CML-Patienten mit Resistenz oder Unverträglichkeit gegenüber Imatinib in der CP
Die Wirksamkeit von Bosulif bei pädiatrischen Patienten mit Ph+ CML mit Resistenz oder Unverträglichkeit wurde als Teil der BCHILD-Studie untersucht.
Im Dosiseskalationsteil der Phase I erhielten 28 Patienten mit R/I-CML Bosutinib in Dosen von 300 bis 400 mg/m2 einmal täglich. 6 Patienten waren im Phase-II-Teil eingeschlossen (400 mg/m2).
Tabelle 14 – Demografische Merkmale von CML-Patienten
Phase 1 |
Phase 1 |
Phase 1 |
Phase 2 CP1L |
Phase 2 R/I |
|
Alter (Jahre), n (%) |
|||||
≥ 1‑< 6 |
2 (33,3) |
2 (18,2) |
0 |
2 (6,7) |
0 |
≥ 6‑< 12 |
3 (50,0) |
4 (36,4) |
3 (27,3) |
10 (33,3) |
1 (16,7) |
≥ 12‑< 18 |
1 (16,7) |
5 (45,5) |
8 (72,7) |
18 (60,0) |
5 (83,3) |
Median (Spanne) |
8,50 (1; 17) |
11,00 (4; 17) |
15,00 (6; 17) |
12,50 (5; 17) |
14,50 (11; 16) |
Geschlecht, n (%) |
|||||
Männlich |
5 (83,3) |
4 (36,4) |
7 (63,6) |
18 (60,0) |
4 (66,7) |
Weiblich |
1 (16,7) |
7 (63,6) |
4 (36,4) |
12 (40,0) |
2 (33,3) |
Ethnische Zugehörigkeit, n (%) |
|||||
Kaukasier |
0 |
5 (45,5) |
7 (63,6) |
22 (73,3) |
4 (66,7) |
Schwarze oder Afroamerikaner |
0 |
1 (9,1) |
1 (9,1) |
5 (16,7) |
1 (16,7) |
Asiaten |
0 |
1 (9,1) |
3 (27,3) |
1 (3,3) |
1 (16,7) |
Amerikanische Indianer oder Ureinwohner Alaskas |
0 |
0 |
0 |
0 |
0 |
Ureinwohner Hawaiis oder andere pazifische Insulaner |
0 |
0 |
0 |
2 (6,7) |
0 |
Unbekannt |
6 (100,0) |
4 (36,4) |
0 |
0 |
0 |
Ethnizität, n (%) |
|||||
Hispanoamerikaner oder Lateinamerikaner |
0 |
0 |
2 (18,2) |
7 (23,3) |
0 |
Nicht-Hispanoamerikaner oder -Lateinamerikaner |
0 |
8 (72,7) |
9 (81,8) |
23 (76,7) |
6 (100,0) |
Unbekannt |
6 (100,0) |
3 (27,3) |
0 |
0 |
0 |
Im Gesamt-Phase-I-Teil (N = 28) betrug die mediane Nachbeobachtungszeit im Hinblick auf das Gesamtüberleben 29,27 Monate (15,21; 85,88) und im Phase-II-Teil (N = 6) 9,66 (2,00; 15,54). Die mediane Behandlungsdauer betrug im Phase-I-Teil 17,26 Monate (Spanne: 0,30 bis 60,85) und im Phase-II-Teil 9,64 Monate (1,97; 15,54).
Das kumulative zytogenetische und molekulare Ansprechen zu einem beliebigen Zeitpunkt bei Patienten mit CML ist in Tabelle 15 zusammenfassend dargestellt. Von den Respondern in Phase I trat bei drei Patienten ein Verlust des CCyR und bei 2 Patienten ein Verlust des MCyR auf. Im Phase-I-Teil betrug die Wahrscheinlichkeit für eine Aufrechterhaltung des MMR nach 18 Monaten 92,3 % (95%-KI: 56,6; 98,8).
Es trat keine Progression in die AP oder BK auf.
Tabelle 15 – Wirksamkeitsergebnisse bei pädiatrischen Patienten mit Ph+ CML mit Resistenz oder Unverträglichkeit
Phase 1 gesamt |
Phase 2 CPIL |
Phase 2 R/I |
|
Kumulatives MCyR, n% (95%-KI) |
24 (85,7) |
26 (86,7) |
6 (100,0) |
Kumulatives CCyR, n% (95%-KI) |
23 (82,1) |
25 (83,3) |
6 (100,0) |
Patienten ohne MCyR bei Studienbeginn, n |
4 |
n/a |
1 |
MCyR, n% (95%-KI) |
3 (75,0) |
n/a |
1 (100,0) |
Patienten ohne CCyR |
9 |
n/a |
2 |
CCyR n% (95%-KI) |
7 (77,8) |
n/a |
2 (100,0) |
Kumulatives MMR, n% (95%-KI) |
16 (57,1) |
13 (43,3) |
4 (66,7) |
Kumulatives MR4, n% (95%-KI) |
6 (21,4) |
5 (16,7) |
1 (16,7) |
Kumulatives MR4,5, n% (95%-KI) |
5 (17,9) |
0 (0,0) |
0 (0,0) |
Abkürzungen: CCyR = komplettes zytogenetisches Ansprechen; KI = Konfidenzintervall; CML = chronische myeloische Leukämie; CP = chronische Phase; MCyR = gutes zytogenetisches Ansprechen; MMR = gutes molekulares Ansprechen; MR = molekulares Ansprechen; N = Anzahl Patienten; n=Anzahl Ereignisse; Ph = Philadelphia-Chromosomen-positiv; R/I = Resistenz oder Unverträglichkeit.
Die Pharmakokinetik von Bosutinib bei erwachsenen Patienten mit CML wurde nach Einnahme zusammen mit einer Mahlzeit untersucht und, sofern nicht anders angegeben, als geometrisches Mittel (Variationskoeffizient, VK%) angegeben.
Resorption
Bei gesunden Probanden betrug die absolute Bioverfügbarkeit nach Einnahme einer Einzeldosis von Bosutinib (500 mg) mit einer Mahlzeit 34 %. Die Resorption war mit einer medianen Zeit bis zum Erreichen der Spitzenkonzentration (tmax) nach 6 Stunden verhältnismäßig langsam. Bosutinib zeigt in einem Dosisbereich von 100 bis 600 mg einen dosisproportionalen Anstieg der AUC. Die PK-Parameter von Bosutinib bei Erwachsenen wurden aus einer populationspharmakokinetischen Analyse basierend auf gepoolten Daten der Studien abgeleitet. Nach mehrfacher Einnahme von 400 mg Bosulif betrug die Cmax von Bosutinib im Steady State 127 ng/ml (31 %), die Ctrough 68 ng/ml (39 %) und die AUC 2 370 ng×h/ml (34 %). Nach mehrfacher Einnahme von 500 mg Bosulif betrug die Cmax von Bosutinib im Steady State 171 ng/ml (38 %), die Ctrough 91 ng/ml (42 %) und die AUC 3 150 ng×h/ml (38 %).
Nach Gabe von Bosutinib in Form von Tabletten oder intakten Hartkapseln in der gleichen Dosis wurden im nicht nüchternen Zustand keine klinisch signifikanten Unterschiede in der Pharmakokinetik von Bosutinib beobachtet. Beim Vermischen des Inhalts der Bosutinib-Hartkapseln mit Apfelmus oder Joghurt zeigten sich bei gesunden erwachsenen Teilnehmern im nicht nüchternen Zustand ähnliche PK-Werte wie bei Einnahme der intakten Bosutinib-Hartkapseln.
Die Löslichkeit von Bosutinib ist pH‑abhängig, und die Resorption sinkt mit zunehmendem gastrischen pH‑Wert (siehe Abschnitt 4.5).
Wirkung von Nahrung
Bei Gabe von Bosutinib-Tabletten an gesunde Probanden zusammen mit einer fettreichen Mahlzeit stiegen Cmax bzw. AUC von Bosutinib im Vergleich zum nüchternen Zustand um das 1,8-Fache bzw. 1,7-Fache an. In einer separaten Studie führte die Verabreichung von Bosutinib-Hartkapseln unter nicht nüchternen Bedingungen zu Expositionen, die etwa 1,5- bis 1,6-mal höher waren als bei Gabe in nüchternem Zustand.
Verteilung
Nach intravenöser Verabreichung einer Einzeldosis von 120 mg Bosutinib bei gesunden Probanden zeigte Bosutinib ein mittleres (% Variationskoeffizient [VK]) Verteilungsvolumen von 2 331 (32) l, was darauf hinweist, dass sich das Arzneimittel überwiegend im Extravasalraum verteilt.
Bosutinib war stark an humane Plasmaproteine gebunden, bei In-vitro-Experimenten zu 94 % und bei gesunden Probanden ex vivo zu 96 %, wobei die Bindung unabhängig von der Konzentration war.
Biotransformation
In-vitro- und In-vivo-Studien zufolge wird Bosutinib (Stammverbindung) beim Menschen hauptsächlich in der Leber metabolisiert. Nach Gabe einer Einzeldosis oder mehrerer Dosen Bosutinib (400 oder 500 mg) an Menschen konnten als hauptsächlich zirkulierende Metaboliten oxydechloriertes (M2) und N-desmethyliertes (M5) Bosutinib und als geringfügig zirkulierender Metabolit Bosutinib-N-Oxid (M6) festgestellt werden. Die systemische Exposition des N-desmethylierten Metaboliten machte 25 % der Stammverbindung aus, während der oxydechlorierte Metabolit 19 % der Stammverbindung ausmachte. Die Aktivität aller 3 Metaboliten betrug ≤ 5 % der Aktivität von Bosutinib, die mit einem ankerunabhängigen Proliferationsassay mit Src-transformierten Fibroblasten gemessen wurde. In Fäzes wurden Bosutinib und N-desmethyl-Bosutinib als die hauptsächlichen arzneimittelbezogenen Bestandteile festgestellt. In In-vitro-Studien an humanen Lebermikrosomen zeigte sich, dass das CYP-450-Isozym CYP3A4 in erster Linie an der Metabolisierung von Bosutinib beteiligt war und Wechselwirkungsstudien zeigten, dass Ketoconazol und Rifampicin eine ausgeprägte Auswirkung auf die Pharmakokinetik von Bosutinib hatten (siehe Abschnitt 4.5). Mit folgenden CYP-Isoenzymen wurde keine Metabolisierung von Bosutinib beobachtet: 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 oder 3A5.
Elimination
Nach intravenöser Verabreichung einer Einzeldosis von 120 mg Bosutinib bei gesunden Probanden betrug die mittlere (% VK) terminale Eliminationshalbwertzeit 35,5 (24) Stunden und die mittlere (% VK) Clearance betrug 61,9 (26) l/h. In einer Studie zur Stoffmassenbilanz mit oralem Bosutinib wurden durchschnittlich 94,6 % der gesamten Dosis nach 9 Tagen ausgeschieden; Fäzes (91,3 %) stellten den hauptsächlichen Ausscheidungsweg dar, 3,29 % der Dosis wurden im Urin wiedergefunden. 75 % der Dosis wurden innerhalb von 96 Stunden ausgeschieden. Die Ausscheidung von unverändertem Bosutinib im Urin war niedrig mit ca. 1 % der Dosis sowohl bei gesunden Probanden als auch bei Studienteilnehmern mit fortgeschrittenen malignen soliden Tumoren.
Besondere Bevölkerungsgruppen
Leberfunktionsstörung
Eine mit der Nahrung gegebene 200-mg-Dosis Bosutinib wurde in einer Kohorte mit 18 Studienteilnehmern mit Leberfunktionseinschränkung (Child-Pugh-Klassen A, B und C) und 9 passenden gesunden Probanden untersucht. Die cmax von Bosutinib im Plasma erhöhte sich um das 2,4-Fache, 2-Fache bzw. 1,5-Fache bei Studienteilnehmern mit Child-Pugh-Klasse A, B bzw. C; die Bosutinib-AUC im Plasma stieg um das 2,3-Fache, 2-Fache bzw. 1,9-Fache. Der t½-Wert von Bosutinib erhöhte sich bei Patienten mit Leberfunktionsstörung im Vergleich zu den gesunden Probanden.
Nierenfunktionsstörung
In einer Studie zur Nierenfunktionsstörung wurde eine Einzeldosis von 200 mg Bosutinib mit einer Mahlzeit an 26 Probanden mit leichter, mäßiger oder schwerer Nierenfunktionsstörung sowie an 8 entsprechende, gesunde Probanden verabreicht. Die Nierenfunktionsstörung war bezogen auf eine CLCr (berechnet mittels Cockcroft‑Gault‑Formel) von < 30 ml/min (schwere Nierenfunktionsstörung), 30 ≤ CLCr ≤ 50 ml/min (mäßige Nierenfunktionsstörung) oder 50 < CLCr ≤ 80 ml/min (leichte Nierenfunktionsstörung). Bei Probanden mit mäßiger und schwerer Nierenfunktionsstörung zeigte sich ein Anstieg der AUC im Vergleich zu gesunden Probanden von 35 % bzw. 60 %. Der maximale Spiegel cmax stieg in den Gruppen mit mäßiger und schwerer Nierenfunktionsstörung um 28 % bzw. 34 % an. Bei Probanden mit leichter Nierenfunktionsstörung war die Bosutinib-Exposition nicht erhöht. Die Eliminationshalbwertszeit von Bosutinib war bei Probanden mit Nierenfunktionsstörung ähnlich derjenigen bei gesunden Probanden.
Die Dosisanpassungen bei Nierenfunktionsstörung erfolgten auf Grundlage der Ergebnisse dieser Studie und der bekannten linearen Pharmakokinetik von Bosutinib im Dosisbereich von 200 bis 600 mg.
Alter, Geschlecht und ethnische Zugehörigkeit
Es wurden keine formalen Studien zur Auswertung der Auswirkungen dieser demografischen Faktoren durchgeführt. Populationspharmakokinetische Analysen bei Patienten mit Ph+ Leukämie oder malignem soliden Tumor und bei gesunden Probanden weisen darauf hin, dass Alter, Geschlecht oder Körpergewicht keine klinisch relevanten Auswirkungen haben. Populationspharmakokinetische Analysen zeigten, dass Asiaten eine um 18 % niedrigere Clearance hatten. Dies entsprach einer Erhöhung der Bosutinib-Exposition (AUC) um ca. 25 %.
Kinder und Jugendliche
Die Pharmakokinetik von Bosutinib wurde bei 41 pädiatrischen Patienten mit neu diagnostizierter, resistenter oder therapieunverträglicher CML im Alter von 1 bis < 18 Jahren im Dosisbereich 300 mg/m2 bis 400 mg/m2 nach einmal täglicher oraler Gabe zusammen mit einer Mahlzeit untersucht. Die mediane Tmax wurde bei pädiatrischen Patienten ungefähr 3 Stunden nach der Verabreichung (Spanne: 1 bis 8 Stunden nach der Verabreichung) erreicht. Die Expositionen stiegen zwischen 100 und 600 mg dosisproportional an. In den Kohorten mit 300 mg/m2 bis 400 mg/m2 lag das geometrische Mittel der AUCtau für die jeweiligen Indikationen neu diagnostizierte Ph+ CML und Ph+ CML mit Resistenz oder Unverträglichkeit innerhalb des Bereichs (+/- 20 %) des geometrischen Mittels der AUCtau für die Dosisstufe für Erwachsene; allerdings waren bei pädiatrischen Patienten Cmax und Elimination höher, und die Cmin war niedriger als bei Erwachsenen.
Bosutinib ist in Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, Reproduktionstoxizität und Phototoxizität untersucht worden.
Sicherheitspharmakologie
Bosutinib zeigte keine Auswirkungen auf respiratorische Funktionen. In einer Studie zum zentralen Nervensystem (ZNS) zeigten mit Bosutinib behandelte Ratten eine verringerte Pupillengröße und ein beeinträchtigtes Gangbild. Der No Observed Effect Level (NOEL) wurde nicht für die Pupillengröße bestimmt, der NOEL für das beeinträchtigte Gangbild trat bei Expositionen auf, die nach einer klinischen Dosis von 400 mg etwa dem 11‑Fachen der Exposition beim Menschen entsprachen und nach einer klinischen Dosis von 500 mg dem 8-Fachen der Exposition beim Menschen (cmax basierend auf der ungebundenen Fraktion bei der jeweiligen Spezies). Die In-vitro-Aktivität von Bosutinib in hERG-Tests legt den Schluss nahe, dass eine Verlängerung der ventrikulären Repolarisation (QTc) möglich ist. In einer Studie zur oralen Gabe von Bosutinib bei Hunden führte Bosutinib nicht zu Veränderungen des Blutdrucks, atrialen oder ventrikulären Arrhythmien oder einer Verlängerung des PR, QRS oder QTc im EKG bei Expositionen bis zum 3-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 400 mg und dem 2-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 500 mg (cmax basierend auf der ungebundenen Fraktion bei der jeweiligen Spezies). Eine verzögerte Erhöhung der Herzfrequenz wurde beobachtet. In einer Studie zur intravenösen Gabe bei Hunden wurden vorübergehende Erhöhungen der Herzfrequenz und Senkungen des Blutdrucks sowie eine geringfügige Verlängerung des QTc (< 10 ms) bei Expositionen im Bereich von etwa dem 6- bis 20-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 400 mg und dem 4- bis 15-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 500 mg (cmax basierend auf der ungebundenen Fraktion bei der jeweiligen Spezies) festgestellt. Der Zusammenhang zwischen den beobachteten Auswirkungen und der Behandlung mit dem Arzneimittel war nicht eindeutig.
Toxizität bei wiederholter Gabe
Studien zur Toxizität bei wiederholter Gabe bei Ratten (Studiendauer: bis zu 6 Monate) und bei Hunden (Studiendauer: bis zu 9 Monate) ergaben, dass der Gastrointestinaltrakt das primäre Zielorgan der Bosutinib-Toxizität ist. Die klinischen Zeichen einer Toxizität waren u. a. Veränderungen in den Fäzes und wurden mit einer verringerten Nahrungsaufnahme und Gewichtsverlust in Verbindung gebracht, die in manchen Fällen zum Tod oder Einschläfern führten.
Histopathologisch wurden luminale Dilatation, Hyperplasie der Becherzellen, Blutungen, Erosion und Ödeme des Intestinaltrakts sowie intrasinusoidale Erythrozyten und Blutung in den Mesenteriallymphknoten beobachtet. Die Leber wurde ebenfalls als ein Zielorgan bei Ratten identifiziert. Die Toxizitäten zeichneten sich durch einen Anstieg des Lebergewichts in Verbindung mit hepatozellulärer Hypertrophie aus, die bei Nichtvorhandensein erhöhter Leberenzyme oder mikroskopischer Zeichen einer hepatozellulären Zytotoxizität auftrat. Deren Relevanz für den Menschen ist unbekannt. Der Expositionsvergleich der Spezies zeigt, dass Expositionen, die in den 6- bzw. 9-Monats-Studien mit Ratten bzw. Hunden keine unerwünschten Ereignisse hervorriefen, vergleichbar mit der Exposition beim Menschen nach einer klinischen Dosis von 400 mg oder 500 mg (basierend auf der ungebundenen AUC bei der jeweiligen Spezies) waren.
Genotoxizität
Genotoxizitätsstudien an bakteriellen In-vitro-Systemen sowie In-vitro- und In-vivo-Säugetiermodellen mit und ohne metabolische Aktivierung ergaben keine Hinweise auf ein mutagenes Potenzial von Bosutinib.
Reproduktionstoxizität und Entwicklungstoxizität
In einer Fertilitätsstudie mit Ratten war die Fertilität bei den männlichen Tieren leicht herabgesetzt. Bei den weiblichen Tieren wurden eine vermehrte Resorption von Embryonen und eine verringerte Einnistung sowie weniger lebensfähige Embryonen festgestellt. Die Dosis, bei der keine nachteiligen Auswirkungen auf die Reproduktion bei den männlichen Tieren (30 mg/kg/Tag) bzw. weiblichen Tieren (3 mg/kg/Tag) beobachtet wurden, führte zu Expositionen gleich dem 0,6- bzw. 0,3-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 400 mg und dem 0,5-Fachen bzw. 0,2-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 500 mg (basierend auf der ungebundenen AUC bei der jeweiligen Spezies). Eine Auswirkung auf die männliche Fertilität kann nicht ausgeschlossen werden (siehe Abschnitt 4.6).
Die fetale Exposition mit von Bosutinib abgeleiteter Radioaktivität während der Schwangerschaft wurde in einer Studie zur Plazentapassage mit trächtigen Sprague-Dawley-Ratten nachgewiesen. In einer Studie zur prä- und postnatalen Entwicklung bei Ratten wurde bei Dosen von ≥ 30 mg/kg/Tag eine geringere Anzahl von Jungtieren geboren, und bei 70 mg/kg/Tag wurde eine erhöhte Inzidenz für einen totalen Wurfverlust und ein vermindertes Wachstum der Nachkommen nach der Geburt festgestellt. Die Dosis, bei der keine nachteiligen Auswirkungen auf die Entwicklung nachgewiesen wurde (10 mg/kg/Tag) führte zum 1,3- bzw. 1,0-Fachen der Exposition beim Menschen nach einer klinischen Dosis von 400 mg bzw. 500 mg (basierend auf der ungebundenen AUC bei der jeweiligen Spezies). In einer Entwicklungstoxizitätsstudie mit Kaninchen und einer für Muttertiere toxischen Dosis wurden Anomalien beim Fötus (Sternumfusionen und verschiedene viszerale Auffälligkeiten bei 2 Feten) und eine leichte Abnahme des Fötusgewichts beobachtet. Die Exposition mit der höchsten bei Kaninchen getesteten Dosis (10 mg/kg/Tag), die nicht zu Nebenwirkungen beim Fötus führte, betrug das 0,9- und 0,7-Fache der Exposition beim Menschen nach einer klinischen Dosis von 400 mg bzw. 500 mg (basierend auf der ungebundenen AUC bei der jeweiligen Spezies).
Nach einer oralen Einzeldosis (10 mg/kg) von [14C] radioaktiv markiertem Bosutinib bei säugenden Sprague-Dawley-Ratten wurde die Radioaktivität bereits 30 min nach der Gabe direkt über die Milch ausgeschieden. Die Radioaktivität in der Milch war bis zu 8-mal höher als im Plasma. Dies führte zu einer messbaren Radioaktivität im Plasma der gesäugten Neugeborenen.
Karzinogenität
Bosutinib erwies sich in der 2-Jahres-Karzinogenitätsstudie an Ratten und der 6-monatigen-Karzinogenitätsstudie an rasH2-Mäusen als nicht karzinogen.
Phototoxizität
Bosutinib zeigte die Fähigkeit, Licht im UV-B- und UV-A-Bereich zu absorbieren, und ist in der Haut und in der mittleren Augenhaut von pigmentierten Ratten verteilt. Bosutinib zeigte jedoch kein Potenzial für eine Phototoxizität der Haut oder der Augen bei pigmentierten Ratten, die in Anwesenheit von UV-Strahlung einer Exposition von Bosutinib ausgesetzt waren, die bis zum 3- und 2-Fachen der humanen Exposition nach einer klinischen Dosis von 400 mg bzw. 500 mg (cmax basierend auf der ungebundenen Fraktion bei der jeweiligen Spezies) entsprach.
Tablettenkern
Mikrokristalline Cellulose (E 460)
Croscarmellose-Natrium (E 468)
Poloxamere 188
Povidon (E 1201)
Magnesiumstearat (E 470b)
Filmbeschichtung
Bosulif 100 mg Filmtabletten
Poly(vinylalkohol)
Titandioxid (E 171)
Macrogol 3350
Talkum (E 553b)
Eisen(III)‑hydroxid‑oxid x H2O (E 172)
Bosulif 400 mg Filmtabletten
Poly(vinylalkohol)
Titandioxid (E 171)
Macrogol 3350
Talkum (E 553b)
Eisen(III)‑hydroxid‑oxid x H2O (E 172)
Eisen(III)‑oxid (E 172)
Bosulif 500 mg Filmtabletten
Poly(vinylalkohol)
Titandioxid (E 171)
Macrogol 3350
Talkum (E 553b)
Eisen(III)‑oxid (E 172)
Bosulif Hartkapseln
Mannitol (E 421)
Mikrokristalline Cellulose (E 460)
Croscarmellose-Natrium (E 468)
Poloxamere 188
Povidon (E 1201)
Magnesiumstearat (E 470b)
Bosulif Hartkapselhüllen
Gelatine
Titandioxid (E 171)
Eisen(III)‑hydroxid-oxid x H2O (E 172)
Eisen(III)‑oxid (E 172)
Drucktinte Hartkapseln
Schellack (E 904)
Propylenglycol (E 1520)
Ammoniak-Lösung, konzentriert (E 527)
Eisen(II,III)-oxid (E 172)
Kaliumhydroxid (E 525)
Nicht zutreffend.
Filmtabletten
4 Jahre
Hartkapseln
3 Jahre
Filmtabletten
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Hartkapseln
Nicht über 30 °C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Filmtabletten
Weiße opake 3‑lagige PVC/ Polychlortrifluorethylen/ PVC‑Blisterpackung versiegelt mit Durchdrückfolie auf der Rückseite, mit 14 oder 15 Tabletten.
Bosulif 100 mg Filmtabletten
Jeder Umkarton enthält 28, 30 oder 112 Tabletten.
Bosulif 400 mg Filmtabletten
Jeder Umkarton enthält 28 oder 30 Tabletten.
Bosulif 500 mg Filmtabletten
Jeder Umkarton enthält 28 oder 30 Tabletten.
Hartkapseln
Flasche aus Polyethylen hoher Dichte (HDPE) und Polypropylenverschluss (PP) mit Induktionsversiegelung (Heat Induction Seal, HIS).
Bosulif 50 mg Hartkapseln
Kartons mit einer Flasche, die jeweils 30 Hartkapseln enthält.
Bosulif 100 mg Hartkapseln
Kartons mit einer Flasche, die jeweils 150 Hartkapseln enthält.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brüssel
Belgien
Bosulif 100 mg Filmtabletten
EU/1/13/818/001
EU/1/13/818/002
EU/1/13/818/005
Bosulif 400 mg Filmtabletten
EU/1/13/818/006
EU/1/13/818/007
Bosulif 500 mg Filmtabletten
EU/1/13/818/003
EU/1/13/818/004
Bosulif 50 mg Hartkapseln
EU/1/13/818/008
Bosulif 100 mg Hartkapseln
EU/1/13/818/009
Datum der Erteilung der Zulassung: 27. März 2013
Datum der letzten Verlängerung der Zulassung: 31. März 2022
Dezember 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
___________________________________________________________________
VERKAUFSABGRENZUNG IN DEUTSCHLAND
Verschreibungspflichtig
REZEPTPFLICHT/APOTHEKENPFLICHT IN ÖSTERREICH
Rezept- und apothekenpflichtig, wiederholte Abgabe verboten
PACKUNGSGRÖSSEN IN DEUTSCHLAND
Bosulif 100 mg, Bosulif 400 mg, Bosulif 500 mg: Blisterpackung mit 28 Filmtabletten (N1)
Bosulif 100 mg: Blisterpackung mit 112 Filmtabletten
PACKUNGSGRÖSSEN IN ÖSTERREICH
Bosulif 100 mg, Bosulif 400 mg, Bosulif 500 mg: Blisterpackung mit 28 Filmtabletten
Bosulif 100 mg: Blisterpackung mit 112 Filmtabletten
REPRÄSENTANT IN DEUTSCHLAND
PFIZER PHARMA GmbH
Friedrichstr. 110
10117 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
REPRÄSENTANT IN ÖSTERREICH
Pfizer Corporation Austria Ges.m.b.H.
Floridsdorfer Hauptstraße 1
A-1210 Wien
Tel.: +43 (0)1 521 15-0