Stivarga® 40 mg Filmtabletten.
Jede Filmtablette enthält 40 mg Regorafenib.
Sonstige Bestandteile mit bekannter Wirkung
Jede Tagesdosis von 160 mg enthält 2,438 mmol (oder 56,06 mg) Natrium (siehe Abschnitt 4.4).
Jede Tagesdosis von 160 mg enthält 1,68 mg (3‑sn‑Phosphatidyl)cholin (gewonnen aus Soja) (siehe Abschnitt 4.4).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette.
Hellrosafarbene, ovale Filmtabletten mit einer Länge von 16 mm, einer Breite von 7 mm und der Kennzeichnung "BAYER" auf der einen und "40" auf der anderen Seite.
Stivarga ist angezeigt als Monotherapie zur Behandlung von erwachsenen Patienten mit:
metastasiertem Kolorektalkarzinom (KRK), die zuvor mit verfügbaren Therapien behandelt wurden oder die für diese nicht geeignet sind. Diese Therapien umfassen Fluoropyrimidin‑basierte Chemotherapie, eine Anti‑VEGF‑Therapie und eine Anti‑EGFR‑Therapie (siehe Abschnitt 5.1).
nicht resezierbaren oder metastasierten gastrointestinalen Stromatumoren (GIST), die unter einer früheren Behandlung mit Imatinib und Sunitinib progredient waren oder diese nicht vertragen haben.
hepatozellulärem Karzinom (HCC), die zuvor mit Sorafenib behandelt wurden.
Stivarga sollte nur von Ärzten verschrieben werden, die Erfahrung in der Anwendung von Krebstherapien haben.
Dosierung
Die empfohlene Dosis Regorafenib ist 160 mg (4 Tabletten zu je 40 mg), die 3 Wochen lang einmal täglich eingenommen wird, gefolgt von einer einwöchigen Therapiepause. Diese 4‑wöchige Periode entspricht einem Therapiezyklus.
Wenn eine Dosis ausgelassen wurde, sollte der Patient sie am selben Tag einnehmen, sobald er dies bemerkt. Der Patient sollte nicht zwei Dosen am selben Tag einnehmen, um eine vergessene Einnahme nachzuholen. Falls es nach der Einnahme von Regorafenib zu Erbrechen kommt, darf der Patient keine zusätzlichen Tabletten einnehmen.
Die Behandlung sollte fortgesetzt werden, solange ein Nutzen besteht oder bis zum Auftreten einer inakzeptablen Toxizität (siehe Abschnitt 4.4).
Patienten mit einem ECOG Leistungsstatus (performance status, PS) von 2 oder höher waren von den klinischen Studien ausgeschlossen. Für Patienten mit PS ≥ 2 liegen nur begrenzte Daten vor.
Dosierungsanpassungen
Abhängig von der individuellen Sicherheit und Verträglichkeit können ein Aussetzen und/oder eine Verringerung der Dosis erforderlich sein. Dosisänderungen sind in Schritten von jeweils 40 mg (eine Tablette) vorzunehmen. Die niedrigste empfohlene Tagesdosis beträgt 80 mg. Die maximale Tagesdosis beträgt 160 mg.
Für empfohlene Dosisänderungen und Maßnahmen im Fall einer Hand‑Fuß‑Hautreaktion (HFHR)/eines palmar‑plantaren Erythrodysästhesiesyndroms siehe Tabelle 1.
Tabelle 1: Empfohlene Dosisänderungen und Maßnahmen bei HFHR
Grad der Hauttoxizität | Auftreten | Empfohlene Dosisänderung und Maßnahmen |
Grad 1 | Alle | Höhe der Dosis beibehalten und umgehend unterstützende Maßnahmen zur symptomatischen Linderung einleiten. |
Grad 2 | Erstes Auftreten | Verringerung der Dosis um 40 mg (eine Tablette) und umgehend unterstützende Maßnahmen einleiten. |
Keine Verbesserung innerhalb von 7 Tagen oder zweites Auftreten | Therapie aussetzen, bis die Toxizität Grad 0‑1 erreicht. | |
Drittes Auftreten | Therapie aussetzen, bis die Toxizität Grad 0‑1 erreicht. | |
Viertes Auftreten | Behandlung mit Stivarga endgültig abbrechen. | |
Grad 3 | Erstes Auftreten | Umgehend unterstützende Maßnahmen einleiten. Therapie für mindestens 7 Tage aussetzen, bis die Toxizität Grad 0‑1 erreicht. |
Zweites Auftreten | Umgehend unterstützende Maßnahmen einleiten. Therapie für mindestens 7 Tage aussetzen, bis die Toxizität Grad 0‑1 erreicht. | |
Drittes Auftreten | Behandlung mit Stivarga endgültig abbrechen. |
Für empfohlene Maßnahmen und Dosisänderungen für den Fall einer Verschlechterung der Leberfunktionswerte, von der angenommen wird, dass sie auf die Stivarga-Behandlung zurückzuführen ist, siehe Tabelle 2 (siehe auch Abschnitt 4.4).
Tabelle 2: Empfohlene Maßnahmen und Dosisänderungen für den Fall arzneimittelbedingter Abweichungen der Leberfunktionswerte
Beobachteter Anstieg | Auftreten | Empfohlene Maßnahmen und Dosisänderung |
≤ 5‑fache obere Normgrenze (ONG) | Jegliches Auftreten | Fortsetzung der Stivarga-Behandlung. |
> 5‑fache ONG bis | Erstes Auftreten | Aussetzen der Stivarga-Behandlung. |
Wiederaufnahme: Wenn der mögliche Nutzen das Risiko einer Hepatotoxizität überwiegt, sollte die Behandlung mit Stivarga wieder aufgenommen, die Dosis um 40 mg (eine Tablette) verringert und die Leberfunktion mindestens 4 Wochen lang wöchentlich kontrolliert werden. | ||
Erneutes Auftreten | Die Behandlung mit Stivarga endgültig abbrechen. | |
> 20‑fache ONG | Jegliches Auftreten | Die Behandlung mit Stivarga endgültig abbrechen. |
> 3‑fache ONG (Grad 2 oder höher) mit gleichzeitigem Bilirubinwert von > 2‑fachen ONG | Jegliches Auftreten | Die Behandlung mit Stivarga endgültig abbrechen. |
Leberfunktionsstörung
Regorafenib wird hauptsächlich über die Leber eliminiert.
In klinischen Studien konnten zwischen Patienten mit einer leichten Leberfunktionsstörung (Child‑Pugh A) und solchen mit normaler Leberfunktion keine relevanten Unterschiede hinsichtlich Bioverfügbarkeit, Sicherheit oder Wirksamkeit beobachtet werden. Bei Patienten mit einer leichten Leberfunktionsstörung ist keine Dosisanpassung erforderlich. Da für Patienten mit mittelschwerer Leberfunktionsstörung (Child‑Pugh B) nur begrenzt Daten vorliegen, kann keine Dosisempfehlung gegeben werden. Bei diesen Patienten wird eine engmaschige Überwachung der allgemeinen Sicherheit empfohlen (siehe Abschnitte 4.4 und 5.2).
Die Anwendung von Stivarga wird bei Patienten mit schwerer Leberfunktionsstörung (Child‑Pugh C) nicht empfohlen, da bei dieser Patientengruppe keine Daten vorliegen.
Nierenfunktionsstörung
Verfügbare klinische Daten zeigen eine ähnliche Bioverfügbarkeit von Regorafenib und seinen Metaboliten M‑2 und M‑5 bei Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung verglichen mit Patienten mit normaler Nierenfunktion. Bei Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich (siehe auch Abschnitt 5.2).
Ältere Patienten
In klinischen Studien konnten zwischen älteren Patienten (65 Jahre und älter) und jüngeren Patienten keine relevanten Unterschiede hinsichtlich Bioverfügbarkeit, Sicherheit oder Wirksamkeit beobachtet werden (siehe auch Abschnitt 5.2).
Geschlecht
In klinischen Studien konnten zwischen männlichen und weiblichen Patienten keine relevanten Unterschiede hinsichtlich Bioverfügbarkeit, Sicherheit oder Wirksamkeit beobachtet werden. Eine geschlechtsspezifische Dosisanpassung ist nicht erforderlich (siehe auch Abschnitt 5.2).
Ethnische Unterschiede
In klinischen Studien konnten zwischen Patienten verschiedener ethnischer Gruppen keine relevanten Unterschiede hinsichtlich Bioverfügbarkeit oder Wirksamkeit beobachtet werden. Bei der Behandlung mit Stivarga wurde eine höhere Inzidenz einer HFHR/eines palmar‑plantaren Erythrodysästhesiesyndroms, starker Veränderungen der Leberfunktionswerte und von Leberfunktionsstörungen bei asiatischen Patienten (insbesondere bei Japanern) im Vergleich zu Kaukasiern beobachtet. Die asiatischen Patienten, die in klinischen Studien mit Stivarga behandelt wurden, kamen hauptsächlich aus Ostasien (~ 90 %). Für die Anwendung von Regorafenib bei Patienten mit schwarzer Hautfarbe liegen nur begrenzte Daten vor.
Eine Dosisanpassung aufgrund der ethnischen Herkunft ist nicht erforderlich (siehe Abschnitt 5.2).
Kinder und Jugendliche
Es gibt im Anwendungsgebiet metastasiertes kolorektales Karzinom keinen relevanten Nutzen von Stivarga bei Kindern und Jugendlichen.
Die Sicherheit und Wirksamkeit von Regorafenib bei Patienten unter 18 Jahren mit der Indikation GIST sind nicht erwiesen. Es liegen keine Daten vor.
Es gibt im Anwendungsgebiet HCC keinen relevanten Nutzen von Stivarga bei Kindern und Jugendlichen.
Art der Anwendung
Stivarga ist zum Einnehmen.
Stivarga soll jeden Tag zur gleichen Zeit eingenommen werden. Die Tabletten sollen im Ganzen mit Wasser nach einer leichten Mahlzeit (weniger als 30% Fett) geschluckt werden. Eine leichte (fettarme) Mahlzeit besteht z. B. aus 1 Portion Cerealien (etwa 30 g), 1 Glas Magermilch, 1 Scheibe Toast mit Marmelade, 1 Glas Apfelsaft und 1 Tasse Kaffee oder Tee (520 Kalorien, 2 g Fett).
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Auswirkungen auf die Leber
Abweichende Leberwerte (Alanin-Aminotransferase [ALT], Aspartat-Aminotransferase [AST] und Bilirubin) wurden häufig bei mit Stivarga behandelten Patienten beobachtet. Starke Veränderungen der Leberfunktionswerte (Grad 3 bis 4) und Leberfunktionsstörungen mit klinischer Symptomatik (einschließlich Leberversagen und tödlicher Ausgänge) wurden bei einer kleinen Anzahl von Patienten berichtet (siehe Abschnitt 4.8).
In klinischen Studien wurde bei der Behandlung mit Stivarga eine höhere Inzidenz starker Veränderungen der Leberfunktionswerte und von Leberfunktionsstörungen bei asiatischen Patienten (insbesondere bei Japanern) im Vergleich zu Kaukasiern beobachtet (siehe Abschnitt 4.2).
Es wird empfohlen, die Leberwerte (ALT, AST und Bilirubin) vor Beginn der Behandlung mit Stivarga zu bestimmen und diese während der ersten 2 Behandlungsmonate engmaschig zu überwachen (mindestens alle 2 Wochen). Danach sollte eine regelmäßige Kontrolle mindestens einmal im Monat und wenn es klinisch angezeigt ist, erfolgen.
Regorafenib ist ein Uridindiphosphat-Glucuronosyltransferase(UGT)‑1A1-Hemmer (siehe Abschnitt 4.5). Bei Patienten mit Gilbert-Meulengracht-Syndrom kann eine leichte, indirekte (unkonjugierte) Hyperbilirubinämie auftreten.
Bei Patienten, bei denen eine Verschlechterung der Leberwerte beobachtet wurde, von der angenommen wird, dass sie auf die Behandlung mit Stivarga zurückzuführen ist (z. B. wenn keine alternative Ursache wie eine posthepatische Cholestase oder ein Fortschreiten der Erkrankung ersichtlich ist), sollten die Empfehlungen zur Dosisänderung und Überwachung in Tabelle 2 befolgt werden (siehe Abschnitt 4.2).
Regorafenib wird hauptsächlich über die Leber eliminiert.
Bei Patienten mit leichter oder mittelschwerer Leberfunktionsstörung wird eine engmaschige Überwachung der allgemeinen Sicherheit empfohlen (siehe auch Abschnitte 4.2 und 5.2). Die Anwendung von Stivarga bei Patienten mit stark eingeschränkter Leberfunktion (Child‑Pugh C) wird nicht empfohlen, da für diese Patientengruppe keine Daten vorliegen und die Bioverfügbarkeit bei diesen Patienten erhöht sein könnte.
Infektionen
Stivarga war mit einer erhöhten Inzidenz von Infektionen assoziiert, von denen einige zum Tod führten (siehe Abschnitt 4.8). In Fällen der Verschlechterung von Infektionen, sollte eine Unterbrechung der Behandlung mit Stivarga in Erwägung gezogen werden.
Hämorrhagie
Stivarga war mit einer erhöhten Inzidenz hämorrhagischer Ereignisse assoziiert, von denen einige zum Tod führten (siehe Abschnitt 4.8). Blutbild und Gerinnungsparameter sollten bei Patienten mit Merkmalen, die eine Blutung begünstigen sowie bei solchen, die mit Antikoagulanzien (z. B. Warfarin oder Phenprocoumon) oder anderen gleichzeitig angewendeten Arzneimitteln, die das Blutungsrisiko erhöhen, behandelt werden, kontrolliert werden. Vor der Behandlung mit Stivarga sollten ein Sreening und die anschließende Behandlung von Ösophagusvarizen bei Patienten mit Leberzirrhose mit der Standardtherapie durchgeführt werden. Im Falle einer schweren Blutung, die eine umgehende medizinische Behandlung erfordert, sollte ein endgültiges Absetzen von Stivarga in Erwägung gezogen werden.
Darmperforation und -fistel
Bei mit Stivarga behandelten Patienten wurden Darmperforationen (einschließlich tödlicher Ausgänge) und -fisteln berichtet (siehe Abschnitt 4.8). Diese Ereignisse stellen bekanntermaßen auch häufig krankheitsbedingte Komplikationen bei Patienten mit intraabdominalen Malignomen dar. Das Absetzen von Stivarga wird bei Patienten empfohlen, bei denen eine Darmperforation oder -fistel auftritt.
Kardiale Ischämie und Infarkt
Stivarga war mit einer erhöhten Inzidenz von Myokardischämien und Infarkten assoziiert (siehe Abschnitt 4.8). Patienten mit instabiler Angina pectoris oder erstmalig aufgetretener Angina pectoris (in den letzten 3 Monaten vor Beginn der Stivarga-Therapie), kürzlich erlittenem Myokardinfarkt (in den letzten 6 Monaten vor Beginn der Stivarga-Therapie) sowie Patienten mit Herzinsuffizienz der New York Heart Association (NYHA)‑Klasse 2 oder höher waren aus den klinischen Studien ausgeschlossen.
Patienten mit ischämischen Herzerkrankungen in der Anamnese sollten auf klinische Anzeichen und Symptome einer Myokardischämie überwacht werden. Treten bei Patienten Symptome einer kardialen Ischämie und/oder eines Infarktes auf, wird bis zu deren Abklingen ein Aussetzen von Stivarga empfohlen. Die Entscheidung, die Therapie mit Stivarga wieder aufzunehmen, sollte auf der sorgfältigen Abwägung des potenziellen Nutzens und der Risiken bei jedem einzelnen Patienten beruhen. Stivarga sollte endgültig abgesetzt werden, wenn die Beschwerden nicht abklingen.
Hyperammonämische Enzephalopathie
Im Zusammenhang mit Regorafenib wurden Fälle hyperammonämischer Enzephalopathie beobachtet, einschließlich tödlich verlaufender Fälle (siehe Abschnitt 4.8). Bei Patienten, die ungeklärte Lethargie oder Veränderungen des Geisteszustands entwickeln, sollte die Ammoniakkonzentration gemessen und eine angemessene klinische Behandlung eingeleitet werden. Wenn eine hyperammonämische Enzephalopathie vorliegt, sollte erwogen werden, die Behandlung mit Regorafenib dauerhaft abzusetzen.
Posteriores reversibles Enzephalopathie-Syndrom (PRES)
PRES wurde in Verbindung mit einer Stivarga-Behandlung berichtet (siehe Abschnitt 4.8). Anzeichen und Symptome eines PRES sind unter anderem Krampfanfälle, Kopfschmerzen, veränderter mentaler Status, Sehstörungen oder kortikale Blindheit, mit oder ohne einhergehende Hypertonie. Eine PRES‑Diagnose muss durch eine bildgebende Untersuchung des Gehirns bestätigt werden. Tritt PRES bei Patienten auf, werden das Absetzen von Stivarga zusammen mit einer Behandlung der Hypertonie und die unterstützende medizinische Behandlung anderer Symptome empfohlen.
Arterielle Hypertonie
Stivarga wurde mit einer erhöhten Inzidenz arterieller Hypertonie in Zusammenhang gebracht (siehe Abschnitt 4.8). Der Blutdruck sollte vor Einleitung einer Behandlung mit Stivarga kontrolliert werden. Es wird empfohlen, den Blutdruck zu überwachen und eine Hypertonie entsprechend der üblichen medizinischen Praxis zu behandeln. In Fällen einer schweren oder anhaltenden Hypertonie trotz angemessener medizinischer Behandlung hat der Arzt zu entscheiden, ob die Therapie vorübergehend ausgesetzt und/oder die Dosis verringert werden sollte (siehe Abschnitt 4.2). Im Falle einer hypertensiven Krise sollte Stivarga abgesetzt werden.
Aneurysmen und Arteriendissektionen
Die Verwendung von VEGF-Signalweg-Hemmern bei Patienten mit oder ohne Hypertonie kann die Entstehung von Aneurysmen und/oder Arteriendissektionen begünstigen. Vor Beginn der Behandlung mit Stivarga sollte dieses Risiko bei Patienten mit Risikofaktoren wie Hypertonie oder Aneurysmen in der Vorgeschichte sorgfältig abgewogen werden.
Thrombotische Mikroangiopathie (TMA)
Thrombotische Mikroangiopathie (TMA), einschließlich thrombotisch-thrombozytopenische Purpura (TTP), wurde mit der Anwendung von Regorafenib in Verbindung gebracht (siehe Abschnitt 4.8). Die Diagnose einer TMA sollte bei Patienten mit hämolytischer Anämie, Thrombozytopenie, Müdigkeit, fluktuierender neurologischer Manifestation, Nierenfunktionsstörung und Fieber in Betracht gezogen werden. Bei Patienten, die eine TMA entwickeln, sollte die Regorafenib-Therapie abgesetzt werden. Eine umgehende Behandlung ist erforderlich. Nach Absetzen der Behandlung wurde eine Aufhebung der Wirkungen von TMA beobachtet.
Wundheilungsstörungen
Da Arzneimittel mit antiangiogenen Eigenschaften die Wundheilung unterdrücken oder beeinträchtigen können, wird bei Patienten, die sich größeren chirurgischen Eingriffen unterziehen müssen, ein vorübergehendes Aussetzen von Stivarga als vorbeugende Maßnahme empfohlen. Die Entscheidung, die Therapie mit Stivarga nach einem größeren chirurgischen Eingriff fortzusetzen, sollte auf der medizinischen Beurteilung einer adäquaten Wundheilung basieren.
Dermatologische Toxizität
HFHR bzw. palmar‑plantares Erythrodysästhesiesyndrom und Exantheme stellen die am häufigsten beobachteten dermatologischen Nebenwirkungen mit Stivarga dar (siehe Abschnitt 4.8). In klinischen Studien wurde bei der Behandlung mit Stivarga eine höhere Inzidenz einer HFHR bei asiatischen Patienten (insbesondere bei Japanern) im Vergleich zu Kaukasiern beobachtet (siehe Abschnitt 4.2). Maßnahmen zur Vorbeugung von HFHR sind unter anderem die Überprüfung auf Schwielen und die Verwendung von Schuheinlagen und Handschuhen, um eine Druckbelastung auf Fußsohlen und Handflächen zu vermeiden. Die Behandlung von HFHR kann die Anwendung keratolytischer Cremes (z. B. Harnstoff‑, Salicylsäure‑ oder Alpha‑Hydroxycarbonsäure‑haltige Cremes, die sparsam auf die betroffenen Flächen aufgetragen werden) und (großzügig aufgetragener) Feuchtigkeitscremes zur Linderung der Symptome umfassen. Eine Verringerung der Dosis und/oder ein vorübergehendes Aussetzen von Stivarga oder, in schweren oder anhaltenden Fällen, ein endgültiges Absetzen von Stivarga sollte in Erwägung gezogen werden (siehe Abschnitt 4.2).
Abweichungen biochemischer und metabolischer Laborwerte
Stivarga war mit einer erhöhten Inzidenz abweichender Elektrolytwerte (einschließlich Hypophosphatämie, Hypokalzämie, Hyponatriämie und Hypokaliämie) und abweichender Stoffwechselwerte (einschließlich Erhöhungen von Thyreoidea Stimulierendem Hormon (TSH), Lipase und Amylase) assoziiert. Im Allgemeinen sind die Abweichungen nur leicht bis mäßig. Sie sind nicht mit klinischen Symptomen verbunden und erfordern normalerweise weder eine Unterbrechung noch eine Verringerung der Dosis. Es wird empfohlen, die biochemischen und metabolischen Parameter während der Behandlung mit Stivarga zu überwachen und, falls erforderlich, eine geeignete Ersatztherapie entsprechend der üblichen medizinischen Praxis einzuleiten. Eine Unterbrechung oder eine Verringerung der Dosis oder ein endgültiges Absetzen von Stivarga sollten im Falle einer anhaltenden oder wiederkehrenden signifikanten Abweichung in Betracht gezogen werden (siehe Abschnitt 4.2).
Wichtige Informationen über bestimmte sonstige Bestandteile
Dieses Arzneimittel enthält 56,06 mg Natrium pro Tagesdosis von 160 mg, entsprechend 3% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g. Jede Tagesdosis von 160 mg enthält 1,68 mg (3‑sn‑Phosphatidyl)cholin (gewonnen aus Soja).
CYP3A4‑ und UGT1A9‑Inhibitoren/CYP3A4‑Induktoren
In vitro Daten zeigen, dass Regorafenib durch Cytochrom CYP3A4 und Uridindiphosphat-Glucuronosyltransferase UGT1A9 metabolisiert wird.
Die Anwendung von Ketoconazol (400 mg für 18 Tage), einem starken CYP3A4‑Inhibitor, mit einer Einzeldosis Regorafenib (160 mg an Tag 5) führte zu einem Anstieg der mittleren Bioverfügbarkeit (AUC) von Regorafenib von etwa 33% und einer Verringerung der mittleren Bioverfügbarkeit der aktiven Metaboliten M‑2 (N‑Oxid) und M‑5 (N‑Oxid und N‑Desmethyl) von etwa 90%. Es wird empfohlen, die gleichzeitige Anwendung von starken Inhibitoren der CYP3A4‑Aktivität (z. B. Clarithromycin, Grapefruitsaft, Itraconazol, Ketoconazol, Posaconazol, Telithromycin und Voriconazol) zu vermeiden, da ihr Einfluss auf die Bioverfügbarkeit von Regorafenib und seinen Metaboliten im Steady State nicht untersucht wurde.
Die gleichzeitige Gabe starker UGT1A9‑Inhibitoren (z. B. Mefenaminsäure, Diflunisal und Nifluminsäure) während der Behandlung mit Regorafenib ist zu vermeiden, da deren Einfluss auf die Bioverfügbarkeit von Regorafenib und seinen Metaboliten im Steady State nicht untersucht wurde.
Die Anwendung von Rifampicin (600 mg für 9 Tage), einem starken CYP3A4‑Induktor, mit einer Einzeldosis Regorafenib (160 mg an Tag 7) führte zu einer Verringerung der AUC von Regorafenib von etwa 50%, einem 3‑ bis 4‑fachen Anstieg der mittleren Bioverfügbarkeit des aktiven Metaboliten M‑5 und keiner Veränderung der Bioverfügbarkeit des aktiven Metaboliten M‑2. Andere starke CYP3A4‑Induktoren (z. B. Phenytoin, Carbamazepin, Phenobarbital und Johanniskraut) können die Metabolisierung von Regorafenib ebenfalls erhöhen. Starke CYP3A4‑Induktoren sollten vermieden oder es sollte die Wahl eines anderen gleichzeitig verabreichten Arzneimittels in Erwägung gezogen werden, das über kein oder nur geringes Potenzial zur CYP3A4‑Induzierung verfügt.
UGT1A1‑ und UGT1A9‑Substrate
In vitro Daten zeigen, dass sowohl Regorafenib als auch sein aktiver Metabolit M‑2 die durch UGT1A1 und UGT1A9 vermittelte Glucuronidierung in Konzentrationen hemmen, die in vivo im Steady State erreicht werden, während M‑5 nur UGT1A1 hemmt. Die Anwendung von Regorafenib mit einer 5‑tägigen Unterbrechung vor der Anwendung von Irinotecan führte zu einem Anstieg von etwa 44% der AUC von SN‑38, einem UGT1A1‑Substrat und aktivem Metaboliten von Irinotecan. Ein Anstieg der AUC von Irinotecan von etwa 28% wurde ebenfalls beobachtet. Dies zeigt, dass die gleichzeitige Anwendung von Regorafenib die systemische Bioverfügbarkeit von UGT1A1‑ und UGT1A9‑Substraten erhöhen kann.
Breast Cancer Resistance Protein (BCRP)‑ und P‑Glykoprotein-Substrate
Die Anwendung von Regorafenib (160 mg für 14 Tage) vor der Anwendung einer Einzeldosis Rosuvastatin (5 mg), ein BCRP‑Substrat, führte zu einer 3,8‑fachen Steigerung der mittleren Bioverfügbarkeit (AUC) von Rosuvastatin und einem 4,6‑fachen Anstieg der Cmax.
Dies zeigt, dass die gleichzeitige Anwendung von Regorafenib die Plasmakonzentrationen von anderen gleichzeitig verabreichten BCRP‑Substraten (z. B. Methotrexat, Fluvastatin, Atorvastatin) erhöhen kann. Daher wird empfohlen, die Patienten engmaschig auf Anzeichen und Symptome einer erhöhten Exposition mit BCRP‑Substraten zu überwachen.
Klinische Daten zeigen, dass Regorafenib keine Wirkung auf die Pharmakokinetik von Digoxin aufweist und daher gleichzeitig, ohne eine klinisch relevante Wechselwirkung, mit P‑Glykoprotein‑Substraten wie Digoxin verabreicht werden kann.
P‑Glykoprotein‑ und BCRP‑Inhibitoren/P‑Glykoprotein‑ und BCRP‑Induktoren
In‑vitro-Studien zeigen, dass die aktiven Metaboliten M‑2 und M‑5 Substrate von P‑Glykoprotein und BCRP sind. Inhibitoren und Induktoren von BCRP und P‑Glykoprotein können die Bioverfügbarkeit von M‑2 und M‑5 beeinträchtigen. Die klinische Signifikanz dieser Erkenntnisse ist nicht bekannt (siehe auch Abschnitt 5.2).
CYP‑Isoform‑selektive Substrate
In vitro Daten zeigen, dass Regorafenib ein kompetitiver Inhibitor der Cytochrome CYP2C8 (Ki-Wert von 0,6 Mikromolar), CYP2C9 (Ki‑Wert von 4,7 Mikromolar) und CYP2B6 (Ki‑Wert von 5,2 Mikromolar) bei Konzentrationen ist, die in vivo im Steady State erreicht werden (maximale Plasmakonzentration von 8,1 Mikromolar). In vitro war das Ausmaß der Hemmung gegenüber CYP3A4 (Ki‑Wert von 11,1 Mikromolar) und CYP2C19 (Ki‑Wert von 16,4 Mikromolar) weniger ausgeprägt.
Eine klinische Substratstudie zur Evaluierung der Wirkung von 160 mg Regorafenib nach einer Dosierungsdauer von 14 Tagen auf die Pharmakokinetik der Prüfsubstrate CYP2C8 (Rosiglitazon) CYP2C9 (S‑Warfarin), CYP2C19 (Omeprazol) und CYP3A4 (Midazolam) wurde durchgeführt.
Pharmakokinetische Daten zeigen an, dass Regorafenib ohne klinisch relevante Wechselwirkungen gleichzeitig mit Substraten von CYP2C8, CYP2C9, CYP3A4 und CYP2C19 angewendet werden kann (siehe auch Abschnitt 4.4).
Antibiotika
Das Konzentrations-Zeit-Profil zeigt an, dass Regorafenib und seine Metaboliten einem enterohepatischen Kreislauf unterliegen können (siehe Abschnitt 5.2). Die gleichzeitige Anwendung von Neomycin, einem schwach resorbierten, antimikrobiellen, zur Eradikation der gastrointestinalen Mikroflora angewendeten Mittel (welches den enterohepatischen Kreislauf von Regorafenib beeinträchtigen kann), hatte keinen Effekt auf die Bioverfügbarkeit von Regorafenib, aber es gab eine ungefähr 80%ige Abnahme der Bioverfügbarkeit der aktiven Metaboliten M‑2 und M‑5, welche in vitro und in vivo eine vergleichbare Aktivität zu Regorafenib zeigten. Die klinische Signifikanz dieser Neomycin Wechselwirkung ist nicht bekannt, kann aber zu einer verringerten Wirksamkeit von Regorafenib führen. Pharmakokinetische Wechselwirkungen anderer Antibiotika wurden nicht untersucht.
Gallensalz‑komplexbildende Substanzen
Regorafenib, M‑2 und M‑5 können einem enterohepatischen Kreislauf unterliegen (siehe Abschnitt 5.2). Gallensalz‑komplexbildende Substanzen wie Cholestyramin und Cholestagel können mit Regorafenib interagieren, indem sie unlösliche Komplexe bilden. Dies kann die Absorption (oder Reabsorption) beeinflussen und zu einer verringerten Bioverfügbarkeit führen. Die klinische Signifikanz dieser möglichen Wechselwirkungen ist nicht bekannt, kann aber zu einer verringerten Wirksamkeit von Regorafenib führen.
Frauen im gebärfähigen Alter/Kontrazeption bei Männern und Frauen
Frauen im gebärfähigen Alter müssen darüber informiert werden, dass Regorafenib gesundheitliche Schäden beim ungeborenen Kind verursachen kann.
Frauen im gebärfähigen Alter und Männer müssen während der Behandlung und bis 8 Wochen nach Behandlungsende eine zuverlässige Verhütungsmethode anwenden.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Regorafenib bei Schwangeren vor.
Aufgrund seines Wirkmechanismus besteht der Verdacht, dass eine Anwendung von Regorafenib während der Schwangerschaft das ungeborene Kind schädigen kann. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Stivarga darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich und nur nach sorgfältiger Abwägung des Nutzens für die Mutter und der Risiken für das ungeborene Kind.
Stillzeit
Es ist nicht bekannt, ob Regorafenib oder seine Metaboliten in die Muttermilch übergehen.
Bei Ratten gehen Regorafenib oder seine Metaboliten in die Muttermilch über. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden. Es ist möglich, dass Regorafenib Wachstum und Entwicklung des Säuglings schädigt (siehe Abschnitt 5.3).
Das Stillen muss während der Behandlung mit Stivarga unterbrochen werden.
Fertilität
Bisher liegen keine Erfahrungen zur Wirkung von Stivarga auf die Fertilität beim Menschen vor. Ergebnisse aus tierexperimentellen Studien deuten darauf hin, dass Regorafenib die Fertilität bei Männern und Frauen beeinträchtigen kann (siehe Abschnitt 5.3).
Es wurden keine Studien zu den Auswirkungen von Stivarga auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen durchgeführt. Falls bei den Patienten unter Stivarga Symptome auftreten, die die Konzentrations- und Reaktionsfähigkeit beeinträchtigen, sollten sie nicht aktiv am Straßenverkehr teilnehmen oder Maschinen bedienen, bis die Beschwerden abgeklungen sind.
Zusammenfassung des Sicherheitsprofils
Das allgemeine Sicherheitsprofil von Stivarga basiert auf den Daten von mehr als 4.800 behandelten Patienten aus klinischen Studien, einschließlich Placebo‑kontrollierter Phase III‑Daten von 636 Patienten mit KRK, 132 Patienten mit GIST und 374 Patienten mit HCC.
Das Sicherheitsprofil von Regorafenib in diesen Studien war konsistent mit den Sicherheitsergebnissen einer Phase III B‑Studie, die an 2872 Patienten mit KRK durchgeführt wurde, deren Erkrankung nach Behandlung mit Standardtherapien progredient war.
Die schwerwiegendsten unerwünschten Arzneimittelwirkungen bei mit Stivarga behandelten Patienten sind schwere Leberschäden, Hämorrhagie, Magen-Darmperforation und Infektion.
Die am häufigsten beobachteten unerwünschten Arzneimittelwirkungen (≥ 30%) bei mit Stivarga behandelten Patienten sind Schmerzen, HFHR, Asthenie/Müdigkeit, Diarrhoe, verminderter Appetit und verminderte Nahrungsaufnahme, Hypertonie und Infektionen.
Tabellarische Auflistung der Nebenwirkungen
Unerwünschte Arzneimittelwirkungen, die in klinischen Studien bei mit Stivarga behandelten Patienten beobachtet wurden, werden in Tabelle 3 aufgelistet. Sie sind entsprechend der Systemorganklassen klassifiziert und es wird der am besten geeignete MedDRA‑Begriff verwendet, um eine bestimmte Reaktion und ihre Synonyme und die damit verbundenen Symptome zu beschreiben.
Unerwünschte Arzneimittelwirkungen aus klinischen Studien werden entsprechend ihrer Häufigkeit zusammengefasst. Zur Klassifizierung der Häufigkeitsgruppen werden die folgenden Kategorien verwendet: sehr häufig (≥ 1/10); häufig (≥ 1/100, < 1/10); gelegentlich (≥ 1/1.000, < 1/100); und selten (≥ 1/10.000, < 1/1.000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Tabelle 3: Unerwünschte Arzneimittelwirkungen (UAW), die in klinischen Studien und nach der Markteinführung bei mit Stivarga behandelten Patienten berichtet wurden
Systemorganklasse | Sehr häufig | Häufig | Gelegentlich | Selten | Nicht bekannt |
Infektionen und parasitäre Erkrankungen | Infektion* | ||||
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen) | Keratoakanthom/Plattenepithelkarzinom der Haut | ||||
Erkrankungen des Blutes und des Lymphsystems | Thrombozytopenie | Leukopenie | Thrombotische Mikroangiopathie | ||
Erkrankungen des Immunsystems | Überempfind-lichkeitsreaktion | ||||
Endokrine Erkrankungen | Hypothyreose | ||||
Stoffwechsel- und Ernährungsstörungen | Verminderter Appetit und verminderte Nahrungsaufnahme | Hypokaliämie | |||
Erkrankungen des Nervensystems | Kopfschmerzen | Posteriores reversibles Enzephalopathie-Syndrom (PRES) | Hyperammonämische Enzephalopathie | ||
Herzerkrankungen | Myokardinfarkt | ||||
Gefäßerkrankungen | Hämorrhagie* | Hypertensive Krise | Aneurysmen und Arteriendissektionen | ||
Erkrankungen der Atemwege, des Brustraums und Mediastinums | Dysphonie | ||||
Erkrankungen des Gastrointestinaltrakts | Diarrhoe | Geschmacksstörungen | Darmperforation* | ||
Leber- und Gallenerkrankungen | Hyperbilirubinämie | Schwere Leberschäden (einschließlich Leberversagen)*# | |||
Erkrankungen der Haut und des Unterhautzellgewebes | HFHR** | Alopezie Exfoliative Dermatitis | Nagelerkrankung | Stevens‑Johnson-Syndrom | |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Muskelspasmen | ||||
Erkrankungen der Nieren und Harnwege | Proteinurie | ||||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Asthenie/Müdigkeit | ||||
Untersuchungen | Gewichtsverlust | Erhöhung der Amylase |
* Fälle mit tödlichem Ausgang wurden berichtet
** in der MedDRA‑Terminologie palmar‑plantares Erythrodysästhesiesyndrom genannt
***Die am häufigsten berichteten Schmerzarten (>10%) sind Abdominalschmerzen und Rückenschmerzen.
# gemäß der Kriterien zu arzneimittelinduzierten Leberschäden (DILI) der internationalen DILI‑Experten-Arbeitsgruppe
Beschreibung ausgewählter Nebenwirkungen
In den meisten Fällen von schwerem Leberschaden setzte die hepatische Dysfunktion innerhalb der ersten 2 Behandlungsmonate ein und war durch hepatozelluläre Schädigung mit Transaminasenanstieg > 20 fache ONG und anschließende Erhöhung des Bilirubins charakterisiert. In klinischen Studien wurde bei japanischen Patienten, die mit Stivarga behandelt wurden, eine höhere Inzidenz an schwerem Leberschaden mit tödlichem Ausgang beobachtet (~1,5%) als bei nicht‑japanischen Patienten (< 0,1%).
In den Placebo‑kontrollierten Phase‑III-Studien lag die Gesamtinzidenz von Blutungen der mit Stivarga behandelten Patienten bei 18,2% und der mit Placebo behandelten Patienten bei 9,5%. In den meisten Fällen waren die Blutungsereignisse der mit Stivarga behandelten Patienten von leichtem bis mittelschwerem Schweregrad (Grad 1 und 2: 15,2%), und hier insbesondere Epistaxis (6,1%). Ereignisse, die zum Tod führten, traten bei den mit Stivarga behandelten Patienten gelegentlich (0,7%) auf, wobei zerebrale, Atemwegs-, Magen-Darm-Trakt- und Urogenitaltrakt- Ereignisse inbegriffen waren.
In den Placebo‑kontrollierten Phase‑III-Studien wurden Infektionen häufiger bei den mit Stivarga behandelten Patienten beobachtet als bei Patienten, die Placebo erhielten (alle Grade: 31,6% vs. 17,2%). Die meisten Infektionen bei den mit Stivarga behandelten Patienten waren von leichtem bis mittelschwerem Schweregrad (Grad 1 und 2: 23,0%) und schlossen sowohl Infektionen der Harnwege (5,7%), Nasopharyngitis (4,0%) als auch mukokutane und systemische Pilzinfektionen (3,3%) sowie Lungenentzündung (2,6%) mit ein. Infektionen mit tödlichem Ausgang wurden bei Patienten, die mit Stivarga behandelt wurden (1,0%) öfter beobachtet verglichen mit Patienten, die Placebo erhielten (0,3%) und diese waren hauptsächlich Atemwegsereignisse.
In den Placebo‑kontrollierten Phase‑III-Studien lag die Gesamtinzidenz einer HFHR der mit Stivarga behandelten Patienten höher gegenüber der mit Placebo behandelten Patienten (alle Grade: 51.4% vs. 6.5% KRK, 66.7% vs. 15.2% GIST und 51.6% vs.7.3% HCC). Die meisten Fälle einer HFHR der mit Stivarga behandelten Patienten traten während des ersten Behandlungszyklus auf und waren von leichtem bis mittelschwerem Schweregrad (Grad 1 und 2: 34,3%, KRK 44,7%, GIST und 39,3%, HCC). Die Inzidenz einer Grad 3 HFHR lag bei 17,1% (KRK), 22,0% (GIST) und 12,3% (HCC). Im Vergleich zu anderen ethnischen Gruppen war die Gesamtinzidenz einer HFHR bei mit Stivarga behandelten asiatischen Patienten höher (74,8%, KRK, 88,2%, GIST und 67,1% HCC). Die Inzidenz einer Grad 3 HFHR bei Asiaten lag bei 20,5% (KRK), 23,5% (GIST) und 13,5% (HCC) (siehe Abschnitte 4.2 und 4.4).
Bei den Placebo‑kontrollierten Phase‑III-Studien lag die Gesamtinzidenz einer Hypertonie bei mit Stivarga behandelten Patienten höher als bei mit Placebo behandelten Patienten (29,6% vs. 7,5% KRK, 60,6% vs. 25,8% GIST und 31,0% vs. 6,2% HCC). Die meisten Fälle einer Hypertonie der mit Stivarga behandelten Patienten traten während des ersten Behandlungszyklus auf und waren von leichtem bis mittelschwerem Schweregrad (Grad 1 und 2: 20,9%, KRK, 31,8%, GIST und 15,8% HCC). Die Inzidenz einer Grad 3 Hypertonie lag bei 8,7% (KRK), 28,0% (GIST) und 15,2% (HCC). Ein Fall einer Grad 4 Hypertonie wurde in der GIST‑Studie berichtet.
In den Placebo‑kontrollierten Phase‑III-Studien betrug die Gesamtinzidenz von einer unter der Therapie auftretenden Proteinurie bei den mit Stivarga behandelten Patienten 9,1%, gegenüber 1,9% bei den mit Placebo behandelten Patienten. 35,6% dieser Ereignisse im Stivarga-Arm bzw. 54,5% im Placebo-Arm wurden als nicht wiederhergestellt gemeldet.
In allen klinischen Studien wurden Ereignisse einer Herzerkrankung (alle Grade) häufiger (13,7% vs. 6,5%) bei mit Stivarga behandelten Patienten, die 75 Jahre oder älter waren (n = 410), als bei mit Stivarga behandelten Patienten, die jünger als 75 Jahre waren (n = 4108) berichtet.
Abweichende Laborwerte
Unter der Therapie beobachtete Abweichungen von Laborwerten, die bei Placebo‑kontrollierten Phase‑III-Studien beobachtet wurden, werden in Tabelle 4 und Tabelle 4a aufgelistet (siehe auch Abschnitt 4.4).
Tabelle 4: Unter der Therapie beobachtete Abweichungen von Laborwerten, die bei Patienten mit metastasiertem KRK in Placebo‑kontrollierten Phase‑III-Studien (CORRECT), GIST (GRID) und HCC (RESORCE) berichtet wurden
mKRK (CORRECT) | GIST (GRID) | HCC (RESORCE) | ||||||||||
Labor-Parameter | Stivarga plus | Placebo plus BSC | Stivarga plus BSC | Placebo plus BSC | Stivarga plus | Placebo plus BSC | Stivarga plus BSC | Placebo plus BSC | Stivarga plus BSC | Placebo plus BSC (n = 193) | Stivarga plus BSC | Placebo plus BSC |
Grade a | Grade b | Grade b | ||||||||||
Alle Grade % | Grade 3/4 % | Alle Grade % | Grad 3/4 % | Alle Grade % | Grad 3/4 % | |||||||
Erkrankungen des Blutes und des Lymphsystems | ||||||||||||
Hämoglobin erniedrigt | 78,5 | 66,3 | 5,3 | 2,8 | 75,0 | 72,7 | 3,0 | 1,5 | 72,5 | 71,3 | 6,0 | 4,8 |
Thrombozytenzahl erniedrigt | 40,5 | 16,8 | 2,8 | 0,4 | 12,9 | 1,5 | 0,8 | 1,5 | 63,1 | 50,0 | 5,4 | 0 |
Neutrophilenzahl erniedrigt | 2,8 | 0 | 0,6 | 0 | 15,9 | 12,1 | 3,1 | 3,0 | 13,6 | 14,9 | 3,0 | 1,0 |
Lymphozytenzahl erniedrigt | 54,1 | 34,8 | 9,3 | 4,0 | 29,9 | 24,2 | 7,6 | 3,0 | 67,8 | 58,5 | 17,4 | 11,7 |
Stoffwechsel- und Ernährungsstörungen | ||||||||||||
Kalzium erniedrigt | 59,3 | 18,3 | 1,2 | 1,2 | 16,7 | 4,5 | 1,5 | 0 | 23,4 | 10,1 | 0,3 | 0 |
Kalium erniedrigt | 25,7 | 8,3 | 4,3 | 0,4 | 20,5 | 3,0 | 3,0 | 0 | 30,7 | 9,0 | 4,3 | 2,1 |
Phosphat erniedrigt | 57,4 | 11,1 | 31,1 | 3,6 | 54,5 | 3,1 | 21,2 | 1,5 | 70,4 | 31,4 | 33,9 | 6,9 |
Leber- und Gallenerkrankungen | ||||||||||||
Bilirubin erhöht | 44,6 | 17,1 | 12,2 | 8,4 | 33,3 | 12,1 | 3,8 | 1,5 | 78,2 | 54,5 | 15,9 | 15,7 |
AST erhöht | 65,0 | 45,6 | 5,9 | 5,2 | 58,3 | 47,0 | 3,8 | 3,0 | 92,7 | 84,3 | 17,8 | 19,9 |
ALT erhöht | 45,2 | 29,8 | 5,5 | 3,2 | 39,4 | 39,4 | 4,6 | 1,5 | 70,4 | 58,6 | 6,2 | 4,7 |
Erkrankungen der Nieren und Harnwege | ||||||||||||
Proteinurie | 83,6 | 61,0 | 1,8 | 0,8 | 59,2 | 52,5 | 3,1 | 3,4 | 51,0 | 36,5 | 16,7 | 3,1 |
Untersuchungen | ||||||||||||
INR* erhöht | 23,7 | 16,6 | 4,2 | 1,6 | 9,3 | 12,5 | 1,6 | 4,7 | 44,4 | 35,4 | 0,7 | 2,1 |
Lipase erhöht | 46,0 | 18,7 | 11,4 | 4,4 | 14,4 | 4,6 | 0,8 | 0 | 40,5 | 27,0 | 14,2 | 8,7 |
Amylase erhöht | 25,5 | 16,7 | 2,6 | 2,4 | - | - | - | - | 23,0 | 19,0 | 2,8 | 2,7 |
a Allgemeine Terminologiekriterien von unerwünschten Ereignissen (Common Terminology Criteria for Adverse Events, CTCAE), Version 3.0
b Allgemeine Terminologiekriterien von unerwünschten Ereignissen (Common Terminology Criteria for Adverse Events, CTCAE), Version 4.0
* International Normalised Ratio
BSC = Best Supportive Care, Beste unterstützende Therapie
Im Vergleich zur global durchgeführten Phase‑III-Studie zum KRK (CORRECT), an der vorwiegend (~ 80 %) kaukasische Patienten teilnahmen, wurde in der in Asien durchgeführten Phase‑III-Studie zum KRK (CONCUR), an der vorwiegend (> 90 %) ostasiatische Patienten teilnahmen, bei mit Stivarga behandelten Patienten eine höhere Inzidenz erhöhter Leberenzymwerte beobachtet.
Tabelle 4a: Unter der Therapie beobachtete Abweichungen von Leberenzymwerten, die bei asiatischen Patienten mit metastasiertem KRK in einer Placebo‑kontrollierten Phase‑III-Studie (CONCUR) berichtet wurden
Labor-Parameter | Stivarga plus BSC§ | Placebo plus BSC§ | ||||
Alle Grade* | Grad 3* | Grad 4* | Alle Grade* | Grad 3* | Grad 4* | |
Bilirubin erhöht | 66,7 | 7,4 | 4,4 | 32,8 | 4,5 | 0,0 |
AST erhöht | 69,6 | 10,4 | 0,7 | 47,8 | 3,0 | 0,0 |
ALT erhöht | 54,1 | 8,9 | 0,0 | 29,9 | 1,5 | 0,0 |
§ Beste unterstützende Therapie
* Allgemeine Terminologiekriterien von unerwünschten Ereignissen (Common Terminology Criteria for Adverse Events, CTCAE), Version 4.0
In den Placebo‑kontrollierten Phase‑III-Studien war der Wert des Thyreoidea‑stimulierenden Hormons (TSH) in Untersuchungen nach Therapiebeginn bei 34,6% der mit Stivarga behandelten Patienten und 17,2% der Patienten, die Placebo erhielten, > ONG. Ein TSH‑Wert > 4 x ONG wurde nach Therapiebeginn bei 6,5% der mit Stivarga behandelten Patienten und 1,3% der Patienten, die Placebo erhielten, festgestellt. Ein Konzentrationsabfall von freiem Trijodthyronin (FT3) unter die untere Normgrenze (< UNG) wurde nach Therapiebeginn bei 29,2% der mit Stivarga behandelten Patienten und 20,4% der Patienten, die Placebo erhielten, festgestellt. Ein Konzentrationsabfall von freiem Thyroxin (FT4) < UNG wurde nach Therapiebeginn bei 8,1% der mit Stivarga behandelten Patienten und 5,6% der Patienten, die Placebo erhielten, festgestellt. Insgesamt ungefähr 4,6% der mit Stivarga behandelten Patienten entwickelten eine Hypothyreose, die eine Hormonersatzbehandlung erforderlich machte.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
Die höchste klinisch untersuchte Dosis betrug 220 mg Stivarga pro Tag. Die am häufigsten beobachteten unerwünschten Arzneimittelwirkungen bei dieser Dosis waren dermatologische Ereignisse, Dysphonie, Diarrhoe, Schleimhautentzündung, Mundtrockenheit, verminderter Appetit, Hypertonie und Müdigkeit.
Es gibt kein spezifisches Antidot für den Fall einer Stivarga-Überdosierung. Besteht der Verdacht einer Überdosierung, sollte die Einnahme von Stivarga unverzüglich abgesetzt und die bestmögliche Behandlung durch medizinisches Fachpersonal eingeleitet werden, sowie der Patient bis zur klinischen Stabilisierung unter Beobachtung bleiben.
Pharmakotherapeutische Gruppe: Antineoplastische Mittel, Proteinkinase-Inhibitor, ATC‑Code: L01EX05
Wirkmechanismus und pharmakodynamische Wirkungen
Regorafenib ist ein oraler Tumordeaktivator, der multiple Proteinkinasen wirksam blockiert, einschließlich Kinasen, die an der Tumorangiogenese (VEGFR1, ‑2, ‑3, Tie2), Onkogenese (KIT, RET, RAF‑1, BRAF, BRAFV600E), Metastasierung (VEGFR3, PDGFR, FGFR) und Tumorimmunität (CSF1R) beteiligt sind. Regorafenib hemmt insbesondere mutiertes KIT, einen wichtigen onkogenen Faktor gastrointestinaler Stromatumoren, und blockiert dadurch die Proliferation der Tumorzellen. In präklinischen Studien zeigte Regorafenib bei einer Vielzahl von Tumormodellen, einschließlich kolorektaler, gastrointestinaler Stroma- und hepatozellulärer Tumormodelle, eine starke, gegen Tumoren gerichtete Aktivität, die wahrscheinlich durch seine antiangiogenen und antiproliferativen Wirkungen vermittelt wird. Zusätzlich reduzierte Regorafenib die Spiegel von Tumor‑assoziierten Makrophagen und zeigte Regorafenib in vivo antimetastatische Wirkungen. Wichtige humane Metaboliten (M‑2 und M‑5) wiesen im Vergleich zu Regorafenib eine ähnliche Wirksamkeit in in vitro- und in vivo-Modellen auf.
Klinische Wirksamkeit und Sicherheit
KRK
Die klinische Wirksamkeit und Sicherheit von Stivarga wurden in einer internationalen, multizentrischen, randomisierten, doppelblinden, Placebo‑kontrollierten Phase‑III-Studie (CORRECT) bei Patienten mit KRK untersucht, deren Erkrankung nach Versagen der Standardtherapie weiter fortgeschritten war.
Der primäre Wirksamkeitsendpunkt war das Gesamtüberleben (OS). Sekundäre Endpunkte waren das progressionsfreie Überleben (PFS), die objektive Tumoransprechrate (ORR) und die Krankheitskontrollrate (DCR).
Insgesamt wurden 760 Patienten im Verhältnis von 2:1 randomisiert und erhielten entweder oral 160 mg Regorafenib (4 Tabletten Stivarga mit jeweils 40 mg Regorafenib) einmal täglich (n = 505) plus bestmögliche unterstützende Behandlung (BSC) oder ein entsprechendes Placebo (n = 255) plus BSC über 3 Wochen hinweg, gefolgt von einer einwöchigen Therapiepause. Die durchschnittliche täglich verabreichte Regorafenib-Dosis betrug 147 mg.
Patienten setzten die Therapie bis zur Krankheitsprogression oder einer inakzeptablen Toxizität fort. Eine im Voraus geplante Zwischenanalyse zur Wirksamkeit wurde nach 432 Todesfällen durchgeführt. Die Studie wurde entblindet, nachdem diese geplante Zwischenanalyse zum OS die vorher festgelegte Wirksamkeitsgrenze überschritten hatte.
Bei den 760 randomisierten Patienten lag das mittlere Alter bei 61 Jahren, 61% waren männlich, 78% Kaukasier, und alle Patienten hatten einen anfänglichen ECOG Leistungsstatus (performance status, PS) von 0 oder 1. Ein PS ≥ 2 wurde während der Behandlung mit Stivarga bei 11,4% der Patienten festgestellt. Die mediane Behandlungsdauer und Tagesdosis sowie Dosismodifikations- und Dosisreduktionsraten waren mit den Placebo-Patienten mit PS ≥ 2 vergleichbar (8,3%). Die Mehrheit der Patienten mit PS ≥ 2 brach die Therapie aufgrund einer Krankheitsprogression ab. Die Erkrankung trat primär im Kolon (65%), im Rektum (29%) oder in beiden (6%) auf. Zu Studienbeginn lag bei 57% aller Patienten eine KRAS‑Mutation vor.
Bei den meisten Patienten (52%) wurde die metastasierte Erkrankung zuvor mit 3 oder weniger Therapielinien behandelt. Diese Therapien umfassten eine Behandlung mit einer Fluoropyrimidin‑basierten Chemotherapie, eine Anti‑VEGF-Therapie und, wenn beim Patienten ein KRAS‑Wildtyp vorlag, eine Anti‑EGFR-Therapie.
Die Verabreichung von Stivarga zusätzlich zu einer BSC führte zu einem signifikant verlängerten Überleben im Vergleich mit Placebo plus BSC mit einem p‑Wert von 0,005178 im stratifizierten Log‑Rank-Test, einer Hazard Ratio von 0,774 [95% KI 0,636, 0,942] und einem medianen OS von 6,4 Monaten vs. 5,0 Monaten (siehe Tabelle 5 und Abbildung 1). Bei Patienten, die Stivarga plus BSC erhielten, war das PFS signifikant länger (Hazard Ratio: 0,494, p < 0,000001, siehe Tabelle 5). Die Ansprechrate (komplette oder partielle Remission) betrug 1% für mit Stivarga behandelte Patienten und 0,4% für mit Placebo behandelte Patienten (p = 0,188432, einseitig). Die DCR (komplette bzw. partielle Remission oder stabile Erkrankung) war bei mit Stivarga behandelten Patienten signifikant höher (41,0% versus 14,9%, p < 0,000001, einseitig).
Tabelle 5: Ergebnisse zur Wirksamkeit aus der CORRECT‑Studie
Wirksamkeits-Parameter | Hazard Ratio* (95% KI) | p‑Wert | Median (95% KI) | |
Stivarga plus BSC§ | Placebo plus BSC§ | |||
OS | 0,774 | 0,005178 | 6,4 Monate | 5,0 Monate |
PFS ** | 0,494 | < 0,000001 | 1,9 Monate | 1,7 Monate |
§ Beste unterstützende Therapie
* Hazard Ratio < 1 favorisiert Stivarga
** basierend auf der Beurteilung des Tumoransprechens durch den Prüfarzt
Abbildung 1: Kaplan-Meier-Kurve zum OS
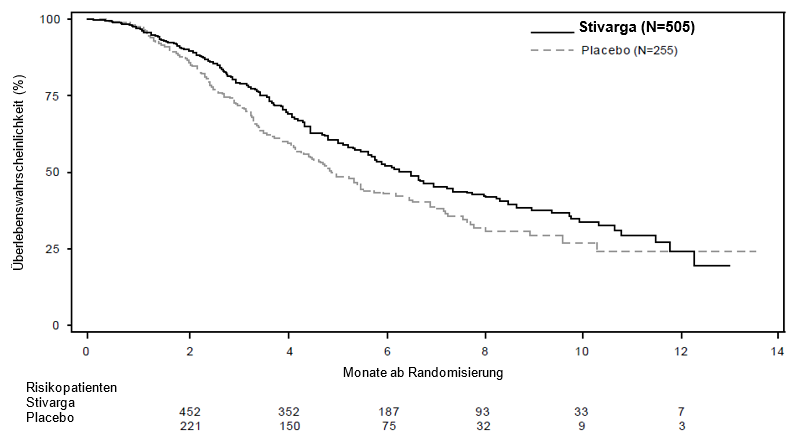
Subgruppen-Analysen zeigten einen Behandlungseffekt zugunsten von Regorafenib- gegenüber Placebogabe im Hinblick auf OS und PFS bezogen auf Alter (< 65; ≥ 65), Geschlecht, ECOG PS, Primärlokalisation der Erkrankung, Zeit seit der Diagnosestellung der metastasierten Erkrankung, vorangehende Krebstherapien, vorangehende Therapielinien gegen die metastasierte Erkrankung und KRAS‑Mutations-Status.
Subgruppen-Analysen nach anamnestischem KRAS‑Mutations-Status zeigten einen Behandlungseffekt für das OS bei Patienten mit KRAS‑Wildtyp Tumoren zugunsten von Regorafenib gegenüber Placebo, während ein numerisch geringerer Effekt für Patienten mit KRAS‑mutierten Tumoren berichtet wurde. Der Behandlungseffekt beim progressionsfreien Überleben PFS zugunsten von Regorafenib wurde unabhängig vom KRAS‑Mutations-Status beobachtet. Die Hazard Ratio (95% CI) hinsichtlich des OS betrug 0,653 (0,476 bis 0,895) bei Patienten mit KRAS‑Wildtyp Tumoren und 0,867 (0,670 bis 1,123) bei Patienten mit KRAS‑mutierten Tumoren, ohne Hinweis auf Heterogenität des Behandlungseffektes (nicht signifikanter Interaktionstest). Die Hazard Ratio (95% CI) hinsichtlich PFS betrug 0,475 (0,362 bis 0,623) bei Patienten mit KRAS‑Wildtyp Tumoren und 0,525 (0,425 bis 0,649) bei Patienten mit KRAS‑mutierten Tumoren.
Eine zweite internationale, multizentrische, randomisierte, doppelblinde, Placebo‑kontrollierte Phase‑III-Studie (CONCUR) untersuchte die Wirksamkeit und Sicherheit von Stivarga bei 204 zuvor behandelten asiatischen Patienten (> 90 % aus Ostasien) mit KRK, bei denen nach erfolgloser Fluoropyrimidin‑basierter Chemotherapie die Krankheit fortschritt. Von den an der CONCUR‑Studie teilnehmenden Patienten waren nur 59,5 % zuvor ebenfalls mit gegen VEGF oder EGFR gerichteten Arzneimitteln behandelt worden. Der primäre Wirksamkeitsendpunkt war das OS. Die Verabreichung von Stivarga zusätzlich zu einer BSC führte zu einem signifikant verlängerten Überleben im Vergleich mit Placebo plus BSC, mit einer Hazard Ratio von 0,550 (p = 0,000159 stratifizierter Log‑Rank-Test) und einem medianen OS von 8,8 Monaten vs. 6,3 Monaten [95% CI 0,395, 0,765]. Das PFS war ebenfalls signifikant verlängert bei Patienten, die Stivarga plus BSC erhielten (Hazard Ratio: 0,311, p < 0,000001), mit einem medianen PFS von 3,2 Monaten bei Stivarga vs. 1,7 Monaten bei Placebo. Das Sicherheitsprofil von Stivarga plus BSC in der CONCUR‑Studie stimmte mit dem in der CORRECT‑Studie beobachteten Sicherheitsprofil überein.
GIST
Die klinische Wirksamkeit und Sicherheit von Stivarga wurden in einer internationalen, multizentrischen, randomisierten, doppelblinden, Placebo‑kontrollierten Phase‑III-Studie (GRID) bei Patienten mit GIST untersucht, die zuvor mit 2 Tyrosinkinase-Inhibitoren (Imatinib und Sunitinib) behandelt worden waren.
Die Analyse des primären Wirksamkeitsendpunktes progressionsfreies Überleben (PFS) wurde nach 144 PFS‑Ereignissen (verblindete zentrale Auswertung) durchgeführt. Sekundäre Endpunkte wie etwa Zeitspanne bis zur Progression (TTP) und Gesamtüberleben (OS) (Zwischenanalyse) wurden ebenfalls beurteilt.
Insgesamt wurden 199 Patienten mit GIST im Verhältnis 2:1 randomisiert und erhielten im Rahmen einer Therapie 3 Wochen lang entweder 160 mg Regorafenib plus beste unterstützende Therapie (BSC; N = 133) oral einmal täglich oder ein entsprechendes Placebo plus BSC (N = 66), gefolgt von 1 Woche Therapiepause. Die mittlere erhaltene Tagesdosis Regorafenib betrug 140 mg.
Patienten setzten die Therapie bis zur Krankheitsprogression oder einer inakzeptablen Toxizität fort. Patienten, die Placebo erhielten und bei denen es zu einer Krankheitsprogression kam, konnten unverblindet auf Regorafenib wechseln (Cross-over-Option). Patienten, die Regorafenib erhielten, und bei denen es zu einer Krankheitsprogression kam und nach Meinung des Prüfarztes die Behandlung mit Regorafenib einen klinischen Nutzen darstellte, wurde die Möglichkeit geboten, mit einer unverblindeten Regorafenib-Einnahme fortzufahren.
Bei den 199 randomisierten Patienten lag das mittlere Alter bei 58 Jahren, 64% waren männlich, 68% Kaukasier, und alle Patienten hatten einen anfänglichen ECOG Leistungsstatus (performance status, PS) von 0 oder 1. Die mediane Gesamtzeit von der letzten Progression oder Rezidiv bis zur Randomisierung betrug 6 Wochen.
Regorafenib plus BSC führte zu einem signifikant verlängerten PFS im Vergleich mit Placebo plus BSC, mit einem Hazard Ratio von 0,268 [95% KI 0,185, 0,388] und medianem PFS von 4,8 Monaten vs. 0,9 Monaten (p < 0,000001). Das relative Risiko einer Krankheitsprogression oder eines Todesfalls wurde bei mit Regorafenib behandelten Patienten um etwa 73,2% gegenüber Patienten, die Placebo erhielten, verringert (siehe Tabelle 6, Abbildung 2). Die Verlängerung des PFS war durchgehend unabhängig von Alter, Geschlecht, geografischer Region, früheren Therapielinien und ECOG PS.
TTP war signifikant verlängert bei Patienten, die Regorafenib plus BSC erhielten, als bei Patienten, die Placebo plus BSC erhielten, mit einem Hazard Ratio von 0,248 [95% KI 0,170, 0,364] und medianem TTP von 5,4 Monaten vs. 0,9 Monaten (p < 0,000001) (siehe Tabelle 6).
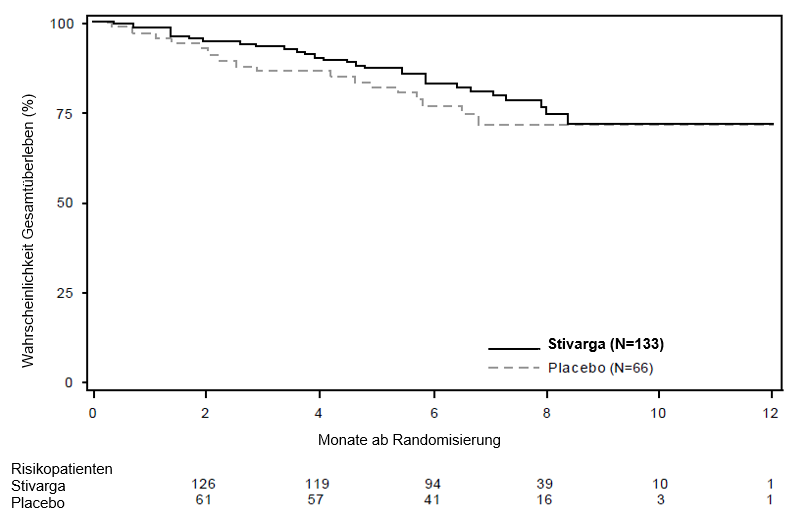
Die HR für OS betrug 0,772 (95% KI, 0,423, 1,408; p = 0,199; in keinem der Arme wurde ein medianes OS erreicht); 85% der Patienten, die zu Beginn dem Placebo-Arm randomisiert zugeteilt worden waren, wurden nach einer Progression mit Regorafenib behandelt (siehe Tabelle 6, Abbildung 3).
Tabelle 6: Ergebnisse zur Wirksamkeit aus der GRID‑Studie
Wirksamkeits-Parameter | Hazard Ratio* (95% KI) | p‑Wert | Median (95% KI) | |
Stivarga plus BSC§ | Placebo plus BSC§ | |||
PFS | 0,268 | < 0,000001 | 4,8 Monate | 0,9 Monate |
TTP | 0,248 | < 0,000001 | 5,4 Monate | 0,9 Monate |
OS | 0,772 | 0,199 | NE** | NE** |
§ Beste unterstützende Therapie
* Hazard Ratio < 1 favorisiert Stivarga
** NE: nicht erreicht
Abbildung 2: Kaplan-Meier-Kurve zum PFS
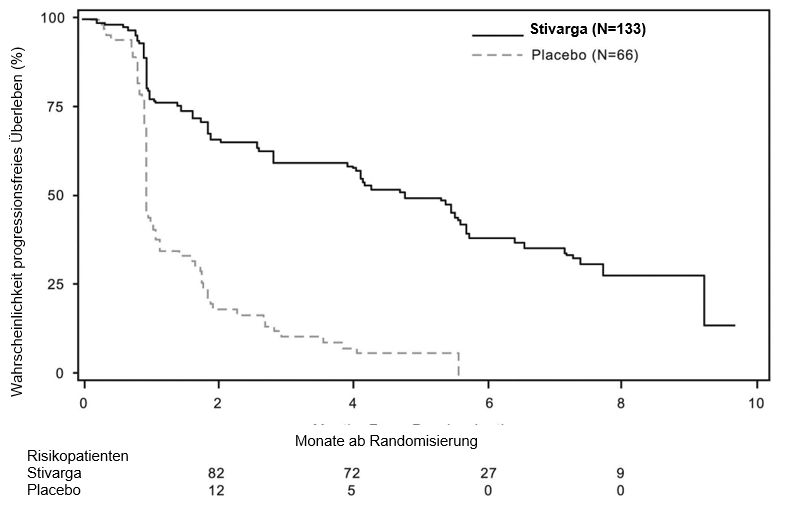
Abbildung 3: Kaplan-Meier-Kurve zum OS
Zusätzlich erhielten 56 Patienten, die Placebo plus BSC verabreicht bekamen, nach dem Cross-over aufgrund einer Krankheitsprogression unverblindet Stivarga und insgesamt 41 Patienten, die Stivarga plus BSC verabreicht bekamen, setzten nach der Krankheitsprogression die Behandlung mit Stivarga fort. Das mediane sekundäre PFS (basierend auf der Beurteilung durch den Prüfarzt) betrug 5,0 bzw. 4,5 Monate.
HCC
Die klinische Wirksamkeit und Sicherheit von Stivarga wurden in einer internationalen, multizentrischen, randomisierten, doppelblinden, Placebo-kontrollierten Phase‑III-Studie (RESORCE) bei Patienten mit HCC, die zuvor mit Sorafenib behandelt wurden, untersucht.
Der primäre Endpunkt der Wirksamkeit war das Gesamtüberleben (OS). Sekundäre Endpunkte waren das progressionsfreie Überleben (PFS), Zeit bis zur Progression (TTP), die objektive Tumoransprechrate (ORR) und die Krankheitskontrollrate (DCR).
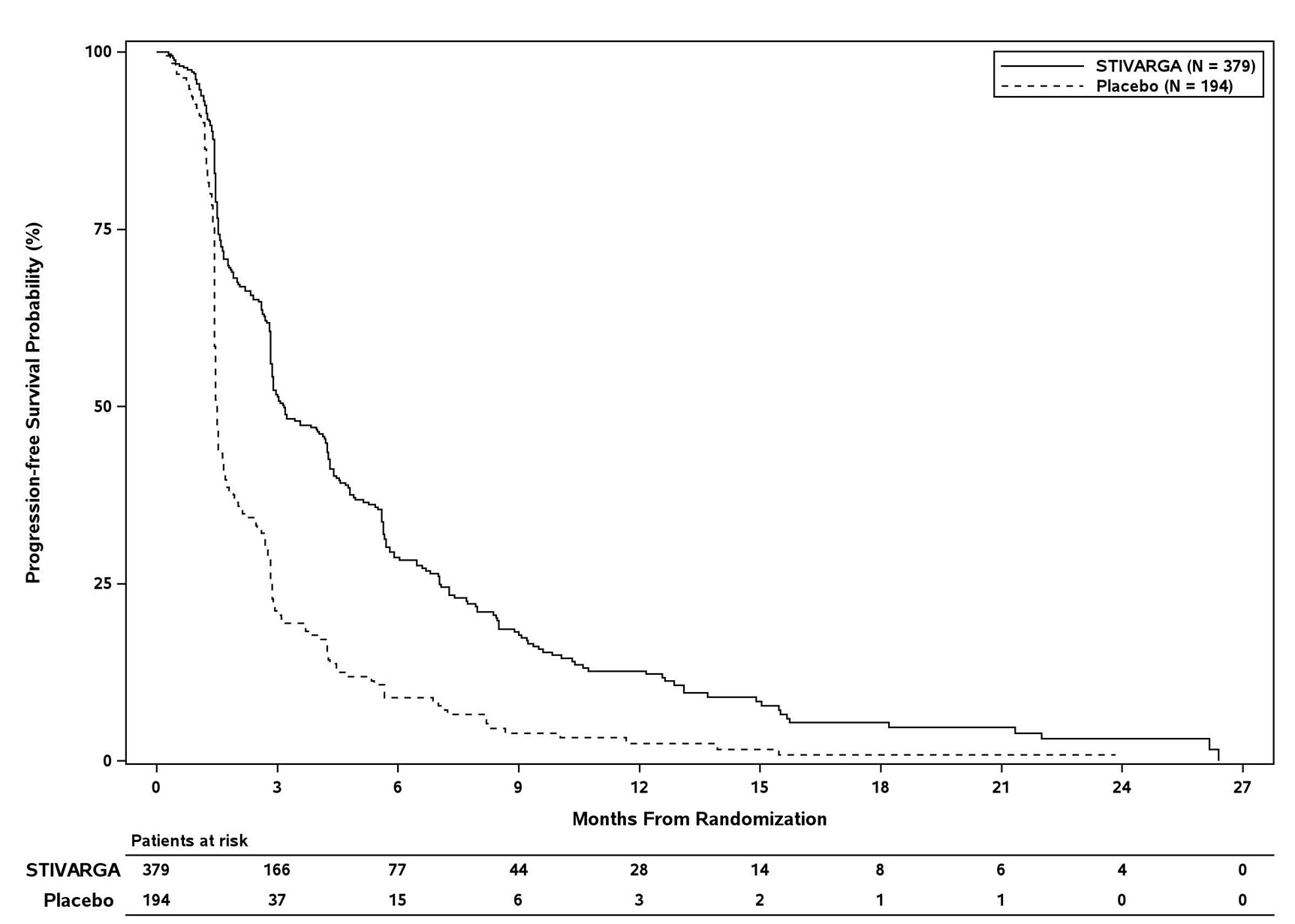
Insgesamt wurden 573 Patienten mit HCC im Verhältnis von 2:1 randomisiert, die entweder oral 160 mg Regorafenib einmal täglich (n = 379) plus bestmögliche unterstützende Behandlung (BSC) oder ein entsprechendes Placebo (n = 194) plus BSC über 3 Wochen hinweg erhielten, gefolgt von einer einwöchigen Therapiepause. Die durchschnittliche, täglich verabreichte Regorafenib-Dosis, betrug 144 mg. Patienten wurden ausgewählt, an der Studie teilzunehmen, wenn sie ein radiologisch diagnostiziertes Fortschreiten der Erkrankung während der Behandlung mit Sorafenib sowie einen Leberfunktionsstatus Child‑Pugh A aufwiesen. Patienten, die eine Behandlung mit Sorafenib aufgrund einer Sorafenib‑induzierten Toxizität dauerhaft beendeten oder die vor dem Absetzen weniger als 400 mg Sorafenib pro Tag vertrugen, waren aus der Studie ausgeschlossen. Die Randomisierung erfolgte innerhalb von 10 Wochen nach der letzten Einnahme von Sorafenib. Die Patienten setzten die Therapie mit Stivarga bis zur klinischen oder radiologisch diagnostizierten Progression oder nicht akzeptabler Toxizität fort. Allerdings konnten die Patienten die Behandlung mit Stivarga nach Progression nach Ermessen des Prüfarztes fortsetzen.
Demografische und wesentliche Krankheitseigenschaften waren zwischen der mit Stivarga und der mit Placebo behandelten Gruppe gleich verteilt und werden im Folgenden für alle 573 randomisierten Patienten aufgeführt:
Medianes Alter: 63 Jahre
Männlich: 88%
Kaukasisch: 36%, Asiatisch: 41%
ECOG Leistungsstatus (performance status, PS) von 0: 66% oder ECOG PS von 1: 34%
Child‑Pugh A: 98%, Child‑Pugh B: 2%
Krankheitsursachen umfassten Hepatitis B (38%), Hepatitis C (21%), nicht-alkoholische Steatohepatitis (NASH, 7%)
Abwesenheit sowohl von makroskopischer vaskulärer Invasion und extra-hepatischer
Tumorausbreitung: 19%
Barcelona Clinic Liver Cancer (BCLC) Stadium B: 13%; BCLC Stadium C: 87%
Loko-regionäre transarterielle Embolisation oder Chemoinfusionsverfahren: 61%
Strahlentherapie vor der Behandlung mit Stivarga: 15%
Mediane Dauer der Sorafenib-Behandlung: 7,8 Monate
Der Zusatz von Stivarga zur bestmöglich unterstützenden Behandlung (BSC) ergab eine statistisch signifikante Verbesserung des Gesamtüberlebens (OS) im Vergleich zu Placebo plus BSC mit einer Hazard Ratio von 0,624 [95% KI 0,498, 0,782], p=0,000017 im stratifizierten Log-Rank-Test und einem medianen Gesamtüberleben von 10,6 Monaten vs. 7,8 Monaten (siehe Tabelle 7 und Abbildung 4).
Tabelle 7: Ergebnisse zur Wirksamkeit aus der RESORCE Studie
Wirksamkeits-Parameter | Hazard Ratio* (95% KI) | p‑Wert | Median (95% KI) | |
Stivarga plus BSC§ | Placebo plus BSC§ | |||
OS | 0,624 | 0,000017 | 10,6 Monate | 7,8 Monate |
PFS ** | 0,453 | <0,000001 | 3,1 Monate | 1,5 Monate |
TTP ** | 0,439 (0,355,0,542) | <0,000001 | 3,2 Monate | 1,5 Monate |
Prozentwerte | ||||
ORR**# | NA | 0,003650 | 11% | 4% |
DCR**# | NA | <0,000001 | 65% | 36% |
§ Best Supportive Care (BSC)
* Hazard Ratio < 1 favorisiert Stivarga
** basierend auf der Beurteilung des Prüfarztes in Bezug auf das Tumoransprechen nach den modifizierten RECIST‑Kriterien
# Ansprechrate (vollständiges oder teilweises Ansprechen), DCR (vollständiges Ansprechen, teilweises Ansprechen und stabiler Krankheitsverlauf über 6 Wochen)
Abbildung 4: Kaplan-Meier-Kurve zum OS
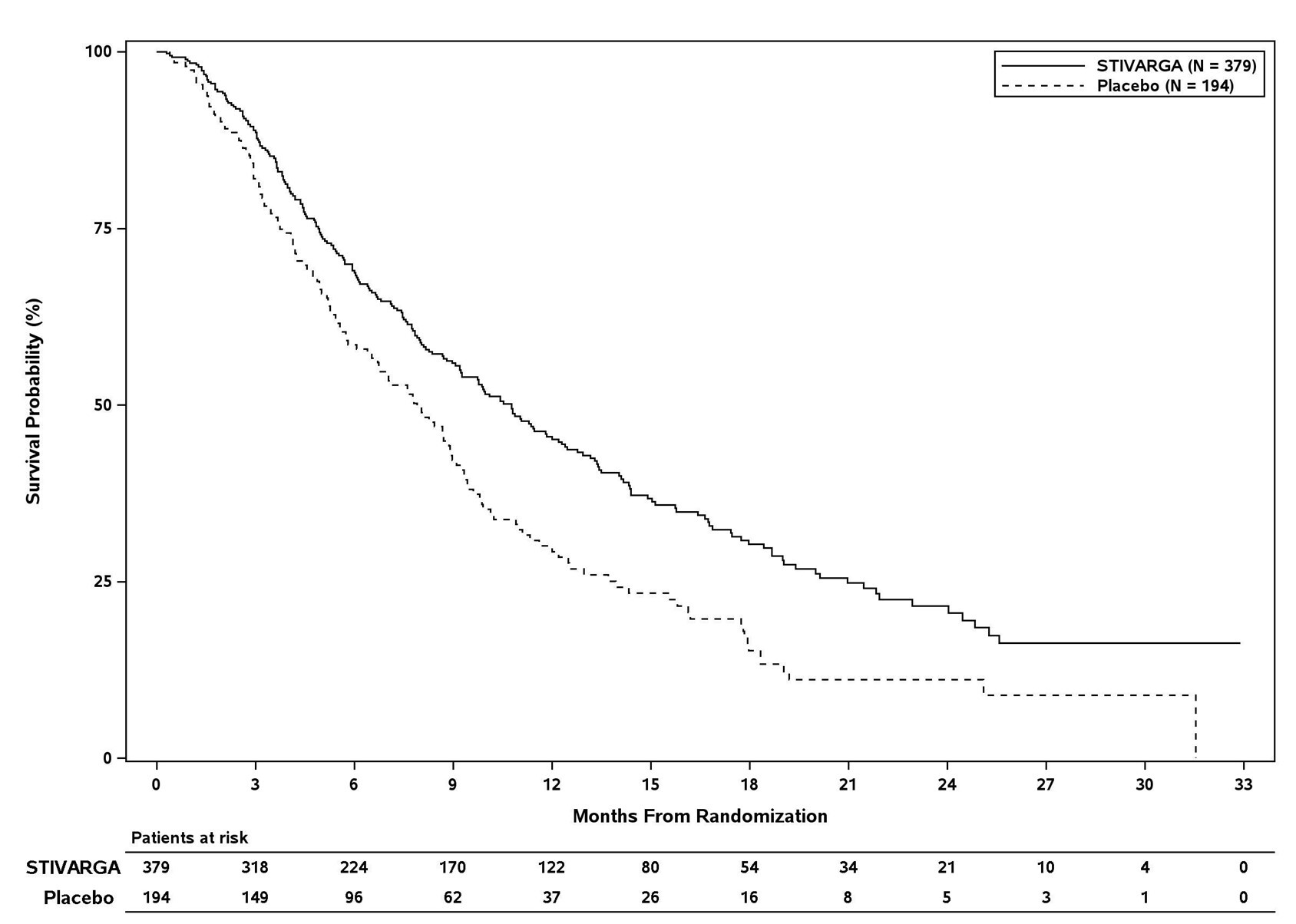
Abbildung 5: Kaplan-Meier-Kurve zum PFS (mRECIST)
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Stivarga eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen in der Behandlung von Adenokarzinomen des Kolons und Rektums gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Europäische Arzneimittel-Agentur hat für Stivarga eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen in der Behandlung von soliden malignen Tumoren gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Europäische Arzneimittel-Agentur hat für Stivarga eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen in der Behandlung von HCC gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Resorption
Nach einer oralen Einzeldosis von 160 mg Regorafenib, die in Form von 4 Tabletten mit jeweils 40 mg verabreicht wird, erreicht Regorafenib nach etwa 3 bis 4 Stunden eine mittlere maximale Plasmakonzentration von ungefähr 2,5 mg/l. Nach Einzelgaben von 60 mg oder 100 mg betrug die mittlere relative Bioverfügbarkeit von Tabletten im Vergleich zu einer Lösung zum Einnehmen 69% bzw. 83%.
Die Konzentrationen von Regorafenib und seinen pharmakologisch aktiven Hauptmetaboliten (M‑2 und M‑5) waren nach Einnahme eines fettarmen (leichten) Frühstücks im Vergleich zu einem fetthaltigen Frühstück oder im Nüchternzustand am höchsten. Die Bioverfügbarkeit von Regorafenib war nach einem fetthaltigen Frühstück 48% höher und nach einem fettarmen Frühstück 36% höher als im Nüchternzustand. Die Bioverfügbarkeit der Metaboliten M‑2 (N‑Oxid) und M‑5 (N‑Oxide und N‑Desmethyl) ist im Vergleich zur Einnahme im nüchternen Zustand höher, wenn Regorafenib mit einem fettarmen Frühstück eingenommen wird, und niedriger, wenn die Einnahme mit einer fettreichen Mahlzeit erfolgt.
Verteilung
Die Plasmakonzentrations‑Zeit-Profile sowohl für Regorafenib als auch für die zirkulierenden Hauptmetaboliten wiesen mehrere Spitzen im Verlauf des 24‑stündigen Dosierungsintervalls auf, die auf den enterohepatischen Kreislauf zurückgeführt werden. Die in‑vitro-Proteinbindung von Regorafenib an menschliche Plasmaproteine ist hoch (99,5%). Die in‑vitro-Proteinbindung von M‑2 und M‑5 ist höher (99,8% bzw. 99,95%) als die von Regorafenib. Die Metaboliten M‑2 und M‑5 sind schwache P‑Gp-Substrate. Der Metabolit M‑5 ist ein schwaches BCRP‑Substrat.
Biotransformation
Regorafenib wird hauptsächlich in der Leber durch oxidative Verstoffwechselung durch CYP3A4, aber auch durch Glucuronidierung durch UGT1A9 metabolisiert. Zwei Haupt- und sechs Nebenmetaboliten von Regorafenib wurden im Plasma identifiziert. Die zirkulierenden Hauptmetaboliten von Regorafenib im menschlichen Plasma sind M‑2 (N‑Oxid) und M‑5 (N‑Oxid und N‑Desmethyl), die pharmakologisch aktiv sind und im Steady State ähnliche Konzentrationen wie Regorafenib aufweisen. Die weitere Metabolisierung von M‑2 erfolgt sowohl durch oxidativen Abbau über CYP3A4 als auch durch UGT1A9‑vermittelte Glucuronidierung.
Die Metaboliten können im Magen-Darm-Trakt durch die mikrobielle Flora reduziert oder hydrolysiert werden, was die Resorption des unkonjugierten Wirkstoffs und der unkonjugierten Metaboliten ermöglicht (enterohepatischer Kreislauf).
Elimination
Nach oraler Anwendung liegt die mittlere Eliminationshalbwertszeit von Regorafenib und seinem Metaboliten M‑2 im Plasma in verschiedenen Studien zwischen 20 und 30 Stunden. Die mittlere Eliminationshalbwertszeit des Metaboliten M‑5 liegt bei ungefähr 60 Stunden (zwischen 40 und 100 Stunden).
Ungefähr 90% der radioaktiv markierten Dosis wurden innerhalb von 12 Tagen nach der Anwendung ausgeschieden, wobei etwa 71% der Dosis mit den Fäzes (47% als Muttersubstanz, 24% als Metaboliten) und etwa 19% der Dosis mit dem Urin in Form von Glucuroniden ausgeschieden wurden. Unter Steady State-Bedingungen sank die Ausscheidung der Glucuronide im Urin unter 10%. Die Muttersubstanz in den Fäzes kann vom Abbau von Glucuroniden oder der Reduktion des Metaboliten M‑2 (N‑Oxid) im Darm sowie vom nicht resorbierten Regorafenib stammen.
M‑5 kann im Gastrointestinaltrakt durch die Mikroflora zu M‑4 reduziert werden, wodurch die Reabsorption von M‑4 ermöglicht wird (enterohepatischer Kreislauf). M‑5 wird schließlich über M‑4 als M‑6 (Carboxylsäure) in den Fäzes ausgeschieden.
Linearität/Nicht‑Linearität
Im Steady State erhöht sich die systemische Bioverfügbarkeit von Regorafenib proportional bei Dosen von bis zu 60 mg und unterproportional bei Dosen von mehr als 60 mg. Eine Anreicherung von Regorafenib im Steady State führt zu einem etwa 2‑fachen Anstieg der Konzentration im Plasma, was mit der Eliminationshalbwertszeit und der Dosierungshäufigkeit übereinstimmt. Im Steady State erreicht Regorafenib nach oraler Anwendung von 160 mg Regorafenib mittlere maximale Plasmakonzentrationen von etwa 3,9 mg/l (8,1 Mikromolar) und die Peak‑to‑Trough‑Ratio der mittleren Plasmakonzentrationen liegt bei weniger als 2.
Beide Metaboliten, M‑2 und M‑5, zeigen eine nichtlineare Akkumulation, die durch enterohepatisches Recycling oder Sättigung des UGT1A9‑Signalwegs verursacht sein könnte. Während die Plasmakonzentrationen von M‑2 und M‑5 nach Gabe einer Einzeldosis von Regorafenib wesentlich niedriger liegen als die der Muttersubstanz, sind die Plasmakonzentrationen von M‑2 und M‑5 im Steady State mit der Konzentration von Regorafenib vergleichbar.
Leberfunktionsstörung
Die Bioverfügbarkeit von Regorafenib und seinen Metaboliten M‑2 und M‑5 bei Patienten mit leichter Leberfunktionsstörung (Child‑Pugh A) ist vergleichbar mit der bei Patienten mit normaler Leberfunktion.
Einige wenige Daten von Patienten mit mittelschwerer Leberfunktionsstörung (Child‑Pugh B) deuten darauf hin, dass nach einer Einzeldosis von 100 mg Regorafenib eine vergleichbare Bioverfügbarkeit wie bei Patienten mit normaler Leberfunktion vorliegt. Für Patienten mit Child‑Pugh C (schwerer Leberfunktionsstörung) liegen keine Daten vor. Regorafenib wird vorwiegend über die Leber eliminiert und die Bioverfügbarkeit könnte in dieser Patientengruppe erhöht sein.
Nierenfunktionsstörung
Die verfügbaren klinischen Daten und ein physiologiebasiertes pharmakokinetisches Model zeigen, dass die Bioverfügbarkeit von Regorafenib und seinen Metaboliten M‑2 und M‑5 im Steady State bei Patienten mit leichter, oder mittelschwerer Nierenfunktionsstörung mit der bei Patienten mit normaler Nierenfunktion vergleichbar ist.
Die Bioverfügbarkeit von Regorafenib war bei Patienten mit schwerer Nierenfunktionsstörung verglichen mit Patienten mit normaler Nierenfunktion ähnlich, während die Bioverfügbarkeit der Metaboliten M‑2 und M‑5 unter Steady State‑Bedingungen um ungefähr 30% sank, was als nicht klinisch relevant erachtet wurde.
Die Pharmakokinetik von Regorafenib wurde bei Patienten mit terminaler Niereninsuffizienz nicht untersucht. Das physiologiebasierte pharmakokinetische Modell prädiziert jedoch keine relevanten Änderungen der Bioverfügbarkeit bei diesen Patienten.
Ältere Patienten
Das Alter beeinflusste innerhalb des untersuchten Altersbereiches (29‑85 Jahre) die Pharmakokinetik von Regorafenib nicht.
Geschlecht
Die Pharmakokinetik von Regorafenib wird durch das Geschlecht nicht beeinflusst.
Ethnische Unterschiede
Die Bioverfügbarkeit von Regorafenib bei verschiedenen asiatischen Populationen (chinesisch, japanisch, koreanisch) liegt im gleichen Bereich wie die bei Kaukasiern.
Kardiale Elektrophysiologie/QT‑Verlängerung
In einer entsprechenden QT‑Studie wurde bei männlichen und weiblichen Krebspatienten nach Anwendung von 160 mg Regorafenib im Steady State keine QTc‑verlängernde Wirkung beobachtet.
Systemische Toxizität
Nach wiederholter Dosierung bei Mäusen, Ratten und Hunden wurden unerwünschte Wirkungen in einer Reihe von Organen beobachtet, hauptsächlich in Niere, Leber, Verdauungstrakt, Schilddrüse, lympho‑/hämatopoetisches System, endokrines System, Reproduktionssystem und Haut. In der 26‑wöchigen Studie zur Toxizität bei wiederholter Verabreichung an Ratten wurde eine geringfügig erhöhte Inzidenz einer Verdickung der Atrioventrikularklappen des Herzens festgestellt. Möglicherweise ist dies auf die Beschleunigung eines altersbedingten physiologischen Prozesses zurückzuführen. Diese Wirkungen traten bei einer systemischen Bioverfügbarkeit auf, die im Bereich der erwarteten humanen Exposition oder darunter lag (basierend auf AUC-Vergleichen).
Bei jungen und heranwachsenden Tieren als auch bei juvenilen Ratten waren Veränderungen der Zähne und Knochen sowie unerwünschte Wirkungen auf die Geschlechtsorgane stärker ausgeprägt, was auf ein potenzielles Risiko bei Kindern und Jugendlichen hindeutet.
Reproduktions- und Entwicklungstoxizität
Es wurden keine besonderen Studien hinsichtlich der Fertilität durchgeführt. Allerdings muss, basierend auf morphologischen Veränderungen der Hoden, Eierstöcke und der Gebärmutter, die nach wiederholter Gabe bei Ratten und Hunden von Dosierungen unterhalb der erwarteten humanen Exposition beobachtet wurden (basierend auf AUC‑Vergleichen), eine potenzielle Beeinträchtigung der männlichen und weiblichen Reproduktionsfähigkeit durch Regorafenib in Betracht gezogen werden. Die beobachteten Veränderungen waren nur zum Teil reversibel.
Eine Wirkung von Regorafenib auf die intrauterine Entwicklung wurde bei Kaninchen bei Expositionen gezeigt, die unterhalb der zu erwartenden Exposition beim Menschen (basierend auf AUC‑Vergleichen) lagen. Die wichtigsten Befunde waren Fehlbildungen des Harnsystems, Herzens und wichtiger Gefäße sowie des Skeletts.
Genotoxizität und Kanzerogenität
Es lagen keine Hinweise auf ein genotoxisches Potenzial von Regorafenib vor, das mittels Standardassays in vitro und in vivo bei Mäusen untersucht wurde.
Es wurden keine Studien zum kanzerogenen Potenzial von Regorafenib durchgeführt.
Beurteilung der Risiken für die Umwelt (Environmental Risk Assessment [ERA])
Studien zur Beurteilung der Risiken für die Umwelt haben gezeigt, dass Regorafenib das Potential hat, persistent, bioakkumulativ und toxisch für die Umwelt zu sein und ein Risiko für Oberflächengewässer und Sedimente darstellen kann (siehe Abschnitt 6.6).
Tablettenkern
Mikrokristalline Cellulose
Croscarmellose‑Natrium
Magnesiumstearat
Povidon (K25)
Hochdisperses Siliciumdioxid
Filmüberzug
Eisen(III)‑oxid (E 172)
Eisen(III)‑hydroxid‑oxid x H2O (E 172)
(3‑sn‑Phosphatidyl)cholin (gewonnen aus Soja)
Macrogol (3350)
Poly(vinylalkohol)
Talkum
Titandioxid (E 171)
Nicht zutreffend.
3 Jahre
Nach Anbruch der Flasche ist das Arzneimittel 7 Wochen lang haltbar. Danach muss das Arzneimittel entsorgt werden.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Die Flasche fest verschlossen halten.
Weiße, opake HDPE‑Flasche mit einem Schraubdeckel aus PP/PP (Polypropylen) mit Dichteinsatz und einem Molekularsieb als Trockenmittel.
Jede Flasche enthält 28 Filmtabletten.
Packungsgrößen:
Packung mit 28 Filmtabletten.
Packung mit 84 (3 Flaschen mit jeweils 28) Filmtabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Das Trockenmittel in der Flasche aufbewahren.
Dieses Arzneimittel kann ein Risiko für die Umwelt darstellen (siehe Abschnitt 5.3).
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Bayer AG
51368 Leverkusen
Deutschland
EU/1/13/858/001
EU/1/13/858/002
Datum der Erteilung der Zulassung: 26. August 2013
Datum der letzten Verlängerung der Zulassung: 22. Mai 2018
Juni 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.
Verschreibungspflichtig
Bayer Vital GmbH
51368 Leverkusen
Tel.: +49 (0)214-30 513 48
Fax: +49 (0)214-2605 516 03
E-Mail: medical-information@bayer.com
DE/17