FOSTER NEXThaler 200 Mikrogramm/6 Mikrogramm pro Inhalation Pulver zur Inhalation
Jede abgemessene Menge von 10 mg des Pulvers zur Inhalation enthält:
200 Mikrogramm Beclometasondipropionat (Ph. Eur.) und 6 Mikrogramm Formoterolfumarat-Dihydrat (Ph. Eur.).
Dies entspricht einer abgegebenen Menge (die das Mündstück verlässt) von 158,8 Mikrogramm Beclometasondipropionat (Ph. Eur.) und 4,9 Mikrogramm Formoterolfumarat-Dihydrat (Ph. Eur.).
Sonstiger Bestandteil mit bekannter Wirkung:
Jede abgegebene Menge enthält 9,8 mg alpha-Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Pulver zur Inhalation.
Der Mehrfachdosis-Inhalator enthält ein weißes oder weißliches Pulver.
Foster Nexthaler ist angezeigt für die regelmäßige Behandlung von Asthma, bei der die Anwendung eines Kombinationspräparats (von inhalativem Kortikosteroid und langwirksamem Beta2-Agonisten) angezeigt ist:
Patienten, die mit inhalativen Kortikosteroiden und inhalativen kurzwirksamen Beta2-Agonisten zur bedarfsweisen Inhalation nicht ausreichend eingestellt sind, oder
Patienten, die mit inhalativen Kortikosteroiden und langwirksamen Beta2-Agonisten in Kombination bereits ausreichend eingestellt sind.
Foster Nexthaler wird bei Erwachsenen angewendet.
Hinweis: Es gibt keine relevanten klinischen Daten von Foster Nexthaler zur Behandlung akuter Asthmaanfälle.
Dosierung
Foster Nexthaler ist nicht zur Anfangsbehandlung von Asthma bestimmt. Die Dosierung von Foster Nexthaler erfolgt individuell und sollte dem Schweregrad der Erkrankung angepasst werden. Dies sollte nicht nur zu Beginn der Behandlung mit Kombinationspräparaten beachtet werden, sondern auch bei Dosisanpassungen. Wenn ein Patient Dosiskombinationen benötigt, die nicht mit dem Kombinationspräparat zur Verfügung stehen, sollten geeignete Dosierungen von Beta2-Agonisten und/oder Kortikosteroiden in separaten Inhalatoren verordnet werden.
Aufgrund seiner extrafeinen Teilchen sind Dosisanpassungen erforderlich, wenn Patienten von einer nicht extrafeinen Formulierung auf Foster Nexthaler Pulver zur Inhalation, umgestellt werden. Bei der Umstellung sollte berücksichtigt werden, dass die empfohlene tägliche Dosis an Beclometasondipropionat für Foster Nexthaler niedriger ist als die empfohlene tägliche Dosis an Beclometasondipropionat einer nicht extrafeinen Zubereitung. Sie sollte auf die individuellen Bedürfnisse des Patienten eingestellt werden.
Erwachsene ab 18 Jahren
Zweimal täglich zwei Inhalationen.
Die maximale Tagesdosis beträgt vier Inhalationen.
Patienten sollten regelmäßig von einem Arzt untersucht werden, sodass die optimale Dosierung von Foster Nexthaler gewahrt bleibt und nur auf ärztlichen Rat hin geändert wird. Die Dosierung sollte auf die niedrigste Dosis eingestellt werden, mit der eine effektive Kontrolle der Symptome erreicht wird. In Fällen, in denen die Kontrolle der Symptomatik mit der niedrigsten empfohlenen Dosisstärke erreicht wird, könnte der nächste Schritt darin bestehen, ein inhalatives Kortikosteroid allein anzuwenden.
Eine niedriger dosierte Beclometasondipropionat-Komponente im gleichen Nexthaler-Inhalator ist für eine „Step-down-Behandlung“ verfügbar (Foster Nexthaler 100/6 Mikrogramm).
Die Patienten sollten angewiesen werden, Foster Nexthaler jeden Tag anzuwenden, auch wenn keine Symptome auftreten.
Besondere Patientengruppen
Bei älteren Patienten sind keine Dosisanpassungen erforderlich.
Für die Anwendung von Foster Nexthaler bei Patienten mit Leber- oder Nierenfunktionsstörungen liegen keine Daten vor (siehe Abschnitt 5.2).
Kinder und Jugendliche
Foster Nexthaler 200/6 Mikrogramm darf bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden.
Art der Anwendung
Foster Nexthaler ist zur Inhalation bestimmt.
Der Nexthaler ist ein atemzuggesteuerter Inhalator. Es konnte gezeigt werden, dass Patienten mit moderatem und schwerem Asthma einen ausreichenden inspiratorischen Fluss erzeugen können, um die Freisetzung einer Inhalation aus dem Foster Nexthaler auszulösen (siehe Abschnitt 5.1). Die Freisetzung einer Inhalation aus dem Foster Nexthaler ist flussunabhängig in dem Bereich des inspiratorischen Flusses, den diese Patienten durch den Inhalator aufbringen können.
Die korrekte Anwendung von Foster Nexthaler ist entscheidend für eine erfolgreiche Behandlung.
Die Patienten sind darauf hinzuweisen, die Gebrauchsinformation sorgfältig durchzulesen und die darin enthaltenen Anweisungen zu befolgen. Hinweise zur Anwendung des Foster Nexthaler, siehe unten.
Die Anzahl der Inhalationen, die im Fenster am unteren Gehäuseteil angezeigt wird, nimmt beim Schließen der Abdeckung nicht ab, wenn der Patient nicht inhaliert hat.
Der Patient sollte angewiesen werden, die Abdeckung des Inhalators nur bei der Anwendung zu öffnen. Hat der Patient den Inhalator geöffnet, jedoch nicht inhaliert und die Abdeckung wieder geschlossen, wird die abgemessene Pulvermenge wieder in das Pulverreservoir des Inhalators zurückgeleitet, sodass die folgende Inhalation sicher inhaliert werden kann.
Die Patienten sollten nach der Inhalation den Mund mit Wasser ausspülen, mit Wasser gurgeln oder die Zähne putzen (siehe Abschnitt 4.4).
GEBRAUCHSANWEISUNG FÜR DEN FOSTER NEXThaler
A. Inhalt der Packung
Für Informationen zum Inhalt der Packung, siehe Abschnitt 6.5.
Ist der Packungsinhalt nicht identisch mit den Angaben aus Abschnitt 6.5, geben Sie den Inhalator wieder dorthin zurück, wo Sie ihn erhalten haben, und lassen sich einen neuen Inhalator geben.
B. Allgemeine Warnhinweise und Vorsichtsmaßnahmen
Nehmen Sie den Inhalator nur dann aus dem Beutel, wenn Sie ihn anschließend direkt anwenden wollen.
Wenden Sie den Inhalator nur wie vorgeschrieben an.
Halten Sie die Abdeckung geschlossen, bis Sie aus dem Gerät inhalieren.
Bewahren Sie den Inhalator bei Nichtgebrauch an einem sauberen und trockenen Ort auf.
Versuchen Sie nicht, den Foster Nexthaler aus irgendeinem Grund auseinanderzunehmen.
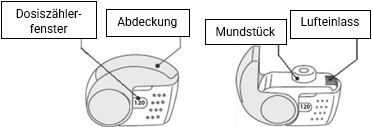
C. Wichtige Bestandteile Ihres FOSTER NEXThaler
 |
Um eine Dosis aus Ihrem Foster Nexthaler zu inhalieren, genügen drei einfache Schritte: Öffnen, Inhalieren, Schließen.
D. Vor Verwendung eines neuen FOSTER NEXThaler
1. Öffnen Sie den Schutzbeutel und entnehmen Sie den Inhalator.
Verwenden Sie den Inhalator nicht, wenn der Schutzbeutel unverschlossen oder beschädigt ist. Bringen Sie ihn dorthin zurück, wo Sie ihn erhalten haben, und lassen Sie sich einen neuen geben.
Verwenden Sie das Etikett auf der Packung, um das Datum einzutragen, an dem Sie den Schutzbeutel öffnen.
2. Überprüfen Sie den Inhalator.
Sieht der Inhalator zerbrochen oder beschädigt aus, bringen Sie ihn dorthin zurück, wo sie ihn erhalten haben, und lassen sich einen neuen geben.
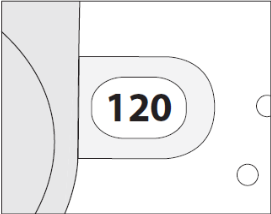
3. Kontrollieren Sie das Dosiszählerfenster. Bei einem neuen Inhalator zeigt der Dosiszähler „120“ an.
Verwenden Sie keinen neuen Inhalator, bei dem ein niedrigerer Wert als “120” angezeigt wird. Bringen Sie ihn dorthin zurück, wo Sie ihn erhalten haben und lassen Sie sich einen neuen geben.
 |
E. Anwendung Ihres FOSTER NEXThaler
Wenn Sie nicht sicher sind, die richtige Dosis zu erhalten, wenden Sie sich an Ihren Arzt oder Apotheker.
Wenn Sie nicht sicher sind, dass der Dosiszähler nach der Inhalation um einen Wert zurückgezählt hat, warten Sie bis zur nächsten planmäßigen Dosis und nehmen Sie diese wie üblich. Inhalieren Sie keine zusätzliche Dosis.
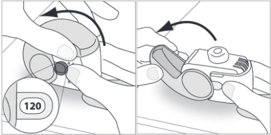
E.1. Öffnen
1. Halten Sie den Inhalator senkrecht fest in der Hand.
2. Prüfen Sie die Anzahl der noch verbliebenen Dosen: ein Wert zwischen „1“ und „120“ zeigt an, dass noch Dosen übrig sind.
Wird im Fenster der Wert „0“ angezeigt, ist das Arzneimittel aufgebraucht. Entsorgen Sie den Inhalator und nehmen Sie einen neuen.
3. Öffnen Sie die Abdeckung vollständig.
 |
4. Atmen Sie vor dem Inhalieren so tief wie möglich aus.
Atmen Sie nicht durch den Inhalator aus.
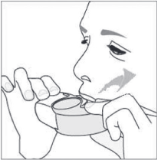
E.2. Inhalieren
Wenn möglich, führen Sie die Inhalation in aufrechter Körperhaltung – stehend oder sitzend – durch.
1. Führen Sie den Inhalator zum Mund und umschließen Sie das Mundstück mit den Lippen.
Halten Sie den Inhalator so, dass der Lufteinlass nicht abgedeckt wird.
Inhalieren Sie nicht durch den Lufteinlass.
2. Inhalieren Sie mit einem kräftigen tiefen Atemzug durch den Mund.
Möglicherweise nehmen Sie bei der Inhalation eine Geschmacksempfindung wahr.
Möglicherweise hören oder fühlen Sie bei der Einnahme ein Klicken.
Inhalieren Sie nicht durch die Nase.
Nehmen Sie den Inhalator während des Inhalationsvorgangs nicht von den Lippen.
 |
3. Nehmen Sie den Inhalator vom Mund.
4. Halten Sie 5 bis 10 Sekunden lang die Luft an oder so lange, wie es Ihnen ohne Anstrengung möglich ist.
5. Atmen Sie langsam aus.
Atmen Sie nicht durch den Inhalator aus.
E.3. Verschließen
1. Bringen Sie den Inhalator wieder in die senkrechte Position und schließen Sie die Abdeckung vollständig.
2. Kontrollieren Sie, dass der Dosiszähler um einen Wert zurückgezählt hat.
 |
3. Benötigen Sie noch eine weitere Dosis, wiederholen Sie die Schritte E.1 bis E.3.
F. Reinigung
Eine Reinigung des Inhalators ist normalerweise nicht erforderlich.
Sollte es doch erforderlich sein, reinigen Sie ihn mit einem trockenen Tuch/Kosmetiktuch.
Reinigen Sie den Inhalator nicht mit Wasser oder einer sonstigen Flüssigkeit. Halten Sie ihn trocken.
G. Lagerung und Entsorgung
Für Informationen zu Lagerungsbedingungen und Entsorgungsvorschriften, siehe Abschnitte 6.4 und 6.6.
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Bei einem Absetzen der Behandlung sollte die Dosis zuvor allmählich reduziert werden. Es wird empfohlen, die Behandlung nicht abrupt zu beenden.
Die Asthmatherapie sollte normalerweise einem Stufenschema folgen. Dabei sollte das Ansprechen des Patienten klinisch und mit Lungenfunktionstests überwacht werden.
Wenn Patienten die Therapie als wirkungslos empfinden, ist eine Rücksprache mit dem behandelnden Arzt notwendig. Eine zunehmende Anwendung von Bronchodilatatoren als Notfallmedikation lässt auf eine Verschlechterung der Grunderkrankung schließen, was ein Überdenken der Therapie erforderlich macht. Eine plötzliche und zunehmende Verschlechterung der Asthmakontrolle ist potenziell lebensbedrohlich und der Patient sollte dringend von einem Arzt untersucht werden. Es sollte erwogen werden, ob die Notwendigkeit einer verstärkten Therapie mit inhalativen oder oralen Kortikosteroiden oder einer Behandlung mit Antibiotika besteht, falls eine Infektion vermutet wird.
Der Therapiebeginn mit Foster Nexthaler sollte nicht während einer akuten schweren Exazerbation, oder wenn sich das Asthma signifikant verschlechtert oder akut verschlimmert, erfolgen. Während der Behandlung mit Foster Nexthaler können schwere Asthma-assoziierte unerwünschte Ereignisse und Exazerbationen auftreten. Patienten sollten aufgefordert werden, die Behandlung fortzusetzen, jedoch ärztlichen Rat einzuholen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese nach Therapiebeginn mit Foster Nexthaler verschlimmern.
Wie bei anderen inhalativen Arzneimitteln kann ein paradoxer Bronchospasmus auftreten, der unmittelbar nach der Anwendung mit stärkeren pfeifenden Atemgeräuschen, Husten und Atemnot verbunden ist. Diese Symptome sollten sofort mit einem schnellwirksamen inhalativen Bronchodilatator behandelt werden. Foster Nexthaler sollte umgehend abgesetzt, der Patient neu beurteilt und gegebenenfalls eine andere Therapie eingeleitet werden.
Foster Nexthaler ist nicht zur einleitenden Behandlung von Asthma bestimmt.
Die Patienten sollten darauf hingewiesen werden, dass sie ihren kurzwirksamen Bronchodilatator zur Behandlung eines akuten Asthmaanfalls jederzeit griffbereit haben.
Die Patienten sollten darauf aufmerksam gemacht werden, Foster Nexthaler wie verordnet täglich anzuwenden, auch wenn sie keine Symptome haben.
Sobald eine Kontrolle der Asthmasymptome erreicht ist, sollte erwogen werden, die Dosierung von Foster Nexthaler schrittweise zu reduzieren. Es ist wichtig, die Patienten regelmäßig nach der Dosisreduktion zu untersuchen. Es sollte die niedrigste wirksame Dosis von Foster Nexthaler eingesetzt werden (siehe Abschnitt 4.2).
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über längere Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe. Mögliche systemische Wirkungen sind: Cushing-Syndrom, cushingoide Erscheinungen, Nebennierenrindensuppression, Wachstumsverzögerungen bei Kindern und Jugendlichen, verringerte Knochenmineraldichte, Katarakt, Glaukom und seltener eine Reihe von Auswirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorischer Hyperaktivität, Schlafstörungen, Angstzustände, Depression oder Aggressivität (vor allem bei Kindern). Deshalb ist es wichtig, dass die niedrigste Dosis angewendet wird, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann.
Die Behandlung von Patienten mit hohen Dosierungen inhalativer Kortikosteroide über längere Zeit kann zu einer Nebennierenrindensuppression und bis zur akuten adrenalen Krise führen. Kinder und Jugendliche unter 16 Jahren, die höhere Dosen von Beclometasondipropionat inhalieren als empfohlen, sind dem Risiko besonders ausgesetzt. Situationen, die möglicherweise eine akute Nebennierenrindeninsuffizienz auslösen können, sind beispielsweise Traumata, Operationen, Infektionen oder eine rasche Dosisreduzierung. Die Symptome sind in der Regel unspezifisch, wie z. B. Appetitlosigkeit, Bauchschmerzen, Gewichtsverlust, Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Hypotonie, Bewusstseinseinschränkungen, Hypoglykämie und Krampfanfälle. Die zusätzliche Anwendung von systemischen Kortikosteroiden sollte während Stresssituationen oder im Rahmen einer geplanten Operation in Erwägung gezogen werden.
Bei Patienten, die von oralen Kortikosteroiden auf eine Inhalationstherapie umgestellt werden, kann das Risiko einer eingeschränkten Funktion der Nebennierenrinde über einen längeren Zeitraum bestehen. Für Patienten, die in der Vorgeschichte eine hochdosierte Kortikosteroidgabe als Notfallmedikation benötigt haben oder eine längere Behandlung mit hohen Dosen inhalativer Kortikosteroide hatten, kann ebenfalls ein Risiko bestehen. Eine möglicherweise eingeschränkte Funktion der Nebennierenrinde sollte vor allem während Stresssituationen wie bei Notfällen oder bei einer anstehenden Operation bedacht und die zusätzliche Anwendung von systemischen Kortikosteroiden in Erwägung gezogen werden. Ein erhöhtes Risiko einer Nebennierenrindenfunktionsstörung kann das Hinzuziehen eines Spezialisten vor geplanten operativen Eingriffen erfordern.
Foster Nexthaler sollte bei Patienten mit aktiver oder nicht aktiver Lungentuberkulose, Mykosen und viralen Infektionen der Atemwege mit Vorsicht angewendet werden.
Foster Nexthaler sollte mit Vorsicht (evtl. Überwachung) bei Patienten mit den folgenden Erkrankungen angewendet werden: Herzrhythmusstörungen, insbesondere AV-Block III. Grades und Tachyarrhythmien, idiopathische subvalvuläre Aortenstenose, hypertrophe obstruktive Kardiomyopathie, ischämische Herzkrankheit, schwere Herzinsuffizienz, schwere arterielle Hypertonie und Aneurysma.
Vorsicht ist auch geboten bei Patienten mit bekannter oder mit Verdacht auf Verlängerung des QTc-Intervalls (Frequenz-korrigiert: QT > 0,44 Sekunden), arzneimittelinduziert oder erblich bedingt. Formoterol selbst kann eine Verlängerung des QTc-Intervalls hervorrufen.
Foster Nexthaler ist außerdem bei Patienten mit Thyrotoxikose, Diabetes mellitus, Phäochromozytom und unbehandelter Hypokaliämie mit Vorsicht anzuwenden.
Durch eine Behandlung mit Beta2-Agonisten kann eine potenziell schwere Hypokaliämie hervorgerufen werden. Bei schwerem Asthma ist besondere Vorsicht geboten, da diese Wirkung durch Hypoxie verstärkt werden kann. Eine Hypokaliämie kann auch durch eine begleitende Behandlung mit anderen Arzneimitteln (siehe Abschnitt 4.5) verstärkt werden, die eine Hypokaliämie auslösen können, etwa Xanthinderivate, Steroide und Diuretika. Vorsicht ist auch geboten bei Patienten mit instabilem Asthma, wenn verschiedene Bronchodilatatoren als Notfallmedikation angewendet werden. Bei betroffenen Patienten wird eine Überwachung der Serumkaliumspiegel empfohlen.
Bei der Inhalation von Formoterol kann der Blutglukosespiegel ansteigen. Daher soll der Blutglukosespiegel bei Patienten mit Diabetes mellitus engmaschig überwacht werden.
Wenn eine Anästhesie unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Foster Nexthaler aufgrund des Risikos kardialer Herzarrhythmien mindestens 12 Stunden vor Beginn der Anästhesie nicht mehr angewendet wird.
Um das Risiko einer oropharyngealen Pilzinfektion oder Dysphonie zu minimieren, sollten Patienten dazu angehalten werden, nach der Inhalation der vorgeschriebenen Dosis den Mund mit Wasser auszuspülen, mit Wasser zu gurgeln oder die Zähne zu putzen.
Dieses Arzneimittel enthält Lactose. Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen. Patienten mit der seltenen, erblichen Erkrankung Galactoseintoleranz, totalem Lactasemangel oder Glucose–Galacatose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Sehstörungen
Bei der systemischen und topischen Anwendung von Kortikosteroiden können Sehstörungen auftreten. Wenn ein Patient mit Symptomen wie verschwommenem Sehen oder anderen Sehstörungen vorstellig wird, sollte eine Überweisung des Patienten an einen Augenarzt zur Bewertung möglicher Ursachen in Erwägung gezogen werden; diese umfassen unter anderem Katarakt, Glaukom oder seltene Erkrankungen, wie z. B. zentrale seröse Chorioretinopathie (CSC), die nach der Anwendung systemischer oder topischer Kortikosteroide gemeldet wurden.
Pharmakokinetische Wechselwirkungen
Beclometasondipropionat wird über Esterasen sehr rasch verstoffwechselt. Beclometason ist weniger abhängig vom CYP3A-Metabolismus als einige andere Corticosteroide, und Wechselwirkungen sind im Allgemeinen unwahrscheinlich. Die Möglichkeit systemischer Wirkungen bei der gleichzeitigen Anwendung starker CYP3A-Inhibitoren (z. B. Ritonavir, Cobicistat) kann jedoch nicht ausgeschlossen werden, weshalb bei der Anwendung solcher Mittel Vorsicht geboten ist und eine entsprechende Überwachung empfohlen wird.
Pharmakodynamische Wechselwirkungen
Beta-Adrenorezeptorenblocker können die Wirkung von Formoterol abschwächen oder hemmen. Foster Nexthaler sollte daher nicht zusammen mit Beta-Adrenorezeptorenblockern (einschließlich Augentropfen) angewendet werden, sofern dies nicht zwingend erforderlich ist.
Die gleichzeitige Anwendung von anderen Beta-adrenergen Arzneimitteln kann einen potenziell additiven Effekt haben. Deswegen ist bei gleichzeitiger Verordnung von Theophyllin oder anderen Beta-adrenergen Wirkstoffen zusammen mit Formoterol Vorsicht geboten.
Die gleichzeitige Behandlung mit Chinidin, Disopyramid, Procainamid, Phenothiazinen, bestimmten Antihistaminika (z. B. Terfenadin), Monoaminoxidase-Hemmern und trizyklischen Antidepressiva kann das QTc-Intervall verlängern und das Risiko für ventrikuläre Arrhythmien erhöhen.
Zusätzlich können L-Dopa, L-Thyroxin, Oxytocin und Alkohol die kardiale Toleranz gegenüber Beta2-Sympathomimetika beeinträchtigen.
Die gleichzeitige Behandlung mit Monoaminoxidase-Hemmern, einschließlich Wirkstoffen mit ähnlichen Eigenschaften wie Furazolidon und Procarbazin, kann die hypertensiven Reaktionen verstärken.
Ein erhöhtes Arrhythmierisiko besteht bei Patienten, die gleichzeitig mit Anästhetika behandelt werden, die halogenierte Kohlenwasserstoffe enthalten.
Die gleichzeitige Behandlung mit Xanthinderivaten, Steroiden oder Diuretika kann eine mögliche hypokalämische Wirkung von Beta2-Agonisten verstärken (siehe Abschnitt 4.4). Bei Patienten, die mit Digitalisglykosiden behandelt werden, kann eine gegebenenfalls auftretende Hypokaliämie die Anfälligkeit für Arrhythmien erhöhen.
Schwangerschaft
Es liegen keine relevanten klinischen Daten für die Anwendung von Foster Nexthaler bei schwangeren Frauen vor. In tierexperimentellen Studien, in denen eine Kombination von Beclometasondipropionat und Formoterol verwendet wurde, gab es Hinweise auf toxische Effekte auf die Reproduktion und auf den Fetus nach hoher systemischer Exposition (siehe Abschnitt 5.3). Es ist bekannt, dass die Verabreichung hochdosierter Kortikosteroide bei trächtigen Tieren zu Anomalien der fetalen Entwicklung, einschließlich Gaumenspalte und intrauteriner Wachstumsretardierung, führt. Wegen der wehenhemmenden Wirkung von Beta2-Sympathomimetika ist eine Anwendung von Foster Nexthaler kurz vor der Entbindung besonders sorgfältig abzuwägen. Formoterol sollte für die Anwendung während der Schwangerschaft und besonders am Ende der Schwangerschaft oder während der Wehen nicht empfohlen werden, es sei denn, es gibt keine bewährte (sicherere) Alternative.
Die Anwendung von Foster Nexthaler während der Schwangerschaft sollte nur dann in Betracht gezogen werden, wenn der erwartete Nutzen die potenziellen Risiken übersteigt.
Stillzeit
Es liegen keine relevanten klinischen Daten für die Anwendung von Foster Nexthaler beim Menschen während der Stillzeit vor.
Obwohl keine tierexperimentellen Befunde vorliegen, ist es angemessen anzunehmen, dass Beclometasondipropionat wie andere Kortikosteroide in die Muttermilch übergeht.
Es ist zwar nicht bekannt, ob Formoterol beim Menschen in die Muttermilch übergeht, es wurde aber in der Milch von laktierenden Tieren nachgewiesen.
Die Anwendung von Foster Nexthaler bei stillenden Frauen sollte dann in Betracht gezogen werden, wenn der erwartete Nutzen die potenziellen Risiken übersteigt. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Foster Nexthaler verzichtet werden soll bzw. die Behandlung mit Foster Nexthaler zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Fertilität
Es liegen keine Daten für Menschen vor. In Tierversuchen bei Ratten ging das Vorliegen von hohen Dosen an Beclometasondipropionat in der Kombination mit verminderter weiblicher Fertilität und mit Embryotoxizität einher (siehe Abschnitt 5.3).
Foster Nexthaler hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Die häufigste Nebenwirkung ist Tremor. In einer 12-wöchigen klinischen Studie mit Foster Nexthaler 100/6 Mikrogramm war nur in Verbindung mit dem höchsten Dosierungsschema (täglich 400/24 Mikrogramm) ein Tremor zu beobachten, häufig zu Behandlungsbeginn und in schwacher Intensität. Kein Patient wurde aufgrund von Tremor aus der Studie genommen.
Erfahrungen mit Asthmapatienten in klinischen Studien
Die Sicherheit von Foster Nexthaler 100/6 Mikrogramm wurde anhand von wirkstoff- und placebokontrollierten klinischen Studien beurteilt, in denen das Arzneimittel 719 Patienten ab 12 Jahren mit Asthma unterschiedlicher Schweregrade verabreicht wurde. Die Inzidenz der Nebenwirkungen in der folgenden Tabelle bezieht sich auf Asthmapatienten ab 12 Jahren und basiert auf den Sicherheitsbefunden zweier klinischer Zulassungsstudien, in denen Foster Nexthaler 100/6 Mikrogramm für die Dauer von 8 bis 12 Wochen in den in der vorliegenden Fachinformation empfohlenen Dosierungen verabreicht wurde. Obwohl bei den klinischen Studien von Foster Nexthaler 100/6 Mikrogramm keine psychiatrischen Erkrankungen beobachtet wurden, sind sie in der Tabelle als potenzieller Klasseneffekt inhalierter Kortikosteroide enthalten.
Nebenwirkungen, die mit der Anwendung von Beclometasondipropionat und Formoterolfumarat-Dihydrat als fixe Kombination (Foster Nexthaler) in Verbindung gebracht werden, sind im Folgenden aufgeführt, geordnet nach Organsystemen. Die Häufigkeiten der Nebenwirkungen sind wie folgt definiert: sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gelegentlich (≥ 1/1.000 bis < 1/100), selten (≥ 1/10.000 bis < 1/1.000) und sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
Infektionen und parasitäre Erkrankungen |
Nasopharyngitis |
Gelegentlich |
Orale Candidiasis |
Gelegentlich |
|
Stoffwechsel- und Ernährungsstörungen |
Hypertriglyceridämie |
Gelegentlich |
Psychiatrische Erkrankungen |
Psychomotorische Hyperaktivität, Schlafstörungen, Angstzustände, Depression, Aggressivität, Verhaltensänderungen (besonders bei Kindern) |
Nicht bekannt |
Augenerkrankungen |
Verschwommenes Sehen (siehe auch Abschnitt 4.4) |
Nicht bekannt |
Erkrankungen des Nervensystems |
Tremor |
Häufig |
Kopfschmerzen |
Gelegentlich |
|
Herzerkrankungen |
Tachykardie |
Gelegentlich |
Sinusbradykardie |
Gelegentlich |
|
Angina pectoris |
Gelegentlich |
|
Myokardischämie |
Gelegentlich |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Rachenreizung, Asthmaexazerbation |
Gelegentlich |
Dyspnoe |
Gelegentlich |
|
Oropharyngeale Schmerzen |
Gelegentlich |
|
Dysphonie |
Gelegentlich |
|
Husten |
Gelegentlich |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit |
Gelegentlich |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Müdigkeit |
Gelegentlich |
Reizbarkeit |
Gelegentlich |
|
Untersuchungen |
Elektrokardiogramm, QT-Verlängerung |
Gelegentlich |
Rückgang des freien Kortisols im Urin |
Gelegentlich |
|
Verminderter Kortisolspiegel im Blut |
Gelegentlich |
|
Erhöhter Kaliumspiegel im Blut |
Gelegentlich |
|
Erhöhter Glukosespiegel im Blut |
Gelegentlich |
|
Veränderter R-Wellen-Verlauf im Elektrokardiogramm |
Gelegentlich |
Unter den beobachteten Nebenwirkungen treten typischerweise folgende im Zusammenhang mit Formoterol auf: Tremor, Kopfschmerzen, Tachykardie, Sinusbradykardie, Angina pectoris, Myokardischämie und QT-Verlängerung.
Nebenwirkungen, die typischerweise in Verbindung mit Beclometasondipropionat auftreten, sind: Nasopharyngitis, orale Candidiasis, Dysphonie, Rachenreizung, Reizbarkeit, Rückgang des freien Kortisols im Urin, verminderter Kortisolspiegel im Blut, erhöhter Glukosespiegel im Blut.
Weitere Nebenwirkungen, die bei der klinischen Anwendung von Foster Nexthaler nicht beobachtet wurden, jedoch typischerweise mit der inhalativen Anwendung von Beclometasondipropionat verbunden werden, sind andere orale Pilzinfektionen. Gelegentlich wurde bei Therapien mit inhalativen Kortikoiden über Geschmacksstörungen berichtet.
Für Maßnahmen zur Minimierung des Auftretens von oralen Pilzinfektionen, oraler Candidiasis und Dysphonie siehe Abschnitt 4.4.
Systemische Effekte bei inhalativen Kortikosteroiden (z. B. Beclometasondipropionat) können vor allem dann auftreten, wenn sie in hohen Dosen über lange Zeit angewendet werden. Dazu können zählen: Cushing-Syndrom, cushingoide Erscheinungen, Nebennierenrindensuppression, verringerte Knochenmineraldichte, Wachstumsverzögerungen bei Kindern und Jugendlichen, Katarakt und Glaukom (siehe auch Abschnitt 4.4).
Weitere Nebenwirkungen, die bei der klinischen Anwendung therapeutischer Dosen von Foster Nexthaler 100/6 Mikrogramm nicht beobachtet wurden, jedoch typischerweise mit der Verabreichung von Beta2-Agonisten wie Formoterol verbunden werden, sind Herzklopfen, Vorhofflimmern, ventrikuläre Extrasystolen, Tachyarrhythmie, potenziell schwere Hypokaliämie und Erhöhung/Senkung des Blutdrucks. Gelegentlich wurde bei der Therapie mit inhalativem Formoterol über Schlaflosigkeit, Schwindel, Ruhelosigkeit und Ängstlichkeit berichtet. Formoterol kann auch Muskelkrämpfe und Myalgie hervorrufen.
Überempfindlichkeitsreaktionen wie Hautausschlag, Urtikaria, Pruritus, Erythem, Ödem der Augen, des Gesichts, der Lippen und des Rachens (Angioödem) wurden ebenfalls beobachtet.
Wie bei anderen inhalativen Arzneimitteln kann ein paradoxer Bronchospasmus auftreten, der sich unmittelbar nach der Inhalation durch ein Giemen, Husten und Atemnot äußert (siehe auch Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels.
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
Die höchste empfohlene Dosis von Foster Nexthaler bei einer Einzelanwendung sind 2 Inhalationen. Bei Asthmapatienten wurden vier kumulative Inhalationen von Foster Nexthaler (insgesamt 800 Mikrogramm Beclometasondipropionat, 24 Mikrogramm Formoterol als Einzeldosis verabreicht) untersucht. Die kumulative Behandlung verursachte keine abnorme, klinisch relevante Wirkung auf die Vitalparameter. Es wurden weder schwerwiegende noch schwere unerwünschte Reaktionen beobachtet (siehe auch Abschnitt 4.8).
Mit Foster Druckgasinhalation, Lösung wurden bei Asthmapatienten Inhalationsdosen von bis zu 12 kumulativen Aerosolstößen zu jeweils 100/6 Mikrogramm (insgesamt 1200 Mikrogramm Beclometasondipropionat, 72 Mikrogramm Formoterol) untersucht. Die kumulativen Behandlungen verursachten keine nachteiligen Wirkungen auf die Vitalparameter und es wurden weder schwerwiegende noch schwere unerwünschte Ereignisse beobachtet.
Eine Überdosierung von Formoterol lässt die für Beta2-adrenerge Agonisten typischen Wirkungen erwarten: Übelkeit, Erbrechen, Kopfschmerzen, Tremor, Schläfrigkeit, Palpitationen, Tachykardie, ventrikuläre Arrhythmien, Verlängerung des QTc-Intervalls, metabolische Azidose, Hypokaliämie, Hyperglykämie.
Im Falle einer Überdosierung von Formoterol ist eine unterstützende und symptomatische Behandlung angezeigt. Bei schweren Fällen wird zu einer Klinikeinweisung geraten. Die Anwendung von kardioselektiven Beta-Adrenorezeptorenblockern kann in Betracht gezogen werden, jedoch ist in diesem Fall extreme Vorsicht geboten, da die Anwendung von Beta-Adrenorezeptorenblockern Bronchospasmen auslösen kann. Der Serumkaliumspiegel sollte überwacht werden.
Die akute Inhalation von Beclometasondipropionat in höheren als den empfohlenen Dosierungen kann zu einer vorübergehenden Nebennierenrindensuppression führen. Notfallmaßnahmen sind nicht erforderlich, da sich die Nebennierenrindenfunktion innerhalb weniger Tage normalisiert, was durch Messung der Cortisolspiegel im Plasma überprüft werden kann. Bei diesen Patienten ist die Behandlung mit einer Dosierung fortzusetzen, die eine ausreichende Kontrolle der Asthmasymptome gewährleistet.
Bei einer chronischen Überdosierung mit inhalativem Beclometasondipropionat besteht das Risiko der Nebennierenrindensuppression (siehe Abschnitt 4.4). Gegebenenfalls ist eine Überwachung der Nebennierenfunktionsreserve erforderlich. Die Behandlung sollte mit einer zur Asthmakontrolle ausreichenden Dosierung weitergeführt werden.
Pharmakotherapeutische Gruppe: Mittel bei obstruktiven Atemwegserkrankungen; Sympathomimetika in Kombination mit Corticosteroiden oder anderen Mitteln, exkl. Anticholinergika
ATC-Code: R03AK08.
Wirkmechanismus und pharmakodynamische Wirkungen
Foster Nexthaler enthält Beclometasondipropionat und Formoterol in einer Trockenpulverformulierung mit einem extrafeinen Aerosol, dessen aerodynamischer Massenmediandurchmesser (MMAD) bei 1,4 bis 1,7 Mikrometern liegt. Beide Wirkstoffe deponieren gemeinsam. Die Aerosolpartikel von Foster Nexthaler sind im Durchschnitt wesentlich kleiner als die Partikel aus nicht extrafeinen Formulierungen.
Eine Depositionsstudie mit Foster Nexthaler 100/6 Mikrogramm mit radioaktiv markiertem Arzneimittel bei erwachsenen Asthmatikern zeigte, dass ein großer Anteil des Arzneimittels (ca. 42 % der nominalen Dosis) mit einer gleichmäßigen Verteilung in den Atemwegen der Lunge deponiert wird. Diese Eigenschaften rechtfertigen die Anwendung einer niedrigen Kortikosteroiddosis mit erhöhten lokalen pharmakodynamischen Effekten, die sich gegenüber denen der Foster Druckgasinhalation, Lösung als gleichwertig erwiesen.
Die beiden Wirkstoffe von Foster Nexthaler haben unterschiedliche Wirkmechanismen. Wie bei anderen Kombinationen von inhalativen Kortikosteroiden und Beta2-Agonisten kommt es zu einer additiven Wirkung hinsichtlich der Verminderung der Asthma-Anfälle.
Beclometasondipropionat
Das Kortikosteroid Beclometasondipropionat hat bei inhalativer Anwendung in den empfohlenen Dosierungen eine entzündungshemmende Wirkung in der Lunge. Hieraus resultiert eine Abnahme der Asthmasymptome und -anfälle mit weniger Nebenwirkungen als bei einer systemischen Kortikosteroidtherapie.
Formoterol
Formoterol ist ein selektiver Beta2-adrenerger Agonist, der bei Patienten mit reversibler Obstruktion der Atemwege eine Erschlaffung der glatten Bronchialmuskulatur bewirkt. Die bronchodilatatorische Wirkung setzt rasch innerhalb von 1 bis 3 Minuten nach Inhalation ein und hat nach Gabe einer Einzeldosis eine durchschnittliche Wirkdauer von 12 Stunden.
Klinische Erfahrungen
Die Wirksamkeit der beiden Komponenten von Foster Nexthaler Pulver zur Inhalation wurde in der niedrigeren Dosierung (100 Mikrogramm/6 Mikrogramm) in drei separaten Studien bei Patienten mit moderatem bis schwerem persistierendem Asthma im Vergleich zur Foster Druckgasinhalation, Lösung 100 Mikrogramm/6 Mikrogramm beurteilt. Insgesamt ist davon auszugehen, dass die Wirksamkeit der beiden Inhalatoren in der klinischen Praxis sowohl bei 1 Inhalation als auch bei 2 Inhalationen zweimal täglich vergleichbar ist.
Die primäre Zielsetzung der ersten Studie bestand in der Bestimmung der Wirksamkeit der inhalierten Kortikosteroid-Komponente, gemessen anhand der Bronchodilatation (Prä-Dosis-FEV1). Eine klinisch signifikante Verbesserung des Prä-Dosis-FEV1 wurde bei 696 Patienten mit moderatem bis schwerem symptomatischem Asthma am Ende eines 3-monatigen Behandlungszeitraums im Vergleich zu den Ausgangswerten bei zweimal täglich 1 oder 2 Inhalationen beider Formulierungen festgestellt. Es wurde ein mittlerer Anstieg von mindestens 250 ml beobachtet. Es gab zwischen Foster Nexthaler Pulver zur Inhalation und Druckgasinhalation, Lösung bei beiden Dosierungen keinen klinisch relevanten Unterschied des Prä-Dosis-FEV1. Beim morgendlichen PEF wurde eine signifikante Dosisabhängigkeit beobachtet. Dagegen wurde bei dem Prä-Dosis-FEV1 keine statistische Signifikanz der Dosisabhängigkeit erreicht. Die Asthmakontrolle – gemessen etwa mit den morgendlichen und abendlichen Asthma-Symptom-Scores und dem prozentualen Anteil symptomfreier Tage – besserte sich signifikant unter beiden Formulierungen bis zum Ende des Behandlungszeitraums gegenüber den Anfangswerten, insbesondere unter den beiden höheren Dosierungen.
In der zweiten Studie bestand die primäre Zielsetzung in der Bestimmung der Wirksamkeit des langwirksamen Beta2-Agonisten von Foster Nexthaler. Dabei wurde die Bronchodilatation zu Beginn und bis zu 12 Stunden nach Verabreichung einer Einzeldosis durch aufeinanderfolgende spirometrische Untersuchungen von FEV1 (FEV1-AUC über mindestens 80 % der Formoterol-Wirkdauer) gemessen. Im Vergleich zum Placebo verbesserten eine und vier Inhalationen der beiden Wirkstoffe von Foster Nexthaler den Parameter FEV1-AUC0-12 signifikant. Beide Dosierungen von Foster Nexthaler Pulver zur Inhalation waren den entsprechenden Dosierungen der Foster Druckgasinhalation, Lösung nicht unterlegen. Bei beiden Formulierungen wurde zwischen niedriger und hoher Dosis eine statistisch signifikante Dosis-Wirkungs-Beziehung festgestellt.
Nach einer 4-wöchigen „Run-in-Phase” mit täglich 2 x 1 Inhalation einer Beclometasondipropionat-/Formoterol-Fixkombination als Druckgasinhalation, Lösung erhielten in der dritten Studie 755 Patienten mit kontrolliertem Asthma über 8 Wochen randomisiert täglich entweder weiterhin den gleichen Inhalator oder jeweils 2 x 1 Inhalation Foster Nexthaler Pulver zur Inhalation oder 2 x 1 Inhalation 100 Mikrogramm Beclometasondipropionat Pulver zur Inhalation. Das primäre Ziel war die Veränderung des mittleren morgendlichen exspiratorischen Spitzenflusses (PEF) über den gesamten Behandlungszeitraum hinweg. Nach 8 Wochen Therapie gab es beim primären Zielparameter keinen Unterschied zwischen den beiden Kombinationsbehandlungen. Beide erwiesen sich gegenüber der Beclometasondipropionat-Monotherapie deutlich überlegen. Bei den ausgewerteten Symptomen, wie etwa der Punktzahl des Asthmakontrollfragebogens oder der Anzahl der Tage ohne Notfallmedikation, wurden keine Unterschiede zwischen den beiden Kombinationsbehandlungen festgestellt.
Es wurde eine offene Placebostudie durchgeführt, um den Nachweis zu erbringen, dass der durch den Nexthaler-Inhalator erzielbare inspiratorische Fluss nicht von Alter, Art und Schweregrad der Erkrankung des Patienten beeinflusst wird und dass bei allen Patienten eine Aktivierung und Dosisfreisetzung aus dem Inhalator erzielt werden kann. Der primäre Zielparameter war der Prozentsatz der Patienten in jeder Alters- und Erkrankungsgruppe, die in der Lage waren, den Inhalator zu aktivieren. An der Studie nahmen 89 Patienten im Altersbereich von 5 bis 84 Jahren teil, einschließlich Patienten mit moderatem und schwerem Asthma (FEV1 > 60 % bzw. ≤ 60 % vom Soll) sowie Patienten mit moderater und schwerer COPD (FEV1 ≥ 50 % bzw. < 50 % vom Soll). Unabhängig von Alter, Art und Schwere der Erkrankung waren alle Patienten in der Lage, einen ausreichenden inspiratorischen Fluss zur Aktivierung des Nexthaler-Inhalators zu erzielen.
In einer doppelblinden, randomisierten, placebokontrollierten 5-armigen-Crossover-Studie mit zwei verschiedenen Einzeldosen (1 oder 4 Inhalationen) Foster Nexthaler 100/6 Mikrogramm und Foster Nexthaler 200 Mikrogramm/6 Mikrogramm oder Placebo wurde der bronchodilatatorische Effekt (FEV1-AUC0-12h zeitlich normiert) bei 60 erwachsenen Patienten mit teilweise kontrolliertem oder unkontrolliertem Asthma untersucht.
Die bereinigte mittlere Differenz (95-%-Konfidenzintervall) für Foster Nexthaler 200 Mikrogramm/6 Mikrogramm gegenüber Foster Nexthaler 100 Mikrogramm/6 Mikrogramm betrug 0,029 (–0,018; 0,076) L für die niedrigere Formoterol-Dosierung (1 Inhalation – 6 Mikrogramm) bzw. 0.027 (–0.020; 0.073) L für die höhere Formoterol-Dosierung (4 Inhalationen – 24 Mikrogramm). Die Ergebnisse zeigten, dass die Untergrenzen des zweiseitigen 95-%-Konfidenzintervalls für die bereinigte mittlere Differenz zwischen den Behandlungen deutlich über der vorbestimmten Nichtunterlegenheitsgrenze (–0,12 L) waren, wodurch diese vorbestimmte Nichtunterlegenheit (–0,12 L) von Foster Nexthaler 200 Mikrogramm/6 Mikrogramm im Vergleich zu niedrigeren Dosierungen bezüglich des FEV1-AUC0-12h zeitlich normalisiert bei beiden Formoterol-Dosierungen (6 und 24 Mikrogramm) aufgezeigt wurde.
Beclometasondipropionat
Beclometasondipropionat ist eine Arzneimittelvorstufe (Prodrug) mit schwacher Bindungsaffinität für den Glukokortikoid-Rezeptor und wird über Esterasen zum aktiven Metaboliten Beclometason-17-monopropionat hydrolysiert. Dieser hat eine stärkere topische entzündungshemmende Wirkung verglichen mit der Arzneimittelvorstufe (Prodrug) Beclometasondipropionat.
Resorption, Verteilung und Biotransformation
Inhaliertes Beclometasondipropionat wird rasch über die Lunge resorbiert. Vor der Resorption findet eine weitgehende Umwandlung zu seinem Hauptmetaboliten Beclometason-17-monopropionat statt, und zwar durch Esteraseenzyme, die in den meisten Geweben vorkommen. Die systemische Verfügbarkeit des Hauptmetaboliten resultiert aus der Deposition in der Lunge und aus der gastrointestinalen Resorption des verschluckten Dosisanteils. Die Bioverfügbarkeit von verschlucktem Beclometasondipropionat ist vernachlässigbar gering, allerdings resultiert die präsystemische Umwandlung zu Beclometason-17-Monopropionat daraus, dass ein Teil der Dosis als aktiver Metabolit resorbiert wird.
Die systemische Exposition zeigt einen ungefähr linearen Anstieg parallel zu steigenden inhalierten Dosierungen.
Die absolute Bioverfügbarkeit nach der Inhalation mit einem Dosieraerosol beträgt etwa 2 bzw. 62 % der nominalen Dosis für unverändertes Beclometasondipropionat bzw. Beclometason-17-monopropionat.
Nach intravenöser Anwendung ist die Verteilung von Beclometasondipropionat und Beclometason-17-monopropionat durch eine hohe Plasma-Clearance (150 bzw. 120 L/Stunde) bei kleinem Verteilungsvolumen im Steady-State für Beclometasondipropionat (20 Liter) und größerer Gewebeverteilung für den aktiven Metaboliten (424 Liter) charakterisiert. Beclometasondipropionat wird in erster Linie (zu 82 %) in Form seines aktiven Metaboliten Beclometason-17-Monopropionat metabolisch verfügbar.
Die Plasmaproteinbindung liegt im moderat hohen Bereich (87 %).
Elimination
Beclometasondipropionat wird hauptsächlich mit den Fäzes als polare Metaboliten ausgeschieden. Die renale Ausscheidung von Beclometasondipropionat und seinen Metaboliten ist vernachlässigbar gering. Die terminalen Eliminationshalbwertszeiten sind 0,5 Stunden und 2,7 Stunden für Beclometasondipropionat bzw. Beclometason-17-monopropionat.
Besondere Patientengruppen
Die Pharmakokinetik von Beclometasondipropionat bei Patienten mit Niereninsuffizienz oder Leberinsuffizienz wurde nicht untersucht. Da Beclometasondipropionat sehr rasch über Esterasen, die sich in der Darmflüssigkeit, dem Serum, den Lungen und der Leber befinden, zu den stärker polaren Produkten Beclometason-21-monopropionat, Beclometason-17-monopropionat und Beclometason abgebaut wird, ist durch eine beeinträchtigte Leberfunktion keine Veränderung der Pharmakokinetik und des Sicherheitsprofils von Beclometasondipropionat zu erwarten.
Weder Beclometasondipropionat noch seine Stoffwechselprodukte konnten im Urin nachgewiesen werden. Daher ist bei Patienten mit Nierenfunktionsstörungen nicht mit einer erhöhten systemischen Exposition zu rechnen.
Linearität/Nichtlinearität
In einer klinisch-pharmakologischen Studie wurde die Bioverfügbarkeit in der Lunge und die systemische Gesamtverfügbarkeit der beiden Komponenten mit zwei verschiedenen Dosierungen des Inhalationspulvers Foster Nexthaler 100/6 Mikrogramm und Foster Nexthaler200/6 Mikrogramm) untersucht. Diese Parameter wurden nach Verabreichung einer Einzeldosis (4 Inhalationen) von jeder Formulierung, einmal mit und einmal ohne Aktivkohleblockade bewertet. Die Studie hatte ein offenes, 6-armiges-Crossover-Einzeldosis-Design. Insgesamt wurden 30 erwachsene Asthmapatienten mit einem FEV1 ≥ 70 % vom Soll eingeschlossen und mit niedrigen Tagesdosen inhalativer Kortikosteroide (z. B. Budesonid oder gleichwertig ≤ 400 Mikrogramm /Tag) oder niedrig dosierten inhalativen Kortikosteroiden/langwirksamen Beta2-Agonisten in Fixkombinationen behandelt. Die Bioverfügbarkeit von B17MP (aktiver Metabolit von Beclometasondipropionat) in der Lunge und die systemische Gesamtverfügbarkeit von B17MP waren unter beiden Studienbedingungen (mit und ohne Aktivkohleblockade) zwischen der Wirkstärke 200/6 und der Wirkstärke 100/6 proportional zur Dosis. Die Bioäquivalenz von Formoterol hinsichtlich der Bioverfügbarkeit in der Lunge und der systemischen Gesamtverfügbarkeit konnte in dieser Studie nicht vollständig gezeigt werden, da das untere 90-%-Konfidenzintervall von Cmax und AUCt beim Vergleich der beiden Dosisstärken unter der unteren Bioäquivalenzgrenze von 80 % lagen. Diese verringerte systemische Exposition [die sich auf 20–14 % in Cmax und AUCt] beläuft) führt nicht zu einem veränderten Sicherheitsprofil, da keine Unterschiede bei den systemischen Effekten beobachtet wurde (einschließlich Glukose-, Kalium- und kardiovaskulärer Parameter). Dies zeigt, dass Foster Nexthaler 200/6 Mikrogramm mindestens ebenso sicher ist wie Foster Nexthaler 100/6 Mikrogramm. Im Hinblick auf die Lungendeposition betrug der Unterschied 20 % bzw. 22 % für Cmax und AUCt. Die entsprechende Wirksamkeit der beiden Dosierstärken (100/6 Mikrogramm und 200/6 Mikrogramm) bezüglich der Bronchodilatation wurde in einer spezifischen pharmakokinetischen Studie nachgewiesen (siehe Abschnitt 5.1).
Formoterol
Resorption und Verteilung
Nach Inhalation wird Formoterolfumarat-Dihydrat sowohl aus den Lungen als auch vom Gastrointestinaltrakt rasch resorbiert. Der Anteil einer inhalierten Dosis, der nach Anwendung eines Dosieraerosols geschluckt wird, beträgt zwischen 60 und 90 %. Mindestens 65 % einer verschluckten Formoterol-Dosis werden vom Gastrointestinaltrakt resorbiert. Maximale Plasmakonzentrationen der unveränderten Substanz liegen innerhalb von einer halben bis einer Stunde nach oraler Gabe vor. Die Plasmaproteinbindung von Formoterol beträgt 61–64 %, wobei 34 % an Albumin gebunden sind. Eine Sättigung der Bindung innerhalb des Konzentrationsbereichs therapeutischer Dosen trat nicht auf. Die Eliminationshalbwertszeit nach oraler Verabreichung beträgt 2–3 Stunden. Nach Inhalation von 12 bis 96 µg Formoterolfumarat zeigt die Resorption von Formoterol einen linearen Verlauf.
Biotransformation
Formoterol wird überwiegend durch die direkte Konjugation an der phenolischen Hydroxylgruppe metabolisiert. Das Glukuronsäurekonjugat ist nicht aktiv. Der zweite Hauptabbauweg ist die O-Demethylierung mit nachfolgender Kopplung an der phenolischen 2'-Hydroxylgruppe. Die Cytochrom-P450-Isoenzyme CYP2D6, CYP2C19 und CYP2C9 sind an der O-Demethylierung von Formoterol beteiligt. Die Leber scheint der Hauptabbauort zu sein. In therapeutisch relevanten Konzentrationen hemmt Formoterol nicht die CYP450-Enzyme.
Elimination
Die Ausscheidung von Formoterolfumarat-Dihydrat im Urin nach einmaliger Inhalation mit einem Trockenpulverinhalator nahm linear im Dosisbereich 12–96 Mikrogramm zu. Durchschnittlich wurden 8 % und 25 % der Dosis unverändert bzw. als Gesamtformoterol ausgeschieden. Berechnet aufgrund der Plasmakonzentrationen, die nach Inhalation einer Einzeldosis von 120 μg bei 12 gesunden Probanden gemessen wurden, wurde die mittlere terminale Eliminationshalbwertszeit von 10 Stunden bestimmt. Die (R,R)- und (S,S)-Enantiomere machten etwa 40 % bzw. 60 % der unverändert im Urin ausgeschiedenen Substanz aus. Der relative Anteil der beiden Enantiomere blieb über den untersuchten Dosisbereich konstant. Nach Mehrfachgabe gab es keinen Hinweis auf eine relative Kumulation des einen Enantiomers im Verhältnis zum anderen Enantiomer.
Nach oraler Gabe (40–80 Mikrogramm) wurden bei gesunden Probanden 6 % bzw. 10 % der Dosis im Urin als unveränderte Substanz gefunden. Bis zu 8 % der Dosis wurde als Glukuronid wiedergefunden.
Insgesamt 67 % einer oralen Dosis Formoterol werden im Urin (hauptsächlich als Metaboliten) ausgeschieden, der Rest in den Fäzes. Die renale Clearance von Formoterol beträgt 150 ml/min.
Besondere Patientengruppen
Leber-/Niereninsuffizienz: Die Pharmakokinetik von Formoterolfumarat-Dihydrat bei Patienten mit Leber- oder Niereninsuffizienz wurde nicht untersucht. Da Formoterol vorrangig über die Leber metabolisiert wird, ist von erhöhter Exposition bei Patienten mit schwerer Leberzirrhose auszugehen.
Klinische Erfahrungen
Die systemische Exposition gegenüber Beclometasondipropionat und Formoterol in der Kombination wurde mit den jeweiligen Einzelkomponenten verglichen. Es gab keine Hinweise auf pharmakokinetische oder (systemische) pharmakodynamische Wechselwirkungen zwischen Beclometasondipropionat und Formoterol.
Nicht klinische Daten der einzelnen Komponenten von Foster Nexthaler lassen auf der Grundlage konventioneller Studien zur Sicherheitspharmakologie und zur Toxizität bei wiederholter Verabreichung keine besondere Gefahr für den Menschen erkennen. Das Toxizitätsprofil der Kombination spiegelt das der Einzelkomponenten wider, ohne dabei einen Anstieg der Toxizität oder unerwartete Ereignisse zu zeigen.
In Studien zur Reproduktionstoxikologie bei Ratten traten dosisabhängige Effekte auf. Das Vorliegen von Beclometasondipropionat in hohen Dosen war mit reduzierter Fruchtbarkeit bei weiblichen Tieren, reduzierter Anzahl von Implantationen und embryofetaler Toxizität verbunden. Es ist bekannt, dass Kortikosteroide in hohen Dosierungen bei trächtigen Tieren zu Abnormalitäten bei der fetalen Entwicklung einschließlich Gaumenspalte und intrauteriner Wachstumsverzögerung führen. Es ist wahrscheinlich, dass die mit der Kombination Beclometasondipropionat/Formoterol beobachteten Wirkungen auf Beclometasondipropionat zurückzuführen waren. Diese Wirkungen waren nur bei hoher systemischer Exposition gegenüber dem aktiven Metaboliten Beclometason-17-monopropionat zu beobachten (mehr als das 200-Fache der erwarteten Plasmaspiegel bei den Patienten). Außerdem wurde in Tierstudien eine Verlängerung der Trächtigkeit und des Geburtsvorgangs beobachtet, was auf die bekannte wehenhemmende Wirkung von Beta2-Sympathomimetika zurückzuführen ist. Diese Wirkungen waren sichtbar, wenn die Plasmaformoterolspiegel des Muttertiers unterhalb der zu erwartenden Werte der mit Foster Nexthaler behandelten Patienten lagen.
Genotoxizitätsstudien, die mit einer Beclometasondipropionat-/Formoterol-Fixkombination durchgeführt wurden, deuten nicht auf ein mutagenes Potenzial hin. Mit der vorliegenden Kombination wurden keine Kanzerogenitätsstudien durchgeführt. Die Daten, die für die einzelnen Bestandteile aus Tierstudien vorliegen, weisen jedoch nicht auf ein mögliches Kanzerogenitätsrisiko beim Menschen hin.
Alpha-Lactose-Monohydrat (enthält möglicherweise Spuren von Milchprotein)
Magnesiumstearat (Ph.Eur.) [pflanzlich]
Nicht zutreffend.
3 Jahre.
Nach dem ersten Öffnen des Schutzbeutels ist das Arzneimittel 6 Monate lang verwendbar.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Entnehmen Sie den Inhalator erst unmittelbar vor der ersten Anwendung aus dem Beutel.
Vor dem ersten Öffnen des Schutzbeutels:
Für dieses Arzneimittel sind bezüglich der Temperatur keine besonderen Lagerungsbedingungen erforderlich.
Nach dem ersten Öffnen des Schutzbeutels:
Nicht über 25 °C lagern.
Jede Packung enthält 1, 2 oder 3 Nexthaler-Inhalatoren mit jeweils 120 Inhalationen.
Jede Klinikpackung enthält 1 Foster Nexthaler Inhalator mit 120 Inhalationen.
Jeder Inhalator befindet sich in einem verschweißten Beutel (Folienverpackung) aus PET/Al/PE (Polyethylenterephthalat/Aluminium/Polyethylen) oder PA/AL/PE (Polyamid/Aluminium/Polyethylen).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Foster Nexthaler ist ein Mehrfachdosis-Inhalator. Das Gerät besteht aus einem Gehäuse, dessen unterer Teil ein Fenster zur Anzeige der verbliebenen Inhalationen enthält, und einer integrierten Abdeckung. Beim Öffnen der Abdeckung, die auch am Inhalationszählmechanismus beteiligt ist, wird ein Mundstück sichtbar, über das das Pulver inhaliert wird. Der untere Gehäuseteil und das Mundstück bestehen aus Acrylnitril-Butadien-Styrol und die Abdeckung aus Polypropylen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Chiesi GmbH
Ludwig-Erhard-Straße 34
20459 Hamburg
Tel: +49 40 89724-0
Fax: +49 40 89724-212
E-Mail: info.de@chiesi.com
92269.00.00
Datum der Erteilung der Zulassung: 27. August 2015
Datum der letzten Verlängerung der Zulassung: 11. November 2020
September 2025
Verschreibungspflichtig.