Hemlibra® 30 mg/ml Injektionslösung
Hemlibra® 150 mg/ml Injektionslösung
Hemlibra 30 mg/ml Injektionslösung
Jeder ml Lösung enthält 30 mg Emicizumab*
Jede Durchstechflasche mit 0,4 ml enthält 12 mg Emicizumab in einer Konzentration von 30 mg/ml.
Jede Durchstechflasche mit 1 ml enthält 30 mg Emicizumab in einer Konzentration von 30 mg/ml.
Hemlibra 150 mg/ml Injektionslösung
Jeder ml Lösung enthält 150 mg Emicizumab*
Jede Durchstechflasche mit 0,4 ml enthält 60 mg Emicizumab in einer Konzentration von 150 mg/ml.
Jede Durchstechflasche mit 0,7 ml enthält 105 mg Emicizumab in einer Konzentration von 150 mg/ml.
Jede Durchstechflasche mit 1 ml enthält 150 mg Emicizumab in einer Konzentration von 150 mg/ml.
Jede Durchstechflasche mit 2 ml enthält 300 mg Emicizumab in einer Konzentration von 150 mg/ml.
* Emicizumab ist ein humanisierter, monoklonaler, modifizierter Immunoglobulin-G4 (IgG4)-Antikörper, der mittels rekombinanter Desoxyribonukleinsäure(DNA)-Technologie in Ovarialzellen des chinesischen Hamsters (CHO-Zellen) hergestellt wird.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Injektionslösung.
Farblose bis hellgelbe Lösung.
Hemlibra wird angewendet als Routineprophylaxe von Blutungsereignissen bei Patienten mit Hämophilie A (hereditärer Faktor-VIII-Mangel):
mit Faktor-VIII-Hemmkörpern
ohne Faktor-VIII-Hemmkörper mit:
schwerer Erkrankung (FVIII < 1 %)
mittelschwerer Erkrankung (FVIII ≥ 1 % und ≤ 5 %) mit schwerem Blutungsphänotyp.
Hemlibra kann bei allen Altersgruppen angewendet werden.
Die Behandlung sollte unter der Aufsicht eines Arztes, der in der Behandlung von Hämophilie und/oder Blutungsstörungen erfahren ist, eingeleitet und überwacht werden.
Dosierung
Die Behandlung mit Bypassing-Präparaten (einschließlich Routine-Prophylaxe), wie z. B. mit aktiviertem Prothrombinkomplex-Konzentrat (aPCC) und mit rekombinantem aktiviertem humanem Faktor VII (rFVIIa), sollte am Tag vor dem Beginn der Therapie mit Hemlibra abgesetzt werden (siehe Abschnitt 4.4).
Die Faktor-VIII-Prophylaxe (FVIII-Prophylaxe) kann über die ersten 7 Tage der Behandlung mit Hemlibra fortgesetzt werden.
Die empfohlene Dosis beträgt 3 mg/kg einmal wöchentlich in den ersten 4 Wochen (Initialdosis), gefolgt von einer Erhaltungsdosis ab Woche 5 von entweder 1,5 mg/kg einmal wöchentlich, 3 mg/kg alle zwei Wochen oder 6 mg/kg alle vier Wochen. Alle Dosen werden als subkutane Injektion appliziert.
Das Dosierungsschema für die Initialdosis bleibt gleich, unabhängig vom Schema der Erhaltungsdosis.
Das Dosierungsschema für die Erhaltungsdosis ist so zu wählen, dass es den Präferenzen des Arztes und des Patienten bzw. der Betreuungsperson entspricht und die Therapieadhärenz unterstützt.
Die Dosis des Patienten (in mg) und das Volumen (in ml) sollte wie folgt berechnet werden:
Initialdosis (3 mg/kg) einmal wöchentlich in den ersten 4 Wochen:
Körpergewicht des Patienten (kg) x Dosis (3 mg/kg) = Gesamtmenge (mg) Emicizumab, die angewendet werden soll
Gefolgt von einer Erhaltungsdosis ab Woche 5 von entweder 1,5 mg/kg einmal wöchentlich, 3 mg/kg alle zwei Wochen oder 6 mg/kg alle vier Wochen auf der Grundlage von:
Körpergewicht des Patienten (kg) x Dosis (1,5; 3 oder 6 mg/kg) = Gesamtmenge (mg) Emicizumab, die angewendet werden soll
Das Gesamtvolumen von Hemlibra zur subkutanen Injektion wird wie folgt berechnet:
Gesamtmenge (mg) Emicizumab, die subkutan injiziert werden soll ÷ Konzentration der Durchstechflasche (mg/ml) = Gesamtvolumen Hemlibra, welches injiziert werden soll (ml).
Unterschiedliche Konzentrationen von Hemlibra (30 mg/ml und 150 mg/ml) dürfen in derselben Spritze nicht kombiniert werden, wenn das Gesamtvolumen für die Anwendung vorbereitet wird.
Ein Volumen von mehr als 2 ml pro Injektion darf nicht angewendet werden.
Beispiele:
Körpergewicht des Patienten von 16 kg bei einem Dosierungsschema für die Erhaltungsdosis von 1,5 mg/kg einmal wöchentlich:
Beispiel für die Initialdosis (erste 4 Wochen): 16 kg x 3 mg/kg = 48 mg Emicizumab für die Initialdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 48 mg durch 150 mg/ml dividiert: 48 mg Emicizumab ÷ 150 mg/ml = 0,32 ml zu injizierendes Hemlibra in einer Konzentration von 150 mg/ml.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Beispiel für die Erhaltungsdosis (ab Woche 5): 16 kg x 1,5 mg/kg = 24 mg Emicizumab für die Erhaltungsdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 24 mg durch 30 mg/ml dividiert: 24 mg Emicizumab ÷ 30 mg/ml = 0,8 ml Hemlibra in einer Konzentration von 30 mg/ml, das einmal wöchentlich injiziert werden muss.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Körpergewicht des Patienten von 40 kg bei einem Dosierungsschema für die Erhaltungsdosis von 3 mg/kg alle zwei Wochen:
Beispiel für die Initialdosis (erste 4 Wochen): 40 kg x 3 mg/kg = 120 mg Emicizumab für die Initialdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 120 mg durch 150 mg/ml dividiert: 120 mg Emicizumab ÷ 150 mg/ml = 0,8 ml zu injizierendes Hemlibra in einer Konzentration von 150 mg/ml.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Beispiel für die Erhaltungsdosis (ab Woche 5): 40 kg x 3 mg/kg = 120 mg Emicizumab für die Erhaltungsdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 120 mg durch 150 mg/ml dividiert: 120 mg Emicizumab ÷ 150 mg/ml = 0,8 ml Hemlibra in einer Konzentration von 150 mg/ml, das alle zwei Wochen injiziert werden muss.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Körpergewicht des Patienten von 60 kg bei einem Dosierungsschema für die Erhaltungsdosis von 6 mg/kg alle vier Wochen:
Beispiel für die Initialdosis (erste 4 Wochen): 60 kg x 3 mg/kg = 180 mg Emicizumab für die Initialdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 180 mg durch 150 mg/ml dividiert: 180 mg Emicizumab ÷ 150 mg/ml = 1,20 ml zu injizierendes Hemlibra in einer Konzentration von 150 mg/ml.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Beispiel für die Erhaltungsdosis (ab Woche 5): 60 kg x 6 mg/kg = 360 mg Emicizumab für die Erhaltungsdosis.
Zur Berechnung des zu verabreichenden Volumens wird die berechnete Dosis von 360 mg durch 150 mg/ml dividiert: 360 mg Emicizumab ÷ 150 mg/ml = 2,4 ml Hemlibra in einer Konzentration von 150 mg/ml, das alle vier Wochen injiziert werden muss.
Wählen Sie die geeignete Dosis sowie das Volumen aus den verfügbaren Stärken aus.
Behandlungsdauer
Hemlibra wird als Langzeit-Prophylaxe angewendet.
Dosisanpassungen während der Behandlung
Dosisanpassungen von Hemlibra werden nicht empfohlen.
Verspätete oder versäumte Dosen
Wenn ein Patient eine geplante subkutane Injektion mit Hemlibra versäumt, ist er anzuweisen, die versäumte Dosis so bald wie möglich, bis einen Tag vor dem Tag der nächsten geplanten Dosis nachzuholen. Die nächste Dosis soll der Patient am regulär geplanten Wochentag applizieren. Der Patient darf nicht zwei Dosen am selben Tag anwenden, um eine versäumte Dosis nachzuholen.
Besondere Patientengruppen
Kinder und Jugendliche
Bei Kindern und Jugendlichen werden keine Dosisanpassungen empfohlen (siehe Abschnitt 5.2). Für Kinder unter 1 Jahr liegen keine Daten vor.
Ältere Patienten
Bei Patienten im Alter von ≥ 65 Jahren werden keine Dosisanpassungen empfohlen (siehe Abschnitte 5.1 und 5.2). Für Patienten über 77 Jahre liegen keine Daten vor.
Nieren- und Leberfunktionsstörung
Bei Patienten mit leichter Nieren- oder Leberfunktionsstörung werden keine Dosisanpassungen empfohlen (siehe Abschnitt 5.2). Für die Anwendung von Hemlibra bei Patienten mit mäßiger Nieren- oder Leberfunktionsstörung liegen nur begrenzte Daten vor. Emicizumab wurde bei Patienten mit schwerer Nieren- oder Leberfunktionsstörung nicht untersucht.
Perioperativer Zeitraum
Die Sicherheit und Wirksamkeit von Emicizumab im perioperativen Zeitraum wurden formal nicht geprüft. In klinischen Studien hatten Patienten chirurgische Eingriffe ohne Absetzen der Emicizumab-Prophylaxe.
Sollten bei chirurgischen Eingriffen Bypassing-Präparate (z. B. aPCC und rFVIIa) benötigt werden, beachten Sie bitte die Dosierungsempfehlungen zur Anwendung von Bypassing-Präparaten in Abschnitt 4.4. Falls FVIII im perioperativen Zeitraum erforderlich ist, siehe bitte Abschnitt 4.5.
Zur Beobachtung der zugrundeliegenden hämostatischen Aktivität eines Patienten, siehe bitte Abschnitt 4.4 zu Labortests, die nicht durch Emicizumab beeinflusst werden.
Immuntoleranzinduktion (ITI)
Die Sicherheit und Wirksamkeit von Emicizumab bei Patienten unter laufender Immuntoleranzinduktion ist bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Hemlibra ist nur zur subkutanen Anwendung geeignet und muss unter angemessenen aseptischen Bedingungen appliziert werden (siehe Abschnitt 6.6).
Die Injektion sollte nur in die empfohlenen Injektionsbereiche erfolgen: Bauch, äußere Oberarme und Oberschenkel (siehe Abschnitt 5.2).
Die subkutane Injektion von Hemlibra in den äußeren Oberarm sollte von einer Betreuungsperson oder dem medizinischen Fachpersonal durchgeführt werden.
Ein Wechsel der Injektionsstelle kann Reaktionen an der Injektionsstelle verhindern oder verringern (siehe Abschnitt 4.8). Die subkutane Injektion von Hemlibra sollte nicht an Stellen erfolgen, an denen die Haut gerötet, verletzt, empfindlich oder verhärtet ist oder wo sich Leberflecke oder Narben befinden.
Während der Therapie mit Hemlibra sollten andere subkutan zu verabreichende Arzneimittel, falls möglich, an anderen Körperstellen injiziert werden.
Anwendung durch den Patienten und/oder die Betreuungsperson
Hemlibra ist für die Anwendung unter Anleitung von medizinischem Fachpersonal vorgesehen. Nach angemessener Unterweisung in die subkutane Injektionstechnik kann ein Patient Hemlibra auch selbst injizieren oder eine Betreuungsperson des Patienten kann die Injektion durchführen, wenn der Arzt dies für angemessen hält.
Arzt und Betreuungsperson sollten gemeinsam entscheiden, ob ein Kind in der Lage ist, Hemlibra selbst zu injizieren. Allerdings wird bei Kindern unter 7 Jahren eine Selbstinjektion nicht empfohlen.
Ausführliche Anweisungen zur Anwendung von Hemlibra, siehe Abschnitt 6.6 und Gebrauchsinformation.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Mit Hemlibra und aPCC assoziierte thrombotische Mikroangiopathie
In einer klinischen Studie mit Patienten unter Prophylaxe mit Hemlibra wurden Fälle thrombotischer Mikroangiopathie (TMA) beobachtet, nachdem eine durchschnittliche kumulative Menge von > 100 E/kg/24 Stunden eines aPCC über 24 Stunden oder länger gegeben wurde (siehe Abschnitt 4.8). Die Behandlung der TMA-Ereignisse bestand aus unterstützenden Maßnahmen mit oder ohne Plasmapherese und Hämodialyse. Innerhalb einer Woche nach Absetzen von aPCC und Unterbrechen der Therapie mit Hemlibra ergaben sich Anzeichen auf eine Besserung. Diese rasche klinische Besserung unterscheidet sich vom üblichen klinischen Verlauf des atypischen hämolytisch-urämischen Syndroms und der klassischen TMA wie der thrombotisch‑thrombozytopenischen Purpura (siehe Abschnitt 4.8). Ein Patient nahm die Behandlung mit Hemlibra nach dem Abklingen der TMA wieder auf und konnte weiterhin sicher behandelt werden.
Wenn Patienten unter Prophylaxe mit Hemlibra zusätzlich aPCC erhalten, sollten sie auf die Entwicklung einer TMA hin überwacht werden. Bei klinischen Symptomen und/oder Laborergebnissen, die auf eine TMA hindeuten, muss der Arzt die aPCC-Gabe sofort abbrechen, die Therapie mit Hemlibra unterbrechen und die klinisch notwendigen Maßnahmen ergreifen. Ärzte und Patienten/Betreuungspersonen sollten nach vollständigem Abklingen einer TMA von Fall zu Fall den Nutzen und die Risiken einer Fortsetzung der Prophylaxe mit Hemlibra abwägen. Wenn ein Patient unter Prophylaxe mit Hemlibra ein Bypassing-Präparat benötigt, sollten die untenstehenden Dosierungsempfehlungen für Bypassing-Präparate beachtet werden.
Vorsicht ist geboten, wenn Patienten mit hohem Risiko für eine TMA behandelt werden (d. h. Patienten, die eine TMA in der Anamnese oder in der Familienanamnese haben) oder Patienten, die gleichzeitig Arzneimittel erhalten, die bekanntermaßen Risikofaktoren für die Entwicklung einer TMA sind (z. B. Ciclosporin, Chinin, Tacrolimus).
Mit Hemlibra und aPCC assoziierte Thromboembolie
In einer klinischen Studie mit Patienten unter Prophylaxe mit Hemlibra wurden schwerwiegende thrombotische Ereignisse beobachtet, nachdem eine durchschnittliche kumulative Menge von > 100 E/kg/24 Stunden aPCC über 24 Stunden oder länger gegeben wurde (siehe Abschnitt 4.8). In keinem Fall war eine Antikoagulation erforderlich. Nach Absetzen von aPCC und Unterbrechen der Therapie mit Hemlibra zeigte sich innerhalb eines Monats eine Verbesserung oder ein Abklingen (siehe Abschnitt 4.8). Ein Patient nahm die Behandlung mit Hemlibra nach dem Abklingen des thrombotischen Ereignisses wieder auf und konnte weiterhin sicher behandelt werden.
Wenn Patienten unter Prophylaxe mit Hemlibra zusätzlich aPCC erhalten, sollten sie auf die Entwicklung einer Thromboembolie hin überwacht werden. Bei klinischen Symptomen, bildgebenden Untersuchungsbefunden und/oder Laborergebnissen, die auf thrombotische Ereignisse hindeuten, muss der Arzt die aPCC-Gabe sofort abbrechen, die Therapie mit Hemlibra unterbrechen und die klinisch notwendigen Maßnahmen ergreifen. Ärzte und Patienten/Betreuungspersonen sollten nach vollständigem Abklingen eines thrombotischen Ereignisses von Fall zu Fall den Nutzen und die Risiken einer Fortsetzung der Prophylaxe mit Hemlibra abwägen. Wenn ein Patient unter Hemlibra Prophylaxe ein Bypassing-Präparat benötigt, sollten die untenstehenden Dosierungsempfehlungen für Bypassing-Präparate beachtet werden.
Hinweise zur Anwendung von Bypassing-Präparaten bei Patienten unter Prophylaxe mit Hemlibra
Die Behandlung mit Bypassing-Präparaten sollte am Tag vor dem Beginn der Therapie mit Hemlibra beendet werden.
Der Arzt sollte mit allen Patienten und/oder Betreuungspersonen die genaue Dosis und den Anwendungsplan von Bypassing-Präparaten besprechen, falls diese bei Bedarf während einer Prophylaxe mit Hemlibra eingesetzt werden.
Hemlibra erhöht das Gerinnungspotenzial des Patienten. Deswegen ist es möglich, dass die erforderliche Dosis des Bypassing-Präparates niedriger ist als ohne Prophylaxe mit Hemlibra. Die Dosis und die Anwendungsdauer des Bypassing-Präparates hängen von der Lokalisation und dem Ausmaß der Blutung sowie dem klinischen Zustand des Patienten ab. Die Anwendung von aPCC sollte vermieden werden, es sei denn, es stehen keine anderen Therapieoptionen/-alternativen zur Verfügung. Wenn bei einem Patienten unter Prophylaxe mit Hemlibra aPCC indiziert ist, darf die Anfangsdosis 50 E/kg nicht überschreiten und es wird eine Überwachung der Laborwerte empfohlen (einschließlich, aber nicht beschränkt auf, Überwachung der Nierenfunktion, Blutplättchen-Testung und Prüfung auf Thrombose). Kann die Blutung mit aPCC mit einer Anfangsdosis von bis zu 50 E/kg nicht unter Kontrolle gebracht werden, sollten weitere Dosen von aPCC unter medizinischer Anleitung oder Aufsicht verabreicht werden. Vor der Gabe weiterer Dosen sollten eine Überwachung der Laborwerte auf die Diagnose einer TMA oder Thromboembolie hin und eine Blutungskontrolle in Betracht gezogen werden. Die Gesamtdosis von aPCC in den ersten 24 Stunden der Behandlung soll 100 E/kg nicht überschreiten. Bei der Entscheidung, ob die Behandlung mit aPCC in den ersten 24 Stunden über die anfängliche Dosis von maximal 100 E/kg hinaus erhöht werden soll, muss der behandelnde Arzt die Risiken von TMA und Thromboembolie sorgfältig gegen das Blutungsrisiko abwägen.
In klinischen Studien wurden keine Fälle von TMA oder thrombotischen Ereignissen bei Patienten unter Prophylaxe mit Hemlibra beobachtet, wenn es nur in Kombination mit rFVIIa eingesetzt wurde.
Die Hinweise zur Anwendung von Bypassing-Präparaten sollten für mindestens 6 Monate nach Absetzen der Prophylaxe mit Hemlibra weiter beachtet werden (siehe Abschnitt 5.2).
Immunogenität
Eine Entwicklung von neutralisierenden Anti-Emicizumab-Antikörpern mit abnehmender Emicizumab-Konzentration, die zu einem Verlust der Wirksamkeit führen, wurde gelegentlich während klinischen Studien beobachtet (siehe Abschnitte 4.8 und 5.1). Patienten mit klinischen Anzeichen eines Wirksamkeitsverlustes (z. B. Zunahme von Durchbruchblutungen) sollen umgehend zur Ermittlung der Ätiologie untersucht werden und bei Verdacht auf neutralisierende Anti-Emicizumab-Antikörper sollen andere Therapieoptionen in Erwägung gezogen werden.
Einfluss von Emicizumab auf Gerinnungstests
Emicizumab ersetzt die Tenase-Kofaktor-Aktivität des fehlenden aktivierten Faktor VIII (FVIIIa). Gerinnungstests, die auf intrinsischer Gerinnung basieren, einschließlich aktivierter Gerinnungszeit (ACT) und aktivierter partieller Thromboplastinzeit (aPTT), messen die Gesamtgerinnungszeit einschließlich der Zeit, die für die Aktivierung von FVIII zu FVIIIa durch Thrombin benötigt wird. Mit solchen Tests, die auf dem intrinsischen Aktivierungsweg basieren, wird unter Emicizumab eine übermäßig verkürzte Gerinnungszeit gemessen, da dieses keine Aktivierung durch Thrombin benötigt. Die übermäßig verkürzte intrinsische Gerinnungszeit verfälscht alle auf aPTT basierenden Einzelfaktor-Assays wie den Einstufentest der FVIII-Aktivität (siehe Abschnitt 4.4, Tabelle 1). Einzelfaktor-Assays, die chromogen- oder immunbasierte Methoden anwenden, werden hingegen nicht von Emicizumab beeinflusst und können zur Bestimmung der Gerinnungsparameter während der Behandlung eingesetzt werden. Für chromogene FVIII-Assays sind spezifische Aspekte zu beachten, die unten beschrieben werden.
Chromogene Tests zur FVIII-Aktivität können entweder mit humanen oder mit bovinen Gerinnungsproteinen hergestellt werden. Tests mit humanen Gerinnungsfaktoren sprechen auf Emicizumab an, können aber das klinische hämostatische Potenzial von Emicizumab überschätzen. Tests mit bovinen Koagulationsfaktoren hingegen sind nicht sensitiv für Emicizumab (es wird keine Aktivität gemessen) und können zur Überwachung der endogenen oder infundierten FVIII-Aktivität oder zur Messung von FVIII-Hemmkörpern verwendet werden.
Emicizumab bleibt in Gegenwart von FVIII-Hemmkörpern aktiv und führt so bei gerinnungsbasierten Bethesda-Assays zur funktionalen Hemmung von FVIII zu einem falsch negativen Ergebnis. Stattdessen kann ein chromogener Bethesda-Assay mit einem bovin-basierten, chromogenen FVIII-Test verwendet werden, der nicht sensitiv für Emicizumab ist.
Diese beiden pharmakodynamischen Marker spiegeln nicht den wahren hämostatischen Effekt von Emicizumab in vivo wider (die aPTT wird übermäßig verkürzt und die gemessene FVIII-Aktivität kann überschätzt werden), vermitteln aber einen relativen Hinweis auf die gerinnungsfördernde Wirkung von Emicizumab.
Zusammenfassend sollten bei Patienten, die mit Hemlibra behandelt werden, keine Labortests, die auf intrinsischer Gerinnung basieren, verwendet werden, um dessen Aktivität zu überwachen, die Dosis für eine Faktor-Ersatztherapie oder Antikoagulation zu bestimmen oder den FVIII-Hemmkörper-Titer zu messen. Vorsicht ist geboten, wenn Labortests, die auf intrinsischer Gerinnung basieren, angewendet werden, da eine falsche Interpretation der Ergebnisse zu einer nicht ausreichenden Behandlung von Patienten mit Blutungsereignissen führen kann, was potenziell schwere oder lebensbedrohliche Blutungen hervorrufen kann.
Labortests, die durch Emicizumab beeinflusst oder nicht beeinflusst werden, sind in Tabelle 1 aufgeführt. Aufgrund der langen Halbwertszeit können diese Auswirkungen auf Gerinnungstests bis zu 6 Monate nach der letzten Dosis anhalten (siehe Abschnitt 5.2).
Tabelle 1: Ergebnisse von Gerinnungstests, die Emicizumab beeinflusst bzw. nicht beeinflusst
Von Emicizumab beeinflusste Ergebnisse |
Von Emicizumab nicht beeinflusste Ergebnisse |
- Aktivierte partielle Thromboplastinzeit (aPTT) |
- Bethesda-Assays (bovin chromogen) für FVIII-Hemmkörper-Titer |
1Wichtige Aspekte zu chromogen-basierten Assays der FVIII-Aktivität, siehe Abschnitt 4.4.
Kinder und Jugendliche
Für Kinder unter 1 Jahr liegen keine Daten vor. Das hämostatische System bei Neugeborenen und Säuglingen ist dynamisch und befindet sich in der Entwicklung. Daher müssen die relativen Konzentrationen von pro- und antikoagulierenden Proteinen bei diesen Patienten für eine Nutzen-Risiko-Abwägung berücksichtigt werden, einschließlich des möglichen Risikos einer Thrombose (z. B. zentralvenöse katheter-bedingte Thrombose).
Schulungsmaterialien
Alle Ärzte, die Hemlibra verschreiben, anwenden oder die Verabreichung von Hemlibra überwachen sollen, müssen sicherstellen, dass sie das Schulungsmaterial für Ärzte erhalten haben und damit vertraut sind. Medizinisches Fachpersonal muss die Vorteile und Risiken der Hemlibra Therapie dem Patienten und dessen Betreuungspersonen erklären und mit diesen besprechen und sicherstellen, dass der Patientenpass und der Leitfaden für Patienten/Betreuungspersonen ausgehändigt wird. Der Patient/die Betreuungsperson ist anzuweisen, den Patientenpass immer bei sich zu tragen und diesen jedem anderen konsultierten medizinischen Fachpersonal vorzuzeigen.
Es wurden keine adäquaten oder gut kontrollierten Studien zur Erfassung von Wechselwirkungen mit Emicizumab durchgeführt.
Die klinische Erfahrung weist auf eine Arzneimittelwechselwirkung zwischen Emicizumab und aPCC hin (siehe Abschnitte 4.4 und 4.8).
Auf Grundlage von präklinischen Versuchen besteht die Möglichkeit einer Hyperkoagulabilität unter rFVIIa oder FVIII in Kombination mit Emicizumab. Emicizumab erhöht das Gerinnungspotenzial, daher kann die zum Erreichen der Hämostase benötigte rFVIIa- oder FVIII-Dosis niedriger ausfallen als ohne Prophylaxe mit Hemlibra.
Im Falle einer thrombotischen Komplikation sollte der Arzt gemäß klinischer Indikation ein Absetzen von rFVIIa oder FVIII und eine Unterbrechung der Prophylaxe mit Hemlibra in Betracht ziehen. Weitere Maßnahmen sollten den individuellen klinischen Gegebenheiten entsprechen.
Entscheidungen zu Dosisanpassungen sollten die Halbwertszeit der verwendeten Arzneimittel berücksichtigen. Insbesondere ist zu bedenken, dass eine Unterbrechung der Emicizumab-Anwendung keine sofortige Wirkung haben kann.
Eine Verlaufsbeobachtung unter Verwendung eines chromogenen FVIII-Tests kann die Gaben von Gerinnungsfaktoren steuern, und eine Testung auf thrombophile Merkmale kann in Betracht gezogen werden.
Erfahrungen mit der gleichzeitigen Anwendung von Antifibrinolytika mit aPCC oder rFVIIa bei Patienten, die eine Prophylaxe mit Hemlibra erhalten, sind begrenzt. Jedoch muss bei der Anwendung systemischer Antifibrinolytika in Kombination mit aPCC oder rFVIIa bei Patienten, die Emicizumab erhalten, die Möglichkeit des Auftretens thrombotischer Ereignisse in Betracht gezogen werden.
Gebärfähige Frauen/Empfängnisverhütung
Frauen, die schwanger werden können und Hemlibra erhalten, müssen während und mindestens 6 Monate nach Abschluss der Therapie mit Hemlibra eine wirksame Verhütungsmethode anwenden (siehe Abschnitt 5.2).
Schwangerschaft
Es gibt keine klinischen Studien zur Anwendung von Emicizumab bei Schwangeren. Reproduktionsstudien mit Tieren wurden mit Hemlibra nicht durchgeführt. Es ist nicht bekannt, ob Emicizumab bei Verabreichung an Schwangere dem Fötus schadet ober ob es die Reproduktionsfähigkeit beeinflusst. Hemlibra sollte während der Schwangerschaft nur verwendet werden, wenn der zu erwartende Nutzen für die Mutter das mögliche Risiko für den Fötus überwiegt. Hierbei ist zu berücksichtigen, dass während der Schwangerschaft und nach der Entbindung ein erhöhtes Thromboserisiko besteht und dass verschiedene Schwangerschaftskomplikationen mit einem erhöhten Risiko für disseminierte intravasale Koagulopathie (DIC) verbunden sind.
Stillzeit
Es ist nicht bekannt, ob Emicizumab in die Muttermilch übergeht. Es wurden keine Studien durchgeführt, die den Einfluss von Emicizumab auf die Bildung von Muttermilch oder das Vorhandensein von Emicizumab in der Muttermilch untersuchen. Es ist bekannt, dass humanes IgG in der Muttermilch vorhanden ist. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen abzubrechen oder ob die Behandlung mit Hemlibra einzustellen ist bzw. ob auf die Behandlung mit Hemlibra verzichtet werden soll. Dabei sollten sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Fertilität
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen hinsichtlich Reproduktionstoxizität (siehe Abschnitt 5.3). Es liegen keine Fertilitätsdaten für Menschen vor. Deshalb ist die Wirkung von Emicizumab auf die weibliche und männliche Fertilität unbekannt.
Hemlibra hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Das allgemeine Sicherheitsprofil von Hemlibra basiert auf Daten aus klinischen Studien und Beobachtungen nach der Markteinführung. Die schwerwiegendsten Nebenwirkungen, die in den klinischen Studien mit Hemlibra gemeldet wurden, waren thrombotische Mikroangiopathie (TMA) und thrombotische Ereignisse einschließlich Thrombose des Sinus cavernosus (CST) sowie oberflächliche Thrombophlebitis begleitet von Hautnekrose (siehe unten und Abschnitt 4.4).
Die häufigsten Nebenwirkungen, die nach Behandlung mit mindestens einer Dosis Hemlibra bei ≥ 10 % der Patienten beobachtet wurden, waren Reaktionen an der Injektionsstelle (19,4 %), Arthralgie (14,2 %) und Kopfschmerzen (14,0 %).
In den klinischen Studien brachen insgesamt 3 Patienten (0,7 %), die eine Prophylaxe mit Hemlibra erhielten, die Behandlung wegen Nebenwirkungen ab. Diese Nebenwirkungen waren TMA und Hautnekrose, begleitet von oberflächlicher Thrombophlebitis sowie Kopfschmerzen.
Tabellarische Auflistung der Nebenwirkungen
Die folgenden Nebenwirkungen basieren auf Daten aus Beobachtungen nach der Markteinführung und gepoolten Daten aus fünf klinischen Studien der Phase III (Studien an Erwachsenen und Jugendlichen [BH29884 – HAVEN 1, BH30071 – HAVEN 3 und BO39182 – HAVEN 4], eine Studie mit allen Altersgruppen [BO41423 – HAVEN 6] und eine pädiatrische Studie [BH29992 – HAVEN 2]), in denen insgesamt 444 Patienten mit Hämophilie A mindestens eine Dosis Hemlibra als Routineprophylaxe erhielten (siehe Abschnitt 5.1). Von den Studienteilnehmern waren 307 (69,1 %) Erwachsene (darunter zwei Frauen), 61 (13,7 %) Jugendliche (≥ 12 bis < 18 Jahre), 71 (16,0 %) Kinder (≥ 2 bis < 12 Jahre) und 5 (1,1 %) Säuglinge und Kleinkinder (1 Monat bis < 2 Jahre). Die mediane Expositionsdauer in den Studien betrug 32 Wochen (Bereich: 0,1 bis 94,3 Wochen).
Nebenwirkungen aus den klinischen Studien der Phase III und den Beobachtungen nach der Markteinführung werden hier nach MedDRA Systemorganklasse aufgeführt (Tabelle 2). Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (≥ 1/10), häufig (≥ 1/100, < 1/10), gelegentlich (≥ 1/1 000, < 1/100), selten (≥ 1/10 000, < 1/1 000), sehr selten (< 1/10 000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 2: Zusammenfassung der Nebenwirkungen aus gepoolten klinischen HAVEN-Studien und Beobachtungen nach der Markteinführung von Hemlibra
Systemorganklasse (SOK) |
Nebenwirkungen |
Häufigkeit |
Erkrankungen des Blutes und des Lymphsystems |
Thrombotische Mikroangiopathie |
Gelegentlich |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Sehr häufig |
Gefäßerkrankungen |
Oberflächliche Thrombophlebitis |
Gelegentlich |
Thrombose des Sinus cavernosusa |
Gelegentlich |
|
Erkrankungen des Gastrointestinaltrakts |
Diarrhö |
Häufig |
Erkrankungen der Haut und des Unterhautgewebes |
Hautnekrose |
Gelegentlich |
Angioödem |
Gelegentlich |
|
Urtikaria |
Häufig |
|
Ausschlag |
Häufig |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Arthralgie |
Sehr häufig |
Myalgie |
Häufig |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Reaktion an der Injektionsstelle |
Sehr häufig |
Fieber |
Häufig |
|
Therapeutische Wirkung abgeschwächtb |
Gelegentlich |
|
Erkrankungen des Immunsystems |
Überempfindlichkeit |
Gelegentlich |
aGefäßerkrankungen sind eine sekundäre SOK für die Thrombose des Sinus cavernosus. | ||
Beschreibung ausgewählter Nebenwirkungen
Thrombotische Mikroangiopathie
In gepoolten klinischen Studien der Phase III wurden bei weniger als 1 % der Patienten (3/444) und bei 9,7 % der Patienten (3/31), die mindestens eine Dosis aPCC erhielten, unter Behandlung mit Emicizumab Fälle von TMA gemeldet. Alle 3 TMA-Fälle ereigneten sich, nachdem eine durchschnittliche kumulative Dosis von > 100 E/kg/24 Stunden aPCC über 24 Stunden oder mehr während eines behandlungsbedürftigen Ereignisses gegeben wurde (siehe Abschnitt 4.4). Diese Patienten litten unter Thrombozytopenie, mikroangiopathischer hämolytischer Anämie und akutem Nierenversagen ohne schwere Verminderung der ADAMTS-13-Aktivität. Bei einem Patienten wurde, nachdem sich die TMA aufgelöst hatte, die Behandlung mit Hemlibra fortgesetzt, ohne Rezidiv der TMA.
Thrombotische Ereignisse
In gepoolten klinischen Studien der Phase III wurden bei weniger als 1 % der Patienten (2/444) und bei 6,5 % der Patienten (2/31), die mindestens eine Dosis aPCC erhielten, unter Behandlung mit Emicizumab schwerwiegende thrombotische Ereignisse gemeldet. Beide schwerwiegenden thrombotischen Ereignisse traten auf, nachdem eine durchschnittliche kumulative Dosis von > 100 E/kg/24 Stunden aPCC über 24 Stunden oder mehr während eines behandlungsbedürftigen Ereignisses gegeben wurde. Bei einem Patienten wurde, nachdem das thrombotische Ereignis abgeklungen war, die Behandlung mit Hemlibra fortgesetzt, ohne Rezidiv des thrombotischen Ereignisses (siehe Abschnitt 4.4).
Charakterisierung der Wechselwirkung zwischen Emicizumab und einer Behandlung mit aPCC in zulassungsrelevanten klinischen Studien
Bei Patienten, die eine Prophylaxe mit Hemlibra erhielten, erfolgten insgesamt 82 aPCC-Behandlungen*; davon acht (10 %), bei denen eine durchschnittliche kumulative Dosis von > 100 E/kg/24 Stunden aPCC über 24 Stunden oder mehr verabreicht wurde. Zwei dieser acht Behandlungen waren mit thrombotischen Ereignissen assoziiert und drei von acht Behandlungen mit TMA (Tabelle 3). Mit den übrigen aPCC-Behandlungen waren keine TMA oder thrombotischen Ereignisse assoziiert. 68 % der einzelnen aPCC-Behandlungen bestanden in einer Einzelinfusion < 100 E/kg.
Tabelle 3: Übersicht der aPCC-Behandlungen* in den gepoolten klinischen Studien der Phase III
Dauer der aPCC-Behandlung |
Durchschnittliche kumulative Dosis von aPCC über 24 Stunden (E/kg/24 Stunden) |
||
< 50 |
50 – 100 |
> 100 |
|
< 24 Stunden |
9 |
47 |
13 |
24 – 48 Stunden |
0 |
3 |
1b |
> 48 Stunden |
1 |
1 |
7a,a,a,b |
* Eine einzelne aPCC-Behandlung ist definiert als sämtliche Dosen aPCC, die ein Patient aus einem beliebigen Grund erhalten hat, bis ein 36-stündiger behandlungsfreier Zeitraum eintrat. Beinhaltet alle aPCC-Behandlungen mit Ausnahme von Behandlungen an den ersten 7 Tagen und solchen, die 30 Tage nach dem Absetzen von Hemlibra erfolgten.
a Thrombotische Mikroangiopathie
b Thrombotisches Ereignis
Reaktionen an der Injektionsstelle
Reaktionen an der Injektionsstelle wurden in den gepoolten klinischen Studien der Phase III sehr häufig (19,4 %) gemeldet. Alle in den klinischen Studien mit Hemlibra beobachteten Fälle wurden als nicht schwerwiegend eingestuft, waren von leichter bis mittelschwerer Intensität und 94,9 % gingen ohne Behandlung zurück. Die am häufigsten berichteten Symptome waren Erythem an der Injektionsstelle (10,6 %), Schmerzen an der Injektionsstelle (4,1 %), Juckreiz an der Injektionsstelle (2,9 %) und Schwellung an der Injektionsstelle (2,7 %).
Immunogenität
In den gepoolten klinischen Studien der Phase III mit Hemlibra wurde die Entwicklung von neutralisierenden Anti-Emicizumab-Antikörpern, die mit einer Abnahme der Emicizumab-Konzentration in Verbindung steht, gelegentlich beobachtet (siehe Abschnitt 5.1). Bei einem Patienten, der neutralisierende Anti-Emicizumab-Antikörper mit abnehmender Emicizumab-Konzentration entwickelte, kam es nach 5-wöchiger Behandlung zu einem Wirksamkeitsverlust (manifestiert als Durchbruchblutung) und später zum Abbruch der Behandlung mit Hemlibra (siehe Abschnitte 4.4 und 5.1).
Kinder und Jugendliche
Die untersuchte pädiatrische Population umfasst insgesamt 137 Patienten, von denen 5 (3,6 %) Säuglinge und Kleinkinder (im Alter von 1 Monat bis unter 2 Jahren), 71 (51,8 %) Kinder (im Alter von 2 bis unter 12 Jahren) und 61 (44,5 %) Jugendliche (im Alter von 12 bis unter 18 Jahren) waren. Das Sicherheitsprofil von Hemlibra war bei Säuglingen, Kleinkindern, Kindern, Jugendlichen und Erwachsenen insgesamt übereinstimmend.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51‑59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
anzuzeigen.
Es gibt nur begrenzte Erfahrungen mit einer Überdosierung von Hemlibra.
Symptome
Eine versehentliche Überdosis könnte zu Hyperkoagulabilität führen.
Behandlung
Patienten, die versehentlich eine Überdosis erhalten haben, sollten unverzüglich ihren Arzt konsultieren und engmaschig beobachtet werden.
Pharmakotherapeutische Gruppe: Antihämorrhagika, andere systemische Hämostatika; ATC-Code: B02BX06
Wirkmechanismus
Emicizumab ist ein humanisierter, monoklonaler, modifizierter Immunoglobulin-G4(IgG4)-Antikörper mit einer bispezifischen Antikörper-Struktur.
Emicizumab verbindet aktivierten Faktor IX und Faktor X, um die Funktion des fehlenden FVIIIa wiederherzustellen, die für eine effektive Hämostase notwendig ist.
Emicizumab hat keine strukturelle Beziehung oder Sequenzhomologie zu FVIII, sodass es die Entwicklung direkter Hemmkörper gegen FVIII weder auslöst noch verstärkt.
Pharmakodynamische Wirkungen
Eine prophylaktische Therapie mit Hemlibra verkürzt die aPTT und erhöht die gemessene FVIII-Aktivität (bei Verwendung eines chromogenen Tests mit humanem Gerinnungsfaktor). Diese beiden pharmakodynamischen Marker spiegeln nicht den wahren hämostatischen Effekt von Emicizumab in vivo wider (die aPTT wird übermäßig verkürzt und die gemessene FVIII-Aktivität kann überschätzt werden), vermitteln aber einen relativen Hinweis auf die gerinnungsfördernde Wirkung von Emicizumab.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit von Hemlibra bei der Routineprophylaxe wurde an Patienten mit Hämophilie A in fünf klinischen Studien beurteilt (drei Studien an erwachsenen und jugendlichen Patienten mit Hämophilie A mit oder ohne FVIII-Hemmkörper [HAVEN 1, HAVEN 3 und HAVEN 4], eine pädiatrische Studie an Patienten mit Hämophilie A mit FVIII-Hemmkörpern [HAVEN 2] und eine Studie in allen Altersgruppen an Patienten mit leichter oder mittelschwerer Hämophilie A ohne FVIII-Hemmkörper [HAVEN 6]).
Klinische Studien an erwachsenen und jugendlichen Patienten mit Hämophilie A mit oder ohne FVIII-Hemmkörper
Patienten (Alter ≥ 12 Jahre und > 40 kg) mit Hämophilie A ohne FVIII-Hemmkörper (Studie BH30071 – HAVEN 3)
Bei der Studie HAVEN 3 handelte es sich um eine randomisierte, multizentrische, offene klinische Studie der Phase III, an der 152 männliche Jugendliche und Erwachsene (Alter ≥ 12 Jahre und > 40 kg) mit schwerer Hämophilie A ohne FVIII-Hemmkörper teilnahmen, die zuvor entweder episodisch („bei Bedarf“) oder prophylaktisch mit FVIII behandelt worden waren. Die Patienten erhielten über die ersten vier Wochen einmal wöchentlich subkutane Injektionen von 3 mg/kg Hemlibra, gefolgt von entweder 1,5 mg/kg einmal wöchentlich (Arme A und D) oder 3 mg/kg alle zwei Wochen (Arm B) oder keiner Prophylaxe (Arm C). Die Patienten in Arm C konnten nach Ablauf von mindestens 24 Wochen ohne Prophylaxe auf Hemlibra (3 mg/kg alle zwei Wochen) umgestellt werden. In den Armen A und B war für Patienten, bei denen zwei oder mehr qualifizierte Blutungen auftraten (d. h. spontane und klinisch bedeutsame Blutungen im Steady State), nach 24 Wochen eine Dosiserhöhung auf 3 mg/kg wöchentlich zulässig. Bei den Patienten in Arm D war eine Dosiserhöhung nach der zweiten qualifizierenden Blutung möglich. Zum Zeitpunkt der Primäranalyse war die Erhaltungsdosis bei fünf Patienten erhöht worden.
Neunundachtzig (89) Patienten, die zuvor eine episodische („bei Bedarf“) FVIII-Behandlung erhalten hatten, wurden im Verhältnis 2:2:1 randomisiert einer Behandlung mit Hemlibra einmal wöchentlich (Arm A, n = 36), Hemlibra alle zwei Wochen (Arm B, n = 35) oder keiner Prophylaxe (Arm C, n = 18) zugeteilt. Die Stratifizierung erfolgte dabei auf der Grundlage der Blutungsrate in den vorangegangenen 24 Wochen (< 9 oder ≥ 9). Dreiundsechzig (63) zuvor prophylaktisch mit FVIII behandelte Patienten wurden in Arm D aufgenommen und erhielten Hemlibra (1,5 mg/kg einmal wöchentlich).
Primäres Ziel der Studie war es, bei Patienten, die zuvor episodisch mit FVIII behandelt worden waren, die Wirksamkeit der prophylaktischen Behandlung mit Hemlibra einmal wöchentlich (Arm A) oder alle zwei Wochen (Arm B) im Vergleich zu keiner Prophylaxe (Arm C) zu beurteilen. Zugrunde gelegt wurde dafür die Anzahl der Blutungen, bei denen eine Behandlung mit Gerinnungsfaktoren erforderlich war (siehe Tabelle 4). Zu den weiteren Zielen der Studie gehörten die Beurteilung des randomisierten Vergleichs der Arme A oder B mit Arm C in Bezug auf die Wirksamkeit der Prophylaxe mit Hemlibra zur Senkung der Anzahl von allen Blutungen, spontanen Blutungen, Gelenkblutungen und Blutungen in Zielgelenken (siehe Tabelle 4) sowie die Bewertung der Behandlungspräferenzen der Patienten auf Grundlage einer Präferenzbefragung.
Die Wirksamkeit der Prophylaxe mit Hemlibra wurde darüber hinaus mit einer vorangehenden prophylaktischen FVIII-Behandlung (Arm D) bei Patienten verglichen, die vor der Aufnahme an einer nicht-interventionellen Studie (NIS) teilgenommen hatten (siehe Tabelle 5). In diesen Vergleich wurden nur Patienten der NIS eingeschlossen, weil Blutungs- und Behandlungsdaten mit der gleichen Granularität erfasst wurden wie in HAVEN 3. Diese NIS ist eine Beobachtungsstudie, die vorrangig mit dem Ziel durchgeführt wird, ausführliche klinische Daten zu Blutungsepisoden und zur Anwendung von Hämophilie-Arzneimitteln bei Hämophilie A-Patienten außerhalb interventioneller klinischer Studien zu erfassen.
Patienten (im Alter von mindestens 12 Jahren) mit Hämophilie A und FVIII-Hemmkörpern (Studie BH29884 – HAVEN 1)
Bei der Studie HAVEN 1 handelte es sich um eine randomisierte, multizentrische, offene klinische Studie an 109 männlichen Jugendlichen und Erwachsenen (im Alter von mindestens 12 Jahren) mit Hämophilie A mit FVIII-Hemmkörpern, die zuvor entweder episodisch oder prophylaktisch mit Bypassing-Präparaten (aPCC und rFVIIa) behandelt wurden. In dieser Studie erhielten die Patienten einmal wöchentlich eine Prophylaxe mit Hemlibra (Arm A, C und D: 3 mg/kg einmal wöchentlich über vier Wochen, gefolgt von 1,5 mg/kg einmal wöchentlich) oder keine Prophylaxe (Arm B). Die in Arm B randomisierten Patienten konnten nach Ablauf von mindestens 24 Wochen ohne Prophylaxe auf eine Prophylaxe mit Hemlibra umgestellt werden. Bei Patienten, bei denen zwei oder mehr qualifizierte Blutungen auftraten (d. h. spontane und überprüfte klinisch signifikante Blutungen im Steady State), konnte die Dosis nach 24 Wochen unter Prophylaxe mit Hemlibra auf 3 mg/kg einmal wöchentlich erhöht werden. Zum Zeitpunkt der Primäranalyse war die Erhaltungsdosis bei zwei Patienten auf 3 mg/kg einmal wöchentlich erhöht worden.
Dreiundfünfzig (53) Patienten, die zuvor episodisch („bei Bedarf“) mit Bypassing-Präparaten behandelt worden waren, wurden im Verhältnis 2:1 randomisiert und erhielten entweder eine Prophylaxe mit Hemlibra (Arm A) oder keine Prophylaxe (Arm B). Es erfolgte eine Stratifizierung gemäß der Blutungsrate in den vorangegangenen 24 Wochen (< 9 oder ≥ 9).
Neunundvierzig (49) Patienten, die zuvor prophylaktisch mit Bypassing-Präparaten behandelt worden waren, wurden in Arm C aufgenommen und erhielten eine Prophylaxe mit Hemlibra. Sieben Patienten, die zuvor episodisch („bei Bedarf“) mit Bypassing-Präparaten behandelt worden waren und an der NIS teilgenommen hatten, jedoch nicht vor Schließung von Arm A und B in HAVEN 1 aufgenommen werden konnten, wurden in Arm D aufgenommen und erhielten eine Prophylaxe mit Hemlibra.
Das primäre Ziel der Studie war, den Behandlungseffekt einer einmal wöchentlich verabreichten Prophylaxe mit Hemlibra im Vergleich zu keiner Prophylaxe (Arm A vs. Arm B) bei Patienten, die zuvor episodisch („bei Bedarf“) mit Bypassing-Präparaten behandelt worden waren, bezogen auf die Anzahl von Blutungen, die mit Gerinnungsfaktoren behandelt werden mussten, über die Zeit (mindestens 24 Wochen oder bis zum Absetzen der Behandlung) zu beurteilen (siehe Tabelle 6). Weitere sekundäre Studienziele des randomisierten Vergleichs der Arme A und B waren die Wirksamkeit der wöchentlichen Prophylaxe mit Hemlibra zur Reduzierung der Anzahl aller Blutungen, der spontanen Blutungen, der Gelenkblutungen und der Blutungen in Zielgelenken (siehe Tabelle 6) sowie die Beurteilung der gesundheitsbezogenen Lebensqualität (Health-Related Quality of Life [HRQoL]) und ihres Gesundheitszustands (siehe Tabellen 10 und 11). Die Dauer der mittleren Exposition (SD) aller Patienten aus der Studie lag bei 21,38 Wochen (12,01). Bei den jeweiligen Behandlungsarmen lag die mittlere Expositionszeit (SD) bei 28,86 Wochen (8,37) in Arm A; 8,79 (3,62) in Arm B; 21,56 (11,85) in Arm C und 7,08 (3,89) in Arm D. Ein Patient aus Arm A beendete seine Teilnahme an der Studie vor Beginn der Behandlung mit Hemlibra.
Die Studie untersuchte auch die Wirksamkeit der wöchentlichen Prophylaxe mit Hemlibra im Vergleich zu zuvor eingesetzten episodischen („bei Bedarf“) und prophylaktischen Bypassing-Präparaten (getrennte Vergleiche) bei Patienten, die vor der Aufnahme in diese Studie an einer NIS teilgenommen hatten (Arm A bzw. C) (siehe Tabelle 7).
Patienten (im Alter von ≥ 12 Jahren) mit Hämophilie A mit oder ohne FVIII-Hemmkörper (Studie BO39182 – HAVEN 4)
Hemlibra wurde in einer einarmigen, multizentrischen klinischen Studie der Phase III untersucht, an der 41 männliche Jugendliche und Erwachsene (Alter ≥ 12 Jahre und > 40 kg) teilnahmen, die Hämophilie A mit FVIII-Hemmkörpern oder schwere Hämophilie A ohne FVIII-Hemmkörper hatten und die zuvor entweder eine episodische („bei Bedarf“) oder prophylaktische Behandlung mit Bypassing-Präparaten oder FVIII erhalten hatten. Die Patienten erhielten eine Prophylaxe mit Hemlibra 3 mg/kg einmal wöchentlich über einen Zeitraum von vier Wochen, gefolgt von 6 mg/kg alle vier Wochen. Primäres Ziel der Studie war es, die Wirksamkeit der Prophylaxe mit Hemlibra alle vier Wochen zur Aufrechterhaltung einer angemessenen Blutungskontrolle auf der Grundlage der behandelten Blutungen zu beurteilen. Zu den anderen Zielen gehörten die Beurteilung der klinischen Wirksamkeit der Prophylaxe mit Hemlibra in Bezug auf alle Blutungen, behandelte spontane Blutungen, behandelte Gelenkblutungen und behandelte Blutungen in Zielgelenken (siehe Tabelle 8). Zudem wurden mittels einer Präferenzbefragung die Behandlungspräferenzen der Patienten beurteilt.
Patienten (alle Altersgruppen) mit leichter oder mittelschwerer Hämophilie A ohne FVIII-Hemmkörper (Studie BO41423 ‑ HAVEN 6)
Bei der Studie HAVEN 6 handelte es sich um eine multizentrische, offene, einarmige klinische Studie der Phase III, an der 71 mit Emicizumab behandelte Patienten (alle Altersgruppen) mit leichter (n = 20 [28,2 %]) oder mittelschwerer (n = 51 [71,8 %]) Hämophilie A ohne FVIII-Hemmkörper teilnahmen, bei denen nach Bewertung des Prüfarztes eine Prophylaxe angezeigt war. Die meisten Patienten waren männlich (69 Patienten [97,2 %]) und 2 waren weiblich (2,8 %). Zu Studienbeginn waren 34 Patienten (47,9 %) unter episodischer und 37 Patienten (52,1 %) unter prophylaktischer Behandlung mit FVIII. Die Patienten erhielten über die ersten vier Wochen einmal wöchentlich subkutane Injektionen von 3 mg/kg Hemlibra, gefolgt von der vom Patienten bevorzugten Behandlung mit einem der folgenden Erhaltungsschemata ab Woche 5: 1,5 mg/kg einmal wöchentlich (n = 24 [33,8 %]), 3 mg/kg alle zwei Wochen (n = 39 [54,9 %]) oder 6 mg/kg alle vier Wochen (n = 8 [11,3 %]). Für Patienten, bei denen zwei oder mehr qualifizierte Blutungen auftraten (d. h. spontane und klinisch bedeutsame Blutungen im Steady State), war nach 24 Wochen eine Dosiserhöhung auf 3 mg/kg wöchentlich zulässig. Zum Zeitpunkt der Zwischenanalyse war die Erhaltungsdosis bei keinem Patienten erhöht worden.
Primäres Wirksamkeitsziel der Studie war es, die Wirksamkeit der prophylaktischen Behandlung mit Hemlibra zu beurteilen. Zugrunde gelegt wurde dafür die Anzahl der Blutungen, bei denen im Laufe der Zeit eine Behandlung mit Gerinnungsfaktoren erforderlich war (d. h. Blutungsrate der behandelten Blutungen, siehe Tabelle 9). Zu den weiteren Zielen der Studie gehörten die Beurteilung der Wirksamkeit der Prophylaxe mit Hemlibra bezogen auf die Anzahl aller Blutungen, spontaner Blutungen, Gelenkblutungen und Blutungen in Zielgelenken im Laufe der Zeit sowie die Beurteilung der vom Patienten berichteten HRQoL anhand des Fragebogens „Comprehensive Assessment Tool of Challenges in Haemophilia (CATCH)“ im Laufe der Zeit.
Wirksamkeitsergebnisse
HAVEN 3
Tabelle 4 enthält eine Zusammenfassung der Wirksamkeitsergebnisse der Prophylaxe mit Hemlibra im Vergleich zu keiner Prophylaxe in Bezug auf die Rate der behandelten Blutungen, aller Blutungen, behandelten spontanen Blutungen, behandelten Gelenkblutungen und der behandelten Blutungen in Zielgelenken.
Tabelle 4: Studie HAVEN 3: Jährliche Blutungsrate im Arm mit Prophylaxe mit Hemlibra im Vergleich zum Arm ohne Prophylaxe bei Patienten im Alter von ≥ 12 Jahren ohne FVIII-Hemmkörper
Endpunkt |
Arm C: |
Arm A: |
Arm B: |
Behandelte Blutungen | |||
ABR (95-%-KI) |
38,2 (22,9; 63,8) |
1,5 (0,9; 2,5) |
1,3 (0,8; 2,3) |
% Reduktion (RR), p-Wert |
N/A |
96 % (0,04), < 0,0001 |
97 % (0,03), < 0,0001 |
% Patienten mit 0 Blutungen (95-%-KI) |
0,0 (0,0; 18,5) |
55,6 (38,1; 72,1) |
60,0 (42,1; 76,1) |
Mediane ABR (IQR) |
40,4 (25,3; 56,7) |
0 (0; 2,5) |
0 (0; 1,9) |
Alle Blutungen | |||
ABR (95-%-KI) |
47,6 (28,5; 79,6) |
2,5 (1,6; 3,9) |
2,6 (1,6; 4,3) |
% Reduktion (RR), p-Wert |
N/A |
95 % (0,05), < 0,0001 |
94 % (0,06), < 0,0001 |
% Patienten mit 0 Blutungen (95-%-KI) |
0 (0,0; 18,5) |
50 (32,9; 67,1) |
40 (23,9; 57,9) |
Behandelte spontane Blutungen | |||
ABR (95-%-KI) |
15,6 (7,6; 31,9) |
1,0 (0,5; 1,9) |
0,3 (0,1; 0,8) |
% Reduktion (RR), p-Wert |
N/A |
94 % (0,06), < 0,0001 |
98 % (0,02), < 0,0001 |
% Patienten mit 0 Blutungen (95-%-KI) |
22,2 (6,4; 47,6) |
66,7 (49,0; 81,4) |
88,6 (73,3; 96,8) |
Behandelte Gelenkblutungen | |||
ABR (95-%-KI) |
26,5 (14,67; 47,79) |
1,1 (0,59; 1,89) |
0,9 (0,44; 1,67) |
% Reduktion (RR), p-Wert |
N/A |
96 % (0,04), < 0,0001 |
97 % (0,03), < 0,0001 |
% Patienten mit 0 Blutungen (95-%-KI) |
0 (0; 18,5) |
58,3 (40,8; 74,5) |
74,3 (56,7; 87,5) |
Behandelte Blutungen in Zielgelenken | |||
ABR (95-%-KI) |
13,0 (5,2; 32,3) |
0,6 (0,3; 1,4) |
0,7 (0,3; 1,6) |
% Reduktion (RR), p-Wert |
N/A |
95 % (0,05), < 0,0001 |
95 % (0,05), < 0,0001 |
% Patienten mit 0 Blutungen (95-%-KI) |
27,8 (9,7; 53,5) |
69,4 (51,9; 83,7) |
77,1 (59,9; 89,6) |
Inzidenzquotient (Rate Ratio) und Konfidenzintervall (KI) stammen aus dem Negativ–Binomial-Regressions- (NBR)-Modell und der p-Wert aus dem stratifizierten Wald-Test, Vergleich der Blutungsrate zwischen bestimmten Behandlungsarmen. | |||
Die Analyse der Einzelpatientendaten (intraindividuelle Analyse) in HAVEN 3 ergab, dass die Prophylaxe mit Hemlibra im Vergleich zu der vor Aufnahme in diese Studie in der NIS erfassten FVIII-Prophylaxe zu einer statistisch signifikanten (p < 0,0001) Reduktion (68 %) der Blutungsrate behandelter Blutungen führte (siehe Tabelle 5).
Tabelle 5: Studie HAVEN 3: Intraindividueller Vergleich der jährlichen Blutungsrate (behandelte Blutungen) bei Prophylaxe mit Hemlibra gegenüber der vorangegangenen FVIII-Prophylaxe
Endpunkt |
Arm D NIS: |
Arm D: |
Medianer Wirksamkeitszeitraum (Wochen) |
30,1 |
33,7 |
Behandelte Blutungen | ||
ABR (95-%-KI) |
4,8 (3,2; 7,1) |
1,5 (1; 2,3) |
% Reduktion (RR), p-Wert |
68 % (0,32); < 0,0001 |
|
% Patienten mit 0 Blutungen (95-%-KI) |
39,6 (25,8; 54,7) |
54,2 (39,2; 68,6) |
Mediane ABR (IQR) |
1,8 (0; 7,6) |
0 (0; 2,1) |
Inzidenzquotient (Rate Ratio) und Konfidenzintervall (KI) stammen aus dem Negativ-Binomial-Regressions (NBR)-Modell und der p-Wert aus dem stratifizierten Wald-Test, Vergleich der ABR zwischen bestimmten Behandlungsarmen. | ||
HAVEN 1
Tabelle 6 enthält die Wirksamkeitsergebnisse der Prophylaxe mit Hemlibra im Vergleich zu keiner Prophylaxe in Bezug auf die Rate der behandelten Blutungen, aller Blutungen, behandelten spontanen Blutungen, behandelten Gelenkblutungen und behandelten Blutungen in Zielgelenken.
Tabelle 6: HAVEN 1: Jährliche Blutungsrate im Arm mit Prophylaxe mit Hemlibra im Vergleich zum Arm ohne Prophylaxe bei Patienten im Alter von ≥ 12 Jahren mit FVIII-Hemmkörpern
Endpunkt |
Arm B: keine Prophylaxe |
Arm A: Hemlibra 1,5 mg/kg wöchentlich |
|
|
n = 18 |
n = 35 |
|
Behandelte Blutungen | |||
ABR (95-%-KI) |
23,3 (12,33; 43,89) |
2,9 (1,69; 5,02) |
|
% Reduktion (RR), p-Wert |
87 % (0,13); < 0,0001 |
||
% Patienten mit 0 Blutungen |
5,6 (0,1; 27,3) |
62,9 (44,9; 78,5) |
|
Median ABR (IQR) |
18,8 (12,97; 35,08) |
0 (0; 3,73) |
|
Alle Blutungen | |||
ABR (95-%-KI) |
28,3 (16,79; 47,76) |
5,5 (3,58; 8,60) |
|
% Reduktion (RR), p-Wert |
80 % (0,20); < 0,0001 |
||
% Patienten mit 0 Blutungen |
5,6 (0,1; 27,3) |
37,1 (21,5; 55,1) |
|
Behandelte spontane Blutungen | |||
ABR (95-%-KI) |
16,8 (9,94; 28,30) |
1,3 (0,73; 2,19) |
|
% Reduktion (RR), p-Wert |
92 % (0,08); < 0,0001 |
||
% Patienten mit 0 Blutungen |
11,1 (1,4; 34,7) |
68,6 (50,7; 83,1) |
|
Behandelte Gelenkblutungen | |||
ABR (95-%-KI) |
6,7 (1,99; 22,42) |
0,8 (0,26; 2,20) |
|
% Reduktion (RR), p-Wert |
89 % (0,11); 0,0050 |
||
% Patienten mit 0 Blutungen |
50,0 (26,0; 74,0) |
85,7 (69,7; 95,2) |
|
Behandelte Blutungen in Zielgelenken | |||
ABR (95-%-KI) |
3,0 (0,96; 9,13) |
0,1 (0,03; 0,58) |
|
% Reduktion (RR), p-Wert |
95 % (0,05); 0,0002 |
||
% Patienten mit 0 Blutungen |
50,0 (26,0; 74,0) |
94,3 (80,8; 99,3) |
|
Inzidenzquotient (Rate Ratio) und Konfidenzintervall (KI) stammt aus dem Negativ-Binomial-Regressions(NBR)-Modell und p-Wert vom stratifizierten Wald-Test, Vergleich der Blutungsrate zwischen bestimmten Behandlungsarmen. | |||
Die Analyse der Einzelpatientendaten (intraindividuelle Analyse) in HAVEN 1 ergab, dass die Prophylaxe mit Hemlibra im Vergleich zu der vor Aufnahme in diese Studie in der NIS erfassten Prophylaxe mit Bypassing-Präparaten zu einer statistisch signifikanten (p = 0,0003) und klinisch relevanten Reduktion (79 %) der Blutungsrate behandelter Blutungen führte (siehe Tabelle 7).
Tabelle 7: Studie HAVEN 1: Intraindividueller Vergleich der jährlichen Blutungsrate (behandelte Blutungen) bei Prophylaxe mit Hemlibra gegenüber der vorangegangenen Prophylaxe mit Bypassing-Präparat (NIS-Teilnehmer)
Endpunkt |
Arm CNIS: vorangegangene Prophylaxe mit Bypassing-Präparat |
Arm C: Hemlibra 1,5 mg/kg wöchentlich |
n = 24 |
n = 24 |
|
Behandelte Blutungen | ||
ABR (95-%-KI) |
15,7 (11,08; 22,29) |
3,3 (1,33; 8,08) |
% Patienten mit 0 Blutungen (95-%-KI) |
12,5 (2,7; 32,4) |
70,8 (48,9; 87,4) |
Mediane ABR (IQR) |
12,0 (5,73; 24,22) |
0,0 (0,00; 2,23) |
% Reduktion |
79 % |
|
|
Inzidenzquotient (Rate Ratio) und Konfidenzintervall (KI) stammt aus dem Negativ-Binomial-Regressions (NBR)-Modell und p-Wert vom stratifizierten Wald-Test, Vergleich von ABR zwischen bestimmten Armen. Obwohl bei Prophylaxe mit Emicizumab eine höhere Therapietreue als unter vorhergehender Bypassing-Agent (BPA)-Prophylaxe beobachtet wurde, konnte bei Patienten mit Dosierungen, die ≥ 80 % oder < 80 % der entsprechenden, zugelassenen Dosierungen für die BPA-Prophylaxe entsprachen, kein Unterschied in der ABR festgestellt werden. (Die Daten sind jedoch aufgrund geringer Fallzahlen mit Vorsicht zu interpretieren.) Aufgrund der kurzen Halbwertszeit der BPA wird nach deren Absetzen kein Übertragungseffekt erwartet. Es mussten nur die ersten fünf Emicizumab-Dosierungen unter Aufsicht angewendet werden, um die Sicherheit und die Beherrschung der Injektionstechnik sicherzustellen. Ähnlich wie bei der BPA-Prophylaxe wurde für die nachfolgenden Emicizumab-Dosierungen die Selbstanwendung zu Hause gestattet. | ||
HAVEN 4
Tabelle 8 enthält die Ergebnisse der primären Wirksamkeitsanalyse der Prophylaxe mit Hemlibra alle vier Wochen in Bezug auf die Rate der behandelten Blutungen, aller Blutungen, behandelten spontanen Blutungen, behandelten Gelenkblutungen und behandelten Blutungen in Zielgelenken. Zur Beurteilung der Wirksamkeit wurden 41 Patienten im Alter von ≥ 12 Jahren mit einer medianen Beobachtungszeit von 25,6 Wochen (Bereich: 24,1 - 29,4) betrachtet.
Tabelle 8: HAVEN 4: Jährliche Blutungsrate der Prophylaxe mit Hemlibra bei Patienten im Alter von ≥ 12 Jahren mit oder ohne FVIII-Hemmkörper
Hemlibra 6 mg/kg Q4W |
|||
Endpunkte |
aABR (95-%-KI) |
bMediane ABR (IQR) |
% 0 Blutungen (95-%-KI) |
n |
41 |
41 |
41 |
Behandelte Blutungen |
2,4 (1,4; 4,3) |
0,0 (0,0; 2,1) |
56,1 (39,7; 71,5) |
Alle Blutungen |
4,5 (3,1; 6,6) |
2,1 (0,0; 5,9) |
29,3 (16,1; 45,5) |
Behandelte spontane Blutungen |
0,6 (0,3; 1,5) |
0,0 (0,0; 0,0) |
82,9 (67,9; 92,8) |
Behandelte Gelenkblutungen |
1,7 (0,8; 3,7) |
0,0 (0,0; 1,9) |
70,7 (54,5; 83,9) |
Behandelte Blutungen in Zielgelenken |
1,0 (0,3; 3,3) |
0,0 (0,0; 0,0) |
85,4 (70,8; 94,4) |
a Berechnet nach dem Negativ-Binomial-Regressions (NBR)-Modell | |||
HAVEN 6 (Zwischenanalyse)
Die Wirksamkeit wurde bei 51 Patienten mit mittelschwerer Hämophilie A im Alter von 2 bis 56 Jahren über eine mediane Beobachtungsdauer von 30,4 Wochen (Bereich: 17,4 – 61,7) beurteilt. Die Zwischenergebnisse zur Wirksamkeit der Prophylaxe mit Hemlibra in Patienten mit mittelschwerer Hämophilie A (siehe Abschnitt 4.1) bezogen auf die Rate von behandelten Blutungen, allen Blutungen, behandelten spontanen Blutungen, behandelten Gelenkblutungen und behandelten Blutungen in Zielgelenken sind in Tabelle 9 aufgeführt.
Tabelle 9: HAVEN 6: Jährliche Blutungsrate der Prophylaxe mit Hemlibra bei Patienten mit mittelschwerer Hämophilie A ohne FVIII-Hemmkörper
cHemlibra 1,5 mg/kg QW, 3 mg/kg Q2W oder 6 mg/kg Q4W |
|||
Endpunkte |
aABR (95‑%-KI) |
bMediane ABR (IQR) |
% 0 Blutungen (95‑%-KI) |
n |
51 |
51 |
51 |
Behandelte Blutungen |
0,9 [0,43; 1,89] |
0,0 [0,00; 0,00] |
78,4 [64,7; 88,7] |
Alle Blutungen |
2,6 [1,81; 3,81] |
1,7 [0,00; 3,90] |
43,1 [29,3; 57,8] |
Behandelte spontane Blutungen |
0,1 [0,03; 0,30] |
0,0 [0,00; 0,00] |
94,1 [83,8; 98,8] |
Behandelte Gelenkblutungen |
0,3 [0,10; 0,84] |
0,0 [0,00; 0,00] |
90,2 [78,6; 96,7] |
Behandelte Blutungen in Zielgelenken |
0,1 [0,02; 0,26] |
0,0 [0,00; 0,00] |
96,1 [86,5; 99,5] |
a Berechnet nach dem Negativ-Binomial-Regressions(NBR)-Modell | |||
Instrumente zur Messung gesundheitsbezogener Zielgrößen
In den HAVEN-Studien wurden HRQoL und Gesundheitszustand anhand von Fragebögen zur Beurteilung der klinischen Zielgrößen bewertet. In HAVEN 1 und 2 wurde der Fragebogen „Haemophilia-specific Quality of Life“ (Haem-A-QoL) für Erwachsene (im Alter von mindestens 18 Jahren) bzw. die Version für Jugendliche (Haemo-QoL-SF, für Jugendliche im Alter von 8 ‑ 17 Jahren) verwendet, wobei der Wert für die körperliche Gesundheit (d. h. schmerzhafte Schwellungen, Gelenkschmerzen, Schmerzen bei Bewegungen, Schwierigkeit, weit zu laufen und mehr benötigte Zeit, um sich fertig zu machen) und der Gesamtwert (Summe aller Werte) wichtige, im Prüfplan definierte Endpunkte waren. In HAVEN 2 wurde zusätzlich der Fragebogen „Adapted InhibQoL with Aspects of Caregiver Burden“ verwendet, um die von den Betreuungspersonen berichtete HRQoL bei Kindern < 12 Jahren zu erfassen. In HAVEN 6 wurde die HRQoL bei erwachsenen und pädiatrischen Patienten sowie bei Betreuungspersonen von pädiatrischen Patienten anhand des Fragebogens „Comprehensive Assessment Tool of Challenges in Haemophilia (CATCH)“ beurteilt. Es wurden die Domänen zur Risikowahrnehmung und zu den Auswirkungen der Hämophilie auf Alltagsaktivitäten, soziale Aktivitäten, Freizeitaktivitäten und Arbeit/Schule sowie die Sorgen und die Belastung durch die Behandlung untersucht. Zum Messen von Veränderungen im Gesundheitszustand wurden der Index Utility Score (IUS) und die visuelle Analogskala (VAS) aus dem Fragebogen „EuroQoL Five-Dimension Five-Levels“ (EQ-5D-5L) herangezogen.
Gesundheitsbezogene Zielgrößen in HAVEN 1
In dieser Studie waren die Gesamtwerte bei Studienbeginn (Mittelwert = 41,14 sowie 44,58) und körperliche Gesundheit-Subskala-Werte (Mittelwert = 52,41 sowie 57,19) unter Prophylaxe mit Hemlibra ähnlich wie ohne Prophylaxe. Tabelle 10 enthält eine Zusammenfassung des Vergleichs zwischen dem Arm mit Prophylaxe mit Hemlibra (Arm A) und dem Arm ohne Prophylaxe (Arm B) bezogen auf den Haem-A-QoL-Gesamtwert und die Körperliche Gesundheit-Subskala nach 24 Behandlungswochen, adjustiert um die Werte bei Studienbeginn. Die wöchentliche Prophylaxe mit Hemlibra zeigte bei der Beurteilung in Woche 25 im Vergleich zu keiner Prophylaxe eine statistisch signifikante und klinisch relevante Verbesserung im vorab festgelegten Endpunkt für den Haem‑A‑QoL-Wert der körperlichen Gesundheit.
Tabelle 10: Studie HAVEN 1: Änderung des Haem‑A‑QoL‑Wertes für die körperliche Gesundheit und des Gesamtwertes durch die Prophylaxe mit Hemlibra im Vergleich zu keiner Prophylaxe bei Patienten im Alter von ≥ 18 Jahren mit FVIII-Hemmkörpern
Haem‑A‑QoL‑Werte in Woche 25 |
Arm B: keine Prophylaxe |
Arm A: Hemlibra 1,5 mg/kg wöchentlich |
Wert für die körperliche Gesundheit (Bereich 0 bis 100) | ||
Adjustierter Mittelwert |
54,17 |
32,61 |
Differenz der adjustierten Mittelwerte (95-%-KI) |
21,55 (7,89; 35,22) |
|
p-Wert |
0,0029 |
|
Gesamtwert (Bereich 0 bis 100) | ||
Adjustierter Mittelwert |
43,21 |
29,2 |
Differenz der adjustierten Mittelwerte (95-%-KI) |
14,01 (5,56; 22,45) |
|
Arm B: Schließt nur den Zeitraum ohne Prophylaxe ein. | ||
Zielgrößen in Bezug auf den Gesundheitszustand in HAVEN 1
Tabelle 11 enthält eine Zusammenfassung des Vergleichs zwischen dem Arm mit Prophylaxe mit Hemlibra (Arm A) und dem Arm ohne Prophylaxe (Arm B) bezogen auf den EQ-5D-5L-IUS und die VAS nach 24 Behandlungswochen, adjustiert um die Werte bei Studienbeginn.
Tabelle 11: Studie HAVEN 1: EQ‑5D‑5L-Werte bei Patienten im Alter von ≥ 12 Jahren in Woche 25
EQ‑5D‑5L‑Werte nach 24 Wochen |
Arm B: keine Prophylaxe (n = 16) |
Arm A: Hemlibra 1,5 mg/kg wöchentlich (n = 29) |
Visuelle Analogskala | ||
Adjustierter Mittelwert |
74,36 |
84,08 |
Differenz der adjustierten Mittelwerte (95-%-KI) |
-9,72 (-17,62; -1,82) |
|
Index-Wert | ||
Adjustierter Mittelwert |
0,65 |
0,81 |
Differenz der adjustierten Mittelwerte (95-%-KI) |
-0,16 (-0,25; -0,07) |
|
Arm B: Schließt nur den Zeitraum ohne Prophylaxe ein. | ||
Gesundheitsbezogene Zielgrößen in HAVEN 6
In HAVEN 6 wurde die HRQoL bei Patienten aller Altersgruppen mit mittelschwerer Hämophilie A in Woche 25 anhand des Fragebogens CATCH beurteilt. Der CATCH-Fragebogen (Version 1.0) ist ein validiertes Instrument zur Beurteilung der Auswirkungen der Hämophilie und deren Behandlung. Der Fragebogen liegt in verschiedenen Versionen für erwachsene Patienten, pädiatrische Patienten sowie Betreuungspersonen von pädiatrischen Patienten vor. Die gesundheitsbezogene Lebensqualität blieb unter der Prophylaxe mit Hemlibra im Allgemeinen stabil und zeigte in der Domäne zur Belastung der Behandlung des CATCH-Fragebogens eine in allen Befragungsgruppen beobachtete Verbesserung.
Kinder und Jugendliche
Kinder und Jugendliche (Patienten unter 12 Jahren oder zwischen 12 und 17 Jahren mit einem Körpergewicht < 40 kg) mit Hämophilie A und FVIII-Hemmkörpern (Studie BH29992 – HAVEN 2)
Die wöchentliche Prophylaxe mit Hemlibra wurde in einer einarmigen, multizentrischen, offenen klinischen Studie bei Kindern und Jugendlichen (Alter < 12 Jahre oder 12 bis 17 Jahre mit einem Gewicht < 40 kg) mit Hämophilie A mit FVIII-Hemmkörpern geprüft. Die Patienten erhielten eine Prophylaxe mit Hemlibra von 3 mg/kg einmal wöchentlich über 4 Wochen, gefolgt von 1,5 mg/kg einmal wöchentlich.
Die Studie untersuchte die Pharmakokinetik (PK), Sicherheit und Wirksamkeit, einschließlich der Wirksamkeit der wöchentlichen Prophylaxe mit Hemlibra im Vergleich zu einer vorherigen Behandlung mit episodischen und prophylaktischen Bypassing-Präparaten bei Patienten, die vor der Aufnahme in diese Studie an der NIS teilgenommen hatten (intraindividueller Vergleich).
Wirksamkeitsergebnisse
HAVEN 2 (Zwischenanalyse)
Zum Zeitpunkt der Zwischenanalyse war die Wirksamkeit bei 59 Patienten beurteilt, die jünger als 12 Jahre waren und mindestens 12 Wochen lang die wöchentliche Prophylaxe mit Hemlibra erhalten hatten, einschließlich vier Patienten im Alter < 2 Jahre, 17 Patienten im Alter von 2 bis < 6 Jahren und 38 Patienten im Alter von 6 bis < 12 Jahren. Es wurden die jährliche Blutungsrate und der Prozentsatz der Patienten mit null Blutungen berechnet (siehe Tabelle 12). Die mediane Beobachtungszeit betrug für diese Patienten 29,6 Wochen (Bereich: 18,4 bis 63,0 Wochen).
Tabelle 12: Studie HAVEN 2: Zusammenfassung der Wirksamkeit (Zwischenanalyse)
Endpunkte |
aABR (95-%-KI) bn = 59 |
cMediane ABR (IQR) bn = 59 |
% 0 Blutungen |
Behandelte Blutungen |
0,3 (0,1; 0,5) |
0 (0; 0) |
86,4 (75; 94) |
Alle Blutungen |
3,8 (2,2; 6,5) |
0 (0; 3,4) |
55,9 (42,4; 68,8) |
Behandelte Spontanblutungen |
0 (0; 0,2) |
0 (0; 0) |
98,3 (90,9; 100) |
Behandelte Gelenkblutungen |
0,2 (0,1; 0,4) |
0 (0; 0) |
89,8 (79,2; 96,2) |
Behandelte Blutungen in Zielgelenken |
0,1 (0; 0,7) |
0 (0; 0) |
96,6 (88,3; 99,6) |
ABR = jährliche Blutungsrate; KI = Konfidenzintervall; IQR = Interquartilbereich, 25. Perzentil bis 75. Perzentil | |||
Die intraindividuelle Analyse zeigte, dass die wöchentliche Prophylaxe mit Hemlibra nach mindestens 12‑wöchiger Anwendung bei 18 pädiatrischen Patienten zu einer klinisch bedeutsamen Reduktion (98 %) der Rate der behandelten Blutungen im Vergleich zur Blutungsrate, die während der NIS vor Aufnahme in diese Studie ermittelt wurde, führte (Tabelle 13).
Tabelle 13: Studie HAVEN 2: Intraindividueller Vergleich der jährlichen Blutungsrate (behandelte Blutungen) bei Prophylaxe mit Hemlibra gegenüber der vorangegangenen Prophylaxe mit Bypassing-Präparat
Endpunkt |
Vorherige Bypassing-Präparat-Behandlung* (n = 18) |
Prophylaxe mit Hemlibra |
Behandelte Blutungen | ||
ABR (95-%-KI) |
19,8 (15,3; 25,7) |
0,4 (0,15; 0,88) |
% Reduktion (RR) |
98 % |
|
(0,02) |
||
% Patienten mit 0 Blutungen (95-%-KI) |
5,6 (0,1; 27,3) |
77,8 (52,4; 93,6) |
Median ABR (IQR) |
16,2 (11,49; 25,78) |
0 (0; 0) |
|
* Vorherige prophylaktische Behandlung bei 15 von 18 Patienten; vorherige episodische („bei Bedarf“) Behandlung bei 3 Studienteilnehmern Obwohl bei Prophylaxe mit Emicizumab eine höhere Therapietreue als unter vorhergehender Bypassing-Agent (BPA)-Prophylaxe beobachtet wurde, konnte bei Patienten mit Dosierungen, die ≥ 80 % oder < 80 % der entsprechenden, zugelassenen Dosierungen für die BPA-Prophylaxe entsprachen, kein Unterschied in der ABR festgestellt werden. (Die Daten sind jedoch aufgrund geringer Fallzahlen mit Vorsicht zu interpretieren.) | ||
Ergebnisse zu den gesundheitsbezogenen Zielgrößen bei Kindern
Gesundheitsbezogene Zielgrößen in HAVEN 2
Die HRQoL wurde in HAVEN 2 für Patienten im Alter von ≥ 8 bis < 12 Jahren anhand des Fragebogens Haemo-QoL-SF für Kinder beurteilt (siehe Tabelle 14). Bei diesem Fragebogen handelt es sich um ein gültiges und zuverlässiges Instrument zur Messung der HRQoL. Darüber hinaus wurde die HRQoL für Patienten im Alter von < 12 Jahren in Woche 25 anhand des Fragebogens „Adapted InhibQoL with Aspects of Caregiver Burden“ beurteilt, der von Betreuungspersonen ausgefüllt wurde (siehe Tabelle 14). Bei diesem Fragebogen handelt es sich um ein gültiges und zuverlässiges Instrument zur Messung der HRQoL.
Tabelle 14: HAVEN 2: Veränderung des Werts für die körperliche Gesundheit von Baseline bis Woche 25 für Patienten (im Alter von < 12 Jahren) nach der Prophylaxe mit Hemlibra, berichtet von Patienten und Betreuungspersonen
Haemo-QoL-SF |
|
Wert für die körperliche Gesundheit (Bereich 0 bis 100)a | |
Mittlerer Wert bei Baseline (95-%-KI) (n = 18) |
29,5 (16,4 – 42,7) |
Mittlere Veränderung von Baseline (95-%-KI) (n = 15) |
-21,7 (-37,1 – -6,3) |
Angepasster InhibQoL mit Aspekten der Belastung der Betreuungspersonen |
|
Wert für die körperliche Gesundheit (Bereich 0 bis 100)a | |
Mittlerer Wert bei Baseline (95-%-KI) (n = 54) |
37,2 (31,5 – 42,8) |
Mittlere Veränderung von Baseline (95-%-KI) (n = 43) |
-32,4 (-38,6 – -26,2) |
a Niedrigere Werte (negative Veränderungswerte) weisen auf eine bessere Funktion hin. | |
Es gibt nur begrenzte Erfahrungen mit dem Einsatz von Bypassing-Präparaten oder FVIII bei chirurgischen Eingriffen und invasiven Verfahren. Über den Einsatz von Bypassing-Präparaten oder FVIII bei chirurgischen Eingriffen und invasiven Verfahren entschied der Prüfarzt.
Beim Auftreten von Durchbruchblutungen sind Patienten, die eine Emicizumab-Prophylaxe erhalten, mithilfe verfügbarer Therapien zu versorgen. Anweisungen für Bypassing-Präparate finden Sie in Abschnitt 4.4.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht auch bei Patienten, die mit Emicizumab behandelt werden, die Möglichkeit einer Immunreaktion. In den gepoolten klinischen Studien wurden insgesamt 739 Patienten auf Anti-Emicizumab-Antikörper getestet. Bei 36 Patienten (4,9 %) war das Ergebnis des Tests auf Anti-Emicizumab-Antikörper positiv. Bei 19 Patienten (2,6 %) waren die Anti-Emicizumab-Antikörper in vitro neutralisierend. Bei 15 dieser 19 Patienten hatten die neutralisierenden Anti-Emicizumab-Antikörper keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik oder die Wirksamkeit von Hemlibra, wohingegen bei 4 Patienten (0,5 %) verringerte Emicizumab-Plasmakonzentrationen beobachtet wurden. Bei einem Patienten (0,1 %) mit neutralisierenden Anti-Emicizumab-Antikörpern und verringerten Emicizumab-Plasmakonzentrationen kam es nach 5-wöchiger Behandlung zu einem Wirksamkeitsverlust und dem Abbruch der Behandlung mit Hemlibra. Insgesamt war das Sicherheitsprofil von Hemlibra bei Patienten mit Anti-Emicizumab-Antikörpern (einschließlich neutralisierenden Antikörpern) und ohne diese Antikörper ähnlich (siehe Abschnitte 4.4 und 4.8).
Ältere Patienten
Die Studien HAVEN 1, HAVEN 3, HAVEN 4 und HAVEN 6 stützen die Anwendung von Hemlibra bei Patienten mit Hämophilie A im Alter ab 65 Jahren. Auf der Grundlage der begrenzten Daten gibt es keinen Hinweis auf eine unterschiedliche Wirksamkeit oder Sicherheit bei Patienten im Alter ab 65 Jahren.
Die Pharmakokinetik von Emicizumab wurde mittels nicht-kompartimenteller Analyse gesunder Teilnehmer und mittels einer populationspharmakokinetischen Analyse eines Datenstamms von 389 Patienten mit Hämophilie A ermittelt.
Resorption
Nach subkutaner Anwendung bei Patienten mit Hämophilie A betrug die Resorptionshalbwertszeit 1,6 Tage.
Nach mehreren subkutanen Injektionen von 3 mg/kg einmal wöchentlich über die ersten 4 Wochen bei Patienten mit Hämophilie A erreichten die mittleren (±SD) Talkonzentrationen von Emicizumab im Plasma 52,6 ± 13,6 µg/ml in Woche 5.
Die prädiktiven Mittelwerte (±SD) für Ctal und Cmax und die Verhältnisse Ctal/Cmax im Steady State für die empfohlenen Erhaltungsdosen von 1,5 mg/kg einmal wöchentlich, 3 mg/kg alle zwei Wochen oder 6 mg/kg alle vier Wochen sind in Tabelle 15 zusammengefasst.
Tabelle 15: Mittlere (± SD) Emicizumab-Konzentrationen im Steady State
Erhaltungsdosis |
|||
Parameter |
1,5 mg/kg QW |
3 mg/kg Q2W |
6 mg/kg Q4W |
Cmax, ss (µg/ml) |
54,9 ± 15,9 |
58,1 ± 16,5 |
66,8 ± 17,7 |
Cmittl., ss (µg/ml) |
53,5 ± 15,7 |
53,5 ± 15,7 |
53,5 ± 15,7 |
Ctal, ss (µg/ml) |
51,1 ± 15,3 |
46,7 ± 16,9 |
38,3 ± 14,3 |
Cmax/Ctal |
1,08 ± 0,03 |
1,26 ± 0,12 |
1,85 ± 0,46 |
Cmittl., ss = mittlere Konzentration im Steady State; Cmax, ss = maximale Plasmakonzentration im Steady State; Ctal, ss = Talkonzentration im Steady State; QW = einmal wöchentlich; Q2W = alle zwei Wochen; Q4W = alle vier Wochen. Die pharmakokinetischen Parameter wurden anhand des PK-Modells der Population bestimmt. | |||
Nach wöchentlicher Dosierung (3 mg/kg/Woche über 4 Wochen gefolgt von 1,5 mg/kg/Woche) bei Erwachsenen/Jugendlichen (≥ 12 Jahre) und Kindern (< 12 Jahre) wurden ähnliche PK-Profile beobachtet (siehe Abbildung 1).
Abbildung 1: Mittlere (± 95-%-KI) Emicizumab-Konzentration im Plasma als Funktion der Zeitprofile für Patienten im Alter von ≥ 12 Jahren (Studien HAVEN 1 und HAVEN 3) im Vergleich zu Patienten im Alter von < 12 Jahren (Studie HAVEN 2)
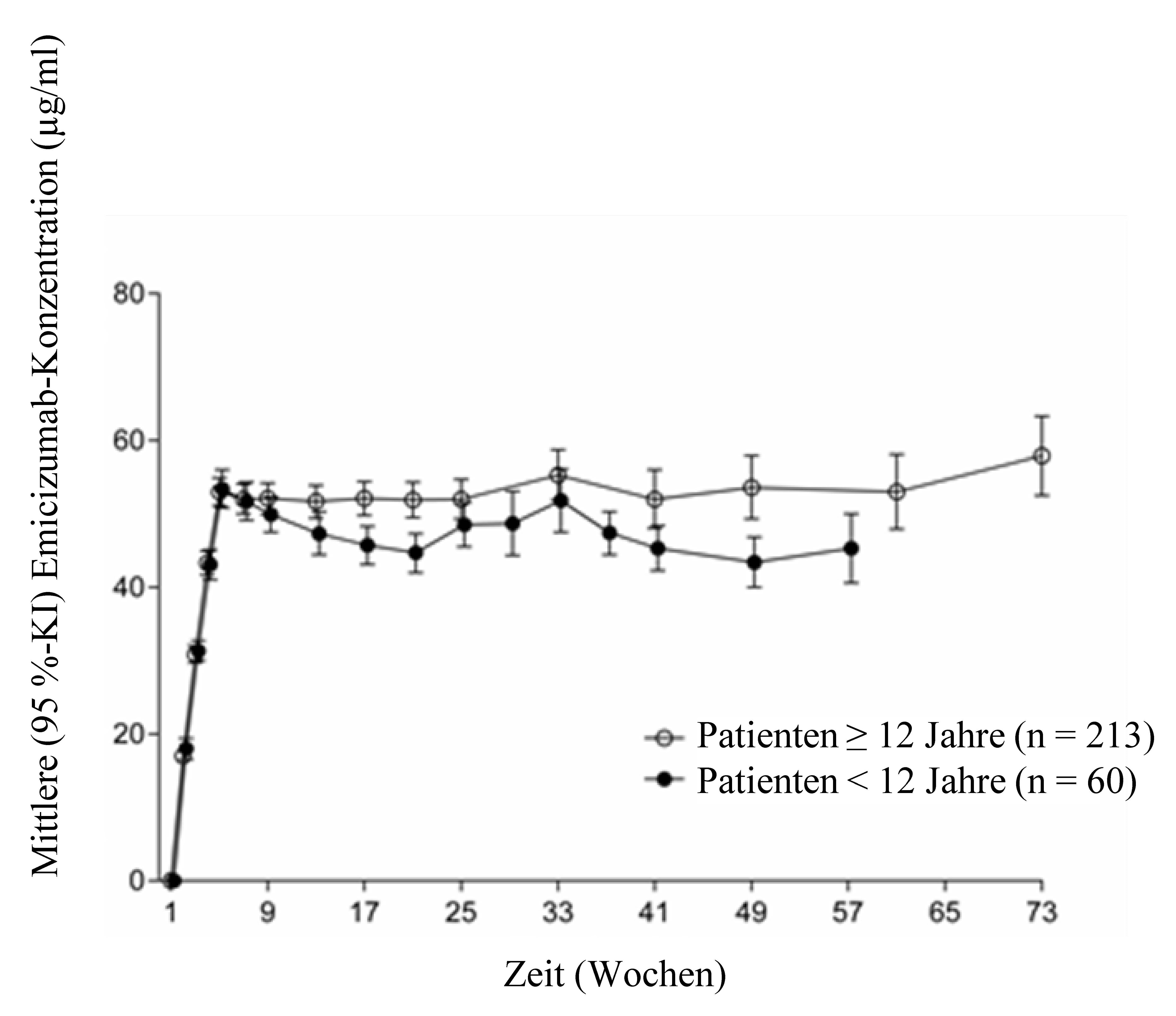
Bei gesunden Teilnehmern lag die absolute Bioverfügbarkeit nach subkutaner Verabreichung von 1 mg/kg in Abhängigkeit von der Injektionsstelle zwischen 80,4 % und 93,1 %. Nach subkutaner Verabreichung in Bauch, Oberarme und Oberschenkel wurden ähnliche pharmakokinetische Profile beobachtet. Emicizumab kann wechselweise in diese Körperstellen injiziert werden (siehe Abschnitt 4.2).
Verteilung
Nach einer einzelnen intravenösen Dosis von 0,25 mg/kg Emicizumab bei gesunden Teilnehmern betrug das Verteilungsvolumen im Steady State 106 ml/kg (d. h. 7,4 l bei einem Erwachsenen mit einem Körpergewicht von 70 kg).
Das scheinbare Verteilungsvolumen (V/F) wurde anhand der Populations-PK-Analyse geschätzt und beträgt nach mehreren subkutanen Dosen von Emicizumab bei Patienten mit Hämophilie A 10,4 l.
Biotransformation
Der Metabolismus von Emicizumab ist nicht untersucht worden. IgG-Antikörper werden hauptsächlich durch lysosomale Proteolyse katabolisiert und dann vom Körper ausgeschieden oder wiederverwendet.
Elimination
Nach einer intravenösen Verabreichung von 0,25 mg/kg bei gesunden Teilnehmern lag die Gesamt-Clearance von Emicizumab bei 3,26 ml/kg/Tag (d. h. 0,228 l/Tag bei einem Erwachsenen mit einem Körpergewicht von 70 kg) und die mittlere terminale Halbwertszeit betrug 26,7 Tage.
Nach einer einzelnen subkutanen Injektion bei gesunden Teilnehmern lag die Eliminationshalbwertszeit bei etwa 4 bis 5 Wochen.
Nach mehreren subkutanen Injektionen bei Patienten mit Hämophilie A betrug die scheinbare Clearance 0,272 l/Tag und die scheinbare Eliminationshalbwertszeit lag bei 26,8 Tagen.
Dosislinearität
Emicizumab zeigte nach der ersten Hemlibra Dosis bei Patienten mit Hämophilie A eine dosisproportionale Pharmakokinetik über einen Dosisbereich von 0,3 mg/kg bis 6 mg/kg. Die Exposition (Cavg, ss) nach Anwendung mehrerer Dosen ist bei Gabe von 1,5 mg/kg einmal wöchentlich, 3 mg/kg alle 2 Wochen und 6 mg/kg alle 4 Wochen vergleichbar.
Besondere Patientengruppen
Kinder und Jugendliche
Die Auswirkung des Alters auf die Pharmakokinetik von Emicizumab wurde in einer populationspharmakokinetischen Analyse untersucht, die 5 Kinder (≥ 1 Monat bis < 2 Jahre), 55 Kinder (< 12 Jahre) und 50 Jugendliche (12 bis < 18 Jahre) mit Hämophilie A umfasste.
Das Alter hatte keinen Einfluss auf die Pharmakokinetik von Emicizumab bei Kindern und Jugendlichen.
Ältere Patienten
Die Auswirkung des Alters auf die Pharmakokinetik von Emicizumab wurde in einer populationspharmakokinetischen Analyse untersucht, die 13 Teilnehmer im Alter von 65 Jahren oder älter umfasste (kein Teilnehmer war älter als 77 Jahre). Die relative Bioverfügbarkeit nahm mit steigendem Alter ab, aber es wurden keine klinisch relevanten Unterschiede in der Pharmakokinetik von Emicizumab bei Teilnehmern im Alter von < 65 Jahren und Teilnehmern im Alter von ≥ 65 Jahren beobachtet.
Bevölkerungsgruppe
Populationspharmakokinetische Analysen von Patienten mit Hämophilie A zeigten, dass die Bevölkerungsgruppe keinen Einfluss auf die Pharmakokinetik von Emicizumab hat. Für diesen demografischen Faktor ist keine Dosisanpassung erforderlich.
Geschlecht
Daten zu weiblichen Patienten sind zu begrenzt um Rückschlüsse zu ziehen.
Nierenfunktionsstörung
Es wurden keine gezielten Studien zur Auswirkung von Nierenfunktionsstörungen auf die Pharmakokinetik von Emicizumab durchgeführt.
Die meisten Patienten mit Hämophilie A in der populationspharmakokinetischen Analyse hatten eine normale Nierenfunktion (n = 332; Kreatinin-Clearance [CLcr] ≥ 90 ml/min) oder eine leichte Nierenfunktionsstörung (n = 27; CLcr ≥ 60 - 89 ml/min). Leichte Nierenfunktionsstörungen hatten keine Auswirkungen auf die Pharmakokinetik von Emicizumab. Zur Anwendung von Hemlibra bei Patienten mit mittelschwerer Nierenfunktionsstörung liegen nur begrenzte Daten (nur 2 Patienten mit einer CLcr von 30 - 59 ml/min) und bei Patienten mit schwerer Nierenfunktionsstörung liegen keine Daten vor. Die Auswirkungen einer mittelschweren und schweren Nierenfunktionsstörung auf die Pharmakokinetik von Emicizumab können nicht abschließend beurteilt werden.
Emicizumab ist ein monoklonaler Antikörper und unterliegt überwiegend dem katabolen Stoffwechsel und weniger der Ausscheidung über die Niere. Es ist daher nicht zu erwarten, dass bei Patienten mit Nierenfunktionsstörung eine Dosisanpassung erforderlich ist.
Leberfunktionsstörung
Es wurden keine gezielten Studien zur Auswirkung von Leberfunktionsstörungen auf die Pharmakokinetik von Emicizumab durchgeführt. Die meisten Patienten mit Hämophilie A in der populationspharmakokinetischen Analyse hatten eine normale Leberfunktion (Bilirubin und AST ≤ ULN, n = 300) oder eine leichte Leberfunktionsstörung (Bilirubin ≤ ULN und AST > ULN oder Bilirubin von 1,0 bis 1,5 × ULN und beliebige AST, n = 51). Nur 6 Patienten hatten eine mittelschwere Leberfunktionsstörung (1,5 × ULN < Bilirubin ≤ 3 × ULN und beliebige AST). Eine leichte Leberfunktionsstörung hatte keinen Einfluss auf die Pharmakokinetik von Emicizumab (siehe Abschnitt 4.2). Die Sicherheit und Wirksamkeit von Emicizumab wurden nicht spezifisch bei Patienten mit Leberfunktionsstörung geprüft. Patienten mit leichter und mittelschwerer Leberfunktionsstörung wurden in die klinischen Studien eingeschlossen. Zur Anwendung von Hemlibra bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Emicizumab ist ein monoklonaler Antikörper und unterliegt überwiegend dem katabolen Stoffwechsel und weniger dem hepatischen Metabolismus. Es ist daher nicht zu erwarten, dass bei Patienten mit Leberfunktionsstörung eine Dosisanpassung erforderlich ist.
Andere besondere Patientengruppen
Modellberechnungen zeigen, dass bei Patienten mit Hypoalbuminämie und geringem altersentsprechendem Körpergewicht eine verringerte Dosierungshäufigkeit zu einer geringeren Emicizumab-Exposition führt. Simulationen weisen darauf hin, dass diese Patienten immer noch eine klinisch bedeutsame Blutungskontrolle hätten. Es wurden keine Patienten mit solchen Merkmalen in klinische Studien eingeschlossen.
Basierend auf den konventionellen Studien zur akuten Toxizität und zur Toxizität bei wiederholter Gabe, einschließlich sicherheitspharmakologischer Endpunkte und Endpunkte zur Reproduktionstoxizität, lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Fertilität
Bis zur höchsten getesteten Dosis von 30 mg/kg/Woche (dem 11‑Fachen der humanen Exposition in der höchsten Dosis von 3 mg/kg/Woche gemäß AUC) hat Emicizumab keine Veränderungen in den Fortpflanzungsorganen von männlichen oder weiblichen Cynomolgus-Affen hervorgerufen.
Teratogenität
Es stehen keine Daten über mögliche Nebenwirkungen von Emicizumab auf die embryofetale Entwicklung zur Verfügung.
Reaktionen an der Injektionsstelle
Reversible Hämorrhagie, perivaskuläre mononukleäre Zellinfiltration, Degeneration/Nekrose der Unterhaut sowie Anschwellen des Unterhaut-Endothels wurden bei Tieren nach subkutaner Injektion beobachtet.
Arginin
Histidin
Asparaginsäure
Poloxamer 188
Wasser für Injektionszwecke
Es wurden keine Inkompatibilitäten zwischen Hemlibra und Spritzen aus Polypropylen oder Polycarbonat und Edelstahlnadeln beobachtet.
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Ungeöffnete Durchstechflasche
Hemlibra 30 mg/ml Injektionslösung
2 Jahre.
Hemlibra 150 mg/ml Injektionslösung
2 Jahre.
Nach der Entnahme aus dem Kühlschrank können Durchstechflaschen ungeöffnet bis zu 7 Tage bei Raumtemperatur (unter 30 °C) aufbewahrt werden.
Ungeöffnete Durchstechflaschen können nach Aufbewahrung bei Raumtemperatur wieder im Kühlschrank gelagert werden. Bei Aufbewahrung außerhalb und anschließender Aufbewahrung im Kühlschrank darf die Gesamtaufbewahrungsdauer außerhalb des Kühlschrankes 7 Tage nicht überschreiten. Die Durchstechflaschen sollten niemals Temperaturen über 30 °C ausgesetzt werden. Durchstechflaschen, die mehr als 7 Tage bei Raumtemperatur aufbewahrt wurden oder Temperaturen über 30 °C ausgesetzt waren, sind zu entsorgen.
Durchstochene Flasche und befüllte Spritze
Aus mikrobiologischer Sicht sollte das Arzneimittel, sobald es von der Durchstechflasche in die Spritze überführt wurde, unverzüglich angewendet werden. Wird es nicht sofort verwendet, liegt die Verantwortung für die Aufbewahrungszeit und die Lagerungsbedingungen beim Anwender.
Im Kühlschrank lagern (2 °C ‑ 8 °C).
Nicht einfrieren.
Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Anbruch des Arzneimittels, siehe Abschnitt 6.3.
Hemlibra 30 mg/ml Injektionslösung
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit grauer Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 12 mg Emicizumab in 0,4 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit himmelblauer Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 30 mg Emicizumab in 1 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
Hemlibra 150 mg/ml Injektionslösung
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit violetter Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 60 mg Emicizumab in 0,4 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit türkiser Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 105 mg Emicizumab in 0,7 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit brauner Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 150 mg Emicizumab in 1 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
3-ml-Durchstechflasche aus klarem Glas vom Typ I mit einem Butylgummistopfen, der mit einem Fluorharzüberzug laminiert und mit einem Aluminiumbördelverschluss mit gelber Kunststoffkappe versehen ist. Jede Durchstechflasche enthält 300 mg Emicizumab in 2 ml Injektionslösung. Jeder Umkarton enthält eine Durchstechflasche.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Hemlibra ist eine sterile, gebrauchsfertige Lösung ohne Konservierungsstoffe zur subkutanen Injektion, die nicht verdünnt werden muss.
Vor der Anwendung muss Hemlibra visuell geprüft werden, um sicherzustellen, dass keine Partikel oder Verfärbung vorhanden sind. Hemlibra ist eine farblose bis hellgelbe Lösung. Die Lösung ist zu entsorgen, wenn Partikel sichtbar sind oder das Produkt sich verfärbt hat.
Nicht schütteln.
Die Durchstechflaschen mit Hemlibra Injektionslösung sind nur zur einmaligen Anwendung bestimmt.
Es werden eine Einmal-Spritze, eine Transfernadel mit Filter oder ein Durchstechflaschenadapter mit Filter und eine Injektionsnadel benötigt, um die Hemlibra Lösung aus der Durchstechflasche zu entnehmen und subkutan zu injizieren.
Beachten Sie bitte die folgenden Empfehlungen:
Für die Injektion von bis zu 1 ml Lösung ist eine 1-ml-Einmal-Spritze zu verwenden; für die Injektion von mehr als 1 ml und bis zu 2 ml ist eine 2- bis 3-ml-Einmal-Spritze zu verwenden.
Wenn mehrere Durchstechflaschen von Hemlibra in einer Spritze kombiniert werden, siehe „Gebrauchsanleitung“. Es dürfen keine unterschiedlichen Konzentrationen von Hemlibra (30 mg/ml und 150 mg/ml) in einer einzelnen Spritze kombiniert werden, um die verschriebene Dosis zu verabreichen.
1-ml-Einmal-Spritze
Kriterien: Transparente Spritze aus Polypropylen oder Polycarbonat mit Luer-Lock™-Spitze, Skala in 0,01-ml-Schritten.
2- bis 3-ml-Einmal-Spritze
Kriterien: Transparente Spritze aus Polypropylen oder Polycarbonat mit Luer-Lock™-Spitze, Skala in 0,1-ml-Schritten.
Transfernadel mit Filter
Kriterien für die Transfernadel mit Filter: Edelstahl mit Luer-Lock™-Anschluss, 18 G, Länge 35 mm (1½“), mit 5 Mikrometer-Filter und vorzugsweise mit halbstumpfer Spitze.
Durchstechflaschenadapter mit Filter
Kriterien für den Durchstechflaschenadapter mit Filter: Polypropylen mit Luer-Lock™-Anschluss, mit 5 Mikrometer-Filter, passend für 15 mm Flaschenhalsaußendurchmesser.
Injektionsnadel
Kriterien: Edelstahl mit Luer-Lock™-Anschluss, 26 G (zulässiger Bereich: 25 - 27 G), Länge vorzugsweise 9 mm (3/8“) oder maximal 13 mm (1/2“), vorzugsweise einschließlich Nadelschutzsystem.
Weitere Informationen zur Anwendung, siehe Abschnitt 4.2 und Packungsbeilage (Abschnitt 7. Gebrauchsanleitung).
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Roche Registration GmbH
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Deutschland
Hemlibra 30 mg/ml Injektionslösung
EU/1/18/1271/006 (12 mg/0,4 ml)
EU/1/18/1271/001 (30 mg/1 ml)
Hemlibra 150 mg/ml Injektionslösung
EU/1/18/1271/002 (60 mg/0,4 ml)
EU/1/18/1271/003 (105 mg/0,7 ml)
EU/1/18/1271/004 (150 mg/1 ml)
EU/1/18/1271/005 (300 mg/2 ml)
Datum der Erteilung der Zulassung: 23. Februar 2018
Datum der letzten Verlängerung der Zulassung: 15. September 2022
März 2025
Verschreibungspflichtig
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Telefon (07624) 14-0
Telefax (07624) 1019
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.