Hydromorphon-dura 4 mg Retardtabletten
Hydromorphon-dura 8 mg Retardtabletten
Hydromorphon-dura 16 mg Retardtabletten
Hydromorphon-dura 24 mg Retardtabletten
Hydromorphon-dura 4 mg
Jede Retardtablette enthält 4 mg Hydromorphonhydrochlorid (entsprechend 3,55 mg Hydromorphon).
Hydromorphon-dura 8 mg
Jede Retardtablette enthält 8 mg Hydromorphonhydrochlorid (entsprechend 7,09 mg Hydromorphon).
Hydromorphon-dura 16 mg
Jede Retardtablette enthält 16 mg Hydromorphonhydrochlorid (entsprechend 14,19 mg Hydromorphon).
Hydromorphon-dura 24 mg
Jede Retardtablette enthält 24 mg Hydromorphonhydrochlorid (entsprechend 21,28 mg Hydromorphon).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Retardtablette
Hydromorphon-dura 4 mg
Weiße, runde, bikonvexe Tabletten mit einer Bruchkerbe auf beiden Seiten.
Die Tablette kann in gleiche Dosen geteilt werden.
Hydromorphon-dura 8 mg
Pinkfarbene, längliche, bikonvexe Tabletten mit einer Bruchkerbe auf beiden Seiten.
Die Tablette kann in gleiche Dosen geteilt werden.
Hydromorphon-dura 16 mg
Gelbe, längliche, bikonvexe Tabletten mit einer Bruchkerbe auf beiden Seiten.
Die Tablette kann in gleiche Dosen geteilt werden.
Hydromorphon-dura 24 mg
Weiße, längliche, bikonvexe Tabletten mit einer Bruchkerbe auf beiden Seiten.
Die Tablette kann in gleiche Dosen geteilt werden.
Behandlung von starken Schmerzen.
Zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahren.
Dosierung
Die Dosierung von Hydromorphon-dura muss der Stärke der Schmerzen und der individuellen Reaktion des Patienten angepasst werden.
Grundsätzlich sollte eine ausreichend hohe Dosis gegeben werden und gleichzeitig die im Einzelfall kleinste analgetisch wirksame Dosis angestrebt werden.
Die Dosis sollte schrittweise bis zur optimalen Schmerzstillung gesteigert werden.
Erwachsene und Jugendliche ab 12 Jahre
Die Anfangsdosis von Hydromorphon-dura beträgt im Allgemeinen 4 mg alle 12 Stunden. Die Dosis kann abhängig von der Schmerzlinderung vorsichtig titriert werden. Bei Patienten, die regelmäßig mit Opioiden behandelt werden, kann eine höhere Anfangsdosis von Hydromorphon-dura in Abhängigkeit von der vorherigen Opioid-Tagesdosis notwendig sein.
Bei der Behandlung chronischer Schmerzen ist der Dosierung nach festem Zeitplan der Vorzug zu geben. Dabei sollte ein Zeitintervall von 12 Stunden nicht unterschritten werden.
Eine angemessene Prophylaxe bekannter Nebenwirkungen (zum Beispiel Obstipation) sollte in Betracht gezogen werden.
Dauer der Anwendung
Hydromorphon-dura sollte nicht länger als unbedingt notwendig verabreicht werden. Wenn entsprechend Art und Schwere der Erkrankung eine Langzeitbehandlung erforderlich ist, sollte eine sorgfältige und regelmäßige Überprüfung sicherstellen, ob und in welchem Ausmaß eine Weiterbehandlung notwendig ist.
Therapieende
Bei Patienten mit einer physischen Abhängigkeit von Opioiden kann ein abruptes Absetzen von Hydromorphon zu einem Abstinenz-/Entzugssyndrom führen. Ist eine Beendigung der Therapie mit Hydromorphon indiziert, sollte die Hydromorphon-Dosis deshalb alle 2 Tage um jeweils 50 % verringert werden, bis die niedrigste Dosis erreicht ist, bei der die Therapie sicher beendet werden kann. Falls Entzugserscheinungen auftreten, ist die Dosisreduktion abzubrechen. Die Dosis sollte dann geringfügig erhöht werden, bis die Anzeichen und Symptome eines Opioid-Entzugs verschwinden. Danach ist die Dosisreduktion von Hydromorphon fortzusetzen, jedoch mit längeren Zeitintervallen zwischen jeder Hydromorphon-Dosisreduktion oder indem die Reduktion mit einer äquianalgetischen Dosis eines anderen Opioids fortgeführt wird.
Umstellung von Patienten von parenteraler Anwendung zu einer oralen Einnahme von Hydromorphon
Werden Patienten von einer parenteralen auf eine orale Hydromorphon-Therapie umgestellt, sollte sich nach der individuell unterschiedlichen Empfindlichkeit der Patienten gerichtet werden. Die orale Anfangsdosis darf nicht überschätzt werden (zur oralen Bioverfügbarkeit siehe Abschnitt 5.2).
Besondere Patientengruppen
Ältere Patienten
Bei älteren Patienten kann eventuell mit einer geringeren Dosierung als bei anderen Erwachsenen eine ausreichende Analgesie erzielt werden.
Patienten mit Leber- und/oder Nierenfunktionsstörungen
Diese Patienten benötigen möglicherweise niedrigere Dosen als andere Patientengruppen, um eine ausreichende Analgesie zu erreichen. Sie sollen vorsichtig entsprechend der Wirkung eingestellt werden.
Kinder
Hydromorphon-dura wird für die Anwendung bei Kindern unter 12 Jahren nicht empfohlen, da bei Kindern unter 12 Jahren keine ausreichend dokumentierten Erfahrungen vorliegen.
Art der Anwendung
Zum Einnehmen
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit zu schlucken und dürfen nicht zerkaut oder zerstoßen werden.
Behandlungsziele und Abbruch
Vor Einleitung der Behandlung mit Hydromorphon-dura sollten eine Behandlungsstrategie, einschließlich Behandlungsdauer und Behandlungszielen, sowie ein Plan für das Behandlungsende gemeinsam mit dem Patienten und in Übereinstimmung mit den Leitlinien zur Schmerzbehandlung vereinbart werden. Während der Behandlung sollte ein häufiger Kontakt zwischen Arzt und Patient stattfinden, um die Notwendigkeit einer Fortsetzung der Behandlung zu beurteilen, die Beendigung der Behandlung in Erwägung zu ziehen und die Dosis bei Bedarf anzupassen. Wenn ein Patient die Hydromorphon-Therapie nicht mehr benötigt, kann es ratsam sein, die Dosis schrittweise zu reduzieren, um Entzugserscheinungen zu vermeiden. Bei fehlender adäquater Schmerzkontrolle sollte die Möglichkeit einer Hyperalgesie, einer Gewöhnung (Toleranz) und einer Progression der zugrundeliegenden Erkrankung in Erwägung gezogen werden (siehe Abschnitt 4.4).
Behandlungsdauer
Hydromorphon sollte nicht länger als notwendig angewendet werden.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
schwere Atemdepression mit Hypoxie oder Hyperkapnie
schwere chronisch obstruktive Atemwegserkrankung
schweres Bronchialasthma
Koma
akutes Abdomen
paralytischer Ileus
gleichzeitige Gabe von Monoaminoxidase-Hemmern oder wenn diese innerhalb der letzten 14 Tage abgesetzt wurden
Vorsicht bei der Anwendung von Hydromorphon ist geboten bei:
älteren und geschwächten Patienten
schwer beeinträchtigter Atemfunktion
Schlaf-Apnoe
gleichzeitiger Anwendung von anderen zentraldämpfend wirkenden Arzneimitteln (siehe unten und Abschnitt 4.5)
Opioid-Toleranz, physischer Abhängigkeit oder Entzugserscheinungen (siehe unten)
Psychischer Abhängigkeit (Arzneimittelsucht), Missbrauchsprofil und Vorgeschichte von Drogen- und/oder Alkoholmissbrauch (siehe unten)
Kopfverletzungen, Hirnverletzungen (intrakranielle Läsionen) oder erhöhtem Hirndruck, Bewusstseinsstörungen unklaren Ursprungs
Hypotonie bei Hypovolämie
Pankreatitis
Hypothyreose
toxischer Psychose
Prostatahypertrophie
Nebennierenrindeninsuffizienz (z. B. Morbus Addison)
schwerer Beeinträchtigung der Nieren- oder Leberfunktion
Alkoholismus
Obstipation
Atemdepression
Eine Atemdepression ist die bedeutsamste Gefährdung einer Opioidüberdosierung.
Schlafbezogene Atemstörungen
Opioide können schlafbezogene Atemstörungen, einschließlich zentraler Schlafapnoe und schlafbezogener Hypoxämie, verursachen. Die Anwendung von Opioiden geht mit einer dosisabhängigen Erhöhung des Risikos für eine zentrale Schafapnoe einher (siehe Abschnitt 4.8).
Bei Patienten mit zentraler Schlafapnoe sollte eine Verringerung der Opioidgesamtdosis in Betracht gezogen werden.
Risiken einer gleichzeitigen Anwendung von sedierenden Arzneimitteln wie Benzodiazepinen oder vergleichbaren Arzneimitteln
Die gleichzeitige Anwendung von Hydromorphon-dura und sedierenden Arzneimitteln wie Benzodiazepinen oder vergleichbaren Arzneimitteln kann zu Sedierung, Atemdepression, Koma und Tod führen. Aufgrund dieser Risiken ist die gleichzeitige Verschreibung mit diesen sedierenden Arzneimitteln nur bei den Patienten angebracht, für die es keine alternativen Behandlungsmöglichkeiten gibt. Wenn dennoch eine gleichzeitige Verschreibung von Hydromorphon-dura zusammen mit Sedativa für notwendig erachtet wird, sollte die niedrigste wirksame Dosis verwendet werden und die Behandlungsdauer sollte so kurz wie möglich sein. Die Patienten sollten engmaschig auf Anzeichen und Symptome von Atemdepression und Sedierung überwacht werden. In diesem Zusammenhang wird dringend empfohlen, Patienten und ihre Bezugspersonen über diese Symptome zu informieren (siehe Abschnitt 4.5).
Vorsicht bei der Anwendung ist außerdem geboten bei opioidabhängigen Patienten, Krampfleiden, Delirium tremens, Gallenwegserkrankungen, Gallen- oder Nierenkolik, obstruktiven oder entzündlichen Darmerkrankungen, chronisch obstruktiver Atemwegserkrankung und verminderter Atemreserve (siehe Abschnitt 4.2). Bei allen vorgenannten Patienten kann eine niedrigere Dosierung ratsam sein.
Opioidgebrauchsstörung (Missbrauch und Abhängigkeit)
Bei wiederholter Anwendung von Opioiden wie Hydromorphon können sich eine Toleranz sowie eine physische und/oder psychische Abhängigkeit entwickeln.
Die wiederholte Anwendung von Hydromorphon-dura kann zu einer Opioidgebrauchsstörung führen. Eine höhere Dosis und längere Dauer der Opioidbehandlung können das Risiko erhöhen, eine Opioidgebrauchsstörung zu entwickeln. Durch Missbrauch oder absichtliche Falschanwendung von Hydromorphon-dura kann es zu einer Überdosierung und/oder zum Tod kommen. Das Risiko, eine Opioidgebrauchsstörung zu entwickeln, ist bei Patienten mit einer Substanzgebrauchsstörung (einschließlich Alkoholgebrauchsstörung) in der persönlichen oder familiären Vorgeschichte (Eltern oder Geschwister), bei Rauchern oder bei Patienten mit anderen psychischen Erkrankungen in der persönlichen Vorgeschichte (z. B. Major Depression, Angststörungen und Persönlichkeitsstörungen) erhöht.
Vor Beginn der Behandlung mit Hydromorphon-dura und während der Behandlung sollten die Behandlungsziele und ein Plan für die Beendigung der Behandlung mit dem Patienten vereinbart werden (siehe Abschnitt 4.2). Vor und während der Behandlung sollte der Patient außerdem über die Risiken und Anzeichen einer Opioidgebrauchsstörung aufgeklärt werden. Den Patienten sollte geraten werden, sich bei Auftreten dieser Anzeichen mit ihrem Arzt in Verbindung zu setzen.
Die Patienten müssen auf Anzeichen eines Suchtverhaltens (drug-seeking behaviour) überwacht werden (z. B. zu frühes Nachfragen nach Folgerezepten). Hierzu gehört auch die Überprüfung der gleichzeitigen Anwendung von Opioiden und psychoaktiven Arzneimitteln (wie Benzodiazepinen). Bei Patienten mit Anzeichen und Symptomen einer Opioidgebrauchsstörung sollte die Konsultation eines Suchtspezialisten in Betracht gezogen werden.
Bei längerfristiger Anwendung von Hydromorphon kann es zur Entwicklung einer Toleranz mit der Notwendigkeit höherer Dosen zum Erzielen des erwünschten analgetischen Effektes kommen. Eine Kreuztoleranz zu anderen Opioiden kann bestehen. Die chronische Anwendung von Hydromorphon kann zu physischer Abhängigkeit führen und bei abrupter Beendigung der Therapie kann ein Entzugssyndrom auftreten. Wenn die Therapie mit Hydromorphon nicht mehr länger erforderlich ist, kann es ratsam sein, die Tagesdosis allmählich zu reduzieren, um das Auftreten der Symptome eines Entzugssyndroms zu vermeiden.
Um zu verhindern, dass die kontrollierte Freisetzung aus den in den Tabletten enthaltenen Pellets beeinträchtigt wird, dürfen die Retardtabletten nicht zerkaut oder zermahlen/zerstoßen werden. Die Anwendung zerkauter oder zermahlener/zerstoßener Tabletten führt zu einer schnellen Freisetzung und zur Resorption einer möglicherweise letalen Dosis von Hydromorphon (siehe Abschnitt 4.9).
Bei gleichzeitiger Einnahme von Alkohol und Hydromorphon-dura können vermehrt Nebenwirkungen von Hydromorphon-dura auftreten. Die gleichzeitige Einnahme sollte vermieden werden.
Hydromorphon-dura ist nur für die orale Einnahme bestimmt. Eine missbräuchliche parenterale Verabreichung von Hydromorphon-dura kann zu schwerwiegenden, potenziell letalen unerwünschten Ereignissen führen.
Hydromorphon-dura sollte nicht eingesetzt werden, wenn die Möglichkeit besteht, dass ein paralytischer Ileus auftritt. Sollte ein paralytischer Ileus vermutet werden oder während der Behandlung auftreten, muss die Behandlung mit Hydromorphon sofort abgebrochen werden.
Hydromorphon-dura wird präoperativ und in den ersten 24 Stunden postoperativ wegen des gegenüber Nichtoperierten in der postoperativen Phase höheren Risikos eines Ileus nicht empfohlen. Danach sollte Hydromorphon-dura - insbesondere bei abdominalen Eingriffen - mit Vorsicht angewendet werden.
Patienten, die einer anderen zusätzlichen Schmerztherapie (z. B. Operation, Plexusblockade) unterzogen werden, sollten 12 Stunden vor dem Eingriff kein Hydromorphon mehr erhalten. Falls eine Weiterbehandlung mit Hydromorphon-dura indiziert ist, sollte die Dosierung nach dem Eingriff den neuen Erfordernissen entsprechend eingestellt werden.
Es ist zu beachten, dass Patienten nach erfolgter Einstellung (Titration) auf wirksame Dosen eines bestimmten Opioids nicht ohne ärztliche Beurteilung und sorgfältige bedarfsorientierte Neueinstellung auf ein anderes Opioid umgestellt werden sollten. Andernfalls ist eine kontinuierliche, analgetische Wirkung nicht gewährleistet.
Hydromorphon-dura 8, 16 und 24 mg ist nicht für eine initiale Opioid-Therapie geeignet. Die höheren Wirkstärken von Hydromorphon-dura (8, 16 und 24 mg) dürfen nur bei Patienten angewendet werden, bei denen im Rahmen einer langfristigen Schmerzbehandlung mit niedriger dosierten Hydromorphon-Präparaten (Hydromorphon-dura 4 mg) oder anderen vergleichbar starken Schmerzmitteln keine ausreichende Schmerzfreiheit mehr erreicht werden kann.
Bei bestehender Nebennierenrinden-Insuffizienz sollte die Plasmakortisolkonzentration kontrolliert und gegebenenfalls Kortikoide zugeführt werden.
Opioide wie Hydromorphon können die Hypothalamus-Hypophysen-Nebennieren- oder -Gonaden-Achsen beeinflussen. Zu den möglichen Veränderungen zählen ein Anstieg von Prolaktin im Serum und eine Abnahme von Kortisol und Testosteron im Plasma. Auf Grundlage dieser Hormonveränderungen können sich klinische Symptome manifestieren.
Bei einer Hyperalgesie, die insbesondere bei hoher Dosierung auftreten kann, wird eine weitere Dosiserhöhung von Hydromorphon-dura zu keiner weiteren Schmerzreduktion führen. Eine Dosisreduktion oder der Wechsel zu einem anderen Opioid kann dann erforderlich werden.
Opioide können Krämpfe der Gallenwege induzieren.
Die Anwendung von Hydromorphon-dura kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Hydromorphon-dura enthält weniger als 1 mmol (23 mg) Natrium pro Retardtablette, d. h., es ist nahezu „natriumfrei“.
Zentralnervensystem (ZNS)
Die gleichzeitige Anwendung von Opioiden zusammen mit sedierenden Arzneimitteln wie Benzodiazepinen oder vergleichbaren Arzneimitteln erhöht das Risiko von Sedierung, Atemdepression, Koma und Tod aufgrund einer additiven ZNS-dämpfenden Wirkung. Die Dosis und Dauer der gleichzeitigen Anwendung sollten begrenzt werden (siehe Abschnitt 4.4). Zu den Arzneimitteln, die das Zentralnervensystem (ZNS) beeinflussen, zählen unter anderem Tranquilizer, Anästhetika wie z. B. Barbiturate, Hypnotika und Sedativa (einschließlich Benzodiazepine), Neuroleptika (einschließlich Benzodiazepine), Antidepressiva, Antihistaminika/Antiemetika und andere Opioide.
Die gleichzeitige Anwendung von Opioiden und Gabapentinoiden (Gabapentin und Pregabalin) erhöht das Risiko für Opioid-Überdosierung, Atemdepression und Tod.
Alkohol kann die pharmakodynamischen Effekte von Hydromorphon-dura verstärken. Die gleichzeitige Einnahme sollte vermieden werden.
Monoaminoxidase-Hemmer (MAO-Hemmer) können bei gleichzeitiger Anwendung mit Opioiden entweder stimulierend oder hemmend auf das ZNS wirken oder zu einer Hypotonie oder Hypertonie führen. Hydromorphon-dura ist bei gleichzeitiger Therapie mit MAO-Hemmern kontraindiziert (siehe Abschnitt 4.3).
Ebenso wie andere Opioide kann Hydromorphon-dura die neuromuskuläre Blockadewirkung von Muskelrelaxantien erhöhen und zu einer verstärkten Atemdepression führen.
Es wurden keine Wechselwirkungsstudien durchgeführt.
Schwangerschaft
Für die Anwendung von Hydromorphon bei schwangeren Frauen liegen keine adäquaten Daten vor. Tierexperimentelle Untersuchungen haben eine Reproduktionstoxizität aufgezeigt (siehe Abschnitt 5.3). Das mögliche Risiko für den Menschen ist unbekannt.
Die Anwendung von Hydromorphon-dura während Schwangerschaft und Geburt wird wegen einer verminderten Uteruskontraktilität und der Gefahr einer Atemdepression beim Neugeborenen nicht empfohlen. Eine chronische Einnahme von Hydromorphon während der Schwangerschaft kann zu einem Entzugssyndrom beim Neugeborenen führen.
Hydromorphon sollte deshalb in der Schwangerschaft nicht angewendet werden, außer dies ist eindeutig erforderlich.
Stillzeit
Hydromorphon wird in geringen Mengen in die Muttermilch sezerniert. Hydromorphon-dura sollte deshalb von stillenden Müttern nicht eingenommen werden. Wenn die Einnahme erforderlich ist, sollte abgestillt werden.
Fertilität
Es liegen keine ausreichenden Daten der Wirkung von Hydromorphon in Bezug auf eine Reproduktionstoxizität beim Menschen vor. Tierexperimentelle Studien an Ratten ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen von Hydromorphon bei männlichen oder weiblichen Tieren in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3).
Hydromorphon kann die Verkehrstüchtigkeit und die Fähigkeit, Maschinen zu bedienen, beeinträchtigen. Dies ist insbesondere zu Beginn einer Hydromorphon-Therapie, nach Dosiserhöhung oder Präparatewechsel sowie beim Zusammenwirken von Hydromorphon mit ZNS-dämpfenden Substanzen zu erwarten. Bei einer stabilen Therapie sind Beschränkungen nicht zwangsläufig erforderlich. Deshalb sollten Patienten mit ihrem behandelnden Arzt besprechen, ob sie ein Fahrzeug führen oder Maschinen bedienen dürfen.
Die am häufigsten berichteten Nebenwirkungen sind Übelkeit (vor allem zu Beginn der Therapie) und Obstipation.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gelegentlich (≥ 1/1000 bis < 1/100), selten (≥ 1/10 000 bis < 1/1 000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Erkrankungen des Immunsystems
Nicht bekannt: Überempfindlichkeit (einschließlich Schwellungen im Bereich des Oropharynx), anaphylaktische Reaktionen
Stoffwechsel- und Ernährungsstörungen
Häufig: Appetitabnahme
Psychiatrische Erkrankungen
Häufig: Angstzustände, Verwirrtheit, Schlaflosigkeit
Gelegentlich: Agitiertheit, Depression, euphorische Stimmung, Halluzinationen, Albträume, verminderte Libido
Nicht bekannt: Abhängigkeit (siehe Abschnitt 4.4.), Dysphorie
Erkrankungen des Nervensystems
Sehr häufig: Schwindel, Somnolenz
Häufig: Kopfschmerzen
Gelegentlich: Tremor, Myoklonus, Parästhesie
Selten: Sedierung, Lethargie
Nicht bekannt: Krampfanfälle, Dyskinesie, Hyperalgesie (siehe Abschnitt 4.4), Zentrales Schlafapnoe-Syndrom
Augenerkrankungen
Gelegentlich: Sehstörung
Nicht bekannt: Miosis
Herzerkrankungen
Selten: Tachykardie, Bradykardie, Palpitationen
Gefäßerkrankungen
Gelegentlich: Hypotonie
Nicht bekannt: Hitzegefühl
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe
Selten: Atemdepression, Bronchospasmus
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Obstipation, Übelkeit
Häufig: Bauchschmerzen, Mundtrockenheit, Erbrechen
Gelegentlich: Dyspepsie, Diarrhoe, Geschmacksstörungen
Nicht bekannt: Paralytischer Ileus
Leber- und Gallenerkrankungen
Gelegentlich: Erhöhung leberspezifischer Enzyme
Selten: Erhöhung von Pankreasenzymen
Nicht bekannt: Gallenkoliken
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Pruritus, Schwitzen
Gelegentlich: Hautausschlag
Selten: Rötung des Gesichts
Nicht bekannt: Urtikaria
Erkrankungen der Nieren und Harnwege
Häufig: verstärkter Harndrang
Gelegentlich: Harnverhalten
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Erektionsstörungen
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Asthenie
Gelegentlich: Entzugserscheinungen*, Ermüdung, Unwohlsein, periphere Ödeme
Nicht bekannt: Toleranz, Arzneimittelentzugssyndrom beim Neugeborenen
*Entzugserscheinungen können auftreten und sich in Symptomen wie gesteigerter Erregbarkeit, Angstzuständen, Nervosität, Schlaflosigkeit, Hyperkinesie, Tremor und gastrointestinalen Symptomen äußern.
Beschreibung ausgewählter Nebenwirkungen
Arzneimittelabhängigkeit
Die wiederholte Anwendung von Hydromorphon-dura kann, auch in therapeutischer Dosierung, zu einer Arzneimittelabhängigkeit führen. Das Risiko für eine Arzneimittelabhängigkeit kann je nach individuellen Risikofaktoren des Patienten, Dosierung und Dauer der Opioidbehandlung variieren (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: https://www.bfarm.de, anzuzeigen.
Symptome der Intoxikation
Zeichen und Symptome einer übermäßigen Hydromorphon-Wirkung sind durch Beschwerden wie „sich komisch fühlen”, schlechte Konzentrationsfähigkeit, Schläfrigkeit und möglicherweise Schwindelgefühl im Stehen gekennzeichnet.
Weitere mögliche typische Symptome einer Überdosierung sind Atemdepression (Verringerung der Atemfrequenz und/oder des Atemzugvolumens, Cheyne-Stokes-Atmung, Zyanose), extreme Schläfrigkeit, Bewusstseinsstörungen bis hin zum Koma, Miosis, Erschlaffung der Skelettmuskulatur, feuchtkalte Haut, Bradykardie und Hypotension. Es kann zu einer Aspirationspneumonie kommen. Massive Vergiftungen können Atemstillstand, Kreislaufversagen, Herzstillstand und den Tod hervorrufen.
Toxische Leukoenzephalopathie wurde bei Überdosierung von Hydromorphon beobachtet.
Therapie der Intoxikation
Im Falle einer Überdosierung ist der kardiale und respiratorische Zustand des Patienten engmaschig zu überwachen und es sind entsprechende unterstützende Maßnahmen einzuleiten. Ein spezifischer Opioidantagonist wie Naloxon kann die Wirkungen von Hydromorphon aufheben. Es muss darauf geachtet werden, dass die Wirkungsdauer von Opioiden länger sein kann als die von Naloxon, wodurch ein Wiederauftreten der Atemdepression möglich ist. Bei Einnahme größerer Mengen Hydromorphon-dura sollte eine Magenspülung erwogen werden.
Pharmakotherapeutische Gruppe: Analgetika; Opioide, natürliches Opium-Alkaloid
ATC-Code: N02A A03
Hydromorphon ist ein µ-selektiver, reiner Opioid-Agonist. Hydromorphon und verwandte Opioide wirken hauptsächlich auf das zentrale Nervensystem und den Darm. Die Wirkungen sind vornehmlich analgetisch, anxiolytisch, antitussiv und sedativ. Darüber hinaus können Stimmungsveränderungen, Atemdepression, verminderte gastrointestinale Motilität, Übelkeit, Erbrechen und Veränderungen des endokrinen und autonomen Nervensystems auftreten.
Präklinische Studien zeigen unterschiedliche Effekte von Opioiden auf Komponenten des Immunsystems. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Resorption
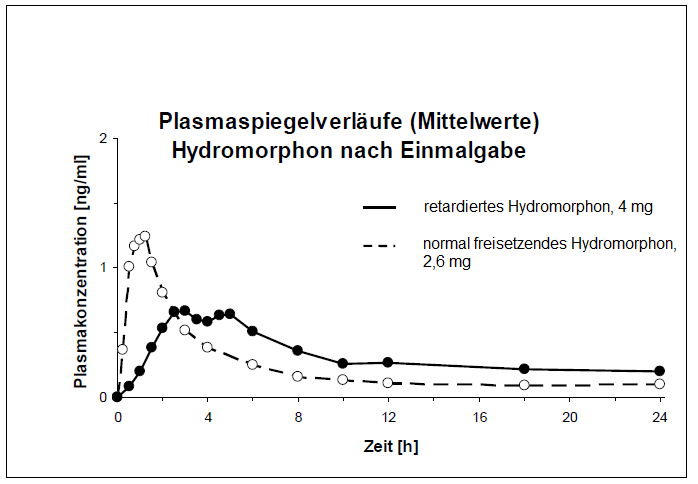
Hydromorphon wird im Gastrointestinaltrakt resorbiert und unterliegt einer präsystemischen Elimination. Das Ausmaß der absoluten Bioverfügbarkeit beträgt 36,4 % (C.I. 90 %: 32,7 - 40,5 %) für retardiertes Hydromorphon und 32,3 % (C.I. 90 %: 29,0 - 35,9 %) für die orale Hydromorphonlösung. Die relative Bioverfügbarkeit von retardiertem Hydromorphon ist vergleichbar mit der Bioverfügbarkeit des normal freisetzenden Hydromorphonhydrochlorid, jedoch mit geringerer Fluktuation der Plasmaspiegel. Die maximale Plasmakonzentration (Cmax=1,2 ± 1,24 ng/ml) nach Einnahme von retardiertem Hydromorphon wird nach 2 bis 5 Stunden (Tmax =3 (2-5)) erreicht, gefolgt von einer langgestreckten Plateauphase mit relativ konstantem therapeutischen Plasmaspiegel von mindestens 12 Stunden.
Verteilung
Die Plasmaproteinbindung des Hydromorphons ist gering (< 10 %), wobei dieser Prozentsatz von 2,46 ng/ml bis zu sehr hohen Plasmaspiegeln von 81,99 ng/ml, die nur bei sehr hohen Hydromorphon-Dosen erreicht werden, konstant bleibt.
Hydromorphonhydrochlorid weist ein relativ hohes Verteilungsvolumen von 1,22 ± 0,23 l/kg (C.I.: 90 %: 0,97 - 1,60 l/kg, N = 6 männliche Probanden) auf. Dies weist auf eine deutliche Gewebeaufnahme hin.
Aus dem Verlauf der Plasmakonzentrations-Zeit-Kurven nach einmaliger Gabe von Hydromorphonhydrochlorid 2 mg i.v. oder 4 mg oral an 6 gesunde Probanden im randomisierten Cross-over-Versuch ergab sich eine relative kurze Eliminationshalbwertszeit von 2,64 ± 0,88 Stunden (1,68-3,87 Stunden).
Biotransformation
Hydromorphon wird durch direkte Konjugation oder durch Reduktion der Ketogruppe mit nachfolgender Konjugation metabolisiert. Nach Resorption wird Hydromorphon hauptsächlich zu Hydromorphon-3-Glucuronid, Hydromorphon-3-Glucosid und Dihydroisomorphin-6-Glucuronid metabolisiert. Zu einem kleineren Anteil wurden auch die Metabolite Dihydroisomorphin-6-Glucosid, Dihydromorphin und Dihydroisomorphin beobachtet. Hydromorphon wird hepatisch metabolisiert und zum geringen Teil unverändert hauptsächlich renal ausgeschieden.
Elimination
Hydromorphonmetaboliten wurden im Plasma, Urin und in humanen Hepatozyten-Test-Systemen festgestellt. Es gibt keine Hinweise, dass Hydromorphon in-vivo durch das Cytochrom-P450-Enzymsystem metabolisiert wird. In-vitro hemmt Hydromorphon mit einer IC50 > 50 μM nur geringfügig die rekombinanten CYP-Isoformen, einschließlich CYP1A2, 2A6, 2C8, 2D6 und 3A4. Es ist deshalb nicht zu erwarten, dass Hydromorphon den Metabolismus von anderen Arzneistoffen, die durch diese CYP-Isoformen metabolisiert werden, inhibiert.
Nicht-klinische Daten basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Anwendung und Genotoxizität lassen keine besonderen Gefahren für den Menschen erkennen.
Reproduktions- und Entwicklungstoxikologie
Bei Ratten, die oral Hydromorphon-Dosen von 5 mg/kg/Tag erhielten (30 mg/m2/Tag, was 1,4‑fach höher ist, als die für den Menschen auf Basis der Körperoberfläche zu erwartende Dosis), wurden keine Auswirkungen auf die männliche oder weibliche Fertilität oder die Eigenschaften der Spermien beobachtet.
Hydromorphon, welches oral während der Hauptentwicklungszeit der Organe gegeben wurde, war weder in schwangeren Ratten noch Kaninchen teratogen. Eine Beeinträchtigung der fetalen Entwicklung ergab sich in Kaninchen bei einer Dosis von 50 mg/kg (der No-Effect-Level für Entwicklungsparameter lag bei einer Dosis von 25 mg/kg oder 380 mg/m2 bei einer Exposition mit der Wirksubstanz (AUC), die ungefähr 4‑fach über der für den Menschen zu erwartenden liegt). Bei Ratten, die oral mit Hydromorphon-Dosen bis zu 10 mg/kg (308 mg/m2 mit einer AUC, die ungefähr 1,8‑fach über der für den Menschen zu erwartenden liegt) behandelt wurden, wurden keine Anzeichen für fetale Toxizität beobachtet.
In der Literatur gibt es Hinweise auf eine teratogene Wirkung von Hydromorphon bei Mäusen und Hamstern.
Eine prä- und postnatale Studie an Ratten zeigte eine erhöhte Mortalität von Rattenjungen und eine reduzierte Zunahme ihres Körpergewichts in der frühen postnatalen Phase bei Hydromorphon Hydrochlorid-Dosen von 2 und 5 mg/kg/Tag, einhergehend mit maternaler Toxizität. Es wurden keine Auswirkungen auf die weitere Entwicklung der Jungtiere oder die Reproduktionsfähigkeit beobachtet.
Kanzerogenität
Langzeitstudien zur Kanzerogenität wurden nicht durchgeführt.
Tablettenkern:
Mikrokristalline Cellulose
Hypromellose
Ethylcellulose
Hyprolose
Propylenglycol
Talkum
Carmellose-Natrium (Ph.Eur.)
Magnesiumstearat (Ph.Eur.)
hochdisperses Siliciumdioxid
Filmüberzug:
Hypromellose
Macrogol 6000
Talkum
Titandioxid (E171)
Zusätzlich:
Hydromorphon-dura 8 mg: Eisen(III)-oxid (E172)
Hydromorphon-dura 16 mg: Eisen(III)-hydroxid-oxid x H2O (E172)
Nicht zutreffend.
4 Jahre
Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Kindergesicherte Aluminium/PVC-PE-PVDC-Blisterpackungen.
Packungsgrößen
20, 50 und 100 Retardtabletten
Keine besonderen Anforderungen.
Mylan Germany GmbH
Lütticher Straße 5
53842 Troisdorf
Mitvertrieb
Viatris Healthcare GmbH
Lütticher Straße 5
53842 Troisdorf
Hydromorphon-dura 4 mg: 78115.00.00
Hydromorphon-dura 8 mg: 78115.01.00
Hydromorphon-dura 16 mg: 78115.02.00
Hydromorphon-dura 24 mg: 78115.03.00
Datum der Erteilung der Zulassung: 26. Januar 2010
Datum der letzten Verlängerung der Zulassung: 18. Dezember 2014
September 2025
Verschreibungspflichtig, Betäubungsmittel