SANASTHMAX 400 Mikrogramm Suspension für einen Vernebler
Jede Ampulle enthält 400 Mikrogramm Beclometasondipropionat (Ph.Eur.) in 1 ml.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Suspension für einen Vernebler.
Weiße oder fast weiße Suspension.
SANASTHMAX ist angezeigt für die
Erhaltungstherapie bei Asthma bei Erwachsenen und Kindern im Alter bis zu 18 Jahren, wenn die Anwendung von Druckgas- oder Trockenpulverinhalatoren nicht zufriedenstellend oder ungeeignet ist.
Therapie des wiederkehrenden Giemens bei Kindern im Alter bis zu 5 Jahren (siehe Abschnitte 4.2 und 4.4, Kinder und Jugendliche)
Die Anfangsdosis von vernebeltem Beclometasondipropionat sollte die Häufigkeit und den Schweregrad der Symptome berücksichtigen.
Empfohlene Anfangsdosen:
Erwachsene und Jugendliche (ab 12 Jahren): 800 – 1.600 Mikrogramm zweimal täglich
(Tagesgesamtdosis: 1.600 – 3.200 Mikrogramm)
Kinder (bis zu 11 Jahren): 400 – 800 Mikrogramm zweimal täglich
(Tagesgesamtdosis: 800 – 1600 Mikrogramm)
Eine tägliche Dosis von 3.200 Mikrogramm bei Erwachsenen und Jugendlichen und 1.600 Mikrogramm bei Kindern im Alter bis zu 11 Jahren sollte im Normalfall nicht überschritten werden.
Sobald eine bessere Kontrolle des Asthmas oder des Giemens erreicht ist, sollte die Tagesgesamtdosis auf die niedrigste wirksame Dosis reduziert werden und eine einmal tägliche Gabe kann angewendet werden.
Bei Patienten mit Asthma muss SANASTHMAX regelmäßig jeden Tag angewendet werden. Die Dauer der Behandlung richtet sich nach dem Schweregrad der Symptome.
Bei Kindern mit wiederkehrendem Giemen sollte die Therapie abgebrochen werden, wenn sich innerhalb von 2 bis 3 Monaten kein Behandlungserfolg einstellt. Außerdem sollte die Dauer der Behandlung des wiederkehrenden Giemens 3 Monate nicht überschreiten, um eine unnötige Langzeit-Exposition zu vermeiden, es sei denn, die Diagnose des Asthmas ist bestätigt (siehe Abschnitt 4.4).
Art der Anwendung
Nur zur Inhalation bestimmt. SANASTHMAX darf nicht injiziert oder oral angewendet werden.
SANASTHMAX sollte vorzugsweise mit einem Düsenvernebler angewendet werden und der Kompressor sollte mit einem Mundstück oder einer geeigneten Mund-Nasen-Maske ausgestattet sein.
Die Patienten sollten angewiesen werden, die Anweisungen des Herstellers für den Vernebler sorgfältig zu befolgen und nur die empfohlenen Einstellungen zu verwenden. Nicht ordnungsgemäßer Gebrauch des Verneblers könnte zu einer falschen Dosierung des Arzneimittels führen.
Von der Anwendung von SANASTHMAX mit Ultraschallverneblern wird abgeraten, da damit eine korrekte Anwendung des Arzneimittels nicht möglich ist.
Hinweise zur Vorbereitung und Verdünnung des Arzneimittels siehe Abschnitt 6.6.
Nach der Inhalation der verordneten Dosis sollten die Patienten ihren Mund mit Wasser ausspülen, um das Risiko einer oropharyngealen Candida-Infektion zu minimieren (siehe Abschnitt 4.4).
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Die Asthmabehandlung sollte in der Regel einem Stufenprogramm folgen, wobei der Behandlungserfolg klinisch und durch Lungenfunktionstests zu überwachen ist.
SANASTHMAX ist nicht für die Behebung akuter Asthmasymptome vorgesehen. Dafür ist ein inhalativer, kurzwirksamer Beta2-Agonist erforderlich. Den Patienten sollte angeraten werden, eine solche Bedarfsmedikation zur Hand zu haben.
Die zunehmende Anwendung von Bronchodilatatoren, insbesondere von inhalativen, kurzwirksamen Beta2-Agonisten, zur Linderung von Symptomen weist auf eine Verschlechterung der Asthmakontrolle hin. Stellen die Patienten fest, dass die Wirkung der Behandlung mit kurzwirksamen Bronchodilatatoren nachlässt oder mehr Inhalationen als gewöhnlich benötigt werden, so ist ärztlicher Rat einzuholen. Die Patienten sollten dann erneut untersucht werden. Eine Steigerung der antiinflammatorischen Therapie (z. B. höhere Dosen inhalativer Kortikosteroide oder Behandlung mit oralen Kortikosteroiden) ist in Betracht zu ziehen.
Schwere Exazerbationen des Asthmas sind auf dem üblichen Weg zu behandeln, z. B. durch Erhöhung der inhalierten Beclometasondipropionat-Dosis und ggf. durch Gabe eines systemischen Steroids und/oder ggf. eines Antibiotikums sowie Behandlung mit einem Beta2-Agonisten.
Mit allen inhalativen Kortikosteroiden können systemische Wirkungen auftreten, vor allem bei Gabe hoher Dosen über längere Zeiträume. Die Wahrscheinlichkeit, dass diese Wirkungen auftreten, ist deutlich geringer als bei oralen Kortikosteroiden. Als systemische Effekte sind unter anderem möglich: Suppression der Hypothalamus-Hypophysen-Nebennierenrinden-(HNR)-Funktion, Wachstumsverzögerung bei Kindern und Jugendlichen, Abnahme der Knochenmineraldichte, Katarakt, Glaukom und seltener auch eine Reihe von Auswirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorische Hyperaktivität, Schlafstörungen, Angstzustände, Depression oder Aggression (vor allem bei Kindern). Deshalb ist es wichtig, bei dem Patienten häufige Kontrollen durchzuführen und die inhalierte Kortikosteroid-Dosis auf die niedrigste Dosis einzustellen, mit der eine wirksame Kontrolle des Asthmas aufrechterhalten wird.
Einige Patienten fühlen sich für ungefähr zwei Wochen nach Absetzen einer Behandlung mit systemischen Kortikosteroiden unwohl, obwohl die Atemwegsfunktion gleich geblieben ist oder sich sogar verbessert hat. Diese Patienten sollten angehalten werden, die Behandlung mit inhalativem Beclometasondipropionat fortzusetzen und das systemische Kortikosteroid weiterhin nicht anzuwenden, sofern nicht objektive klinische Anzeichen einer Nebennierenfunktionsstörung vorliegen.
Wenn Patienten auf SANASTHMAX eingestellt werden, die zuvor über einen längeren Zeitraum oder in einer hohen Dosis mit systemischen Steroiden behandelt wurden, ist besondere Vorsicht geboten, da die Erholung von einer etwaigen Nebennierenrindensuppression eine beträchtliche Zeit in Anspruch nehmen kann. In jedem Fall sollte die Anwendung von Beclometasondipropionat ohne Absetzen der systemischen Behandlung erfolgen; diese sollte nach etwa einer Woche allmählich verringert werden (wobei sich das Ausmaß der Dosisreduzierung nach der Erhaltungsdosis des systemischen Steroids richten sollte). Der Patient ist regelmäßig zu untersuchen (insbesondere mit Tests der Nebennierenrindenfunktion) und die inhalative Beclometasondipropionat-Dosis sollte an die erhaltenen Ergebnisse angepasst werden.
Besondere Sorgfalt ist bei Patienten mit aktiver oder latenter Lungentuberkulose oder anderen Infektionen geboten. Patienten, die an Tuberkulose leiden, sollten während der Behandlung mit Beclometasondipropionat eine tuberkulostatische Therapie erhalten.
Patienten mit viralen oder bakteriellen Infektionen oder Pilzinfektionen der Augen oder des Mundes oder der Atemwege benötigen eine besondere ärztliche Betreuung. Im Fall von bakteriellen Infektionen der Atemwege ist eine adäquate Begleitbehandlung mit Antibiotika erforderlich.
Die Häufigkeit des Auftretens von Candida-Infektionen scheint mit der Höhe der angewendeten Dosis und der Dauer der Behandlung im Zusammenhang zu stehen. Meist spricht die Erkrankung auf eine entsprechende topische antimykotische Therapie an, ohne dass die Behandlung mit Beclometasondipropionat unterbrochen werden muss.
Den Patienten muss geraten werden, sofort nach der Inhalation ihren Mund mit Wasser auszuspülen, um die Häufigkeit des Auftretens von oralen Candida-Infektionen zu verringern.
Eine auftretende Heiserkeit ist reversibel und verschwindet nach Absetzen der Behandlung und/oder nach Schonung der Stimme.
Nach der Inhalation können paradoxe Bronchospasmen mit unmittelbarer Zunahme von Giemen, Kurzatmigkeit und Husten auftreten. Diese Symptome sollten direkt mit einem rasch wirkenden inhalativen Bronchodilatator behandelt werden. SANASTHMAX sollte sofort abgesetzt werden, der Patient ist zu untersuchen und bei Bedarf ist eine alternative Therapie einzuleiten.
Bei Reduzierung oder Absetzen einer oralen Kortikosteroid-Therapie können klinische Merkmale des Churg-Strauss-Syndroms oder hypereosinophiler Zustände aufgedeckt werden.
Die Substitution einer systemischen Steroidbehandlung durch eine Inhalationstherapie kann manchmal auch Allergien aufdecken, z. B. allergische Rhinitis oder Ekzeme, die zuvor von dem systemisch applizierten Arzneimittel unter Kontrolle gehalten wurden. Treten solche Allergien auf, sollte eine symptomatische Behandlung mit Antihistaminika und/oder topischen Arzneimitteln, einschließlich Steroiden zur lokalen Anwendung, erfolgen.
Sehstörung
Bei der systemischen und topischen Anwendung von Kortikosteroiden können Sehstörungen auftreten. Wenn ein Patient mit Symptomen wie verschwommenem Sehen oder anderen Sehstörungen vorstellig wird, sollte eine Überweisung des Patienten an einen Augenarzt zur Bewertung möglicher Ursachen in Erwägung gezogen werden; diese umfassen unter anderem Katarakt, Glaukom oder seltene Erkrankungen, wie z. B. zentrale seröse Chorioretinopathie (CSC), die nach der Anwendung systemischer oder topischer Kortikosteroide gemeldet wurden.
Kinder und Jugendliche
Die Entscheidung über den Therapiebeginn mit Beclometasondipropionat für die Behandlung des wiederkehrenden Giemens bei Kindern im Alter von bis zu 5 Jahren sollte auf der Schwere und Häufigkeit der Giemenepisoden basieren. Regelmäßige Nachuntersuchungen sind erforderlich, um das Ansprechen auf die Behandlung zu überprüfen. Wenn innerhalb von 2 bis 3 Monaten kein Therapieerfolg eintritt oder die Diagnose Asthma nicht bestätigt wird, sollte SANASTHMAX abgesetzt werden, um unnötige Langzeit-Exposition mit inhalierten Kortikosteroiden und die damit assoziierten Risiken für Kinder, einschließlich Wachstumsverzögerung, zu vermeiden (siehe Abschnitt 4.8).
Es wird empfohlen, die Körpergröße von Kindern, die langfristig mit inhalativen Kortikosteroiden behandelt werden, regelmäßig zu überprüfen. Bei Wachstumsverzögerungen sollte die Behandlung überprüft werden mit dem Ziel, die Dosis des inhalativ anzuwendenden Kortikosteroids zu verringern. Der Nutzen der Kortikosteroid-Behandlung und die möglichen Risiken der Wachstumshemmung müssen sorgfältig gegeneinander abgewogen werden. Es sollte in Erwägung gezogen werden, den Patienten an einen pädiatrischen Facharzt für Atemwegserkrankungen zu überweisen.
Es liegen nur unzureichende Daten über die mögliche wachstumsverzögernde Wirkung von inhalativen Kortikosteroiden bei Säuglingen und Kleinkindern unter 2 Jahren vor.
Pharmakokinetische Wechselwirkungen
Es wurden keine konventionellen pharmakokinetischen Studien zu Arzneimittelwechselwirkungen durchgeführt.
Beclometasondipropionat wird sehr rasch über Esterase-Enzyme präsystemisch verstoffwechselt, ohne Beteiligung des Cytochrom-P450-Systems.
Beclomethason ist weniger abhängig vom CYP3A-Metabolismus als einige andere Corticosteroide, und Wechselwirkungen sind im Allgemeinen unwahrscheinlich. Die Möglichkeit systemischer Wirkungen bei der gleichzeitigen Anwendung starker CYP3A-Inhibitoren (z. B. Ritonavir, Cobicistat) kann jedoch nicht ausgeschlossen werden, weshalb bei der Anwendung solcher Mittel Vorsicht geboten ist und eine entsprechende Überwachung empfohlen wird.
Pharmakodynamische Wechselwirkungen
Wird begleitend mit systemischen oder intranasalen Steroiden behandelt, so wirkt sich dies additiv auf den suppressiven Effekt auf die adrenale Funktion aus.
Schwangerschaft
In den veröffentlichten Daten finden sich keine Hinweise auf teratogene Wirkungen bei Schwangeren, die Beclometason inhalativ anwenden. Mögliche Auswirkungen einer Behandlung mit hohen Dosen von inhalativ angewendetem Beclometasondipropionat auf die fetale Entwicklung können allerdings nicht ausgeschlossen werden.
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Der mögliche Nutzen einer Behandlung mit Beclometasondipropionat für die Mutter muss gegen das mögliche Risiko für den Fötus oder das Neugeborene abgewogen werden. Wenn eine Behandlung während der Schwangerschaft erforderlich ist, muss die niedrigste wirksame Dosis Beclometasondipropionat angewendet werden.
Kleinkinder und Säuglinge, deren Mütter während der Schwangerschaft erhebliche Beclometasondipropionat-Dosen erhielten, sollten auf Nebennierenrindensuppression überwacht werden.
Stillzeit
Da Glukokortikoide in die Muttermilch übergehen, kann davon ausgegangen werden, dass auch Beclometasondipropionat und seine Metaboliten in die Muttermilch übergehen. Bei therapeutischen Dosen von Beclometasondipropionat sind allerdings keine Auswirkungen auf gestillte Neugeborene/Kinder zu erwarten.
Es wurden keine schädlichen Auswirkungen durch Glukokortikoide für gestillte Kinder berichtet. Der Nutzen des Stillens überwiegt wahrscheinlich die theoretischen Risiken.
Beclometasondipropionat kann während der Stillzeit angewendet werden. Wenn allerdings eine hohe Dosis Beclometasondipropionat inhalativ angewendet wird, wird empfohlen, nach der Anwendung das Stillen für 4 Stunden zu vermeiden.
Fertilität
Spezifische Untersuchungen zur Sicherheit in Bezug auf die Fertilität beim Menschen wurden mit Beclometasondipropionat nicht durchgeführt. Die Ergebnisse von Tierstudien haben zwar Hinweise auf eingeschränkte Fertilität ergeben, allerdings bei hohen Dosierungen.
SANASTHMAX hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen, die in klinischen Studien unter Einsatz von inhalativ angewendetem Beclometason zur Behandlung des Asthmas und des Giemens beobachtet wurden, waren Laryngitis, Pharyngitis und orale Candidose.
In seltenen Fällen wurden schwere Überempfindlichkeitsreaktionen, wie Ödeme um die Augen, im Gesicht, den Lippen oder im Rachen (Angioödem) berichtet.
Nach der Anwendung können paradoxe Bronchospasmen auftreten.
Tabellarische Auflistung der Nebenwirkungen
Die mit inhaliertem Beclometason zur Behandlung des Asthmas und des Giemens in klinischen Studien beobachteten Nebenwirkungen sind in der folgenden Tabelle gemäß MedDRA nach Häufigkeit und Systemorganklassen aufgeführt: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1.000, <1/100), selten (≥1/10.000, <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
Infektionen und parasitäre Erkrankungen |
Laryngitis, Pharyngitis |
Sehr häufig |
Orale Candidose |
Häufig |
|
Herpes simplex |
*Selten |
|
Endokrine Erkrankungen |
Nebennierenrindensuppression** |
Sehr selten |
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen mit folgenden Ausprägungen: Angioödem, Hautausschlag, Urtikaria, Juckreiz |
*Selten |
Psychiatrische Erkrankungen |
Psychomotorische Hyperaktivität, Schlafstörungen, Angst, Depression, Aggressivität, Verhaltensänderungen (vorwiegend bei Kindern) |
Nicht bekannt |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Gelegentlich |
Tremor |
*Selten |
|
Augenerkrankungen |
Katarakt**, Glaukom** |
Sehr selten |
Verschwommenes Sehen (siehe auch Abschnitt 4.4) |
Nicht bekannt |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten |
Häufig |
Rachenreizung, Dysphonie, Heiserkeit, paradoxer Bronchospasmus, Giemen |
Gelegentlich |
|
Dyspnoe |
*Selten |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Dyspepsie |
Häufig |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Wachstumsverzögerung* (bei Kindern und Jugendlichen), Abnahme der Knochenmineraldichte* |
Sehr selten |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie |
*Selten |
* aus spontanen Nebenwirkungsmeldungen
** systemische Effekte inhalierter Kortikosteroide
Beschreibung ausgewählter Nebenwirkungen
Der systemische Effekt inhalativ angewendeter Kortikosteroide (einschließlich Beclometasondipropionat) kann insbesondere bei Anwendung hoher Dosen über längere Zeiträume auftreten und Folgendes umfassen: Nebennierenrindensuppression, Abnahme der Knochenmineraldichte, Wachstumsverzögerung bei Kindern und Jugendlichen, Katarakt und Glaukom (siehe Abschnitt 4.4).
Maßnahmen zur Verringerung des Auftretens von Candidose, Heiserkeit und paradoxem Bronchospasmus sind beschrieben im Abschnitt 4.4.
Kinder und Jugendliche
Besonders bei Behandlung über längere Zeiträume mit hohen Dosen kann es bei Kindern und Jugendlichen häufiger als bei Erwachsenen zu Wachstumsverzögerungen und Verhaltensauffälligkeiten kommen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger-Allee 3
D-53175 Bonn
Website: http://www.bfarm.de
anzuzeigen.
Die Anwendung von Beclometasondipropionat-Suspension für einen Vernebler über einen längeren Zeitraum in höherer Dosierung als der empfohlenen Dosis könnte zu Suppression der Hypothalamus-Hypophysen-Nebennierenrinden-(HNR)-Funktion führen. Es wird empfohlen, in diesen Fällen die Nebennierenrindenfunktion zu überwachen. Patienten mit Nebennierenrindensuppression sind steroidabhängig und müssen entsprechend mit zusätzlichen systemischen Glukokortikoiden behandelt werden.
Die Behandlung mit SANASTHMAX kann mit der niedrigsten Dosis fortgeführt werden, unter der eine wirksame Krankheitskontrolle (Asthma oder Giemen) aufrechterhalten werden kann (siehe Abschnitt 4.4).
Unter hohen Dosen über einen sehr kurzen Zeitraum kann es zu einer Suppression der Hypothalamus-Hypophysen-Nebennierenrinden (HNR)-Funktion kommen. In diesen Fällen sind keine besonderen Notfallmaßnahmen erforderlich. Die HNR-Achse erholt sich innerhalb von 1 – 2 Tagen.
Pharmakotherapeutische Gruppe: Andere inhalative Mittel bei obstruktiven Atemwegserkrankungen; Glukokortikoide
ATC-Code: R03 BA01.
Wirkmechanismus
Die Affinität von Beclometasondipropionat und seinem aktiven Hauptmetaboliten Beclometasonmonopropionat (B17MP) für den Glukokortikoid-Rezeptor des Menschen wurde bestimmt. Die Wirksamkeit von B17MP ist etwa 30-mal so hoch wie die der Muttersubstanz. Deshalb sind die meisten Wirkungen auf die systemische B17MP-Exposition zurückzuführen.
Pharmakodynamische Wirkungen
Beclometasondipropionat ist ein Glukokortikoid mit starker entzündungshemmender und beschränkter mineralokortikoider Wirkung. Nach Verabreichung in das Respirationssystem durch Inhalation wird eine lokale Wirkung in den unteren Atemwegen erreicht.
Die systemischen pharmakodynamischen Wirkungen von Beclometasondipropionat und seinem aktiven Metabolit B17MP lassen sich durch Bestimmung der Wirkungen auf die Funktion der Hypothalamus-Hypophysen-Nebennierenrinden (HNR)-Achse beurteilen.
Bei gesunden Männern hatte eine mit einem Vernebler verabreichte Beclometasondipropionat -Einzeldosis von 1.600 µg keine Wirkung auf die Kortisolausscheidung im 24-Stunden-Urin, während eine Einzeldosis von 3.200 µg zu einer Reduzierung der Kortisolausscheidung im Urin von etwa 10 % führte, ohne dass es signifikante Unterschiede zwischen den beiden Behandlungen gab. Nach einem 3-wöchigen Behandlungszeitraum, in dem Asthmapatienten über einen Vernebler 1.600 und 3.200 µg pro Tag bei zweimal täglicher Anwendung erhielten, wurde keine signifikante Wirkung auf den morgendlichen Serum-Kortisolspiegel berichtet.
Klinische Wirksamkeit und Sicherheit
Neben der Evidenz, die sich aus dem dauerhaften Einsatz von inhalativ angewendetem Beclometason in der Behandlung von Asthma und Giemen ergibt, stellen die folgenden Informationen eine Sammlung der wichtigsten unterstützenden veröffentlichten Daten dar.
Asthma
Eine Studie, deren Zweck darin bestand, die Wirksamkeit und Sicherheit von SANASTHMAX mit Fluticasonpropionat-Suspension für Vernebler zu vergleichen, wurde bei 205 erwachsenen Asthma-Patienten im Alter zwischen 18-65 Jahren durchgeführt, die in eine zwölfwöchige Behandlungsphase randomisiert wurden. Am Ende der Studie wurde zwischen den zwei Behandlungen eine vergleichbare Wirksamkeit bei der Kontrolle von Asthma in Bezug auf Lungenfunktionstests, Asthma-Exazerbationen, Symptome und die Anwendung der Bedarfsmedikation Salbutamol berichtet (Terzano et al., 2003).
Kinder und Jugendliche
Asthma
In einer multizentrischen, randomisierten, doppelblinden, Double-Dummy-Parallelgruppenstudie wurde die Wirksamkeit und Sicherheit von SANASTHMAX und Beclometasondipropionat, das über Druckgasinhalationssysteme angewendet wurde, bei 151 Patienten im Alter zwischen 6 und 16 Jahren mit mittelschwerem bis schwerem Asthma über 4 Wochen verglichen. Am Ende der Studie wurden für beide Behandlungsgruppen vergleichbare Verbesserungen gegenüber den Ausgangswerten des morgendlichen exspiratorischen Spitzenflusses (primary endpoint), den klinischen Symptom-Scores und der Anwendung der Bedarfsmedikation Salbutamol berichtet. Die zwei Behandlungen wurden gleichermaßen gut vertragen (Bisca et al., 2003).
Die Wirksamkeit und Sicherheit von SANASTHMAX zur Behandlung von schwerem anhaltenden Asthma bei Säuglingen und jungen Kindern im Alter zwischen 6 Monaten bis 6 Jahren im Vergleich zu Budesonid-Suspension zur Verneblung wurden in einer multizentrischen, randomisierten kontrollierten offenen Studie über 14 Wochen untersucht. In der Studie kam es bei 40,4 % der Patienten in der SANASTHMAX-Gruppe und bei 51,7 % der Patienten in der Budesonid-Gruppe zu keinen schwereren Exazerbationen (primary endpoint). Beide Behandlungen gingen mit einer deutlichen Verringerung von nächtlichem Giemen und der Häufigkeit der Tage, an denen Steroide angewendet werden mussten, einher. Die Cortisolwerte im Urin und die Größen- und Gewichtsentwicklung wurden durch beide Behandlungen nicht beeinträchtigt, und es wurde bestätigt, dass SANASTHMAX keine Auswirkungen auf den Knochenmetabolismus hat (Delacourt et al., 2003).
Giemen
SANASTHMAX wurde bei 276 Kindern im Alter zwischen 1 bis 4 Jahren mit häufigem Giemen in einer randomisierten, doppelblinden 12-wöchigen kontrollierten Studie untersucht. Regelmäßige Gabe von SANASTHMAX plus Salbutamol im Bedarfsfall erhöhte signifikant den Anteil an symptomfreien Tagen (primary endpoint, definiert als Abwesenheit von Giemen, Husten, Kurzatmigkeit und nächtlichen Erwachen von Patienten/Eltern in 24 Stunden) (69,6 ± 20,89 [SD]; P = 0,034) vs. Placebo/ Salbutamol im Bedarfsfall (61,0 ± 24,83 [SD]) aber nicht vs. die Kombination SANASTHMAX/ Salbutamol im Bedarfsfall (64,9 ± 24,74 [SD]) ungeachtet der Anwesenheit von Risikofaktoren Asthma zu entwickeln.. Zusätzlich war die Zeitspanne bis zur ersten Exazerbation bei den mit SANASTHMAX behandelten Kindern länger.
In Bezug auf die Sicherheit fanden sich keine Unterschiede in den morgendlichen Cortisolwerten im Speichel (Papi et al., 2009).
Beclometasondipropionat (BDP) ist eine Wirkstoff-Vorstufe, die über Esterase-Enzyme zum aktiven Metaboliten Beclometasonmonopropionat (B17MP), welches der häufigste Metabolit im Plasma ist, hydrolisiert wird.
Resorption
Nach der Inhalation wird BDP unverändert hauptsächlich über die Lungen systemisch resorbiert, bei minimaler oraler Resorption der geschluckten Dosis. Die systemische Resorption des aktiven Hauptmetaboliten B17MP erfolgt sowohl aufgrund von Deponierung in der Lunge als auch durch orale Resorption der geschluckten Dosis. Die Bioverfügbarkeit von oral angewendetem BDP ist vernachlässigbar gering, aber der präsystemische Abbau zu B17MP führt zu einer Resorption von etwa 40 % des geschluckten Anteils von B17MP. Die absolute Bioverfügbarkeit nach der Inhalation beträgt ca. 2 % der Nominaldosis von BDP bzw. 62 % der Nominaldosis von B17MP.
Verteilung
Die Plasmaproteinbindung ist mäßig stark ausgeprägt. Nach intravenöser Anwendung ist die Disposition von BDP und seinem aktiven Metaboliten B17MP durch eine hohe Plasma-Clearance (150 bzw. 120 L/h) und ein geringes Verteilungsvolumen im Steady-State von BDP (20 L) sowie eine breitere Gewebeverteilung seines aktiven Metaboliten (424 L) gekennzeichnet.
Biotransformation
Das hauptsächliche Stoffwechselprodukt ist der aktive Metabolit (B17MP). Es werden auch geringe Mengen der nicht aktiven Metaboliten Beclometason-21-Monopropionat (B21MP) und Beclometason (BOH) gebildet, die jedoch nur geringfügig zur systemischen Exposition beitragen.
Elimination
BDP wird sehr rasch aus dem systemischen Kreislauf ausgeschieden, und zwar über die Verstoffwechselung durch Esterase-Enzyme, die in den meisten Geweben vorhanden sind. Die renale Ausscheidung von BDP und seinen Metaboliten ist minimal. BDP wird hauptsächlich über die Fäzes als polare Metaboliten ausgeschieden. Die terminale Eliminationshalbwertszeit beträgt 0,5 h für BDP und 2,7 h für B17MP.
Linearität/Nicht-Linearität
Die systemische Exposition des aktiven Metaboliten B17MP zeigt einen ungefähr linearen Anstieg parallel zum Anstieg der inhalierten Dosis
Besondere Populationen
Bei Patienten mit Nieren- oder Leberfunktionsstörungen wurde die Pharmakokinetik von BDP nicht untersucht. Da jedoch BDP über Esterase-Enzyme, die in Darmflüssigkeiten, Serum, Lunge und Leber vorhanden sind, sehr rasch zu den stärker polaren Produkten B21MP, B17MP und BOH verstoffwechselt wird, ist nicht zu erwarten, dass die Pharmakokinetik und das Sicherheitsprofil von BDP aufgrund von Leberfunktionsstörungen verändert sind. BDP und seine Metaboliten wurden nicht im Urin festgestellt. Daher ist bei Patienten mit Nierenfunktionsstörung nicht mit einer erhöhten systemischen Exposition zu rechnen.
Die präklinischen toxischen Wirkungen von Beclometasondipropionat waren auf diejenigen beschränkt, die mit einer übermäßigen Ausprägung der anerkannten pharmakologischen Wirkung zusammenhängen.
In Studien zur Toxizität bei wiederholter Gabe hatte die Gabe von Beclometasondipropionat mittels Verneblung an Ratten (für 180 Tage) und Hunde (für 90 Tage) keine Auswirkung auf Körpergewicht, Blutzellen und den Tropismus der Atemwegsschleimhaut. Die Leber- und Nierenfunktionswerte blieben im Normalbereich.
Beclometason erwies sich in Tierversuchen nach subkutaner und oraler Anwendung als teratogen und embryoletal. Tierversuche lassen darauf schließen, dass die Anwendung von Glukokortikoiden während der Schwangerschaft, das Risiko für intrauterine Wachstumsverzögerungen sowie kardiovaskuläre Erkrankungen und/oder Stoffwechselerkrankungen und/oder neurologische Verhaltensstörungen im Erwachsenenalter erhöht.
Beclometasondipropionat hat sich als nicht genotoxisch erwiesen.
In einer 95-wöchigen Studie bei Ratten wurden keine Hinweise auf Kanzerogenität gefunden.
Polysorbat 20
Sorbitanlaurat
Natriumchlorid
Wasser für Injektionszwecke
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
2 Jahre.
Nach dem Öffnen des Beutels die Ampullen innerhalb von 3 Monaten verbrauchen.
Die Ampullen aufrecht in der Originalverpackung (Umkarton) aufbewahren, um den Inhalt vor Licht zu schützen.
Jede Polyethylen-Ampulle enthält 400 Mikrogramm Beclometasondipropionat (Ph.Eur.) in 1 ml Suspension.
Streifen mit 5 Ampullen sind in einem verschweißten Beutel aus PET/Al/PE (Polyethylenterephthalat/Aluminium/Polyethylen) verpackt.
2, 4 oder 8 Beutel sind in einem Umkarton verpackt, d. h. ein Umkarton enthält 10, 20 oder 40 Ampullen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Die Ampullen sind wie folgt zu verwenden:
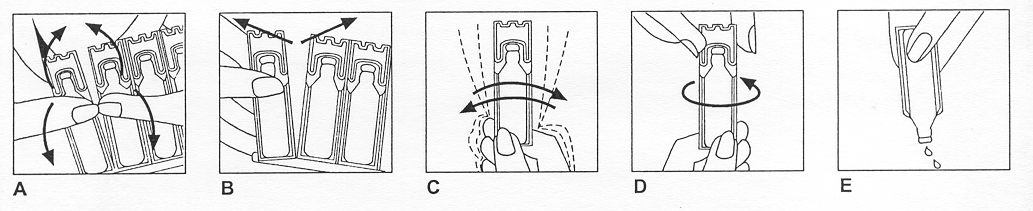 |
1. Die Ampulle nach vorn und hinten biegen (Abbildung A).
2. Vorsichtig eine neue Ampulle zuerst oben, dann in der Mitte von dem Streifen abtrennen (Abbildung B); der Rest bleibt in dem Beutel.
3. Die Ampulle kräftig schütteln und auf den Kopf stellen, damit die Suspension homogen wird. Diesen Vorgang wiederholen, bis sich der ganze Inhalt gleichmäßig verteilt und vermischt hat (Abbildung C).
4. Die Ampulle durch Drehen der Verschlusskappe in Pfeilrichtung öffnen (Abbildung D).
5. Den Inhalt der Ampulle vorsichtig in die Verneblerkammer drücken (Abbildung E).
Die Ampulle darf erst unmittelbar vor der Anwendung geöffnet werden.
Die 400-Mikrogramm-Ampulle ist für den einmaligen Gebrauch vorgesehen.
SANASTHMAX kann verdünnt werden. In diesem Fall den Inhalt der Ampulle in die Verneblerkammer füllen. Dann die erforderliche Menge sterile Natriumchloridlösung 9 mg/ml (0,9 %) hinzugeben.
Den Deckel auf den Vernebler auflegen und vorsichtig schütteln, um den Inhalt zu mischen.
Es darf nur sterile Natriumchloridlösung 9 mg/ml (0,9 %) verwendet werden.
Bei Benutzung, Pflege und Reinigung des Verneblers sind die Herstelleranweisungen zu beachten.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Chiesi GmbH
Ludwig-Erhard-Straße 34
20459 Hamburg
Telefon: 040 89724-0
Telefax: 040 89724-212
E-Mail: info.de@chiesi.com
62894.00.00
20.10.2005/ 18.04.2012
September 2025
Verschreibungspflichtig