Perjeta® 420 mg Konzentrat zur Herstellung einer Infusionslösung
Eine Durchstechflasche mit 14 ml Konzentrat enthält insgesamt 420 mg Pertuzumab in einer Konzentration von 30 mg/ml.
Nach Verdünnung enthält ein ml der Lösung ca. 3,02 mg Pertuzumab für die Initialdosis und ca. 1,59 mg Pertuzumab für die Erhaltungsdosis (siehe Abschnitt 6.6).
Pertuzumab ist ein humanisierter monoklonaler IgG1-Antikörper, der mit rekombinanter DNA-Technologie in Säugetierzellen (Ovarialzellen des chinesischen Hamsters) hergestellt wird.
Sonstiger Bestandteil mit bekannter Wirkung
Jede 14-ml-Durchstechflasche enthält 2,8 mg Polysorbat 20.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Konzentrat zur Herstellung einer Infusionslösung.
Klare bis leicht opaleszente, farblose bis blassgelbe Flüssigkeit.
Brustkrebs im Frühstadium (early breast cancer – EBC)
Perjeta ist zur Anwendung in Kombination mit Trastuzumab und Chemotherapie indiziert zur:
neoadjuvanten Behandlung von erwachsenen Patienten mit HER2-positivem lokal fortgeschrittenem, entzündlichem oder frühem Brustkrebs mit hohem Rezidivrisiko (siehe Abschnitt 5.1).
adjuvanten Behandlung von erwachsenen Patienten mit HER2-positivem frühem Brustkrebs mit hohem Rezidivrisiko (siehe Abschnitt 5.1).
Metastasierter Brustkrebs
Perjeta ist zur Anwendung in Kombination mit Trastuzumab und Docetaxel bei erwachsenen Patienten mit HER2-positivem metastasiertem oder lokal rezidivierendem, inoperablem Brustkrebs indiziert, die zuvor noch keine anti-HER2-Therapie oder Chemotherapie zur Behandlung ihrer metastasierten Erkrankung erhalten haben.
Die Behandlung mit Perjeta darf nur unter Aufsicht eines in der Anwendung antineoplastischer Arzneimittel erfahrenen Arztes begonnen werden. Perjeta sollte von medizinischem Fachpersonal, das in der Behandlung einer Anaphylaxie ausgebildet ist, und in einer Umgebung, in der eine vollständige Ausrüstung zur Wiederbelebung sofort verfügbar ist, angewendet werden.
Dosierung
Patienten, die mit Perjeta behandelt werden, müssen einen HER2-positiven Tumorstatus haben, immunohistochemisch (IHC) definiert durch einen Wert von 3+ und/oder eine In-situ-Hybridisierung (ISH) mit einem Verhältnis von ≥ 2,0, der mit einem validierten Test ermittelt wurde.
Um genaue und reproduzierbare Ergebnisse zu erhalten, müssen die Tests in einem spezialisierten Labor durchgeführt werden, in dem eine Validierung der Testmethoden sichergestellt werden kann. Die vollständige Anleitung zur Durchführung und Auswertung des Tests ist den Packungsbeilagen der validierten HER2-Tests zu entnehmen.
Die empfohlene Initialdosis von Pertuzumab beträgt 840 mg, verabreicht als 60-minütige intravenöse Infusion, gefolgt von Erhaltungsdosen zu 420 mg, die im Abstand von 3 Wochen, jeweils über einen Zeitraum von 30 bis 60 Minuten verabreicht werden. Eine Beobachtungszeit von 30 - 60 Minuten nach Abschluss jeder Infusion wird empfohlen. Diese Beobachtungszeit sollte vor jeder anschließenden Infusion von Trastuzumab oder Chemotherapie abgeschlossen sein (siehe Abschnitt 4.4.).
Perjeta und Trastuzumab sind nacheinander in beliebiger Reihenfolge zu verabreichen und nicht im gleichen Infusionsbeutel zu mischen. Wenn Trastuzumab zusammen mit Perjeta verabreicht wird, wird empfohlen, eines der nachfolgenden 3-wöchigen Schemata für die Verabreichung von Trastuzumab anzuwenden:
intravenöse Infusion mit einer Initialdosis von Trastuzumab 8 mg/kg Körpergewicht, gefolgt von einer Erhaltungsdosis von 6 mg/kg Körpergewicht alle 3 Wochen
oder
Injektion einer subkutanen Fixdosis von Trastuzumab (600 mg) alle 3 Wochen, unabhängig vom Körpergewicht des Patienten.
Bei Patienten, die ein Taxan erhalten, sind Perjeta und Trastuzumab vor dem Taxan zu verabreichen.
Wenn Docetaxel zusammen mit Perjeta verabreicht wird, kann mit einer Docetaxel-Dosis von 75 mg/m² begonnen und diese nachfolgend bis auf 100 mg/m² gesteigert werden, abhängig vom ausgewählten Schema und der Verträglichkeit der Initialdosis. Alternativ kann Docetaxel ab Behandlungsbeginn mit einer Dosis von 100 mg/m² alle 3 Wochen verabreicht werden, ebenfalls abhängig vom ausgewählten Schema. Wird ein carboplatinbasiertes Schema angewendet, beträgt die empfohlene Dosis von Docetaxel durchgängig 75 mg/m² (keine Dosissteigerung). Wenn im adjuvanten Setting eine Verabreichung zusammen mit Perjeta erfolgt, beträgt die empfohlene Dosis von Paclitaxel 80 mg/m² einmal wöchentlich über 12 wöchentliche Zyklen.
Bei Patienten, die eine anthrazyklinbasierte Therapie erhalten, sind Perjeta und Trastuzumab nach Abschluss der vollständigen Anthrazyklintherapie zu verabreichen (siehe Abschnitt 4.4).
Metastasierter Brustkrebs
Perjeta ist in Kombination mit Trastuzumab und Docetaxel zu verabreichen. Die Behandlung mit Perjeta und Trastuzumab kann bis zur Krankheitsprogression oder dem Auftreten nicht beherrschbarer Toxizität weitergeführt werden, auch wenn die Gabe von Docetaxel beendet wird.
Brustkrebs im Frühstadium
Im neoadjuvanten Setting ist Perjeta über 3 bis 6 Zyklen in Kombination mit Trastuzumab und Chemotherapie als Teil eines vollständigen Behandlungsschemas des frühen Brustkrebses zu verabreichen (siehe Abschnitt 5.1).
Im adjuvanten Setting ist Perjeta in Kombination mit Trastuzumab für insgesamt ein Jahr (bis zu 18 Zyklen oder bis zum Rezidiv oder bis zum Auftreten nicht beherrschbarer Toxizität, je nachdem, was zuerst eintritt) als Teil eines vollständigen Behandlungsschemas bei Brustkrebs im Frühstadium, unabhängig vom Zeitpunkt der Operation, zu verabreichen. Die Behandlung sollte eine anthrazyklin- und/oder eine taxanbasierte Standardchemotherapie einschließen. Perjeta und Trastuzumab sind an Tag 1 des ersten taxanhaltigen Zyklus zu starten und sollten auch dann weitergeführt werden, wenn die Chemotherapie beendet wird.
Verspätete oder versäumte Dosen
Für Empfehlungen bezüglich verspäteter oder versäumter Dosen, siehe Tabelle 1.
Tabelle 1: Empfehlungen bezüglich verspäteter oder versäumter Dosen
Zeitraum zwischen zwei aufeinanderfolgenden Infusionen |
Perjeta |
Trastuzumab |
|
intravenös |
subkutan |
||
< 6 Wochen |
Die 420 mg Dosis Pertuzumab ist so bald wie möglich zu verabreichen. Nicht bis zur nächsten geplanten Dosis warten. Anschließend zum ursprünglich geplanten Schema zurückkehren. |
Die intravenöse 6 mg/kg Dosis Trastuzumab ist so bald wie möglich zu verabreichen. Nicht bis zur nächsten geplanten Dosis warten. Anschließend zum ursprünglich geplanten Schema zurückkehren. |
Die Fixdosis von 600 mg Trastuzumab subkutan ist so bald wie möglich zu verabreichen. Nicht bis zur nächsten geplanten Dosis warten. |
≥ 6 Wochen |
Die 840 mg Initialdosis Pertuzumab ist als 60-minütige Infusion erneut zu verabreichen, gefolgt von einer intravenösen Erhaltungsdosis von 420 mg alle 3 Wochen. |
Die intravenöse Initialdosis von 8 mg/kg Trastuzumab ist als etwa 90-minütige Infusion erneut zu verabreichen, gefolgt von einer intravenösen Erhaltungsdosis von 6 mg/kg alle 3 Wochen. |
|
Dosisanpassungen
Eine Dosisreduktion von Perjeta oder Trastuzumab wird nicht empfohlen. Zu Einzelheiten bezüglich Trastuzumab, siehe entsprechende Zusammenfassung der Merkmale des Arzneimittels (SmPC).
Patienten können die Therapie bei Auftreten einer reversiblen, Chemotherapie-induzierten Myelosuppression fortsetzen, sollen aber während dieser Zeit engmaschig auf Komplikationen einer Neutropenie überwacht werden. Dosisanpassungen von Docetaxel und anderen Chemotherapeutika sind den entsprechenden SmPCs zu entnehmen.
Wenn die Behandlung mit Trastuzumab abgebrochen wird, sollte auch die Behandlung mit Perjeta abgebrochen werden.
Linksventrikuläre Dysfunktion
Perjeta und Trastuzumab sind für mindestens 3 Wochen abzusetzen, wenn Zeichen und Symptome auftreten, die auf eine kongestive Herzinsuffizienz hinweisen. Perjeta sollte abgesetzt werden, wenn eine symptomatische Herzinsuffizienz bestätigt wurde (siehe Abschnitt 4.4 für weitere Details).
Patienten mit metastasiertem Brustkrebs
Die Patienten sollen vor Behandlung eine linksventrikuläre Auswurffraktion (LVEF) von ≥ 50 % aufweisen. Perjeta und Trastuzumab sind für mindestens 3 Wochen abzusetzen, bei
Absinken der LVEF auf unter 40 %
einer LVEF von 40 % – 45 % verbunden mit einem Absinken von ≥ 10-%-Punkten unter den Ausgangswert vor Behandlungsbeginn.
Die Behandlung mit Perjeta und Trastuzumab kann wieder aufgenommen werden, wenn die LVEF wieder auf > 45 % gestiegen ist, oder auf 40 % – 45 % verbunden mit einer Differenz von < 10-%-Punkten unter die Ausgangswerte vor Behandlungsbeginn.
Patienten mit Brustkrebs im Frühstadium
Die Patienten sollen vor Behandlung eine LVEF von ≥ 55 % aufweisen (≥ 50 % nach Beendigung der Anthrazyklin-Komponente der Chemotherapie, wenn zutreffend). Perjeta und Trastuzumab sind für mindestens 3 Wochen abzusetzen, bei:
Rückgang der LVEF auf weniger als 50 % verbunden mit einem Absinken von ≥ 10-%-Punkten unter die Ausgangswerte vor Behandlungsbeginn.
Die Behandlung mit Perjeta und Trastuzumab kann wieder aufgenommen werden, wenn die LVEF wieder auf ≥ 50 % gestiegen ist oder eine Differenz von < 10-%-Punkten unter den Ausgangswerten vor Behandlungsbeginn vorliegt.
Ältere Patienten
Bei Patienten im Alter von ≥ 65 und < 65 Jahren wurden keine generellen Unterschiede bezüglich der Wirksamkeit von Perjeta beobachtet. Bei älteren Patienten ≥ 65 Jahren ist keine Dosisanpassung erforderlich. Zu Patienten > 75 Jahre liegen nur begrenzte Daten vor. Zur Bewertung der Sicherheit von Perjeta bei älteren Patienten siehe Abschnitt 4.8.
Nierenfunktionsstörung
Bei Patienten mit leichter oder mäßiger Nierenfunktionsstörung ist keine Dosisanpassung von Pertuzumab erforderlich. Für Patienten mit schwerer Nierenfunktionsstörung können aufgrund der begrenzten verfügbaren pharmakokinetischen Daten keine Dosierungsempfehlungen gegeben werden (siehe Abschnitt 5.2).
Leberfunktionsstörung
Die Sicherheit und Wirksamkeit von Perjeta wurde bei Patienten mit Leberfunktionsstörung nicht untersucht. Es können keine spezifischen Dosierungsempfehlungen gegeben werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Perjeta wurde bei Kindern und Jugendlichen unter 18 Jahren nicht untersucht. Für das Anwendungsgebiet Brustkrebs gibt es in der pädiatrischen Population keinen relevanten Einsatz von Perjeta.
Art der Anwendung
Perjeta wird als intravenöse Infusion verabreicht. Es darf nicht als intravenöse Druck- oder Bolusinjektion verabreicht werden. Hinweise zur Verdünnung von Perjeta vor der Anwendung, siehe Abschnitte 6.2 und 6.6.
Die empfohlene Infusionsdauer für die Initialdosis beträgt 60 Minuten. Wenn die erste Infusion gut vertragen wird, können alle nachfolgenden Infusionen über eine Dauer von 30 Minuten bis 60 Minuten verabreicht werden (siehe Abschnitt 4.4).
Infusionsreaktionen
Wenn der Patient eine Infusionsreaktion entwickelt, kann die Infusionsrate verlangsamt oder die Infusion unterbrochen werden (siehe Abschnitt 4.8). Sobald die Symptome abklingen, kann die Infusion wieder aufgenommen werden. Behandlungen mit Sauerstoff, Beta-Agonisten, Antihistaminika, schnelle i.v.-Flüssigkeitszufuhr und Antipyretika können ebenso zur Linderung der Symptome beitragen.
Überempfindlichkeitsreaktionen/Anaphylaxie
Die Infusion sollte sofort und dauerhaft abgebrochen werden, wenn der Patient eine schwere Reaktion vom Grad 4 gemäß NCI-CTCAE-Kriterien (Anaphylaxie), Bronchospasmus oder ein akutes respiratorisches Distresssyndrom entwickelt (siehe Abschnitt 4.4).
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Linksventrikuläre Dysfunktion (inklusive kongestiver Herzinsuffizienz)
Ein Absinken der LVEF wurde bei Arzneimitteln berichtet, die die HER2-Aktivität hemmen, so auch bei Perjeta. Die Inzidenz symptomatischer linksventrikulärer systolischer Dysfunktion (LVD [kongestive Herzinsuffizienz]) war bei Patienten, die mit Perjeta in Kombination mit Trastuzumab und Chemotherapie behandelt wurden höher als bei Patienten, die nur mit Trastuzumab und Chemotherapie behandelt wurden. Patienten, die im Vorfeld Anthrazykline oder eine Strahlentherapie des Brustraums erhalten hatten, können ein höheres Risiko für ein Absinken der LVEF haben. Die Mehrzahl der Fälle symptomatischer Herzinsuffizienz, über die im adjuvanten Setting berichtet wurde, trat bei Patienten mit anthrazyklinbasierter Chemotherapie auf (siehe Abschnitt 4.8).
Perjeta wurde bei Patienten mit folgenden Charakteristika nicht untersucht: LVEF-Werte von < 50 % vor der Behandlung; kongestiver Herzinsuffizienz (CHF) in der Anamnese; Absinken der LVEF auf < 50 % während einer vorangegangenen adjuvanten Therapie mit Trastuzumab; oder Zuständen, die die linksventrikuläre Funktion beeinträchtigen können, wie z. B. nicht kontrollierte Hypertonie, kürzlich erfolgter Myokardinfarkt, schwerwiegende behandlungsbedürftige Herzrhythmusstörungen oder eine vorangegangene kumulative Anthrazyklin-Exposition von > 360 mg/m² mit Doxorubicin oder einem Äquivalent.
Die LVEF muss vor dem Behandlungsbeginn mit Perjeta und während der Behandlung mit Perjeta in regelmäßigen Abständen (z. B. im neoadjuvanten Setting einmal, im adjuvanten oder metastasierten Setting alle 12 Wochen) untersucht werden, um sicherzustellen, dass sie im Normalbereich liegt. Wenn die LVEF wie in Abschnitt 4.2 beschrieben gesunken ist und sich nicht verbessert hat, oder in den nachfolgenden Untersuchungen weiter gesunken ist, sollte ernsthaft erwogen werden, Perjeta und Trastuzumab abzusetzen, es sei denn, der Nutzen für den einzelnen Patienten überwiegt das Risiko.
Vor der Anwendung von Perjeta mit einem Anthrazyklin sollten Risikofaktoren für ein kardiales Ereignis sorgfältig beachtet und gegen die medizinische Notwendigkeit für den einzelnen Patienten abgewogen werden. Aufgrund der pharmakologischen Wirkungsweise der gegen HER2-gerichteten Wirkstoffe und Anthrazyklinen, kann ein höheres Risiko kardialer Toxizität bei gleichzeitiger Anwendung von Perjeta und Anthrazyklinen angenommen werden als bei sequenzieller Anwendung.
Die sequenzielle Anwendung von Perjeta (in Kombination mit Trastuzumab und einem Taxan) nach Behandlung mit der Epirubicin- oder Doxorubicin-Komponente vieler anthrazyklinbasierter Schemata, wurde in den Studien APHINITY und BERENICE untersucht. Allerdings sind nur begrenzt Sicherheitsdaten zur gleichzeitigen Anwendung von Perjeta und Anthrazyklin vorhanden. In der TRYPHAENA-Studie wurde Perjeta gleichzeitig mit Epirubicin, als Teil des FEC (5-Fluorouracil, Epirubicin, Cyclophosphamid)-Schemas verabreicht (siehe Abschnitte 4.8 und 5.1). Nur Chemotherapie-naive Patienten wurden behandelt und erhielten niedrige kumulative Dosen von Epirubicin (bis zu 300 mg/m2). In dieser Studie war die kardiale Sicherheit vergleichbar mit der von Patienten, die dasselbe Schema, allerdings mit sequenzieller Gabe von Perjeta erhielten (nach FEC-Chemotherapie).
Infusionsreaktionen
Perjeta wurde mit Infusionsreaktionen, einschließlich Ereignissen mit tödlichem Ausgang, in Verbindung gebracht (siehe Abschnitt 4.8). Eine engmaschige Überwachung des Patienten wird während und bis zu 60 Minuten nach Verabreichung der ersten Infusion bzw. während und bis zu 30 – 60 Minuten nach jeder darauffolgenden Infusion von Perjeta empfohlen. Wenn eine bedeutende Infusionsreaktion auftritt, sollte die Infusion verlangsamt oder unterbrochen und eine angemessene medizinische Behandlung eingeleitet werden. Die Patienten sollten untersucht und bis zum vollständigen Abklingen der Anzeichen und Symptome engmaschig überwacht werden. Bei Patienten mit schweren Infusionsreaktionen sollte ein dauerhafter Abbruch der Behandlung erwogen werden. Die klinische Beurteilung sollte darauf beruhen, wie schwer die vorangegangene Reaktion und wie das Ansprechen auf die Behandlung der Nebenwirkung war (siehe Abschnitt 4.2).
Überempfindlichkeitsreaktionen/Anaphylaxie
Die Patienten sollten engmaschig auf Überempfindlichkeitsreaktionen überwacht werden. Bei Anwendung von Perjeta wurden schwere Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie und Ereignisse mit tödlichem Ausgang, beobachtet (siehe Abschnitt 4.8). Arzneimittel zur Behandlung solcher Reaktionen sowie eine Notfallausrüstung sollten zur unmittelbaren Anwendung zur Verfügung stehen. Perjeta muss bei Überempfindlichkeitsreaktionen vom Grad 4 gemäß NCI-CTCAE-Kriterien (Anaphylaxie), Bronchospasmus oder akutem respiratorischem Distresssyndrom dauerhaft abgesetzt werden (siehe Abschnitt 4.2).
Febrile Neutropenie
Patienten, die mit Perjeta, Trastuzumab und Docetaxel behandelt werden, haben im Vergleich zu Patienten, die mit Placebo, Trastuzumab und Docetaxel behandelt werden, vor allem während der ersten 3 Zyklen der Behandlung ein erhöhtes Risiko für eine febrile Neutropenie (siehe Abschnitt 4.8). In der CLEOPATRA-Studie bei metastasiertem Brustkrebs war der Nadir der Neutrophilenzahl bei Patienten, die mit Perjeta behandelt wurden, und bei Patienten, die mit Placebo behandelt wurden, ähnlich. Bei Patienten, die mit Perjeta behandelt wurden, war die höhere Inzidenz febriler Neutropenien mit einer höheren Inzidenz von Mukositis und Diarrhö assoziiert. Eine symptomatische Behandlung der Mukositis und der Diarrhö sollte in Erwägung gezogen werden. Nach Absetzen von Docetaxel wurden keine Ereignisse von febriler Neutropenie berichtet.
Diarrhö
Perjeta kann schwere Diarrhö hervorrufen. Diarrhö tritt am häufigsten während einer gleichzeitigen Therapie mit Taxanen auf. Ältere Patienten (≥ 65 Jahre) haben ein größeres Risiko für das Auftreten von Diarrhö als jüngere Patienten (< 65 Jahre). Eine Diarrhö sollte gemäß klinischer Praxis und Richtlinien behandelt werden. Eine frühe Intervention mit Loperamid, Flüssigkeit und Elektrolytersatz ist, insbesondere bei älteren Patienten und im Falle von schwerer oder länger andauernder Diarrhö, in Erwägung zu ziehen. Wenn keine Verbesserung des Zustandes des Patienten erreicht werden kann, sollte eine Unterbrechung der Behandlung mit Pertuzumab in Erwägung gezogen werden. Wenn die Diarrhö unter Kontrolle ist, kann die Behandlung mit Pertuzumab wieder aufgenommen werden.
Sonstige Bestandteile mit bekannter Wirkung
Perjeta enthält Polysorbat 20. Jede 14-ml-Durchstechflasche enthält 2,8 mg Polysorbat 20. Polysorbate können allergische Reaktionen hervorrufen.
In einer Substudie der randomisierten Zulassungsstudie CLEOPATRA bei metastasiertem Brustkrebs mit 37 Patienten wurden keine pharmakokinetischen (PK) Wechselwirkungen zwischen Pertuzumab und Trastuzumab oder zwischen Pertuzumab und Docetaxel beobachtet. Zusätzlich ergab die populationspharmakokinetische Analyse keine Anzeichen für Arzneimittelwechselwirkungen zwischen Pertuzumab und Trastuzumab oder zwischen Pertuzumab und Docetaxel. Das Fehlen von Arzneimittelwechselwirkungen wurde durch pharmakokinetische Daten aus den NEOSPHERE- und APHINITY-Studien bestätigt.
In fünf Studien wurde die Wirkung von Pertuzumab auf die PK gleichzeitig verabreichter zytotoxischer Substanzen (Docetaxel, Paclitaxel, Gemcitabin, Capecitabin, Carboplatin und Erlotinib) evaluiert. Sie ergaben keine Hinweise auf pharmakokinetische Wechselwirkungen zwischen Pertuzumab und einer dieser Substanzen. Die PK von Pertuzumab war in diesen Studien mit der in Monotherapie-Studien beobachteten vergleichbar.
Kontrazeption
Frauen im gebärfähigen Alter sollten während sie Perjeta erhalten und in den 6 Monaten nach der letzten Dosis von Pertuzumab eine effiziente Kontrazeption durchführen.
Schwangerschaft
Zur Anwendung von Pertuzumab bei Schwangeren liegen limitierte Daten vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Perjeta wird nicht zur Anwendung während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Kontrazeption durchführen, empfohlen.
Stillzeit
Da menschliches IgG in die Muttermilch übergeht und das Potenzial zur Resorption und Schädigung des Säuglings nicht bekannt ist, muss, unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Behandlung mit Perjeta für die Mutter, die Entscheidung getroffen werden, entweder das Stillen oder die Behandlung abzubrechen (siehe Abschnitt 5.2).
Fertilität
Es wurden keine spezifischen tierexperimentellen Studien zur Bewertung der Wirkung von Pertuzumab auf die Fertilität durchgeführt. Aus Toxizitätsstudien mit wiederholter Gabe bei Cynomolgus-Affen, konnten keine definitiven Schlussfolgerungen bezüglich Nebenwirkungen auf männliche Fortpflanzungsorgane gezogen werden. Bei Exposition von geschlechtsreifen weiblichen Cynomolgus-Affen gegenüber Pertuzumab wurden keine Nebenwirkungen beobachtet (siehe Abschnitt 5.3).
Auf Grundlage von berichteten Nebenwirkungen hat Perjeta einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Während der Behandlung mit Perjeta kann es zu Schwindelgefühl kommen (siehe Abschnitt 4.8). Patienten mit Infusionsreaktionen sollen angewiesen werden, bis zum Abklingen der Symptome kein Fahrzeug zu führen und keine Maschinen zu bedienen.
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von Perjeta wurde bei mehr als 6 000 Patienten in Phase-I, -II und -III Studien bei Patienten mit unterschiedlichen Tumorerkrankungen untersucht, von denen die meisten mit Perjeta in Kombination mit anderen antineoplastischen Wirkstoffen behandelt wurden. Zu diesen Studien zählen die zulassungsrelevanten Studien CLEOPATRA (n = 808), NEOSPHERE (n = 417), TRYPHAENA (n = 225) und APHINITY (n = 4 804) [zusammengefasst in Tabelle 2]. Die Sicherheit von Perjeta war in allen Studien vergleichbar, wobei die Inzidenz und die am häufigsten auftretenden Nebenwirkungen variierten, je nachdem ob Perjeta als Monotherapie oder in Kombination mit antineoplastischen Substanzen verabreicht wurde.
Tabelle der Nebenwirkungen
Tabelle 2 fasst die Nebenwirkungen in den mit Perjeta behandelten Gruppen der folgenden zulassungsrelevanten klinischen Studien zusammen:
CLEOPATRA, in der Patienten mit metastasiertem Brustkrebs Perjeta in Kombination mit Docetaxel und Trastuzumab erhielten (n = 453),
NEOSPHERE (n = 309) und TRYPHAENA (n = 218), in denen Patienten mit lokal fortgeschrittenem, entzündlichem oder frühem Brustkrebs neoadjuvant Perjeta in Kombination mit Trastuzumab und Chemotherapie erhielten,
APHINITY, in der Patienten mit frühem Brustkrebs adjuvant Perjeta in Kombination mit Trastuzumab und einer anthrazyklinbasierten oder nicht-anthrazyklinbasierten, taxanhaltigen Chemotherapie erhielten (n = 2 364).
Zusätzlich sind Nebenwirkungen, die nach der Markteinführung berichtet wurden, in Tabelle 2 aufgeführt. Da in diesen Studien Perjeta in Kombination mit Trastuzumab und Chemotherapie angewendet wurde, ist es schwierig, den kausalen Zusammenhang zwischen einem unerwünschten Ereignis und einem bestimmten Arzneimittel mit Sicherheit herzustellen.
Die Nebenwirkungen sind nachfolgend gemäß MedDRA nach Systemorganklasse und den folgenden Häufigkeitskategorien aufgelistet:
Sehr häufig (≥ 1/10)
Häufig (≥ 1/100, < 1/10)
Gelegentlich (≥ 1/1 000, < 1/100)
Selten (≥ 1/10 000, < 1/1 000)
Sehr selten (< 1/10 000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Innerhalb jeder Häufigkeitsgruppe und Systemorganklasse werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Die häufigsten Nebenwirkungen (≥ 30 %) aus den zusammengefassten Daten waren Diarrhö, Alopezie, Übelkeit, Fatigue, Neutropenie und Erbrechen. Die häufigsten Nebenwirkungen gemäß NCI-CTCAE-Kriterien Grad 3 - 4 (≥ 10 %) waren Neutropenie und febrile Neutropenie.
Tabelle 2: Zusammenfassung von Nebenwirkungen bei Patienten, die in klinischen Studien mit Perjeta behandelt wurden^ und nach der Markteinführung† berichtete Nebenwirkungen
Systemorganklasse |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Infektionen und parasitäre Erkrankungen |
Nasopharyngitis |
Paronychie |
||
Erkrankungen des Blutes und des Lymphsystems |
Febrile Neutropenie* |
|||
Erkrankungen des Immunsystems |
Infusionsreaktion°°, * |
Überempfindlich-keit°, * |
Anaphylaktische Reaktion°, * |
Zytokin-Freisetzungs-Syndrom°° |
Stoffwechsel- und Ernährungsstörungen |
Verminderter Appetit |
Tumorlyse-syndrom† |
||
Psychiatrische Erkrankungen |
Schlaflosigkeit |
|||
Erkrankungen des Nervensystems |
Periphere Neuropathie |
|||
Augenerkrankungen |
Verstärkte Tränensekretion |
|||
Herzerkrankungen |
Linksventrikuläre Dysfunktion** |
Kongestive Herzinsuffizienz** |
||
Gefäßerkrankungen |
Hitzewallungen |
|||
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten |
Interstitielle Lungenerkrankung |
||
Erkrankungen des Gastrointestinaltrakts |
Diarrhö |
|||
Erkrankungen der Haut und des Unterhautgewebes |
Alopezie |
|||
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Myalgie |
|||
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schleimhautentzündung |
Schüttelfrost |
^ Tabelle 2 zeigt gepoolte Daten aus der Gesamtbehandlungszeit von CLEOPATRA (Datenschnitt 11. Februar 2014; mediane Anzahl an Zyklen von Perjeta war 24); sowie aus dem neoadjuvanten Behandlungszeitraum von NEOSPHERE (mediane Anzahl an Zyklen von Perjeta war in allen Behandlungsarmen 4); sowie TRYPHAENA (mediane Anzahl an Zyklen von Perjeta in allen Behandlungsarmen war 3 – 6); sowie aus dem Behandlungszeitraum von APHINITY (mediane Anzahl an Zyklen von Perjeta war 18).
* Nebenwirkungen mit tödlichem Ausgang wurden berichtet.
** Für die Gesamtbehandlungszeit in allen 4 Studien. Die Inzidenz von linksventrikulärer Dysfunktion und kongestiver Herzinsuffizienz stellen die in den jeweiligen Studien berichteten MedDRA Preferred Terms dar.
° Überempfindlichkeit/anaphylaktische Reaktion basiert auf einer Gruppe von Begriffen.
°° Infusionsreaktion beinhaltet eine Reihe unterschiedlicher Begriffe innerhalb eines Zeitfensters, siehe „Beschreibung ausgewählter Nebenwirkungen“ unten.
† Nebenwirkungen, die nach der Markteinführung berichtet wurden.
Beschreibung ausgewählter Nebenwirkungen
Linksventrikuläre Dysfunktion (LVD)
In der Zulassungsstudie CLEOPATRA bei metastasiertem Brustkrebs war die Inzidenz von LVD während der Behandlung in der mit Placebo behandelten Gruppe höher als in der mit Perjeta behandelten Gruppe (8,6 % bzw. 6,6 %). Die Inzidenz symptomatischer LVD war in der mit Perjeta behandelten Gruppe ebenfalls niedriger (1,8 % in der mit Placebo behandelten Gruppe gegenüber 1,5 % in der mit Perjeta behandelten Gruppe) (siehe Abschnitt 4.4).
In der neoadjuvanten NEOSPHERE-Studie, in der die Patienten 4 Zyklen Perjeta als neoadjuvante Behandlung erhielten, war die Inzidenz von LVD (während des gesamten Behandlungszeitraums) in der mit Perjeta, Trastuzumab und Docetaxel behandelten Gruppe höher (7,5 %) als in der mit Trastuzumab und Docetaxel behandelten Gruppe (1,9 %). In der mit Perjeta und Trastuzumab behandelten Gruppe gab es einen Fall von symptomatischer LVD.
In der neoadjuvanten TRYPHAENA-Studie betrug die Inzidenz von LVD (während des gesamten Behandlungszeitraums) in der mit Perjeta plus Trastuzumab und FEC (5-Fluorouracil, Epirubicin, Cyclophosphamid), gefolgt von Perjeta plus Trastuzumab und Docetaxel behandelten Gruppe 8,3 %, in der nach FEC mit Perjeta plus Trastuzumab und Docetaxel behandelten Gruppe 9,3 % und in der mit Perjeta in Kombination mit TCH (Docetaxel, Carboplatin und Trastuzumab) behandelten Gruppe 6,6 %. Die Inzidenz symptomatischer LVD (kongestive Herzinsuffizienz) betrug 1,3 % in der nach FEC mit Perjeta plus Trastuzumab und Docetaxel behandelten Gruppe (ausgenommen eine Patientin, bei der es während der FEC-Behandlung zu symptomatischer LVD kam, bevor sie Perjeta plus Trastuzumab und Docetaxel erhielt) und ebenfalls 1,3 % in der mit Perjeta in Kombination mit TCH behandelten Gruppe. Bei keinem Patienten der mit Perjeta plus Trastuzumab und FEC, gefolgt von Perjeta plus Trastuzumab und Docetaxel behandelten Gruppe trat eine symptomatische LVD auf.
In der neoadjuvanten Phase der Studie BERENICE betrug die Inzidenz von NYHA Klasse III/IV symptomatischer LVD (kongestive Herzinsuffizienz gemäß NCI-CTCAE-Kriterien v.4) 1,5 % in der Gruppe, die mit dosisintensiviertem Doxorubicin und Cyclophosphamid (AC), gefolgt von Perjeta plus Trastuzumab und Paclitaxel behandelt wurde. Bei keinem der Patienten (0 %) aus der Gruppe, die mit FEC, gefolgt von Perjeta in Kombination mit Trastuzumab und Docetaxel behandelt wurde, trat eine symptomatische LVD auf. Die Inzidenz asymptomatischer LVD (Abnahme der Auswurffraktion gemäß NCI-CTCAE-Kriterien v.4) lag bei 7 % in der Gruppe, die dosisintensiviertes AC, gefolgt von Perjeta plus Trastuzumab und Paclitaxel erhielt, und 3,5 % in der Gruppe, die FEC, gefolgt von Perjeta plus Trastuzumab und Docetaxel erhielt.
In der APHINITY-Studie betrug die Inzidenz von symptomatischer Herzinsuffizienz (NYHA Klasse III oder IV) mit einem LVEF-Rückgang von mindestens 10-%-Punkten vom Ausgangswert und auf < 50 % weniger als 1 % (0,8 % der mit Perjeta behandelten Patienten vs. 0,4 % der mit Placebo behandelten Patienten). Von den Patienten mit symptomatischer Herzinsuffizienz hatten sich 62,5 % der mit Perjeta behandelten Patienten und 66,7 % der mit Placebo behandelten Patienten zum Datenschnitt erholt (definiert als 2 aufeinanderfolgende LVEF-Messungen über 50 %). Die Mehrzahl der Ereignisse wurde in der Gruppe der mit Anthrazyklin behandelten Patienten berichtet. Ein asymptomatisches oder schwach symptomatisches (NYHA Klasse II) Absinken der LVEF von mindestens 10-%-Punkten vom Ausgangswert und auf < 50 % wurde in 2,7 % der mit Perjeta behandelten Patienten und bei 2,9 % der mit Placebo behandelten Patienten berichtet, von denen sich zum Datenschnitt 84,4 % der mit Perjeta behandelten und 87,0 % der mit Placebo behandelten Patienten erholt hatten.
Infusionsreaktionen
Als Infusionsreaktion wurde in den Zulassungsstudien jedes Ereignis definiert, das als Überempfindlichkeit, anaphylaktische Reaktion, akute Infusionsreaktion oder Zytokin-Freisetzungs-Syndrom berichtet wurde und das während einer Infusion oder am Tag der Infusion auftrat. In der Zulassungsstudie CLEOPATRA wurde die Initialdosis Perjeta am Tag vor der Anwendung von Trastuzumab und Docetaxel verabreicht, damit mit Perjeta assoziierte Nebenwirkungen untersucht werden konnten. Am ersten Tag, an dem nur Perjeta verabreicht wurde, lag die Gesamthäufigkeit von Infusionsreaktionen in der mit Placebo behandelten Gruppe bei 9,8 % und in der mit Perjeta behandelten Gruppe bei 13,2 %. Hierbei war die Mehrzahl der Infusionsreaktionen leicht oder mäßig. Die häufigsten Infusionsreaktionen (≥ 1,0 %) in der mit Perjeta behandelten Gruppe waren Fieber, Schüttelfrost, Fatigue, Kopfschmerzen, Asthenie, Überempfindlichkeit und Erbrechen.
Während des zweiten Zyklus, bei dem alle Arzneimittel am selben Tag verabreicht wurden, waren die häufigsten Infusionsreaktionen (≥ 1,0 %) in der mit Perjeta behandelten Gruppe Fatigue, Dysgeusie, Arzneimittelüberempfindlichkeit, Myalgie und Erbrechen (siehe Abschnitt 4.4).
In Studien mit neoadjuvantem und adjuvantem Setting wurde Perjeta in allen Zyklen am selben Tag verabreicht, wie die anderen Studienbehandlungen. Infusionsreaktionen traten bei 18,6 % - 25,0 % der Patienten am ersten Tag der Perjeta Gabe (in Kombination mit Trastuzumab und Chemotherapie) auf. Art und Schweregrad der Ereignisse stimmten mit jenen überein, die in der CLEOPATRA-Studie während der Zyklen beobachtet wurden, in denen Perjeta am selben Tag wie Trastuzumab und Docetaxel verabreicht wurde; dabei handelte es sich meist um leichte oder mäßig schwere Reaktionen.
Überempfindlichkeitsreaktionen/Anaphylaxie
In der Zulassungsstudie CLEOPATRA mit Patienten mit metastasiertem Brustkrebs lag die Gesamthäufigkeit der vom Prüfarzt berichteten Überempfindlichkeits-/Anaphylaxie-Ereignisse während des gesamten Behandlungszeitraums bei den mit Placebo behandelten Patienten bei 9,3 % und bei den mit Perjeta behandelten Patienten bei 11,3 %, davon waren 2,5 % bzw. 2,0 % vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien. Insgesamt kam es in der mit Placebo behandelten Gruppe bei 2 Patienten und in der mit Perjeta behandelten Gruppe bei 4 Patienten zu einem vom Prüfarzt als Anaphylaxie beschriebenen Ereignis (siehe Abschnitt 4.4).
Insgesamt war die Mehrzahl der Überempfindlichkeitsreaktionen von leichtem oder mäßigem Schweregrad und klang nach der Behandlung wieder ab. Auf der Basis der Anpassungen in Bezug auf die Behandlung in den Studien wurden die meisten Reaktionen als eine Folge der Docetaxel-Infusionen bewertet.
In den Studien im neoadjuvanten und adjuvanten Setting stimmten die Überempfindlichkeits- bzw. Anaphylaxie-Ereignisse mit jenen in der CLEOPATRA-Studie überein. In der NEOSPHERE-Studie kam es bei zwei Patienten in der mit Perjeta und Docetaxel behandelten Gruppe zur Anaphylaxie. In der TRYPHAENA-Studie und der APHINITY-Studie war die Gesamthäufigkeit von Überempfindlichkeit/Anaphylaxie in der mit Perjeta und TCH behandelten Gruppe am höchsten (13,2 % bzw. 7,6 %), davon waren 2,6 % bzw. 1,3 % der Ereignisse vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien.
Febrile Neutropenie
In der Zulassungsstudie CLEOPATRA kam es bei der Mehrzahl der Patienten beider Behandlungsgruppen zu mindestens einem Ereignis von Leukopenie (bei 63,0 % der mit Perjeta behandelten Patienten und bei 58,3 % der mit Placebo behandelten Patienten), wovon die meisten Neutropenie-Ereignisse waren (siehe Abschnitt 4.4). Eine febrile Neutropenie trat bei 13,7 % der mit Perjeta behandelten Patienten und bei 7,6 % der mit Placebo behandelten Patienten auf. In beiden Behandlungsgruppen war der Anteil der Patienten, bei denen eine febrile Neutropenie auftrat, im ersten Therapiezyklus am höchsten und nahm danach stetig ab. Bei asiatischen Patienten wurde im Vergleich zu Patienten anderer Bevölkerungsgruppen und anderer geographischer Regionen in beiden Behandlungsgruppen eine erhöhte Inzidenz febriler Neutropenie beobachtet. Bei asiatischen Patienten war die Inzidenz febriler Neutropenie in der mit Perjeta behandelten Gruppe (25,8 %) höher als in der mit Placebo behandelten Gruppe (11,3 %).
In der NEOSPHERE-Studie trat bei 8,4 % der neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten Patienten febrile Neutropenie auf, im Vergleich zu 7,5 % der mit Trastuzumab und Docetaxel behandelten Patienten. In der TRYPHAENA-Studie trat febrile Neutropenie bei 17,1 % der neoadjuvant mit Perjeta + TCH behandelten Patienten auf und bei 9,3 % der mit FEC, gefolgt von neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten Patienten. In der TRYPHAENA-Studie war die Häufigkeit von febriler Neutropenie bei Patienten, die sechs Zyklen Perjeta erhielten, höher als bei Patienten, die drei Zyklen Perjeta erhielten, unabhängig von der verabreichten Chemotherapie. Wie in der CLEOPATRA-Studie wurde in beiden neoadjuvanten Studien bei asiatischen Patienten im Vergleich zu anderen Patienten eine höhere Inzidenz von Neutropenie und febriler Neutropenie beobachtet. In der NEOSPHERE-Studie trat bei 8,3 % der neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten asiatischen Patienten febrile Neutropenie auf, im Vergleich zu 4,0 % der neoadjuvant mit Trastuzumab und Docetaxel behandelten asiatischen Patienten.
In der APHINITY-Studie trat eine febrile Neutropenie bei 12,1 % der mit Perjeta behandelten Patienten und bei 11,1 % der mit Placebo behandelten Patienten auf. Wie in den CLEOPATRA, TRYPHAENA und NEOSPHERE-Studien wurde eine höhere Inzidenz febriler Neutropenien bei mit Perjeta behandelten asiatischen Patienten im Vergleich zu anderen Bevölkerungsgruppen in der APHINITY-Studie beobachtet (15,9 % der mit Perjeta behandelten Patienten und 9,9 % der mit Placebo behandelten Patienten).
Diarrhö
In der Zulassungsstudie CLEOPATRA bei metastasiertem Brustkrebs kam es bei 68,4 % der mit Perjeta behandelten Patienten und bei 48,7 % der mit Placebo behandelten Patienten zu Diarrhö (siehe Abschnitt 4.4). Die meisten Ereignisse waren von leichtem bis mäßigem Schweregrad und traten in den ersten Behandlungszyklen auf. Die Inzidenz von Diarrhö vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien betrug bei den mit Perjeta behandelten Patienten 9,3 %, im Vergleich zu 5,1 % bei den mit Placebo behandelten Patienten. Die mediane Dauer der längsten Episode war bei den mit Perjeta behandelten Patienten 18 Tage und bei den mit Placebo behandelten Patienten 8 Tage. Ereignisse von Diarrhö sprachen gut auf eine proaktive Behandlung mit Antidiarrhoika an.
In der NEOSPHERE-Studie trat bei 45,8 % der neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten Patienten Diarrhö auf, im Vergleich zu 33,6 % der mit Trastuzumab und Docetaxel behandelten Patienten. In der TRYPHAENA-Studie trat Diarrhö bei 72,3 % der neoadjuvant mit Perjeta + TCH behandelten Patienten auf und bei 61,4 % der mit FEC, gefolgt von neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten Patienten. In beiden Studien waren die meisten Ereignisse leicht bis mittelschwer.
In der APHINITY-Studie wurde eine höhere Inzidenz von Diarrhö im mit Perjeta behandelten Arm (71,2 %) verglichen mit dem Placebo Arm (45,2 %) festgestellt. Diarrhö Grad ≥ 3 wurde bei 9,8 % der Patienten im Perjeta Arm vs. 3,7 % im Placebo Arm berichtet. Die Mehrzahl der Ereignisse war vom Schweregrad 1 oder 2. Die höchste Inzidenz von Diarrhö (alle Grade) wurde während des Zeitraums mit zielgerichteter Therapie (targeted therapy) + Taxan-Chemotherapie (61,4 % der Patienten im Perjeta Arm vs. 33,8 % der Patienten im Placebo Arm) berichtet. Die Inzidenz von Diarrhö war nach Ende der Chemotherapie viel geringer und betraf 18,1 % der Patienten im Perjeta Arm vs. 9,2 % der Patienten im Placebo Arm im Post-Chemotherapie Zeitraum mit zielgerichteter Therapie.
Ausschlag
In der Zulassungsstudie CLEOPATRA bei metastasiertem Brustkrebs traten bei 51,7 % der mit Perjeta behandelten Patienten Ausschläge auf, im Vergleich zu 38,9 % der mit Placebo behandelten Patienten. Die meisten Fälle waren vom Schweregrad 1 oder 2, traten während der ersten 2 Zyklen auf und sprachen auf eine Standardbehandlung, wie z. B. eine topische oder orale Akne-Behandlung, an.
In der NEOSPHERE-Studie traten bei 40,2 % der neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelten Patienten Ausschläge auf, im Vergleich zu 29,0 % der mit Trastuzumab und Docetaxel behandelten Patienten. In der TRYPHAENA-Studie traten Ausschläge bei 36,8 % der neoadjuvant mit Perjeta + TCH behandelten Patienten und bei 20,0 % der mit FEC, gefolgt von neoadjuvant Perjeta, Trastuzumab und Docetaxel behandelten Patienten auf. Die Inzidenz von Ausschlägen bei Patienten, die sechs Zyklen Perjeta erhielten, war höher als bei Patienten, die drei Zyklen Perjeta erhielten, unabhängig von der verabreichten Chemotherapie.
In der APHINITY-Studie traten Ausschläge bei 25,8 % der Patienten im Perjeta Arm vs. 20,3 % der Patienten im Placebo Arm als Nebenwirkung auf. Die Mehrzahl der Ausschläge war vom Schweregrad 1 oder 2.
Laborauffälligkeiten
In der Zulassungsstudie CLEOPATRA bei metastasiertem Brustkrebs war die Inzidenz von Neutropenie vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien v.3 zwischen den beiden Behandlungsgruppen ausgeglichen (86,3 % bei den mit Perjeta behandelten Patienten und 86,6 % bei den mit Placebo behandelten Patienten, darunter Neutropenie vom Grad 4 bei 60,7 % bzw. 64,8 % der Patienten).
In der NEOSPHERE-Studie lag die Inzidenz von Neutropenie vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien v.3 bei Patienten, die neoadjuvant mit Perjeta, Trastuzumab und Docetaxel behandelt wurden, bei 74,5 %, verglichen mit 84,5 % bei Patienten, die mit Trastuzumab und Docetaxel behandelt wurden, darunter Neutropenie vom Grad 4 bei 50,9 % bzw. 60,2 %. In der TRYPHAENA-Studie lag die Inzidenz von Neutropenie vom Grad 3 – 4 gemäß NCI-CTCAE-Kriterien v.3 bei Patienten, die neoadjuvant mit Perjeta + TCH behandelt wurden, bei 85,3 % und bei Patienten, die mit FEC, gefolgt von neoadjuvant Perjeta, Trastuzumab und Docetaxel behandelt wurden, bei 77,0 %, darunter Neutropenie vom Grad 4 bei 66,7 % bzw. 59,5 %.
In der APHINITY-Studie lag die Inzidenz von Neutropenie vom Grad 3 - 4 gemäß NCI-CTCAE-Kriterien v.4 bei mit Perjeta, Trastuzumab und Chemotherapie behandelten Patienten bei 40,6 % verglichen mit 39,1 % bei Patienten, die mit Placebo, Trastuzumab und Chemotherapie behandelt wurden, einschließlich 28,3 % bzw. 26,5 % Neutropenien vom Grad 4.
Ältere Patienten
Die Inzidenz der folgenden Nebenwirkungen aller Grade war bei Patienten ≥ 65 Jahre im Vergleich zu Patienten < 65 Jahre mindestens 5 % höher: verminderter Appetit, Anämie, verringertes Gewicht, Asthenie, Dysgeusie, periphere Neuropathie, Hypomagnesiämie und Diarrhö. Zu Patienten > 75 Jahre liegen nur begrenzte Daten vor.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51‑59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
anzuzeigen.
Die maximale verträgliche Dosis von Pertuzumab wurde nicht bestimmt. Einzeldosen von mehr als 25 mg/kg (1 727 mg) wurden in klinischen Studien nicht untersucht.
Im Fall einer Überdosierung sollten Patienten engmaschig auf Anzeichen oder Symptome von Nebenwirkungen überwacht und eine geeignete symptomatische Behandlung eingeleitet werden.
Pharmakotherapeutische Gruppe: Antineoplastische Substanzen, monoklonale Antikörper, ATC-Code: L01FD02
Wirkmechanismus
Pertuzumab ist ein rekombinanter humanisierter monoklonaler Antikörper, der spezifisch an die extrazelluläre Dimerisierungsdomäne (Subdomäne II) des menschlichen epidermalen Wachstumsfaktorrezeptorproteins 2 (HER2) bindet und dabei die ligandenabhängige Heterodimerisierung von HER2 mit anderen Rezeptoren der HER-Rezeptorfamilie, einschließlich EGFR, HER3 und HER4, hemmt. Dadurch hemmt Pertuzumab die ligandenabhängige intrazelluläre Signalübertragung über zwei wesentliche Signalwege, den der mitogenaktivierten Proteinkinase (MAP) und den der Phosphoinositid-3-Kinase (PI3K). Die Hemmung dieser Signalwege kann jeweils zu zellulärem Wachstumsstopp bzw. Apoptose führen. Darüber hinaus ist Pertuzumab ein Mediator für antikörperabhängige zellvermittelte Zytotoxizität (ADCC).
Während Pertuzumab allein die Proliferation menschlicher Tumorzellen hemmte, erhöhte die Kombination von Pertuzumab und Trastuzumab signifikant die antitumorale Aktivität in HER2-überexprimierenden Heterotransplantatmodellen.
Klinische Wirksamkeit und Sicherheit
Die Wirksamkeit von Perjeta bei HER2-positivem Brustkrebs wird gestützt durch eine randomisierte Phase-III Studie und eine einarmige Phase-II Studie bei metastasiertem Brustkrebs, zwei randomisierten neoadjuvanten Phase-II Studien bei Brustkrebs im Frühstadium (eine kontrollierte), einer nicht-randomisierten neoadjuvanten Phase-II Studie und einer randomisierten Phase-III Studie im adjuvanten Setting.
HER2 Überexpression wurde in einem Zentrallabor bestimmt und in den nachfolgend aufgeführten Studien definiert als Wert von 3+ in der IHC oder einem Amplifikationsverhältnis von ≥ 2,0 in der ISH.
Metastasierter Brustkrebs
Anwendung von Perjeta in Kombination mit Trastuzumab und Docetaxel
CLEOPATRA (WO20698) ist eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie mit 808 Patienten mit HER2-positivem metastasiertem oder lokal rezidivierendem, nicht resezierbarem Brustkrebs. Patienten mit klinisch relevanten kardialen Risikofaktoren wurden nicht eingeschlossen (siehe Abschnitt 4.4). Durch den Ausschluss von Patienten mit Hirnmetastasen stehen keine Daten zur Wirkung von Perjeta auf Hirnmetastasen zur Verfügung. Es liegen nur sehr begrenzte Daten zu Patienten mit inoperabler, lokal rezidivierender Erkrankung vor. Die Patienten wurden 1 : 1 randomisiert und erhielten Placebo + Trastuzumab + Docetaxel oder Perjeta + Trastuzumab + Docetaxel.
Perjeta und Trastuzumab wurden in der Standarddosierung im 3-wöchigen Behandlungsschema verabreicht. Patienten wurden bis zur Krankheitsprogression, zum Widerruf des Einverständnisses zur Teilnahme oder zum Auftreten nicht beherrschbarer Toxizität mit Perjeta und Trastuzumab behandelt. Docetaxel wurde als intravenöse Infusion als Initialdosis von 75 mg/m² alle drei Wochen über mindestens 6 Zyklen verabreicht. Wenn die Initialdosis gut vertragen wurde, konnte die Dosis von Docetaxel nach Ermessen des Prüfarztes bis auf 100 mg/m² erhöht werden.
Der primäre Endpunkt der Studie war progressionsfreies Überleben (PFS), bewertet durch eine unabhängige Kontrolleinrichtung (Independent Review Facility - IRF) und definiert als die Zeit vom Zeitpunkt der Randomisierung bis zu Krankheitsprogression oder Tod (aus jeglichen Gründen), wenn der Tod innerhalb von 18 Wochen nach der letzten Tumorbewertung eintrat. Sekundäre Wirksamkeitsendpunkte waren Gesamtüberleben (OS – Overall Survival), PFS (festgestellt durch den Prüfarzt), objektive Ansprechrate (ORR – Objective Response Rate), Dauer des Ansprechens und Zeit bis zum Fortschreiten der Symptome gemäß FACT-B-Fragebogen zur Lebensqualität.
In jeder Behandlungsgruppe hatte ungefähr die Hälfte der Patienten eine Hormonrezeptor-positive Erkrankung (definiert als Östrogenrezeptor [ER]-positiv und/oder Progesteronrezeptor [PgR]-positiv) und ungefähr die Hälfte der Patienten in jeder Behandlungsgruppe hatte eine vorangegangene adjuvante oder neoadjuvante Therapie erhalten. Die meisten dieser Patienten hatten zuvor eine Anthrazyklin-Therapie erhalten und 11 % aller Patienten erhielten zuvor Trastuzumab. Insgesamt hatten 43 % der Patienten aus beiden Behandlungsgruppen zuvor eine Strahlentherapie erhalten. Der mediane Ausgangswert der LVEF der Patienten betrug zu Behandlungsbeginn in beiden Gruppen 65,0 % (Bereich 50 % – 88 %).
Die Ergebnisse zur Wirksamkeit aus der CLEOPATRA-Studie sind in Tabelle 3 zusammengefasst. Eine statistisch signifikante Verbesserung des durch die IRF bewerteten progressionsfreien Überlebens (PFS) wurde in der mit Perjeta behandelten Gruppe im Vergleich zu der mit Placebo behandelten Gruppe gezeigt. Die Ergebnisse des durch den Prüfarzt bewerteten PFS waren ähnlich wie die durch die IRF bewerteten PFS-Ergebnisse.
Tabelle 3: Zusammenfassung der Wirksamkeit aus der CLEOPATRA-Studie
Parameter |
Placebo + |
Perjeta + |
HR |
p-Wert |
Progressionsfreies Überleben |
242 (59 %) 12,4 |
191 (47,5 %) 18,5 |
0,62 |
< 0,0001 |
Gesamtüberleben – sekundärer Endpunkt** |
221 (54,4 %) 40,8 |
168 (41,8 %) 56,5 |
0,68 |
0,0002 |
Objektive Ansprechrate (ORR)^ - sekundärer Endpunkt |
336 233 (69,3 %) |
343 275 (80,2 %) |
Unterschied in der ORR: |
0,0011 |
Dauer des Ansprechens †^ |
233 |
275 |
* Primäre Analyse des progressionsfreien Überlebens, Datenschnitt 13. Mai 2011.
** Ereignisgesteuerte finale Analyse des Gesamtüberlebens, Datenschnitt 11. Februar 2014.
*** Patienten mit bestem Gesamtansprechen auf der Basis eines bestätigten CR oder PR gemäß RECIST.
† Bei Patienten mit bestem Gesamtansprechen in Bezug auf CR oder PR erhoben.
^ Objektive Ansprechrate und Dauer des Ansprechens basieren auf Tumordiagnosen einer IRF.
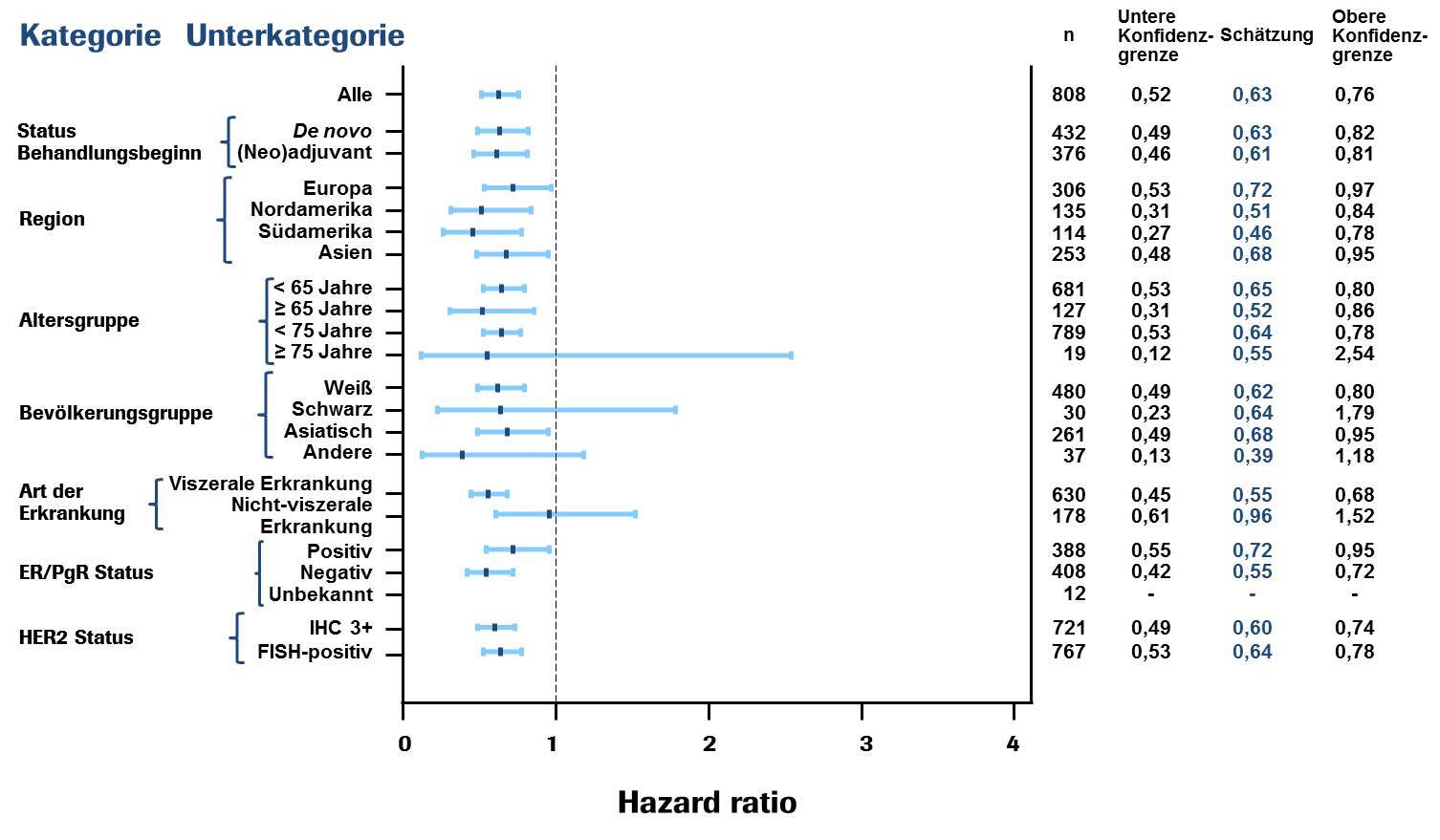
In allen zuvor festgelegten Patienten-Subgruppen, einschließlich der Subgruppen, die auf den Stratifizierungsfaktoren geographische Lage und vorangegangene adjuvante/neoadjuvante Therapie oder neu aufgetretener metastasierter Brustkrebs basierten, wurden konsistente Ergebnisse beobachtet (siehe Abbildung 1). Eine explorative Post-hoc-Analyse ergab für Patienten, die zuvor Trastuzumab erhalten hatten (n = 88), eine Hazard Ratio des durch die IRF-bewerteten PFS von 0,62 (95-%-KI 0,35; 1,07), im Vergleich zu 0,60 (95-%-KI 0,43; 0,83) für Patienten, die zuvor eine Therapie ohne Trastuzumab erhalten hatten (n = 288).
Abbildung 1: Von der IRF bewertetes progressionsfreies Überleben gemäß Patienten-Subgruppe
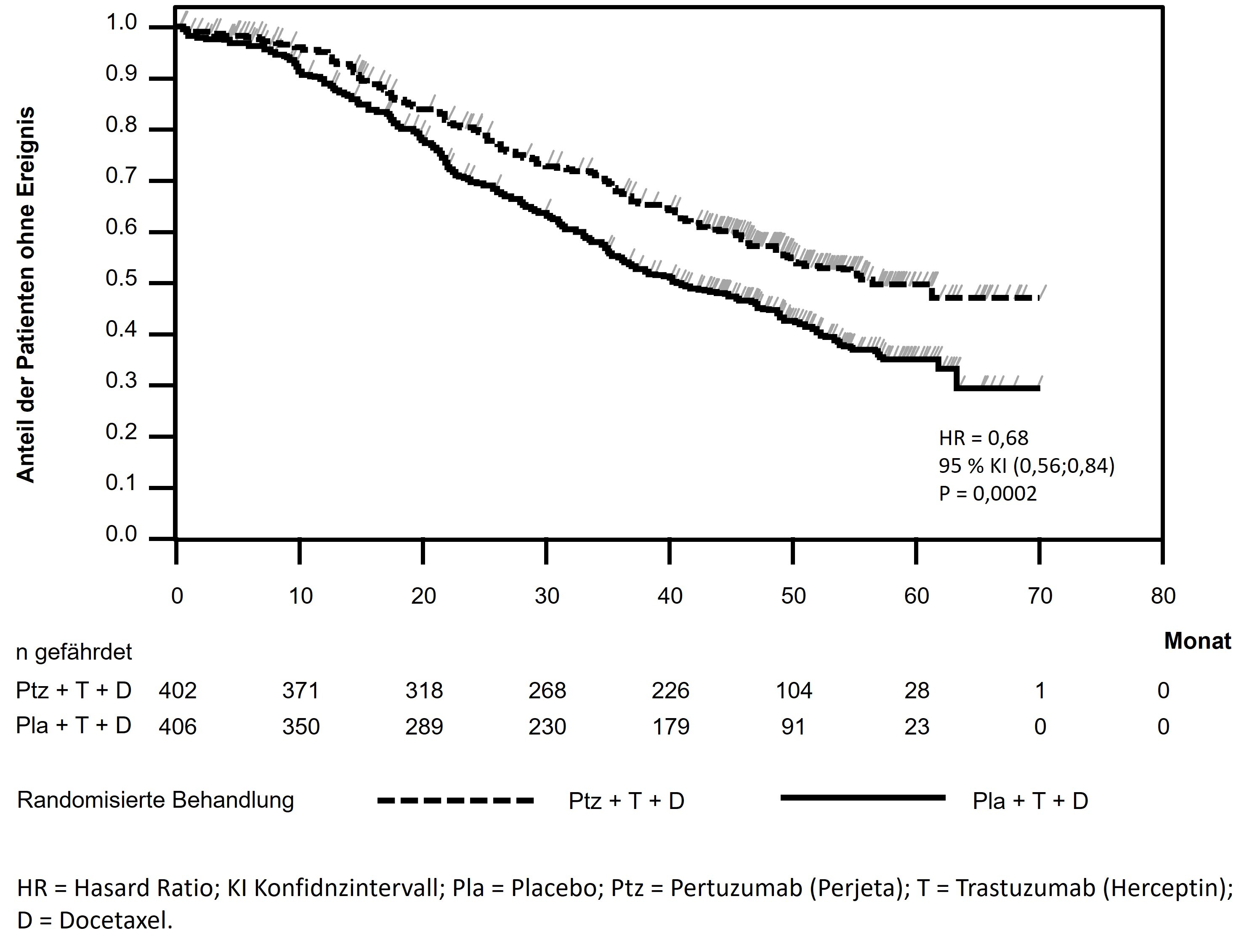
Die ereignisgesteuerte finale OS-Analyse wurde durchgeführt, nachdem 389 Patienten verstorben waren (221 in der mit Placebo behandelten Gruppe und 168 in der mit Perjeta behandelten Gruppe). Der statistisch signifikante OS-Nutzen zu Gunsten der mit Perjeta behandelten Gruppe, der zuvor im Rahmen einer Interimsanalyse des Gesamtüberlebens (durchgeführt ein Jahr nach der primären Analyse) beobachtet worden war, blieb erhalten (HR 0,68, p = 0,0002 Log-Rank-Test). Die mediane Zeit bis zum Tod lag in der mit Placebo behandelten Gruppe bei 40,8 Monaten und in der mit Perjeta behandelten Gruppe bei 56,5 Monaten (siehe Tabelle 3, Abbildung 2).
Eine deskriptive OS-Analyse, die zu Studienende durchgeführt wurde, nachdem 515 Patienten verstorben waren (280 in der mit Placebo behandelten Gruppe und 235 in der mit Perjeta behandelten Gruppe) zeigte, dass der statistisch signifikante OS-Nutzen zu Gunsten der mit Perjeta behandelten Gruppe über die Zeit, mit einer medianen Nachbeobachtung von 99 Monaten (HR 0,69, p < 0,0001 Log-Rank-Test; mediane Zeit bis zum Tod 40,8 Monate [mit Placebo behandelte Gruppe] versus 57,1 Monate [mit Perjeta behandelte Gruppe]), erhalten blieb. Die Überlebensrate nach 8 Jahren (Landmark-Analyse) betrug 37 % in der mit Perjeta behandelten Gruppe und 23 % in der mit Placebo behandelten Gruppe.
Abbildung 2: Kaplan-Meier-Kurve des ereignisgesteuerten Gesamtüberlebens
Zwischen den beiden Behandlungsgruppen wurden gemäß FACT-B TOI-PFB-Bewertung keine statistisch signifikanten Unterschiede im Hinblick auf die gesundheitsbezogene Lebensqualität gefunden.
Zusätzliche unterstützende Informationen aus klinischen Studien
BO17929 – einarmige Studie bei metastasiertem Brustkrebs
Bei BO17929 handelt es sich um eine nicht randomisierte Phase-II-Studie bei Patienten mit metastasiertem Brustkrebs, deren Tumore während der Behandlung mit Trastuzumab progredient waren. Die Behandlung mit Perjeta und Trastuzumab führte zu einer Ansprechrate von 24,2 %, mit weiteren 25,8 % Patienten, bei denen die Stabilisierung der Erkrankung mindestens 6 Monate andauerte, was darauf hinweist, dass Perjeta nach einer Krankheitsprogression unter Trastuzumab wirksam ist.
Brustkrebs im Frühstadium
Neoadjuvante Behandlung
Im neoadjuvanten Setting werden der lokal fortgeschrittene und der entzündliche Brustkrebs als Hochrisikoformen eingestuft, unabhängig vom Hormonrezeptorstatus. Bei frühem Brustkrebs sollten Tumorgröße, Grading, Hormonrezeptorstatus und Lymphknotenmetastasen für die Risikobewertung berücksichtigt werden.
Die Indikation in der neoadjuvanten Brustkrebs-Therapie basiert auf einer nachgewiesenen Verbesserung der Rate der pathologischen Komplettremission sowie einem Trend zur Verbesserung des krankheitsfreien Überlebens, ohne jedoch einen Nutzen im Hinblick auf langfristige Ergebnisse, wie Gesamtüberleben oder krankheitsfreies Überleben, zu untersuchen oder genau zu messen.
NEOSPHERE (WO20697)
Bei NEOSPHERE handelt es sich um eine multizentrische, multinationale, randomisierte, kontrollierte Phase-II-Studie zur Untersuchung von Perjeta, die bei 417 erwachsenen Patientinnen mit neu diagnostiziertem, frühem, entzündlichem oder lokal fortgeschrittenem HER2-positivem Brustkrebs (T2-4d; Primärtumor > 2 cm im Durchmesser), die keine vorangegangene Behandlung mit Trastuzumab, Chemotherapie oder Strahlentherapie erhalten hatten, durchgeführt wurde. Patienten mit Metastasen, beidseitigem Brustkrebs, klinisch bedeutsamen kardialen Risikofaktoren (siehe Abschnitt 4.4) oder LVEF < 55 % wurden nicht eingeschlossen. Die meisten Patienten waren jünger als 65 Jahre.
Die Patienten wurden randomisiert, um eines der folgenden neoadjuvanten Behandlungsschemata über 4 Zyklen vor der Operation zu erhalten:
Trastuzumab plus Docetaxel
Perjeta plus Trastuzumab und Docetaxel
Perjeta plus Trastuzumab
Perjeta plus Docetaxel
Die Randomisierung wurde nach Brustkrebs-Typ (operabel, lokal fortgeschritten oder entzündlich) und ER- oder PgR-Positivität stratifiziert.
Pertuzumab wurde mit einer Anfangsdosis von 840 mg, gefolgt von 420 mg alle drei Wochen intravenös verabreicht. Trastuzumab wurde mit einer Anfangsdosis von 8 mg/kg, gefolgt von 6 mg/kg alle drei Wochen intravenös verabreicht. Docetaxel wurde mit einer Anfangsdosis von 75 mg/m2, gefolgt von 75 mg/m2 oder 100 mg/m2 (falls vertragen) alle 3 Wochen intravenös verabreicht. Nach der Operation bekamen alle Patienten 3 Zyklen 5-Fluorouracil (600 mg/m2), Epirubicin (90 mg/m2), Cyclophosphamid (600 mg/m2) (FEC) intravenös alle drei Wochen verabreicht. Trastuzumab wurde alle drei Wochen intravenös verabreicht, um ein Behandlungsjahr zu vervollständigen. Patienten, die vor der Operation nur Perjeta und Trastuzumab erhalten haben, bekamen nach der Operation sowohl FEC als auch Docetaxel.
Der primäre Endpunkt der Studie war pathologische Komplettremission (pCR) in der Brust (ypT0/is). Sekundäre Wirksamkeitsendpunkte waren die klinische Ansprechrate, die Rate brusterhaltender Operationen (nur T2–3–Tumore), das krankheitsfreie Überleben (DFS) und PFS. Weitere explorative pCR-Raten beinhalteten den Lymphknotenstatus (ypT0/isN0 und ypT0N0).
Die demographischen Daten waren ausgewogen (das mediane Alter betrug 49 – 50 Jahre, die Mehrheit war kaukasischer Abstammung [71 %]) und alle Patienten waren weiblich. Insgesamt 7 % der Patienten hatten entzündlichen Brustkrebs, 32 % lokal fortgeschrittenen Brustkrebs und 61 % operablen Brustkrebs. Bei etwa der Hälfte der Patienten in jeder Behandlungsgruppe war die Erkrankung Hormonrezeptor-positiv (definiert als ER-positiv und/oder PgR-positiv).
Die Ergebnisse zur Wirksamkeit sind in Tabelle 4 dargestellt. Eine statistisch signifikante Verbesserung der pCR-Rate (ypT0/is) wurde bei Patienten beobachtet, die Perjeta plus Trastuzumab und Docetaxel erhielten, im Vergleich zu Patienten, die Trastuzumab und Docetaxel erhielten (45,8 % gegenüber 29,0 %, p-Wert = 0,0141). Unabhängig von der verwendeten pCR-Definition wurde ein einheitliches Muster der Ergebnisse beobachtet. Es gilt als wahrscheinlich, dass der Unterschied in der pCR-Rate in den langfristigen Ergebnissen zu einem klinisch bedeutsamen Unterschied führt, was durch einen positiven Trend im PFS (HR 0,69; 95-%-KI 0,34; 1,40) und im DFS (HR 0,60; 95-%-KI 0,28; 1,27) unterstützt wird.
Die pCR-Raten und das Ausmaß des Benefits von Perjeta (Perjeta plus Trastuzumab und Docetaxel verglichen mit Patienten, die Trastuzumab und Docetaxel erhalten haben) waren in der Subgruppe der Patienten mit Hormonrezeptor-positiven Tumoren (Unterschied von 6 % in der pCR-Rate in der Brust) niedriger als in der Patientengruppe mit Hormonrezeptor-negativen Tumoren (Unterschied von 26,4 % in der pCR-Rate in der Brust).
Die pCR-Raten waren bei Patienten mit operabler und lokal fortgeschrittener Erkrankung ähnlich. Es gab zu wenige Patienten mit entzündlichem Brustkrebs, um eine eindeutige Schlussfolgerung zu ziehen, aber die pCR-Rate war bei Patienten höher, die Perjeta plus Trastuzumab und Docetaxel erhalten haben.
TRYPHAENA (BO22280)
TRYPHAENA ist eine multizentrische, randomisierte klinische Phase-II-Studie mit 225 erwachsenen Patientinnen mit HER2-positivem lokal fortgeschrittenem, operablem oder entzündlichem Brustkrebs (T2–4d; Primärtumor > 2 cm im Durchmesser), die zuvor nicht mit Trastuzumab, Chemotherapie oder Strahlentherapie behandelt worden waren. Patienten mit Metastasen, beidseitigem Brustkrebs, klinisch bedeutsamen kardialen Risikofaktoren (siehe Abschnitt 4.4) oder LVEF < 55 % wurden nicht eingeschlossen. Die meisten Patienten waren jünger als 65 Jahre. Die Patienten wurden für die Gabe von einem der drei neoadjuvanten Behandlungsschemata vor der Operation wie folgt randomisiert:
3 Zyklen FEC, gefolgt von 3 Zyklen Docetaxel, alle gleichzeitig mit Perjeta und Trastuzumab verabreicht
3 Zyklen FEC allein, gefolgt von 3 Zyklen Docetaxel, mit Trastuzumab und Perjeta gleichzeitig verabreicht
6 Zyklen TCH in Kombination mit Perjeta.
Die Randomisierung wurde nach Brustkrebs-Typ (operabel, lokal fortgeschritten oder entzündlich) und ER- und/oder PgR-Positivität stratifiziert.
Pertuzumab wurde mit einer Anfangsdosis von 840 mg, gefolgt von 420 mg alle drei Wochen intravenös verabreicht. Trastuzumab wurde mit einer Anfangsdosis von 8 mg/kg, gefolgt von 6 mg/kg alle drei Wochen intravenös verabreicht. FEC (5-Fluorouracil [500 mg/m2], Epirubicin [100 mg/m2] und Cyclophosphamid [600 mg/m2]) wurden alle drei Wochen über 3 Zyklen intravenös verabreicht. Docetaxel wurde mit einer Anfangsdosis von 75 mg/m2 alle drei Wochen intravenös verabreicht, mit der Möglichkeit, nach Ermessen des Prüfarztes auf 100 mg/m2 zu erhöhen, sofern die erste Dosis gut vertragen wurde. In der mit Perjeta in Kombination mit TCH behandelten Gruppe wurde Docetaxel intravenös mit 75 mg/m2 (eine Erhöhung war nicht zulässig) und Carboplatin (AUC 6) alle drei Wochen intravenös verabreicht. Nach der Operation erhielten alle Patienten Trastuzumab bis zur Vervollständigung eines Behandlungsjahres.
Der primäre Endpunkt der Studie war die kardiale Sicherheit während der neoadjuvanten Behandlungsphase der Studie. Sekundäre Wirksamkeitsendpunkte waren pCR-Rate in der Brust (ypT0/is), DFS, PFS und OS.
Die demographischen Daten waren zwischen den Behandlungsarmen ausgewogen (das mediane Alter betrug 49 – 50 Jahre, die Mehrheit war kaukasischer Abstammung [77 %]) und alle Patienten waren weiblich. Insgesamt hatten 6 % der Patienten entzündlichen Brustkrebs, 25 % lokal fortgeschrittenen Brustkrebs und 69 % operablen Brustkrebs. Bei etwa der Hälfte der Patienten in jeder Behandlungsgruppe war die Erkrankung ER-positiv und/oder PgR-positiv.
Im Vergleich zu veröffentlichten Daten zu ähnlichen Behandlungsschemata ohne Pertuzumab wurden in allen 3 Behandlungsarmen hohe pCR-Raten beobachtet (siehe Tabelle 4). Unabhängig von der verwendeten pCR-Definition wurde ein einheitliches Muster der Ergebnisse beobachtet. Die pCR-Raten waren in der Subgruppe der Patienten mit Hormonrezeptor-positiven Tumoren niedriger (zwischen 46,2 % und 50,0 %) als bei den Patienten mit Hormonrezeptor-negativen Tumoren (zwischen 65,0 % und 83,8 %).
Die pCR-Raten waren bei Patienten mit operabler und lokal fortgeschrittener Erkrankung ähnlich. Es gab zu wenige Patienten mit entzündlichem Brustkrebs, um eindeutige Schlussfolgerungen zu ziehen.
Tabelle 4: NEOSPHERE (WO20697) und TRYPHAENA (BO22280): Überblick zur Wirksamkeit (Intent-to-Treat-Population)
NEOSPHERE (WO20697) |
TRYPHAENA (BO22280) |
||||||
Parameter |
Trastuzu-mab + Docetaxel |
Perjeta + |
Perjeta + |
Perjeta + |
Perjeta + |
FEC |
Perjeta |
pCR-Rate in der Brust (ypT0/is) |
31 (29,0 %) |
49 (45,8 %) |
18 (16,8 %) |
23 (24,0 %) |
45 (61,6 %) |
43 (57,3 %) |
51 (66,2 %) |
Differenz in pCR-Raten2 |
+16,8 % |
-12,2 % |
-21,8 % |
NA |
NA |
NA |
|
p-Wert (mit Simes-Korr. für CMH-Test)4 |
0,0141 |
0,0198 |
0,0030 |
NA |
NA |
NA |
|
pCR-Rate in der Brust und in Lymph-knoten (ypT0/is N0) |
23 (21,5 %) |
42 (39,3 %) |
12 (11,2 %) |
17 (17,7 %) |
41 (56,2 %) |
41 (54,7 %) |
49 (63,6 %) |
ypT0 N0 |
13 (12,1 %) |
35 (32,7 %) |
6 (5,6 %) |
13 (13,2 %) |
37 (50,7 %) |
34 (45,3 %) |
40 (51,9 %) |
Klinisches Anspre-chen5 |
79 (79,8 %) |
89 (88,1 %) |
69 (67,6 %) |
65 (71,4 %) |
67 (91,8 %) |
71 (94,7 %) |
69 (89,6 %) |
FEC: 5-Fluorouracil, Epirubicin, Cyclophosphamid; TCH: Docetaxel, Carboplatin und Trastuzumab; CMH:
Cochran-Mantel-Haenszel
95-%-KI für eine Einstichproben-Binominalvariable unter Anwendung der Pearson-Clopper-Methode.
Die Behandlung Perjeta + Trastuzumab + Docetaxel und Perjeta + Trastuzumab wird verglichen mit Trastuzumab + Docetaxel, während Perjeta + Docetaxel mit Perjeta + Trastuzumab + Docetaxel verglichen wird.
Approximatives 95-%-KI für Differenz zweier Ansprechraten unter Anwendung der Hauck-Anderson-Methode.
p-Wert des Cochran-Mantel-Haenszel-Tests, mit Simes-Korrektur für multiples Testen.
Klinisches Ansprechen ist definiert als CR oder PR der Patienten als bestes Gesamtansprechen, erhoben während der neoadjuvanten Phase (in der Primärläsion in der Brust).
BERENICE (WO29217)
BERENICE ist eine nicht randomisierte, offene, multizentrische, multinationale Phase-II-Studie, die bei 401 Patienten mit HER2-positivem, lokal fortgeschrittenem, entzündlichem oder frühem Brustkrebs (mit einem Durchmesser des Primärtumors > 2 cm oder nodal-positiver Erkrankung) durchgeführt wurde.
Die Studie BERENICE schloss zwei parallele Gruppen von Patienten ein. Patienten, bei denen eine neoadjuvante Behandlung mit Trastuzumab plus Anthrazyklin/Taxan-basierte Chemotherapie angezeigt war, wurden vor der Operation einem der beiden folgenden Behandlungsschemata zugeordnet:
Kohorte A – 4 Zyklen mit zweiwöchentlichem dosisintensiviertem Doxorubicin und Cyclophosphamid, gefolgt von 4 Zyklen mit Perjeta in Kombination mit Trastuzumab und Paclitaxel
Kohorte B – 4 Zyklen FEC, gefolgt von 4 Zyklen mit Perjeta in Kombination mit Trastuzumab und Docetaxel.
Nach der Operation erhielten alle Patienten Perjeta und Trastuzumab alle 3 Wochen intravenös bis zur Vervollständigung eines Behandlungsjahres.
Der primäre Endpunkt während des neoadjuvanten Behandlungszeitraums der Studie BERENICE war kardiale Sicherheit. Der primäre Endpunkt der kardialen Sicherheit, d. h. die Inzidenz von NYHA Klasse III/IV LVD und der Verringerung der LVEF war konsistent mit den früheren Daten aus dem neoadjuvanten Setting (siehe Abschnitte 4.4 und 4.8).
Adjuvante Behandlung
Im adjuvanten Setting, basierend auf Daten aus der Studie APHINITY, werden HER2-positive Patienten mit Brustkrebs im Frühstadium und hohem Rezidivrisiko als solche mit nodal-positiver oder Hormonrezeptor-negativer Erkrankung definiert.
APHINITY (BO25126)
APHINITY ist eine multizentrische, randomisierte, placebokontrollierte Doppelblindstudie der Phase-III, die bei 4 804 Patienten mit HER2-positivem frühem Brustkrebs durchgeführt wurde, deren Primärtumor vor der Randomisierung entfernt worden war. Die Patienten erhielten randomisiert Perjeta oder Placebo, jeweils in Kombination mit adjuvantem Trastuzumab und Chemotherapie. Die Prüfärzte wählten für jeden Patienten eines der folgenden anthrazyklinbasierten oder nicht-anthrazyklinbasierten Chemotherapieschemata aus:
3 oder 4 Zyklen FEC oder 5-Fluorouracil, Doxorubicin und Cyclophosphamid (FAC), gefolgt von 3 oder 4 Zyklen Docetaxel oder 12 Zyklen mit wöchentlich Paclitaxel
4 Zyklen AC oder Epirubicin und Cyclophosphamid (EC), gefolgt von 3 oder 4 Zyklen Docetaxel oder 12 Zyklen mit wöchentlich Paclitaxel
6 Zyklen Docetaxel in Kombination mit Carboplatin
Pertuzumab und Trastuzumab wurden alle 3 Wochen intravenös verabreicht (siehe Abschnitt 4.2), beginnend mit Tag 1 des ersten taxanhaltigen Zyklus und für insgesamt 52 Wochen (bis zu 18 Zyklen) oder bis zum Rezidiv, zur Rücknahme der Einverständniserklärung oder nicht beherrschbarer Toxizität. Verabreicht wurden Standarddosen von 5-Fluorouracil, Epirubicin, Doxorubicin, Cyclophosphamid, Docetaxel, Paclitaxel und Carboplatin.
Nach Beendigung der Chemotherapie erhielten die Patienten eine Strahlentherapie und/oder Hormontherapie entsprechend der lokalen klinischen Standards.
Primärer Endpunkt der Studie war invasiv-krankheitsfreies Überleben (invasive disease-free survival; IDFS), definiert als die Zeit von der Randomisierung bis zum ersten Auftreten eines ipsilateralen lokalen oder regionären invasiven Brustkrebsrezidivs, eines Fernrezidivs, eines kontralateralen invasiven Brustkrebs oder Tod jedweder Ursache. Die sekundären Wirksamkeitsendpunkte waren IDFS einschließlich sekundärem nicht-Brustkrebs Primärkarzinom, Gesamtüberleben (OS), krankheitsfreies Überleben (DFS), rezidivfreies Intervall (RFI) und fernrezidivfreies Intervall (DRFI).
Die demographischen Patientencharakteristika waren zwischen den beiden Behandlungsarmen gut ausgewogen. Das mediane Alter betrug 51 Jahre und über 99 % der Patienten waren weiblich. Die Mehrzahl der Patienten hatte eine nodal-positive (63 %) und/oder Hormonrezeptor-positive Erkrankung (64 %) und war kaukasisch (71 %).
Nach einer medianen Nachbeobachtungszeit von 45,4 Monaten zeigte sich in der APHINITY-Studie eine 19%ige (Hazard Ratio [HR] = 0,81; 95-%-KI 0,66; 1,00; p-Wert 0,0446) Reduktion des Risikos für Rezidiv oder Tod bei Patienten, die aufgrund der Randomisierung Perjeta erhielten, verglichen mit Patienten, die Placebo erhielten.
Nach einer medianen Nachbeobachtungszeit von 101,2 Monaten (8,4 Jahre) betrug die Anzahl der Todesfälle bei der dritten Interimsanalyse des Gesamtüberlebens bei Patienten, die in den Perjeta Arm randomisiert wurden, 168 Todesfälle [7,0 %] im Vergleich zu 202 Todesfällen [8,4 %] im Placebo Arm; HR=0,83; 95-%-KI [0,68; 1,02].
Die Ergebnisse der Wirksamkeit aus der APHINITY-Studie sind in Tabelle 5 und Abbildung 3 zusammengefasst.
Tabelle 5: Gesamtwirksamkeit: ITT-Population
Perjeta + Trastuzumab + Chemotherapie |
Placebo + Trastuzumab + Chemotherapie |
|
Primärer Endpunkt |
||
Invasiv-krankheitsfreies Überleben (IDFS)* |
||
Anzahl (%) Patienten mit Ereignis |
171 (7,1 %) |
210 (8,7 %) |
HR [95-%-KI] |
0,81 [0,66; 1,00] |
|
p-Wert (Log-Rank-Test, stratifiziert1) |
0,0446 |
|
3-Jahres-Rate ohne Ereignis2 [95-%-KI] |
94,1 [93,1; 95,0] |
93,2 [92,2; 94,3] |
Sekundäre Endpunkte1 |
||
IDFS einschließlich sekundärem nicht-Brustkrebs Primärkarzinom* |
||
Anzahl (%) Patienten mit Ereignis |
189 (7,9 %) |
230 (9,6 %) |
HR [95-%-KI] |
0,82 [0,68; 0,99] |
|
p-Wert (Log-Rank-Test, stratifiziert1) |
0,0430 |
|
3-Jahres-Rate ohne Ereignis2 [95-%-KI] |
93,5 [92,5; 94,5] |
92,5 [91,4; 93,6] |
Krankheitsfreies Überleben (DFS)* |
||
Anzahl (%) Patienten mit Ereignis |
192 (8,0 %) |
236 (9,8 %) |
HR [95-%-KI] |
0,81 [0,67; 0,98] |
|
p-Wert (Log-Rank-Test, stratifiziert1) |
0,0327 |
|
3-Jahres-Rate ohne Ereignis2 [95-%-KI] |
93,4 [92,4; 94,4] |
92,3 [91,2; 93,4] |
Gesamtüberleben (OS)** |
||
Anzahl (%) Patienten mit Ereignis |
168 (7,0 %) |
202 (8,4 %) |
HR [95-%-KI] |
0,83 [0,68; 1,02] |
|
Abkürzungen (Tabelle 5): HR: Hazard Ratio; KI: Konfidenzintervall
* Primäranalyse des invasiv-krankheitsfreien Überlebens, Stichtag 19. Dezember 2016.
** Daten der dritten Interimsanalyse des Gesamtüberlebens, Stichtag 10. Januar 2022.
1. Alle Analysen stratifiziert nach Lymphknotenstatus, Protokollversion, zentralem Homonrezeptorstatus und adjuvantem Chemotherapieschema.
2. 3-Jahres-Rate ohne Ereignis abgeleitet von Kaplan-Meier Schätzungen.
Abbildung 3: Kaplan-Meier Kurve invasiv-krankheitsfreies Überleben

Nach 4 Jahren lag das IDFS laut Schätzung in der Gruppe der mit Perjeta behandelten Patienten bei 92,3 % und in der Gruppe der mit Placebo behandelten Patienten bei 90,6 %. Die mediane Nachbeobachtungszeit betrug zum Bestimmungszeitpunkt 45,4 Monate.
Ergebnisse der Subgruppen-Analyse
Zum Zeitpunkt der Primäranalyse zeigten sich deutlichere Vorteile von Perjeta bei Patienten in bestimmten Gruppen mit hohem Risiko, insbesondere bei Patienten mit nodal-positiver oder Hormonrezeptor-negativer Erkrankung (siehe Tabelle 6).
Tabelle 6: Wirksamkeitsergebnisse in den Subgruppen nach Lymphknotenstatus und Hormonrezeptorstatus1
Population |
Anzahl IDFS-Ereignisse/gesamt n (%) |
Nicht stratifizierte HR (95-%-KI) |
|
Perjeta + Trastuzumab + Chemotherapie |
Placebo + |
||
Lymphknotenstatus | |||
Positiv |
139/1 503 |
181/1 502 |
0,77 |
Negativ |
32/897 |
29/902 |
1,13 |
Hormonrezeptorstatus |
|||
Negativ |
71/864 |
91/858 |
0,76 |
Positiv |
100/1 536 |
119/1 546 |
0,86 |
1 Ergebnisse präspezifizierter Subgruppenanalysen gelten als rein deskriptiv, da für multiple Vergleiche nicht adjustiert wurde.
In der nodal-positiven Subgruppe betrug die geschätzte IDFS Rate nach 3 Jahren für die mit Perjeta behandelten Patienten 92,0 % und für die mit Placebo behandelten Patienten 90,2 % bzw. nach 4 Jahren 89,9 % vs. 86,7 %. In der nodal-negativen Subgruppe betrug die geschätzte IDFS Rate nach 3 Jahren 97,5 % vs. 98,4 % und nach 4 Jahren 96,2 % vs. 96,7 %, jeweils in der mit Perjeta behandelten bzw. mit Placebo behandelten Gruppe. In der Hormonrezeptor-negativen Subgruppe betrug die geschätzte IDFS Rate nach 3 Jahren 92,8 % vs. 91,2 % und nach 4 Jahren 91,0 % vs. 88,7 % in der mit Perjeta behandelten bzw. mit Placebo behandelten Gruppe. In der Hormonrezeptor-positiven Subgruppe lag die geschätzte IDFS Rate nach 3 Jahren bei 94,8 % vs. 94,4 % und nach 4 Jahren bei 93,0 % vs. 91,6 %, jeweils in der mit Perjeta behandelten bzw. mit Placebo behandelten Gruppe.
Patienten-berichtete Ergebnisse (PRO)
Die sekundären Endpunkte umfassten die Bestimmung von Patienten-berichtetem globalem Gesundheitsstatus, Rollen- und körperlicher Funktion sowie Behandlungssymptomen, die mittels der Fragebogen EORTC QLQ-C30 und EORTC QLQ-BR23 erfasst wurden. In den Analysen der Patienten-berichteten Ergebnisse galt eine Veränderung um 10-Punkte als klinisch relevant.
Während der Chemotherapie ergaben sich für beide Behandlungsarme klinisch relevante Veränderungen bezüglich der Skalen körperliche Funktion, globaler Gesundheitsstatus und Diarrhö.
Die durchschnittliche Verschlechterung der körperlichen Funktion gegenüber Behandlungsbeginn betrug -10,7 (95-%-KI -11,4; -10,0) im Perjeta Arm und -10,6 (95-%-KI -11,4; -9,9) im Placebo Arm. Die Verschlechterung des globalen Gesundheitsstatus betrug -11,2 (95-%-KI -12,2; -10,2) im Perjeta Arm und -10,2 (95-%-KI -11,1; -9,2) im Placebo Arm. Die Diarrhö-Symptomatik zeigte einen Anstieg um +22,3 (95-%-KI 21,0; 23,6) im Perjeta Arm vs. +9,2 (95-%-KI 8,2; 10,2) im Placebo Arm.
Während der anschließenden zielgerichteten Behandlung kehrten die körperliche Funktion und der globale Gesundheitszustand in beiden Armen wieder auf das Ausgangsniveau zurück. Die Diarrhösymptomatik kehrte im Perjeta Arm nach HER2 Therapie auf das Anfangsniveau zurück. Die Hinzunahme von Perjeta zu Trastuzumab plus Chemotherapie hatte keinen Einfluss auf die Rollenfunktion der Patienten im Verlauf der Studie.
Immunogenität
In der Zulassungsstudie CLEOPATRA wurden die Patienten zu mehreren Zeitpunkten auf anti-Wirkstoff-Antikörper (anti-drug antibodies, ADA) gegen Perjeta untersucht. 3,3 % (13/389 Patienten) der mit Perjeta behandelten Patienten und 6,7 % (25/372 Patienten) der mit Placebo behandelten Patienten wurden positiv auf ADA getestet. In der BERENICE-Studie wurden 4,1 % (16/392) der mit Perjeta behandelten Patienten positiv auf ADA getestet. Keiner der Patienten zeigte Anaphylaxien/Überempfindlichkeitsreaktionen, die eindeutig mit ADA im Zusammenhang standen.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Perjeta eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei Brustkrebs gewährt (siehe Abschnitt 4.2 bezüglich Informationen zur Anwendung bei Kindern und Jugendlichen).
Mit den Daten aus verschiedenen klinischen Studien der Phasen I, II und III von 481 Patienten mit unterschiedlichen Arten fortgeschrittener Tumorerkrankungen wurde eine populationspharmakokinetische Analyse durchgeführt. Die Patienten hatten Pertuzumab als Mono- oder Kombinationstherapie in Dosen zwischen 2 mg/kg und 25 mg/kg alle drei Wochen als 30 – 60-minütige intravenöse Infusion erhalten.
Resorption
Perjeta wird als intravenöse Infusion verabreicht.
Verteilung
In allen klinischen Studien betrug das Verteilungsvolumen des zentralen (Vc) und des peripheren (Vp) Kompartiments beim typischen Patienten 3,11 Liter bzw. 2,46 Liter.
Biotransformation
Der Metabolismus von Pertuzumab wurde nicht direkt untersucht. Antikörper werden hauptsächlich katabolisch ausgeschieden.
Elimination
Die mediane Clearance (Cl) von Pertuzumab betrug 0,235 Liter/Tag und die mediane Halbwertszeit betrug 18 Tage.
Linearität/Nicht-Linearität
Innerhalb des empfohlenen Dosierungsbereiches wies Pertuzumab eine lineare Pharmakokinetik auf.
Ältere Patienten
Basierend auf der populationspharmakokinetischen Analyse wurde bei Patienten < 65 Jahre (n = 306) und Patienten ≥ 65 Jahre (n = 175) kein signifikanter Unterschied in Bezug auf die Pharmakokinetik von Pertuzumab beobachtet.
Nierenfunktionsstörung
Es wurden keine klinischen Studien zur Untersuchung der Wirkung von Perjeta auf die Nierenfunktion durchgeführt. Basierend auf den Ergebnissen der populationspharmakokinetischen Analyse war die Bioverfügbarkeit von Pertuzumab bei Patienten mit leichter Nierenfunktionsstörung (Kreatininclearance [CrCl] 60 ml/min bis 90 ml/min, n = 200) und mäßiger Nierenfunktionsstörung (CrCl 30 ml/min bis 60 ml/min, n = 71) vergleichbar zu derjenigen von Patienten mit normaler Nierenfunktion (CrCl größer als 90 ml/min, n = 200). Über die gesamte Bandbreite der CrCl wurde kein Zusammenhang zwischen CrCl und der Verfügbarkeit von Pertuzumab beobachtet (27 ml/min bis 244 ml/min).
Sonstige besondere Patientengruppen
Die populationspharmakokinetische Analyse ergab keine pharmakokinetischen Unterschiede in Bezug auf Alter, Geschlecht und ethnische Abstammung (japanisch vs. nicht-japanisch). Die Ausgangswerte von Albumin und fettfreiem Körpergewicht waren die wichtigsten signifikanten, die Clearance beeinflussenden, Kovariablen. Die Clearance nahm bei Patienten mit anfangs höheren Albuminkonzentrationen ab und bei Patienten mit höherem fettfreiem Körpergewicht zu. Trotzdem haben Empfindlichkeitsanalysen in präklinischen Heterotransplantatmodellen von Tumoren, bei denen die empfohlene Dosis und das empfohlene Schema von Perjeta angewendet wurden, gezeigt, dass bei den Extremwerten dieser beiden Kovariablen keine signifikante Auswirkung auf die Fähigkeit, die angestrebten Steady-State-Konzentrationen zu erreichen, bestand. Daher ist es nicht notwendig, die Dosierung von Pertuzumab auf der Grundlage dieser Kovariablen anzupassen.
Die PK-Ergebnisse von Pertuzumab in der NEOSPHERE- und der APHINITY-Studie stimmten mit den Prognosen aus dem vorherigen PK-Populationsmodell überein. Bei Patienten mit frühem Brustkrebs wurden im Vergleich zu Patienten mit metastasiertem Brustkrebs keine Unterschiede in der PK von Pertuzumab festgestellt.
Es wurden keine spezifischen Fertilitätsstudien bei Tieren zur Beurteilung des Einflusses von Pertuzumab durchgeführt. Aus der Toxizitätsstudie mit wiederholter Gabe an Cynomolgus-Affen können keine endgültigen Schlüsse in Bezug auf unerwünschte Wirkungen auf männliche Fortpflanzungsorgane gezogen werden.
Studien zur Reproduktionstoxizität wurden bei trächtigen Cynomolgus-Affen (zwischen dem 19. und 50. Gestationstag) mit Initialdosen von 30 mg/kg bis 150 mg/kg, gefolgt von 10 mg/kg bis 100 mg/kg alle zwei Wochen, durchgeführt. Diese Dosierungen führten zu klinisch relevanten Plasmaspiegeln (basierend auf Cmax-Werten), die 2,5- bis 20-mal höher als bei der empfohlenen menschlichen Dosis waren. Die intravenöse Verabreichung von Pertuzumab war zwischen dem 19. und 50. Gestationstag (Phase der Organogenese) embryotoxisch, wobei es zwischen dem 25. und 70. Gestationstag zu einem dosisabhängigen Anstieg embryofötaler Todesfälle kam. Bei trächtigen weiblichen Affen, die alle zwei Wochen Pertuzumab in Dosen von entweder 10, 30 oder 100 mg/kg erhielten (2,5- bis 20-mal höher als die empfohlene menschliche Dosis basierend auf Cmax), lag die Inzidenz embryofötaler Verluste bei 33, 50 und 85 %. Bei Kaiserschnitt am 100. Gestationstag wurden Oligohydramnie, ein verringertes relatives Lungen- und Nierengewicht und mikroskopische Nachweise renaler Hypoplasie, konsistent zu verzögerter renaler Entwicklung, in allen Dosisgruppen von Pertuzumab identifiziert. Zusätzlich und konsistent mit fötalen Wachstumshemmungen als Folge einer Oligohydramnie wurden Lungenhypoplasien (1 von 6 in der 30-mg/kg- und 1 von 2 in der 100-mg/kg-Gruppe), ventrikuläre Septumdefekte (1 von 6 in der 30-mg/kg-Gruppe), dünne Ventrikelwand (1 von 2 in der 100-mg/kg-Gruppe) und kleinere Skelettfehlbildungen (äußerlich – 3 von 6 in der 30-mg/kg-Gruppe) beobachtet. Bei den Nachkommen aller Behandlungsgruppen wurde eine Pertuzumab-Exposition berichtet, mit Serumspiegeln zwischen 29 % und 40 % der maternalen Serumspiegel am 100. Gestationstag.
Wöchentliche intravenöse Verabreichungen von Dosen von Pertuzumab bis zu 150 mg/kg/Dosis wurden von Cynomolgus-Affen im Allgemeinen gut vertragen. Bei Dosen von 15 mg/kg und mehr wurde intermittierende, leichte, behandlungsbedingte Diarrhö festgestellt. Bei einem Teil der Affen führte eine langzeitige Verabreichung (7 bis 26 Wochen) zu Episoden schwerer sekretorischer Diarrhö. Die Diarrhö wurde durch unterstützende Maßnahmen, einschließlich intravenöser Flüssigkeitsersatztherapie, erfolgreich behandelt (Ausnahme ein eingeschläfertes Tier, Dosis 50 mg/kg).
Essigsäure 99 %
Histidin
Saccharose
Polysorbat 20
Wasser für Injektionszwecke
Glukoselösung (5%ig) sollte nicht zur Verdünnung von Perjeta verwendet werden, da es chemisch und physikalisch in dieser Art von Lösung instabil ist.
Das Arzneimittel darf, außer mit den unter Abschnitt 6.6 aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Ungeöffnete Durchstechflasche
2 Jahre.
Verdünnte Lösung
Die chemische und physikalische Anbruchstabilität wurde für 24 Stunden bei 30 °C und bis zu 30 Tage bei lichtgeschützter Lagerung bei 2 °C bis 8 °C nachgewiesen.
Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Wenn es nicht sofort verwendet wird, liegen die Lagerzeiten und Lagerbedingungen nach Anbruch in der Verantwortung des Anwenders und sollten im Normalfall 24 Stunden bei 2 °C bis 8 °C nicht überschreiten, es sei denn, die Verdünnung wurde unter kontrollierten und validierten aseptischen Bedingungen durchgeführt.
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Verdünnung des Arzneimittels, siehe Abschnitt 6.3.
Durchstechflasche (Glasart I) mit Stopfen (Butylgummi) mit 14 ml Lösung.
Packung mit 1 Durchstechflasche.
Perjeta enthält keine antimikrobiellen Konservierungsstoffe. Deswegen muss darauf geachtet werden, dass die Sterilität der zubereiteten Infusionslösung gewährleistet ist. Die Zubereitung sollte daher durch medizinisches Fachpersonal erfolgen.
Perjeta ist nur zur einmaligen Anwendung vorgesehen.
Die Durchstechflasche darf nicht geschüttelt werden. 14 ml Konzentrat von Perjeta sollte aus der Durchstechflasche unter Verwendung einer sterilen Nadel und Spritze aufgezogen und in 250 ml PVC oder nicht-PVC Polyolefin Infusionsbeuteln mit 9 mg/ml (0,9%iger) oder alternativ mit 4,5 mg/ml (0,45%iger) Natriumchlorid-Infusionslösung verdünnt werden. Nach der Verdünnung sollte 1 ml der Lösung für die Initialdosis, für die zwei Durchstechflaschen benötigt werden, ca. 3,02 mg Pertuzumab (840 mg/278 ml) und für die Erhaltungsdosis, für die eine Durchstechflasche benötigt wird, ca. 1,59 mg Pertuzumab (420 mg/264 ml) enthalten.
Der Beutel sollte vorsichtig umgedreht werden, um die Lösung ohne Schaumbildung zu mischen.
Arzneimittel für die parenterale Anwendung sind vor der Anwendung optisch auf Schwebstoffe und Verfärbungen zu überprüfen. Wenn Schwebstoffe oder Verfärbungen beobachtet werden, darf die Lösung nicht verwendet werden. Nach der Zubereitung sollte die Infusion umgehend angewendet werden (siehe Abschnitt 6.3).
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Perjeta ist kompatibel mit Polyvinylchlorid (PVC) oder nicht-PVC Polyolefin-Beuteln, einschließlich Polyethylen.
Roche Registration GmbH
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Deutschland
EU/1/13/813/001
Datum der ersten Erteilung der Zulassung: 04. März 2013
Datum der letzten Verlängerung der Zulassung: 08. Dezember 2017
Mai 2025
Verschreibungspflichtig
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
Telefon (07624) 14-0
Telefax (07624) 1019
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu. verfügbar.