Ozawade 4,5 mg Filmtabletten
Ozawade 18 mg Filmtabletten
Ozawade 4,5 mg Filmtablette
Jede Tablette enthält Pitolisanthydrochlorid, entsprechend 4,45 mg Pitolisant.
Ozawade 18 mg Filmtablette
Jede Tablette enthält Pitolisanthydrochlorid, entsprechend 17,8 mg Pitolisant.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
Filmtablette (Tablette)
Ozawade 4,5 mg Filmtablette
Weiße, runde, bikonvexe Filmtablette mit einem Durchmesser von 3,7 mm und der Kennzeichnung „5“ auf einer Seite.
Ozawade 18 mg Filmtablette
Weiße, runde, bikonvexe Filmtablette mit einem Durchmesser von 7,5 mm und der Kennzeichnung „20“ auf einer Seite.
Ozawade wird angewendet, zur Verbesserung der Wachheit und zur Reduktion übermäßiger Schläfrigkeit während des Tages bei erwachsenen Patienten mit obstruktiver Schlafapnoe (OSA), deren übermäßige Tagesschläfrigkeit (EDS – Excessive Daytime Sleepiness) durch eine primäre OSA-Therapie, wie z. B. eine CPAP-Beatmung (CPAP, continuous positive airway pressure), nicht zufriedenstellend behandelt werden konnte oder wenn eine solche Therapie nicht vertragen wurde.
Die Behandlung sollte von einem Arzt eingeleitet werden, der Erfahrung in der Behandlung von OSA und kardiovaskulärem Risiko hat. Die OSA-Erkrankung sollte jährlich neu beurteilt werden.
Ozawade ist keine Therapie für die zugrunde liegende Atemwegsobstruktion bei Patienten mit OSA. Die primäre OSA-Therapie sollte beibehalten werden, oder bei Patienten, die die primäre OSA-Therapie nicht vertragen, regelmäßig erneut reexponiert werden.
Dosierung
Pitolisant sollte in Abhängigkeit vom individuellen Ansprechen des Patienten und der individuellen Verträglichkeit in der niedrigsten wirksamen Dosis, gemäß nachstehendem Dosissteigerungsschema angewendet werden. Eine Dosis von 18 mg/Tag sollte nicht überschritten werden:
Woche 1: Anfangsdosis von 4,5 mg (eine 4,5-mg-Tablette) pro Tag.
Woche 2: Die Dosis kann auf 9 mg (zwei 4,5-mg-Tabletten) pro Tag erhöht werden.
Woche 3: Die Dosis kann auf 18 mg (eine 18-mg-Tablette) pro Tag erhöht oder auf 4,5 mg (eine 4,5-mg-Tablette) pro Tag verringert werden.
Die Dosis kann jederzeit nach Ermessen des Arztes und gemäß dem Ansprechen des Patienten verringert (bis auf 4,5 mg pro Tag) oder erhöht (auf bis zu 18 oder 36 mg pro Tag) werden.
Die Tagesgesamtdosis sollte als Einzeldosis am Morgen während des Frühstücks eingenommen werden.
Aufrechterhaltung der Wirksamkeit
Da nur begrenzt Daten zur Langzeit-Wirksamkeit vorliegen (siehe Abschnitt 5.1), sollte der Arzt regelmäßig überprüfen, ob die Behandlung weiterhin wirksam ist.
Besondere Patientengruppen
Ältere Patienten
Zur Anwendung bei älteren Patienten liegen nur begrenzte Daten vor. Daher sollte die Dosis gemäß des individuellen Ansprechens und der individuellen Verträglichkeit des Patienten angepasst werden.
Bei älteren Menschen wurde häufiger über Schlaflosigkeit berichtet. Die Dosierung sollte entsprechend angepasst werden (siehe Abschnitt 4.8).
Nierenfunktionsstörung
Bei Patienten mit Nierenfunktionsstörung sollte die Tageshöchstdosis 18 mg betragen.
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse B) kann die Tagesdosis zwei Wochen nach Beginn der Therapie erhöht werden. Eine Höchstdosis von 18 mg darf nicht überschritten werden (siehe Abschnitt 5.2).
Pitolisant darf bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) nicht angewendet werden (siehe Abschnitt 4.3).
Kinder und Jugendliche
Es gibt bei obstruktiver Schlafapnoe (OSA) keinen relevanten Nutzen von Ozawade bei Kindern und Jugendlichen.
Phänotyp von CYP2D6-Metabolisierern (falls bekannt)
Im Vergleich zu extensiven CYP2D6-Metabolisierern wird bei langsamen CYP2D6-Metabolisierern eine höhere systemische Exposition (bis zum 3-Fachen) und bei ultraschnellen CYP2D6-Metabolisierern eine niedrigere Exposition (um das 0,8-Fache) beobachtet. Es werden keine Unterschiede in der systemischen Exposition zwischen extensiven CYP2D6-Metabolisierern und intermediären CYP2D6-Metabolisierern beobachtet.
Im Dosissteigerungsschema sollte die Dosiserhöhung diese höhere Exposition bei langsamen CYP2D6-Metabolisierern berücksichtigen. Eine Dosisanpassung bei Patienten mit bekanntem Genotyp eines langsamen CYP2D6-Metabolisierers könnte in Abhängigkeit vom individuellen Ansprechen und der Verträglichkeit in Betracht gezogen werden (siehe Abschnitt 5.2). Darüber hinaus kann derzeit keine Dosisempfehlung für ultraschnelle CYP2D6-Metabolisierer, die einen CYP3A-Induktor einnehmen, gegeben werden, da die PK in dieser Subpopulation derzeit nicht bekannt ist.
Art der Anwendung
Zum Einnehmen.
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Schwere Leberfunktionsstörung (Child-Pugh-Klasse C).
Stillzeit (siehe Abschnitt 4.6).
Psychiatrische Erkrankungen
Pitolisant sollte bei Patienten mit psychiatrischen Erkrankungen in der Anamnese, wie z. B. schweren Angststörungen oder schweren Depressionen mit Suizidgedanken, mit Vorsicht angewendet werden. Bei mit Pitolisant behandelten Patienten mit psychiatrischer Vorgeschichte wurden Suizidgedanken berichtet.
Leberfunktionsstörung
Pitolisant sollte bei Patienten, die an einer mittelschweren Leberfunktionsstörung (Child-Pugh-Klasse B) leiden, mit Vorsicht angewendet werden. Das Dosisschema sollte gemäß Abschnitt 4.2 angepasst werden.
Erkrankungen des Gastrointestinaltrakts
Im Zusammenhang mit der Anwendung von Pitolisant wurde über Magenerkrankungen berichtet; daher sollte das Arzneimittel bei Patienten mit säurebedingten Magenerkrankungen (siehe Abschnitt 4.8) oder bei gleichzeitiger Anwendung von magenreizenden Arzneimitteln wie z. B. Kortikosteroiden oder NSAR vorsichtig angewendet werden (siehe Abschnitt 4.5).
Ernährungsstörungen
Pitolisant sollte bei Patienten mit schwerer Adipositas oder schwerer Anorexie mit Vorsicht angewendet werden (siehe Abschnitt 4.8). Im Falle einer signifikanten Veränderung des Körpergewichts sollte die Behandlung durch den Arzt erneut beurteilt werden.
Herzerkrankungen
In zwei eigens für die Untersuchung der QT-Zeit durchgeführten Studien führten Pitolisant-Dosen über der therapeutischen Dosierung (das 6- bis 12-Fache der therapeutischen Dosierung, d. h. 108 mg bis 216 mg) zu einer leichten bis mäßigen Verlängerung des QTc-Intervalls (10-13 ms). Patienten mit Herzerkrankungen, Hypertonie oder einem Risiko für schwerwiegende unerwünschte kardiovaskuläre Ereignisse, die gleichzeitig mit anderen Arzneimitteln behandelt werden, welche die QT-Zeit verlängern oder die bekanntermaßen das Risiko für Repolarisationsstörungen erhöhen, oder Patienten, die gleichzeitig mit Arzneimitteln behandelt werden, welche die Cmax und die AUC von Pitolisant signifikant erhöhen (siehe Abschnitt 4.5), sowie Patienten mit schweren Nieren- oder mittelschweren Leberfunktionsstörungen (siehe Abschnitt 4.4) sollten sorgfältig überwacht werden (siehe Abschnitt 4.5).
Epilepsie
Bei hohen Dosierungen wurde in Tiermodellen über Konvulsionen berichtet (siehe Abschnitt 5.3). In klinischen Studien wurde bei einem epileptischen Patienten eine Verschlimmerung der Epilepsie berichtet. Bei Patienten mit schwerer Epilepsie ist Vorsicht geboten.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung und mindestens bis 21 Tage nach dem Absetzen der Behandlung eine zuverlässige Verhütungsmethode anwenden (basierend auf der Halbwertzeit von Pitolisant und dessen Metaboliten). Pitolisant kann die Wirksamkeit von hormonellen Kontrazeptiva reduzieren. Daher muss eine alternative Verhütungsmethode angewendet werden, wenn die Patientin hormonelle Kontrazeptiva anwendet (siehe Abschnitte 4.5 und 4.6).
Arzneimittelwechselwirkungen
Die Kombination von Pitolisant und Substraten von CYP3A4 mit einer geringen therapeutischen Breite sollte vermieden werden (siehe Abschnitt 4.5).
Drogenmissbrauch, Rebound-Effekt
In einer spezifischen Studie zeigte Pitolisant bei der aktuellen therapeutischen Dosis von 36 mg und bei Dosen bis zu 216 mg kein oder nur ein sehr geringes Signal, das auf Missbrauch hindeutet. Folglich ist das Potenzial von Pitolisant für Arzneimittel- oder Drogenmissbrauch sehr gering.
In klinischen Studien wurde über keinen Rebound-Effekt berichtet. Trotzdem sollte beim Absetzen der Behandlung eine Überwachung erfolgen.
Pharmakodynamische Wechselwirkungen
Antidepressiva
Tri- oder tetrazyklische Antidepressiva mit Histamin-H1-rezeptorantagonistischer Wirkung (z. B. Imipramin, Clomipramin, Mirtazapin) können die Wirksamkeit von Pitolisant beeinträchtigen, da sie möglicherweise die Wirkung von endogenem Histamin, das aufgrund der Behandlung im Gehirn ausgeschüttet wird, aufheben. Es sollte eine Alternative angewendet werden.
Antihistaminika
Antihistaminika (H1-Rezeptor-Antagonisten), die die Blut-Hirn-Schranke überwinden (z. B. Pheniraminmaleat, Chlorpheniramin, Diphenhydramin, Promethazin, Mepyramin, Doxylamin), können die Wirksamkeit von Pitolisant beeinträchtigen. Es sollte eine Alternative angewendet werden.
Substanzen, welche die QT-Zeit verlängern oder bekanntermaßen das Risiko für Repolarisationsstörungen erhöhen (z. B. Haloperidol, Risperidon, Erythromycin, Clarithromycin, Roxithromycin, Loratadin, Sildenafil).
Die Kombination mit Pitolisant sollte nur unter sorgfältiger Überwachung stattfinden (siehe Abschnitt 4.4).
Pharmakokinetische Wechselwirkungen
Bei Personen, die intermediäre, extensive (normale) oder ultraschnelle CYP2D6-Metabolisierer sind, ist CYP2D6 das Hauptenzym, das an der Biotransformation von Pitolisant beteiligt ist; CYP3A ist in geringerem Maße beteiligt. Bei Personen, die langsame CYP2D6-Metabolisierer sind oder die intermediäre, extensive oder ultraschnelle CYP2D6-Metabolisierer sind und CYP3A-Induktoren einnehmen, ist CYP3A signifikant an der Biotransformation von Pitolisant beteiligt, und CYP2D6 ist in geringerem Maße beteiligt.
Arzneimittel, die den Metabolismus von Pitolisant beeinflussen
CYP2D6-Inhibitoren
CYP2D6-Inhibitoren werden höchstwahrscheinlich einen Einfluss auf die Pharmakokinetik von Pitolisant bei Personen haben, die intermediäre, extensive oder ultraschnelle CYP2D6-Metabolisierer sind und keine CYP3A-Induktoren einnehmen, jedoch nicht bei Personen, die langsame CYP2D6-Metabolisierer sind oder die intermediäre, extensive oder ultraschnelle CYP2D6-Metabolisierer sind und CYP3A-Induktoren einnehmen. Während der kombinierten Anwendung ist unter Umständen je nach individueller Reaktion und Verträglichkeit eine Dosisanpassung in Erwägung zu ziehen.
Die gleichzeitige Anwendung von Pitolisant und Paroxetin, allein oder in Kombination mit CYP3A4-Inhibitoren, führt in gleichem Maße zu einer signifikanten Erhöhung der mittleren Cmax und der AUC0—72h von Pitolisant um das ca. 1.5- bzw. 2-Fache. Angesichts der 2‑fachen Erhöhung der Pitolisant-Exposition ist bei der gleichzeitigen Anwendung von Pitolisant und CYP2D6-Inhibitoren (z. B. Paroxetin, Fluoxetin, Venlafaxin, Duloxetin, Bupropion, Chinidin, Terbinafin, Cinacalcet) allein oder in Kombination mit CYP3A4-Inhibitoren (Itraconazol, Ketoconazol) Vorsicht geboten.
Enzyminduktoren
CYP3A-Induktoren werden höchstwahrscheinlich einen Einfluss auf die Pharmakokinetik von Pitolisant bei langsamen CYP2D6-Metabolisierern und ultraschnellen CYP2D6-Metabolisierern haben; ihre Wirkung bei Personen dieser Populationen ist derzeit nicht bekannt. Wenn beide Wirkstoffe kombiniert werden, sollte eine klinische Überwachung erfolgen und schließlich während der kombinierten Anwendung und eine Woche nach der Behandlung mit dem Induktor eine Dosisanpassung vorgenommen werden.
Die gleichzeitige Anwendung von Pitolisant und Rifampicin in mehrfachen Dosen führt zu einer signifikanten Verringerung der mittleren Cmax und der AUC von Pitolisant um das ca. 0,6- bzw. 0,5-Fache. Daher ist bei der gleichzeitigen Anwendung von Pitolisant mit starken CYP3A4-Induktoren (z. B. Rifampicin, Phenobarbital, Carbamazepin, Phenytoin) Vorsicht geboten. Bei der Anwendung von Johanniskraut (Hypericum perforatum) ist aufgrund dessen starker CYP3A4-induzierender Wirkung bei gleichzeitiger Anwendung mit Pitolisant Vorsicht geboten.
CYP3A4-Inhibitoren
Basierend auf dem in-vitro-Biotransformationsweg können CYP3A4-Inhibitoren einen Einfluss auf die Pharmakokinetik von Pitolisant haben, insbesondere bei Patienten mit langsamer CYP2D6-Matebolisierung.
Die Kombination von Pitolisant mit Grapefruitsaft und Itraconazol wurde bei gesunden Probanden untersucht. Bei keiner dieser Kombinationen wurde eine klinisch relevante pharmakokinetische Wechselwirkung zwischen den Arzneimitteln nachgewiesen. Bei langsamenCYP2D6-Metabolisierern kann die gleichzeitige Verabreichung von Pitolisant mit Paroxetin (einem starken CYP2D6-Inhibitor) in Kombination mit einem CYP3A4-Inhibitor, die Exposition im Vergleich zur Verabreichung mit Paroxetin allein moderat erhöhen, was die geringe klinische Bedeutung der CYP3A4-Hemmung bestätigt.
Aufgrund des Biotransformationsweges ist jedoch Vorsicht geboten bei der gemeinsamen Gabe von Pitolisant mit sowohl CYP2D6- als auch CYP3A4-Inhibitoren, unabhängig vom CYP2D6-Phänotyp der Patienten, da es zu einer signifikanten Abnahme der Clearance und einer Zunahme der Exposition kommt.
Sonstige
In einer klinischen Studie mit mehrfachen Dosen verringerte die Kombination von Pitolisant mit Probenecid die AUC von Pitolisant um ca. das 0,7-Fache. Der zugrunde liegende Mechanismus ist nicht bekannt. Während der kombinierten Anwendung ist unter Umständen eine Dosisanpassung in Erwägung zu ziehen, je nach individuellem Ansprechen und Verträglichkeit.
Arzneimittel, deren Metabolismus möglicherweise durch Pitolisant beeinträchtigt wird
Substrate von CYP3A4 und CYP2B6
Eine klinische Induktionsstudie zeigte, dass Pitolisant ein schwacher Induktor von CYP3A ist (0,2‑fache Reduktion der Midazolam-Exposition). Daher sollte die Kombination von Pitolisant mit CYP3A4-Substraten mit einer geringen therapeutischen Breite (z. B. Immunsuppressiva, Docetaxel, Kinase-Inhibitoren, Cisaprid, Pimozid, Halofantrin) vermieden werden (siehe Abschnitt 4.4). Bei anderen Substraten von CYP3A4, CYP2C (z. B. Repaglinid, Phenytoin, Warfarin), P-gp (z. B. Dabigatran, Digoxin) und UGT (z. B. Morphin, Paracetamol, Irinotecan) ist Vorsicht geboten und eine klinische Überwachung der Wirksamkeit sollte erfolgen.
Pitolisant kann die Exposition gegenüber oralen Kontrazeptiva verringern. Es sollte eine weitere zuverlässige Verhütungsmethode angewendet werden (siehe Abschnitt 4.6).
Substrate von OCT1
Basierend auf in-vitro-Daten kann Pitolisant ein klinisch relevanter Inhibitor von OCT1 sein. Es kann eine klinisch relevante Wechselwirkung mit Substraten von OCT1 (z. B. Metformin) auftreten.
Auch wenn die klinische Relevanz dieses Effekts nicht erwiesen ist, ist bei der gleichzeitigen Anwendung von Pitolisant und einem Substrat von OCT1 (z. B. Metformin [Biguanide]) Vorsicht geboten (siehe Abschnitt 5.2).
Sonstige
Die Kombination von Pitolisant mit Modafinil oder Natriumoxybat wurde bei gesunden Probanden in therapeutischen Dosen bewertet. Weder mit Modafinil noch mit Natriumoxybat wurde eine klinisch relevante pharmakokinetische Arzneimittelwechselwirkung nachgewiesen. Es ist keine Dosisanpassung erforderlich, wenn Pitolisant zusammen mit den derzeitigen Behandlungen der OSA-Symptome angewendet wird.
Pitolisant verringert die Olanzapin-Exposition um das 0,3-Fache.
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung und mindestens bis 21 Tage nach dem Absetzen der Behandlung eine zuverlässige Verhütungsmethode anwenden (basierend auf der Halbwertzeit von Pitolisant und dessen Metaboliten). Pitolisant und seine Metaboliten können die Wirksamkeit von hormonellen Kontrazeptiva reduzieren. Daher sollte eine alternative Verhütungsmethode angewendet werden, wenn die Frau hormonelle Kontrazeptiva anwendet (siehe Abschnitt 4.5).
Schwangerschaft
Bisher liegen keine oder nur begrenzte Erfahrungen mit der Anwendung von Pitolisant bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität, einschließlich Teratogenität, gezeigt. Bei Ratten wurde gezeigt, dass Pitolisant bzw. seine Metaboliten plazentagängig sind (siehe Abschnitt 5.3).
Pitolisant sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dass der potenzielle Nutzen gegenüber den potenziellen Risiken für den Fötus überwiegt.
Stillzeit
Eine tierexperimentelle Studie hat gezeigt, dass Pitolisant / seine Metaboliten in die Muttermilch sezerniert werden. Daher darf während der Behandlung mit Pitolisant nicht gestillt werden (siehe Abschnitt 4.3).
Fertilität
Tierexperimentelle Studien haben Auswirkungen auf die Samenparameter, ohne signifikante Auswirkung auf die Reproduktionsleistung der männlichen Tiere und bei behandelten weiblichen Tieren eine Reduzierung des prozentualen Anteils lebender Föten gezeigt (siehe Abschnitt 5.3).
Pitolisant hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Patienten mit einem abnormen Schläfrigkeitsgrad, die Pitolisant einnehmen, sollten darauf hingewiesen werden, dass sich ihr Wachheitsgrad möglicherweise nicht wieder normalisiert. Bei Patienten mit exzessiver Tagesschläfrigkeit, einschließlich Patienten, die Pitolisant einnehmen, sollte der Schläfrigkeitsgrad häufig neu bewertet werden und gegebenenfalls sollte diesen Patienten geraten werden, das Führen von Fahrzeugen und andere potenziell gefährliche Aktivitäten zu vermeiden.
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen sind Kopfschmerzen 9,5 %, Schlaflosigkeit (alle Arten) 8,0 %, Angst 2,7 %, Übelkeit 2,3 %, Bauchschmerzen 1,9 % und Schwindel 1,7 %.
Tabellarische Auflistung der Nebenwirkungen
Die folgenden Nebenwirkungen wurden im Zusammenhang mit Pitolisant in klinischen Studien gemeldet und sind nachstehend als bevorzugte MedDRA-Bezeichnung nach Systemorganklasse und Häufigkeit aufgelistet; die Häufigkeiten des Auftretens sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1 000, <1/100), selten (≥1/10 000, <1/1 000), sehr selten (<1/10 000); innerhalb der einzelnen Häufigkeitsgruppen werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben:
Häufig |
Gelegentlich |
|
Infektionen und parasitäre Erkrankungen |
Herpes zoster |
|
Erkrankungen des Blut- und Lymphsystems |
Alaninaminotransferase erhöht |
|
Stoffwechsel- und Ernährungsstörungen |
Alkoholintoleranz |
|
Psychiatrische Erkrankungen |
Schlaflosigkeit (alle Arten) |
Verwirrtheitszustand Depressive Verstimmungen und Störungen |
Erkrankungen des Nervensystems |
Kopfschmerzen |
Störungen des Schlaf-Wach-Rhythmus |
Augenerkrankungen |
Augenlidschwellung |
|
Erkrankungen des Ohrs und des Labyrinths |
Vertigo |
Tinnitus |
Herzerkrankungen |
Atrioventrikulärer Block ersten Grades |
|
Gefäßerkrankungen |
Hitzewallungen |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Gähnen |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit/Erbrechen |
Durchfall |
Erkrankungen der Haut und des Unterhautzellgewebes |
Ausschlag |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Gliederschmerzen |
|
Erkrankungen der Nieren und Harnwege |
Pollakisurie |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Schmerzen und Unwohlsein |
Beschreibung ausgewählter Nebenwirkungen
Kopfschmerzen und Schlaflosigkeit
Während klinischer Studien zur OSA-Indikation wurden Episoden von Kopfschmerzen und Schlaflosigkeit (9,5 % und 8,0 %) häufiger bei Frauen (Kopfschmerzen und Schlaflosigkeit) und bei älteren Patienten (Schlaflosigkeit) berichtet. Die meisten dieser Nebenwirkungen waren leicht bis mäßig (siehe Abschnitt 4.2). Die Dosierung sollte entsprechend angepasst werden.
Magenerkrankungen
Magenerkrankungen, die vermutlich durch eine Übersäuerung verursacht wurden, wurden in klinischen Studien bei 3,5 % der mit Pitolisant behandelten Patienten berichtet. Bei Frauen wird über höhere Raten von Übelkeit berichtet. Diese Nebenwirkungen waren meist leichter bis mäßiger Natur. Wenn sie andauern, kann eine korrigierende Behandlung mit Protonenpumpenhemmern eingeleitet werden.
Patienten mit niedrigem / normalem Body Mass Index (BMI) (<25)
Kopfschmerzen, Schlaflosigkeit, Übelkeit und Angstzustände wurden bei Patienten mit niedrigem / normalem BMI häufiger berichtet. Die Dosierung sollte entsprechend angepasst werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de, anzuzeigen.
Symptome
Zu den Symptomen einer Überdosierung von Pitolisant gehören unter anderem Kopfschmerzen, Schlaflosigkeit, Reizbarkeit, Übelkeit und Abdominalschmerzen.
Behandlung
Im Falle einer Überdosierung wird die Einweisung ins Krankenhaus und die Überwachung der Vitalfunktionen empfohlen. Es existiert kein eindeutig identifiziertes Antidot.
Pharmakotherapeutische Gruppe: Andere Mittel für das Nervensystem, ATC-Code: N07XX11.
Wirkmechanismus
Pitolisant ist ein oral wirksamer Histamin-H3-Rezeptor-Antagonist/inverser Agonist, der mittels Blockierung der Histamin-Autorezeptoren die Aktivität von histaminergen Neuronen im Gehirn, einem wichtigen Erregungssystem mit weitläufigen Projektionen in das gesamte Gehirn, verstärkt. Darüber hinaus moduliert Pitolisant verschiedene Neurotransmittersysteme und erhöht dadurch die Ausschüttung von Acetylcholin, Noradrenalin und Dopamin im Gehirn.
Klinische Wirksamkeit
Die Wirksamkeit von Pitolisant bei der Behandlung von exzessiver Tagesschläfrigkeit (EDS) bei Patienten mit obstruktiver Schlafapnoe (OSA) wurde in zwei zentralen klinischen Studien untersucht: HAROSA I und HAROSA II.
HAROSA I untersuchte die Wirksamkeit und Sicherheit von Pitolisant bei der Behandlung von EDS bei Patienten mit obstruktivem Schlafapnoe-Syndrom (OSA), die mit kontinuierlichem positiven Atemwegsdruck (CPAP) behandelt wurden, aber weiterhin über EDS klagten. Es handelte sich um eine prospektive, multizentrische, randomisierte Doppelblindstudie mit Pitolisant im Vergleich zu Placebo, mit einer 12-wöchigen Doppelblindphase. 244 Patienten wurden analysiert (183 Pitolisant, 61 Placebo), 83 % Männer, durchschnittlich 53 Jahre alt, 12 % über 65 Jahre. Die Patienten hatten EDS (einen ESS-Score [Epworth Sleepiness Scale] größer oder gleich 12) und wurden für einen Mindestzeitraum von 3 Monaten einer nCPAP-Therapie unterzogen. Trotz der zuvor unternommenen Anstrengungen, einen effizienten nCPAP zu erzielen, klagten sie immer noch über EDS.
Die primäre Wirksamkeitsvariable war die Veränderung des Epworth Sleepiness Scale (ESS) Score zwischen Studienbeginn und Behandlungsende. Während der Doppelblindphase betrug die verordnete Höchstdosis 18 mg für 79.8% der Patienten in der aktiven Behandlungsgruppe und für 88.5% der Patienten in der Placebogruppe. Die maximale Dosis wird nach einer dreiwöchigen Titration beginnend mit 4,5 mg erreicht.
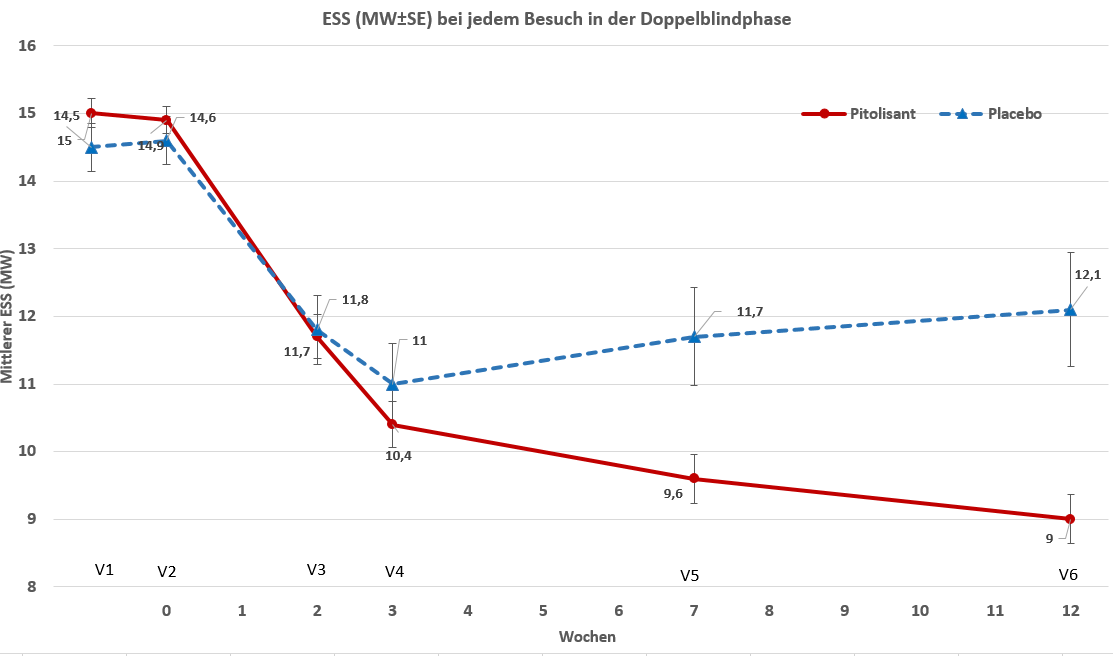
Nach 12-wöchiger DB-Behandlung wurde eine signifikante Verbesserung des ESS-Score mit Pitolisant im Vergleich zu Placebo berichtet (Tabelle 1).
Tabelle 1: Übersicht über die Wirksamkeitsergebnisse nach 12 Wochen in HAROSA I
Parameter |
Behandlungsgruppe (n) |
Baseline-Score (bei V2) |
Endpunkt- Score (bei V6) |
Änderung |
Unterschied zum Placebo |
P-Wert |
ESS (SD) |
Placebo (61) |
14,6 (2,8) |
12,1 (6,4) |
-2,75 |
-2,6[-3,9;-1,4] |
P<0,001 |
Pitolisant (183) |
14,9 (2,7) |
9 (4,8) |
-5,52 |
Abbildung 1 Änderungen des ESS (Epworth Sleepiness Scale)-Score in der Studie P09-08
Doppelblindphase - ITT-Population (N = 244)
HAROSA II untersuchte die Wirksamkeit und Sicherheit von Pitolisant bei der Behandlung von EDS bei Patienten mit obstruktivem Schlafapnoe-Syndrom (OSA), die die Therapie mit kontinuierlichem positivem Atemwegsdruck (CPAP) verweigerten. Es handelte sich um eine prospektive, multizentrische, randomisierte Doppelblindstudie mit Pitolisant im Vergleich zu Placebo, mit einer 12-wöchigen Doppelblindphase gefolgt von einer 40-wöchigen offenen Verlängerungsphase. 268 Patienten wurden analysiert (201 Pitolisant, 67 Placebo), 75 % Männer, durchschnittlich 52 Jahre, 12 % über 65 Jahre. Die Patienten hatten einen ESS-Score (Epworth Sleepiness Scale) von mindestens 12 und lehnten es ab, mit einer nCPAP-Therapie behandelt zu werden und klagten weiterhin über EDS.
Die primäre Wirksamkeitsvariable war die Veränderung des Epworth Sleepiness Scale (ESS)-Score zwischen Studienbeginn und Behandlungsende. Während der Doppelblindphase betrug die verordnete Höchstdosis 18 mg für 82,5% der Patienten in der aktiven Behandlungsgruppe und für 86,6% der Patienten in der Placebogruppe.
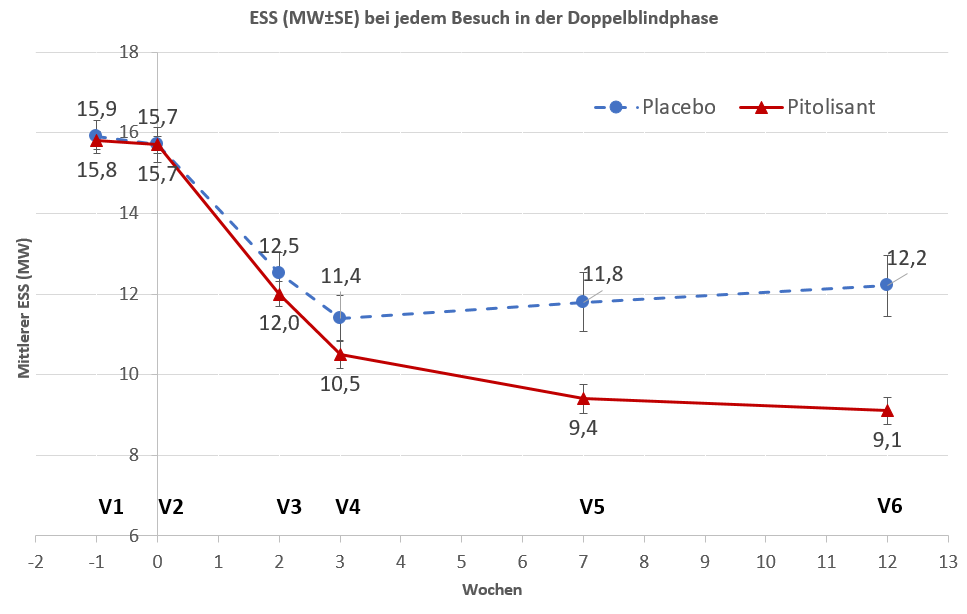
Nach 12-wöchiger Doppelblind-Behandlung wurde mit Pitolisant eine signifikante Verbesserung des ESS-Score im Vergleich zum Placebo berichtet (ANCOVA-Modell, das ESS und BMI bei V2 und im Studienzentrum als zufälligen Effekt anpasst) (Tabelle 2).
Tabelle 2: Übersicht über die Wirksamkeitsergebnisse nach 12 Wochen in HAROSA II
Parameter |
Behandlungsgruppe (n) |
Baseline-Score (bei V2) |
Endpunkt-Score (bei V6) |
Änderung |
Unterschied zum Placebo |
P-Wert |
ESS (SD) |
Placebo (67) |
15,7 (3,6) |
12,2 (6,1) |
-3,6 |
-2,8[-4,0;-1,5] |
P<0,001 |
Pitolisant (201) |
15,7 (3,1) |
9,1 (4,7) |
-6,3 |
Abbildung 2 Änderungen des ESS (Epworth Sleepiness Scale)-Score in der Studie P09-09
Doppelblindphase - ITT-Population (N = 268)
In einer erweiterten Analyse wurden die beiden HAROSA-Studien verglichen und kombiniert, wobei die Hauptparameter (ESS, OSleR-Test, Pichot-Müdigkeitsskala und CGI) signifikante Verbesserungen durch Pitolisant im Vergleich zu Placebo zeigten.
Tabelle 3: Hauptwirksamkeitsergebnisse der zusammengeführten Analyse von HAROSA I - HAROSA II
|
Mittelwert |
95%-KI |
p |
OSleR-Test (1) |
1,18 |
-1,02, 1,35 |
P<0,022 |
Pichot-Müdigkeitsskala (2) |
-1,27 |
-2,30, -0,23 |
P=0,017 |
CGI (3) |
-0,63 |
-0,84, -0,47 |
P<0,001 |
Mittleres Verhältnis Pitolisant/Placebo
Behandlungseffekt
Unterschied Pitolisant-Placebo
Daten zur offenen Phase
Patienten, die an den doppelblinden 12-wöchigen HAROSA I- und HAROSA II-Studien teilgenommen haben, konnten an der 40-wöchigen offenen Phase teilnehmen. Das Hauptziel der offenen Phase war, die langfristige Sicherheit und Wirksamkeit von Pitolisant bis zu 18 mg/Tag zu belegen. Die Aufrechterhaltung der Wirkung von Pitolisant bei EDS bei OSA-Patienten wurde in verblindeten, placebokontrollierten Studien nicht nachgewiesen. In HAROSA I brachen 1,5 % der Patienten die Teilnahme an der Studie während der offenen Phase aufgrund mangelnder Wirksamkeit und 4,0 % aufgrund unerwünschter Ereignisse ab. In HAROSA II brachen 1,3 % der Patienten die Teilnahme an der Studie während der offenen Phase aufgrund mangelnder Wirksamkeit und 2,5 % aufgrund unerwünschter Ereignisse ab.
HAROSA III war eine prospektive, randomisierte, doppelblinde (12 Wochen), Placebo-kontrollierte Studie an 361 Patienten mit OSA-Syndrom. Die Probanden berichteten von EDS trotz nCPAP-Therapie oder lehnten eine nCPAP-Therapie bei bestehender EDS ab. Die Probanden wurden randomisiert und erhielten Pitolisant (n=242) oder Placebo (n=119). Die Dosis von Pitolisant wurde von 9 auf 18 mg auftitriert und dann, in Abhängigkeit vom Ansprechen des Patienten, entweder beibehalten, weiter auf 36 mg erhöht oder auf 9 mg verringert. Die Probanden erhielten anschließend über 9 Wochen die gleiche Dosis. Primärer Wirksamkeitsendpunkt war die Veränderung beim Epworth-Sleepiness-Scale-(ESS)-Score zu Behandlungsende gegenüber dem Ausgangswert. Unter Behandlung mit Pitolisant (36 mg) verbesserte sich der ESS-Score von 14,5 Punkten auf 9,3 Punkte; bei Einnahme des Placebos änderte sich der Score von 14,0 Punkten auf 11,8 Punkte. Die Differenz betrug 2,6 Punkte (p<0,001). Die anhand des ESS-Scores bewertete Verbesserung bei der EDS ist von gleicher Größenordnung wie die in anderen an OSA-Patienten durchgeführten Studien beobachtete Verbesserung. Das Ansprechen der mit nCPAP therapierten Probanden unterschied sich nicht von dem Ansprechen der Probanden, die eine nCPAP-Therapie ablehnten.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für Ozawade eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei obstruktiver Schlafapnoe (OSA) gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
Die Exposition von gesunden Probanden gegenüber Pitolisant wurde in Studien untersucht, die mehr als 200 Teilnehmer umfassten, die Dosen von Pitolisant als Einzelgabe von bis zu 216 mg und über eine Dauer von bis zu 28 Tagen erhielten.
Resorption
Pitolisant wird gut und schnell resorbiert. Die maximale Plasmakonzentration wird ca. drei Stunden nach der Gabe erreicht. Die Cmax und AUC im Steady State (geometrisches Mittel (CV%)) bei einer therapeutischen Dosis von 18 mg betragen 35,5 ng/ml (59,2%) bzw. 378 ng x h/ml (86,3%).
Bei wiederholter Gabe wird der Steady State 5-6 Tage nach der Einnahme erreicht, was zu einem ca. 2‑fach erhöhten Serumspiegel führt. Die interindividuelle Variabilität ist verhältnismäßig hoch (geom. CV% von 59,2 bzw. 86,3 für Cmax bzw. AUC0-24h); einige Probanden zeigten ein Profil mit hohen Ausreißerwerten (ohne Verträglichkeitsprobleme).
Die Pharmakokinetik von Pitolisant wird durch gleichzeitige Nahrungsaufnahme nicht beeinflusst.
Verteilung
Pitolisant weist eine hohe Bindung an Serumproteine (91,4-95,2 %) und eine nahezu identische Verteilung zwischen roten Blutkörperchen und Plasma auf.
Pitolisant ist mit einem scheinbaren Verteilungsvolumen von 5-10 l/kg breitverteilt.
Biotransformation
Der Metabolismus von Pitolisant beim Menschen ist umfassend charakterisiert und stellt den Hauptausscheidungsweg dar. Die wichtigsten nichtkonjugierten Metaboliten sind aufgespaltene Formen von Pitolisant, aus denen inaktive Carbonsäuren als Hauptmetaboliten hervorgehen. Neben drei Hauptmetaboliten sind in geringerem Umfang auch fünf an verschiedenen Positionen hydroxylierte/N-Oxid-Derivate im Urin und im Serum zu finden. Unter Berücksichtigung der Ergebnisse von in-vitro Studien und der Verteilung der Hauptmetaboliten, die in der Mass-Balance-Studie ermittelt wurde, kann der Gesamtbeitrags der CYP-Enzyme am Metabolismus von Pitolisant, wenn der CYP2D6 Phänotyp ein extensiver Metabolisierer ist, wie folgt geschätzt werden: ~60% für CYP2D6 und ~30% für CYP3A4/3A5. Es wurden mehrere konjugierte Metaboliten identifiziert; die wichtigsten davon (inaktiv) sind zwei Glycinkonjugate der Carbonsäuremetaboliten von Pitolisant und ein Glucuronid eines Keton-Metaboliten von Monohydroxy-desaturiertem Pitolisant.
Hemmung/Induktion
Auf Lebermikrosomen bewirken Pitolisant und seine wichtigsten Metaboliten bis zu einer Konzentration von 13,3 µM, einer Konzentration, die deutlich höher ist als die Spiegel, die bei einer therapeutischen Dosis erreicht werden, keine signifikante Hemmung der Wirkung von CYP1A2, CYP2C9, CYP2C19, CYP2C8, CYP2B6, CYP2E1 oder CYP3A4 und der Isoformen der Uridindiphosphat-Glucuronosyl-Transferasen UGT1A1, UGT1A4, UGT1A6, UGT1A9 und UGT2B7. Pitolisant ist ein mittelstarker Inhibitor (IC50 = 2,6 µM) von CYP2D6.
In-vitro-Daten legen nahe, dass Pitolisant und seine Hauptmetaboliten in therapeutischen Konzentrationen möglicherweise CYP3A4 und CYP2B6 und, basierend auf extrapolierten Daten, CYP2C, UGTs und P-gp induzieren. Eine klinische Studie wurde durchgeführt, um die Wirkung von Pitolisant auf CYP3A4 und CYP2B6 unter Verwendung von Midazolam und Bupropion als CYP3A4- bzw. CYP2B6-Modellsubstrat zu bewerten. Pitolisant beeinflusst nicht die Pharmakokinetik von Bupropion und ist folglich kein CYP2B6- oder CYP1A2-Induktor und sollte bei klinisch relevanten Konzentrationen als Borderline-/schwacher Induktor betrachtet werden.
In-vitro-Studien lassen vermuten, dass Pitolisant weder ein Substrat noch ein Inhibitor von humanem P-Glykoprotein und Brustkrebsresistenzprotein (BCRP) ist. Pitolisant ist kein Substrat von OATP1B1 und OATP1B3. Pitolisant ist in der geprüften Konzentration kein signifikanter Inhibitor von OAT1, OAT3, OCT2, OATP1B1, OATP1B3, MATE1 oder MATE2K. Pitolisant weist bei einer Konzentration von 1,33 µM eine Hemmung gegenüber OCT1 (organischen Kationentransportern 1) von mehr als 50 % auf; die extrapolierte IC50 von Pitolisant beträgt 0,795 µM (siehe Abschnitt 4.5).
Elimination
Pitolisant hat eine Plasmahalbwertszeit von 10-12 Stunden. Die Elimination erfolgt hauptsächlich über den Urin (zu ca. 90 %) mittels pharmakologisch inaktiven, nicht konjugierten und mit Glycin und Glucuronid konjugierten Metaboliten. Eine kleine Fraktion (2,3 %) wurde im Stuhl nachgewiesen.
Linearität/Nicht-Linearität
Eine studienübergreifende Bewertung von Einzeldosisdaten zeigt, dass die Exposition gegenüber Pitolisant proportional mit Dosierungen zwischen 18 und 216 mg Pitolisant zunimmt, jedoch etwas mehr als dosisproportional über den klinischen Dosisbereich von 4,5 bis 18 mg.
Besondere Patientengruppen
Es ist unwahrscheinlich, dass es aufgrund des Geschlechts klinisch relevante Unterschiede in der PK von Pitolisant gibt.
Pitolisant wurde bei adipösen Patienten mit einem BMI> 40 kg/m2 nicht untersucht.
Körpergewicht
Basierend auf der populationspharmakokinetischen Analyse resultiert eine Dosis von 20 mg voraussichtlich in einer medianen Cmax,ss und AUCτ,ss von 41,3 ng/ml (90 % Prognoseintervalle [PI]: 5,6 bis 111,1 ng/ml) bzw. 418 h.ng/ml (90 % PI: 40 bis 1302 h.ng/ml) bei Patienten mit einem Gewicht von 48 bis 67 kg, gegenüber 23,6 ng/ml (90 % PI von 3,9 bis 69,1 ng/ml) bzw. 272 h.ng/ml (90 % PI: 33 bis 1300 h.ng/ml) bei Patienten mit einem Gewicht von 95 bis 140 kg. Nach der Titration von Pitolisant erhalten Patienten mit geringem Körpergewicht eher eine niedrigere Dosis als Patienten mit hohem Körpergewicht.
Ältere Patienten
Die Pharmakokinetik von Pitolisant unterscheidet sich bei gesunden Probanden im Alter von 68 bis 80 Jahren nicht von jener bei jüngeren Patienten (im Alter von 18 bis 45 Jahren). Bei Patienten über 80 Jahren zeigt die Kinetik eine leichte Abweichung, die jedoch keine klinische Relevanz hat. Zur Anwendung bei älteren Patienten liegen nur begrenzt Daten vor. Daher sollte die Dosis entsprechend der Leberfunktion des Patienten angepasst werden (siehe Abschnitte 4.2 und 4.4).
Nierenfunktionsstörung
Bei Patienten mit beeinträchtigter Nierenfunktion (Stadien 2 bis 4 gemäß der internationalen Klassifizierung der chronischen Nierenerkrankung, d. h. Kreatinin-Clearance zwischen 15 ml/min und 89 ml/min) waren Cmax und AUC tendenziell um den Faktor 2,5 erhöht (siehe Abschnitt 4.2). Der zugrunde liegende Mechanismus ist nicht bekannt.
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) erhöhte sich die AUC im Vergleich zu normalen gesunden Probanden um den Faktor 1,4, während die Cmax unverändert blieb.
Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse B) erhöhte sich die AUC um den Faktor 2,4, während die Cmax unverändert blieb (siehe Abschnitt 4.2). Die Pharmakokinetik von Pitolisant nach wiederholter Gabe bei Patienten mit Leberfunktionsstörung wurde noch nicht untersucht.
Ethnische Zugehörigkeit
Alle Studien wurden hauptsächlich an Weißen (Kaukasiern) durchgeführt (Kaukasier = 270; Schwarze = 38; Asiaten = 20; Sonstige = 3). Auf Grundlage der vom Antragsteller vorgelegten Daten scheint die Exposition zwischen den verschiedenen ethnischen Zugehörigkeiten ähnlich zu sein.
CYP2D6-Phänotypen und CYP3A-Polymorphismus
Die Exposition gegenüber Pitolisant war bei den langsamen CYP2D6-Metabolisierern nach einer Einzeldosis und unter Steady-State Bedingungen höher; Cmax und AUC(0-tau) waren am Tag 1 ungefähr 2,7‑fach und 3,2‑fach höher und am Tag 7 waren sie 2,1‑fach und 2,4‑fach höher. Die Halbwertszeit von Pitolisant im Serum war bei langsamen CYP2D6-Metabolisierern im Vergleich zu den extensiven Metabolisierern länger.
Bei Personen, die intermediäre, extensive (normale) oder ultraschnelle CYP2D6-Metabolisierer sind, ist CYP2D6 das Hauptenzym, das an der Biotransformation von Pitolisant beteiligt ist; CYP3A ist in geringerem Maße beteiligt. Es ist unwahrscheinlich, dass genetische Polymorphismen von CYP3A4 und CYP3A5 einen signifikanten Einfluss auf die Pharmakokinetik von Pitolisant haben.
Bei diesen Personen haben CYP2D6-Inhibitoren einen Einfluss auf die Pharmakokinetik von Pitolisant, nicht jedoch CYP3A-Inhibitoren. Bei Personen, bei denen es sich um ultraschnelle CYP2D6-Metabolisierer handelt, können CYP3A-Induktoren zu einer noch schnelleren Eliminierung von Pitolisant und einer geringeren Exposition im Vergleich zu den anderen Untergruppen führen. Dies kann zu Expositionen unterhalb der therapeutischen Konzentrationen führen.
Bei Personen, die langsame CYP2D6-Metabolisierer sind oder die intermediäre, extensive oder ultraschnelle CYP2D6-Metabolisierer sind und CYP3A-Induktoren einnehmen, ist CYP3A signifikant an der Biotransformation von Pitolisant beteiligt, und CYP2D6 ist in geringerem Maße beteiligt. Nur unter diesen Bedingungen können genetische Polymorphismen in CYP3A4 und 3A5 einen signifikanten Einfluss auf die Pharmakokinetik von Pitolisant haben.
Bei Personen, die langsame CYP2D6-Metabolisierer sind, wirken sich CYP3A-Inhibitoren und -Induktoren in viel geringerem Maße auf die Pharmakokinetik von Pitolisant- und CYP2D6-Inhibitoren aus. Bei Personen, bei denen es sich um intermediäre, extensive oder ultraschnelle CYP2D6-Metabolisierer handelt und die einen CYP3A-Induktor einnehmen, führt ein CYP3A-Inhibitor zu einer Verringerung des Beitrags von CYP3A zum Gesamtstoffwechsel. Die Exposition ist jedoch höchstwahrscheinlich ähnlich wie bei Personen, die keinen CYP3A-Induktor einnehmen. Daher ist es in dieser Teilpopulation unwahrscheinlich, dass die CYP3A-Inhibition die Pharmakokinetik von Pitolisant beeinflusst.
Bei Ratten traten vorübergehende, reversible Episoden von Konvulsion zum Zeitpunkt Tmax auf, die möglicherweise auf einen Metaboliten zurückzuführen sind, der bei dieser Art, jedoch nicht beim Menschen, reichlich vorkommt. Bei Affen wurden bei den höchsten Dosierungen vorübergehende, mit dem ZNS in Zusammenhang stehende, klinische Anzeichen gemeldet, einschließlich Erbrechen, Tremor und Konvulsionen. Bei den höchsten Dosierungen wiesen Ratten in einigen Organen (Leber, Duodenum, Thymus, Nebenniere und Lunge) in begrenztem Ausmaß gewisse histopathologische Veränderungen auf.
Pitolisant blockierte den hERG-Kanal mit einer IC50, die die therapeutischen Konzentrationen übersteigt und führte zu einer leichten Verlängerung der QTc-Zeit bei Hunden.
In präklinischen Studien wurden Arzneimittelabhängigkeit und das Missbrauchspotenzial an Mäusen, Ratten und Affen untersucht. Basierend auf Studien zur Verträglichkeit, Abhängigkeit und Selbstverabreichung konnte jedoch keine endgültige Schlussfolgerung gezogen werden.
Pitolisant war weder genotoxisch noch kanzerogen.
Eine teratogene Wirkung von Pitolisant wurde bei maternal toxischen Dosen beobachtet (Sicherheitsspannen für die Teratogenität 7,3 bzw. 2,6 bei Ratten bzw. Kaninchen). Bei hohen Dosierungen führte Pitolisant zu morphologischen Anomalien und einer verringerten Motilität der Spermien ohne signifikante Auswirkungen auf die Fertilitätsindizes männlicher Ratten und es reduzierte den prozentualen Anteils an Empfängnissen mit lebenden Embryonen und erhöhte den post-implantären Verlust bei weiblichen Ratten (Sicherheitsspanne von 2,3). Pitolisant führte zu einer Verzögerung der postnatalen Entwicklung (Sicherheitsspanne von 2,3).
Es wurde gezeigt, dass Pitolisant bzw. seine Metaboliten bei Tieren plazentagängig sind und in die Muttermilch sezerniert werden.
Toxizitätsstudien an Jungtieren
Toxizitätsstudien an Jungtieren bei Ratten haben gezeigt, dass die Verabreichung von Pitolisant in hohen Dosierungen zu einer dosisabhängigen Mortalität und zu Episoden von Konvulsionen führte, die möglicherweise auf einen Metaboliten zurückzuführen sind, der bei Ratten, jedoch nicht beim Menschen, reichlich vorkommt.
Tablettenkern
Mikrokristalline Cellulose (E 460)
Crospovidon Typ A (E 1202)
Talkum (E 553b)
Magnesiumstearat (Ph.Eur.) [pflanzlich]
Hochdisperses Siliciumdioxid (E 551)
Tablettenüberzug
Poly(vinylalkohol) (E 1203)
Titandioxid (E 171)
Macrogol 3350 (E 1521)
Talkum (E 553b)
Nicht zutreffend.
4 Jahre
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Flasche aus Polyethylen hoher Dichte (HDPE) mit einem manipulations- und kindergesicherten Schraubdeckel aus Polypropylen mit einem Trockenmittel (Silicagel).
Ozawade 4,5 mg
Packungen mit 1 Flasche mit 30 Tabletten oder 1 Flasche mit 90 Tabletten.
Ozawade 18 mg
Packungen mit 1 Flasche mit 30 Tabletten oder 1 Flasche mit 90 Tabletten.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Bioprojet Pharma
9, rue Rameau
75002 Paris
Frankreich
Tel.: +33 (0) 1 47 03 66 33
Fax: +33 (0) 1 47 03 66 30
E-Mail: contact@bioprojet.com
EU/1/21/1546/001
EU/1/21/1546/002
EU/1/21/1546/003
EU/1/21/1546/004
Datum der Erteilung der Zulassung: 22/07/2021
Oktober 2025
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar.
Verschreibungspflichtig